Mitocin 20 Mg Pulver Und Lösungsmittel Zur Herstellung Einer Lösung Zur Intravesikalen Anwendung
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
1. BEZEICHNUNG DES ARZNEIMITTELS
Mitocin 20 mg Pulver und Lösungsmittel zur Herstellung einer Lösung zur intravesikalen Anwendung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: Mitomycin
1 Durchstechflasche Mitocin 20 mg Pulver zur Herstellung einer Lösung zur intravesikalen Anwendung enthält 20 mg Mitomycin.
Nach Rekonstitution mit dem beiliegenden Lösungsmittel enthält 1 ml Lösung zur intravesikalen Anwendung 1 mg Mitomycin.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver und Lösungsmittel zur Herstellung einer Lösung zur intravesikalen Anwendung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Intravesikale Anwendung zur Rezidivprophylaxe bei oberflächlichem Harnblasenkarzinom nach transurethraler Resektion.
4.2 Dosierung und Art der Anwendung
Dosierung
Intravesikale Verabreichung
Bei der intravesikalen Therapie wird 20-40 mg Mitomycin, entsprechend 1-2 Durchstechflaschen Mitocin 20 mg in 20-40 ml 0,9%iger Natriumchloridlösung, wöchentlich in die Harnblase instilliert. Bei der intravesikalen Gabe sollte der pH des Urins über pH 6 betragen.
Alternative Dosisempfehlungen für die Rezidivprophylaxe bei oberflächlichem Harnblasenkarzinom sind 4-10 mg (0,06-0,15 mg/kg Körpergewicht) 1 bis 3 Mal pro Woche durch einen Ureterkatheter in die Harnblase instilliert.
Bestimmte Patientengruppen
Die Dosis muss bei Patienten reduziert werden, die sich einer vorausgegangenen extensiven Zytostatikatherapie unterzogen haben, sowie bei einer Myelosuppression bzw. bei älteren Patienten.
Zur Anwendung von Mitomycin bei Patienten >65 Jahre liegt nur unzureichendes Datenmaterial aus klinischen Studien vor.
Das Arzneimittel sollte nicht bei Patienten mit eingeschränkter Nierenfunktion angewendet werden (siehe Abschnitt 4.3)
Das Arzneimittel wird für Patienten mit eingeschränkter Leberfunktion aufgrund fehlender Wirksamkeits- und Sicherheitsdaten bei dieser Patientengruppe nicht empfohlen.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Mitomycin bei Kindern und Jugendlichen ist nicht erwiesen. Art der Anwendung
Mitomycin ist nach dem Auflösen zur intravesikalen Instillation vorgesehen. Eine teilweise Verwendung des Inhaltes der Durchstechflasche ist möglich.
Vorbereitung der gebrauchsfertigen Lösung zur intravesikalen Gabe
Der Inhalt von 1-2 Durchstechflaschen Mitocin 20 mg (entsprechend 20-40 mg Mitomycin) wird in 20-40 ml 0,9%iger Natriumchloridlösung gelöst.
Es sollte vorrangig Mitocin 20 mg verwendet werden. Bei Verwendung des Instillations-Sets von Mitocin 20 mg ist die entsprechende Gebrauchsanweisung zu beachten. Zur Herstellung der Lösung wird die 0,9 %ige NaCl-Lösung des beiliegenden Beutels verwendet.
4.3 Gegenanzeigen
• Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
• Stillen
Intravesikale Therapie
Perforation der Harnblasenwand ist eine absolute Kontraindikation.
Zystitis ist eine relative Kontraindikation.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Aufgrund der toxischen Wirkung von Mitomycin auf das Knochenmark müssen andere myelotoxische Therapiemodalitäten (insbesondere andere Zytostatika, Strahlentherapie) mit besonderer Vorsicht gehandhabt werden, um eine additive Myelosuppression in Grenzen zu halten.
Eine Langzeittherapie kann zu kumulativer Knochenmarktoxizität führen. Die
Knochenmarksuppression kann sich mit Verzögerung manifestieren, mit einer maximalen Ausprägung nach 4-6 Wochen und nach längerer Anwendung kumulieren. Daher ist häufig eine individuelle Dosisanpassung erforderlich.
Ältere Patienten leiden häufiger unter reduzierter physiologischer Funktion und Knochenmarkdepression, die längerfristig anhalten kann. Daher ist die Gabe von Mitomycin in dieser Patientengruppe mit besonderer Vorsicht und unter engmaschiger Überwachung zu geben.
Mitomycin ist bei Menschen eine mutagene und potenziell karzinogene Substanz. Haut- und Schleimhautkontakt sind zu vermieden.
Bei Symptomen einer Lungenerkrankung, die nicht auf die Grunderkrankung zurückgeführt werden kann, ist die Therapie sofort abzubrechen. Lungentoxizität kann mit Steroiden gut behandelt werden.
Die Therapie sollte ebenfalls sofort abgebrochen werden, wenn sich Symptome einer Hämolyse oder Indikationen für eine Nierenfunktionsstörung (Nephrotoxizität) zeigen.
Bei Dosen >30 mg Mitomycin/m2 Körperoberfläche wurde eine mikroangiopathisch-hämolytische Anämie beobachtet. Eine engmaschige Überwachung der Nierenfunktion wird empfohlen.
Neue Erkenntnisse lassen einen Therapieversuch zur Entfernung von Immunkomplexen, die anscheinend bei der Auslösung der Symptome eine signifikante Rolle spielen, mittels Staphylococcus-Protein A angezeigt erscheinen.
Bei Patienten, die gleichzeitig mit anderen antineoplastischen Wirkstoffen behandelt wurden, wurde vom Auftreten akuter Leukämie (in einigen Fällen nach präleukämischer Phase) und myelodysplastischem Syndrom berichtet.
Eine Dosis von Mitomycin SEP 20 mg nach Rekonstitution im Lösungsmittel-Beutel enthält 3,08 mmol (70,8 mg) Natrium. Dies ist zu berücksichtigen bei Personen unter Natrium kontrollierter (natriumarmer/-kochsalzarmer) Diät.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Myelotoxische Wechselwirkungen mit anderen Knochenmark schädigenden Therapiemodalitäten (besonders andere zytotoxische Arzneimittel, Strahlentherapie) sind möglich.
Eine Kombination mit Vincaalkaloiden oder Bleomycin kann die pulmonale Toxizität verstärken.
Bei Patienten, die eine gleichzeitige Gabe von Mitomycin und Fluorouracil oder Tamoxifen erhielten, wurde von einem erhöhten Risiko für ein hämolytisch-urämisches Syndrom berichtet.
Die gleichzeitige Gabe von Pyridoxinhydrochlorid (Vitamin B6) führte im Tierversuch zum Wirkungsverlust von Mitomycin.
Während einer Mitomycin-Behandlung sollten keine Impfungen mit Lebendimpfstoffen erfolgen.
Die Kardiotoxizität von Adriamycin (Doxorubicin) kann durch Mitomycin verstärkt werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen keine hinreichenden Daten für die Verwendung von Mitomycin bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). Mitomycin hat eine mutagene, teratogene und karzinogene Wirkung und kann daher die Entwicklung des Embryos beeinträchtigen. Mitomycin sollte während der Schwangerschaft nicht angewendet werden. Bei vitaler Indikation zur Behandlung einer schwangeren Patientin sollte eine medizinische Beratung über das mit der Behandlung verbundene Risiko von schädigenden Wirkungen für das Kind erfolgen.
Stillzeit
Es gibt Hinweise dafür, dass Mitomycin in die Muttermilch übergeht. Aufgrund seiner erwiesenen mutagenen, teratogenen und karzinogenen Wirkung darf Mitomycin während der Stillzeit nicht gegeben werden. Daher ist Mitocin 20 mg während der Stillzeit kontraindiziert (siehe Abschnitt 4.3).
Fertilität/Empfängnisverhütung bei Männern und Frauen
Patientinnen im geschlechtsreifen Alter sollten während und bis zu 6 Monaten nach Beendigung der Chemotherapie empfängnisverhütende Maßnahmen ergreifen bzw. sexuelle Abstinenz einhalten.
Mitomycin wirkt erbgutschädigend. Männern, die mit Mitomycin behandelt werden, wird daher empfohlen, während der Behandlung und bis zu 6 Monaten danach kein Kind zu zeugen und sich vor Therapiebeginn wegen der Möglichkeit einer irreversiblen Infertilität durch die Therapie mit Mitomycin über eine Spermakonservierung beraten zu lassen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Dieses Arzneimittel kann auch bei bestimmungsgemäßem Gebrauch durch Auslösen von Übelkeit und Erbrechen das Reaktionsvermögen soweit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr bzw. zum Bedienen von Maschinen beeinträchtigt ist. Das gilt besonders in Verbindung mit Alkohol.
4.8 Nebenwirkungen
Die Nebenwirkungen sind im Folgenden nach Systemorganklassen und Häufigkeit aufgeführt. Die Häufigkeiten sind wie folgt definiert:
Sehr häufig (1/10), häufig (1/100, < 1/10), gelegentlich (1/1.000, < 1/100), selten (1/10.000, <
1/1.000), sehr selten (< 1/10.000) oder nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Mögliche Nebenwirkungen unter systemischer Therapie
Die häufigsten Nebenwirkungen von systemisch gegebenem Mitomycin sind gastrointestinale Symptome wie Übelkeit und Erbrechen sowie Knochenmarksuppression mit Leukopenie und, meist vorherrschend, Thrombozytopenie. Zur Knochenmarksuppression kommt es bei bis zu 65 % der Patienten.
Bei bis zu 10 % der Patienten muss mit schwerer Organtoxizität in Form von interstitieller Pneumonie oder Nephrotoxizität gerechnet werden.
Mitomycin ist potenziell hepatotoxisch.
|
Erkrankungen des Blutes und des Lymphsystems |
Sehr häufig Knochenmarksuppression, Leukopenie, Thrombozytopenie Selten Lebensbedrohende Infektion, Sepsis Hämolytische Anämie |
|
Erkrankungen des Immunsystems |
Sehr selten Schwere allergische Reaktion |
|
Herzerkrankungen |
Selten Herzinsuffizienz nach vorausgegangener Anthrazyklintherapie |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Häufig Interstitielle Pneumonie, Dyspnoe, Husten, Kurzatmigkeit Selten Pulmonale Hypertonie, Lungenvenenverschlusskrankheit (PV OD) |
|
Erkrankungen des Gastrointestinaltrakts |
Sehr häufig Übelkeit, Erbrechen Gelegentlich Mukositis, Stomatitis, Diarrhoe, Anorexie |
|
Leber- und Gallenerkrankungen |
Selten Leberfunktionsstörung, erhöhte Transaminasen, Ikterus, Lebervenenverschlusskrankheit (V OD) |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Häufig Exanthem, allergischer Hautausschlag, Kontaktdermatitis, palmoplantares Erythem Gelegentlich Alopezie |
|
Selten Generalisiertes Exanthem | |
|
Erkrankungen der Nieren und Harnwege |
Häufig Nierenfunktionsstörung, erhöhtes Serumkreatinin, Glomerulopathie, Nephrotoxizität Selten Hämolytisch-urämisches Syndrom (HUS) (häufig tödlich), Mikroangiopathisch-hämolytische Anämie (MAHA-Syndrom) |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Häufig Nach Extravasation: Cellulitis, Gewebsnekrose Gelegentlich Fieber |
Mögliche Nebenwirkungen unter intravesikaler Therapie
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Häufig Pruritus, allergischer Hautausschlag, Kontaktdermatitis, palmoplantares Erythem Selten Generalisiertes Exanthem |
|
Erkrankungen der Nieren und Harnwege |
Häufig Zystitis (möglicherweise hämorrhagisch), Dysurie, Nokturie, Pollakisurie, Hämaturie, lokale Reizung der Harnblasenwand Sehr selten Nekrotisierende Zystitis, allergische (eosinophile) Zystitis, Stenose der ableitenden Harnwege, verminderte Harnblasenkapazität, Kalzifizierung der Harnblasenwand und Harnblasenwandfibrose. |
4.9 Überdosierung
Im Fall einer Überdosierung muss mit einer schwereren Myelotoxizität bis hin zur Myelophthisis gerechnet werden, die erst nach etwa 2 Wochen klinisch voll in Erscheinung tritt.
Der Zeitraum bis zum Absinken der Leukozyten auf den tiefsten Wert kann 4 Wochen betragen. Auch bei Verdacht auf Überdosierung muss daher eine längere, engmaschige hämatologische Kontrolle erfolgen.
Da keine effektiven Gegenmittel verfügbar sind, ist bei der Gabe dieses Arzneimittels größtmögliche Sorgfalt geboten.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: antineoplastischer Wirkstoff, andere zytotoxische Antibiotika ATC-Code: L01DC03
Das Antibiotikum Mitomycin ist ein Zytostatikum aus der Gruppe der alkylierenden Wirkstoffe.
Mitomycin ist ein aus Streptomyces caespitosus isoliertes Antibiotikum mit anti-neoplastischer Wirkung. Es liegt in inaktiver Form vor. Die Aktivierung zu einem trifunktionellen Alkylans erfolgt rasch, entweder bei physiologischem pH in Anwesenheit von NADPH im Serum oder praktisch in allen Körperzellen intrazellulär mit Ausnahme des Cerebrums, da die Blut-Hirn-Schranke von Mitomycin nicht überwunden wird. Die 3 alkylierenden Radikale stammen je von einer Chinon-, einer Aziridin- und einer Urethangruppe. Der Wirkungsmechanismus beruht überwiegend auf einer Alkylierung der DNS (weniger RNS) mit entsprechender Hemmung der DNS-Synthese. Der Grad der DNS-Schädigung korreliert mit dem klinischen Effekt und ist in resistenten Zellen geringer als in sensiblen. Wie bei anderen Alkylanzien werden proliferierende Zellen stärker geschädigt als solche, die sich in der Ruhephase (GO) des Zellzyklus befinden. Zusätzlich werden, insbesondere bei Anwendung höherer Dosen, freie Peroxidradikale freigesetzt, die zu DNS-Brüchen führen. Die Freisetzung von Peroxidradikalen wird mit dem organspezifischen Muster an Nebenwirkungen in Verbindung gebracht.
5.2 Pharmakokinetische Eigenschaften
Nach intravenöser Gabe von 10 - 20 mg/m2 Mitomycin wurden maximale Plasmaspiegel von 0,4 - 3,2 pg/ml gemessen. Die biologische Halbwertszeit ist kurz und liegt zwischen 40 und 50 Minuten. Der Serumspiegel fällt biexponentiell zunächst innerhalb der ersten 45 Minuten steil, danach langsamer ab.
Nach ca. 3 Stunden liegen die Serumspiegel meist unter der Nachweisgrenze. Der Hauptort der Metabolisierung und Elimination ist die Leber. Entsprechend wurden hohe Konzentrationen von Mitomycin in der Gallenblase gefunden. Die renale Ausscheidung spielt für die Elimination nur eine untergeordnete Rolle.
Bei der intravesikalen Therapie wird Mitomycin in nur unwesentlichen Dosen resorbiert. Trotzdem kann eine systemische Wirkung nicht vollständig ausgeschlossen werden.
5.3 Präklinische Daten zur Sicherheit
Im Tierversuch wirkt Mitomycin toxisch auf alle proliferierenden Gewebe, insbesondere auf die Zellen des Knochenmarks und die der Schleimhaut des Magen-Darm-Kanals, und es kommt zu einer Hemmung der Spermiogenese.
Mitomycin besitzt mutagene, karzinogene und teratogene Wirkungen, die in entsprechenden experimentellen Systemen nachweisbar sind.
Lokale Verträglichkeit
Bei paravenöser Injektion oder beim Übertritt aus dem Gefäß in umliegendes Gewebe verursacht Mitomycin schwerwiegende Nekrosen.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Mannitol (Ph.Eur.),
36%ige Salzsäure und Natriumhydroxid zur pH-Einstellung
Lösungsmittel zur Herstellung einer Lösung zur intravesikalen Anwendung: Natriumchlorid und Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Inkompatibilitäten traten mit stark sauren oder alkalischen Substanzen auf. Der optimale pH der gebrauchsfertigen Mitomycinlösung beträgt 7,0.
6.3 Dauer der Haltbarkeit
Instillationsset: 1 Jahr
Rekonstituierte Lösung:
Es dürfen nur klare Lösungen verwendet werden.
Der Inhalt der Durchstechflaschen ist nur zum Einmalgebrauch bestimmt.
Nicht verwendete Lösung muss verworfen werden.
Die chemische und physikalische Stabilität bei Raumtemperatur und Lichtexposition einer rekonstituierten Lösung beträgt:
• 2 Stunden mit Natriumchloridlösung 9 mg/ml (0,9 %) (Instillationsset)
Alle rekonstituierten Lösungen sind für den sofortigen Gebrauch vorgesehen.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern. Durchstechflasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Aufbewahrungsbedingungen nach Rekonstituieren des Arzneimittels, siehe Abschnitt 6.3.
6.5 Art und Inhalt des Behältnisses
Packungen mit 1 Durchstechflasche aus Braunglas (Typ I), 1 PVC-Beutel mit 20 ml einer 0,9 % Natriumchloridlösung, 1 Tiemann-Katheter
Packungen mit 4 Durchstechflaschen aus Braunglas (Typ I), 4 PVC-Beutel mit 20 ml einer 0,9 % Natriumchloridlösung, 4 Tiemann-Katheter
Packungen mit 5 Durchstechflaschen aus Braunglas (Typ I), 5 PVC-Beutel mit 20 ml einer 0,9 % Natriumchloridlösung, 5 Tiemann-Katheter
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Die besonderen Vorsichtsmaßnahmen für die Vorbereitung und Beseitigung nicht verwendeter zytotoxischer Arzneimittel sind einzuhalten.
Die rekonstituierte Lösung sollte lichtgeschützt im Kühlschrank aufbewahrt werden.
Vor Verwendung der gebrauchsfertigen Lösung muss sie auf Raum- bzw. Körpertemperatur angewärmt werden.
Gebrauchsanweisung für das Lösungsmittel zur Herstellung der intravesikalen Lösung (Instillationsset)
Nehmen Sie den Beutel mit der 0,9%ige Natriumchloridlösung aus der Klarsicht-Schutzfolie.
Die weiße Klemme unterhalb des Beutels mit der 0,9%ig Natriumchloridlösung sollte offen sein und bleiben.
Ziehen Sie die Schutzkappe vom violetten Adapter. Legen Sie den Entsorgungsbeutel griffbereit.
Blauer
Katheter-
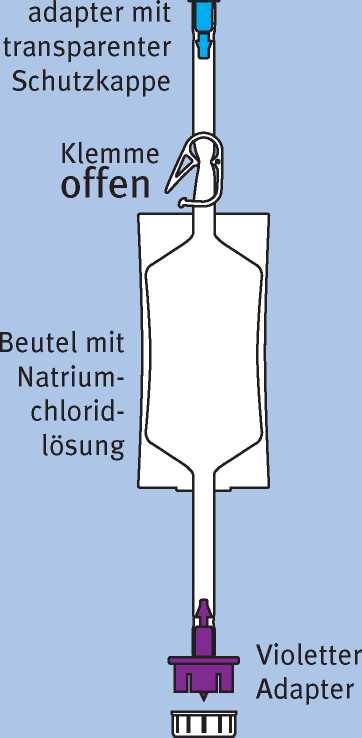
Entfernen Sie die weiße Kappe von der Durchstechflasche.
Setzen Sie den violetten Adapter zentral bzw. senkrecht auf den Gummistopfen und drücken Sie den violetten Adapter in den Gummistopfen der Durchstechflasche, bis er einrastet.
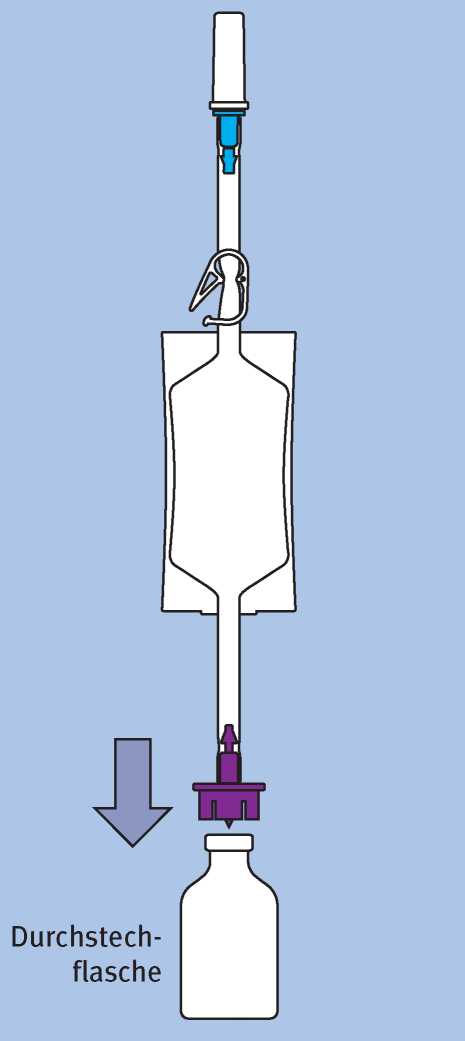
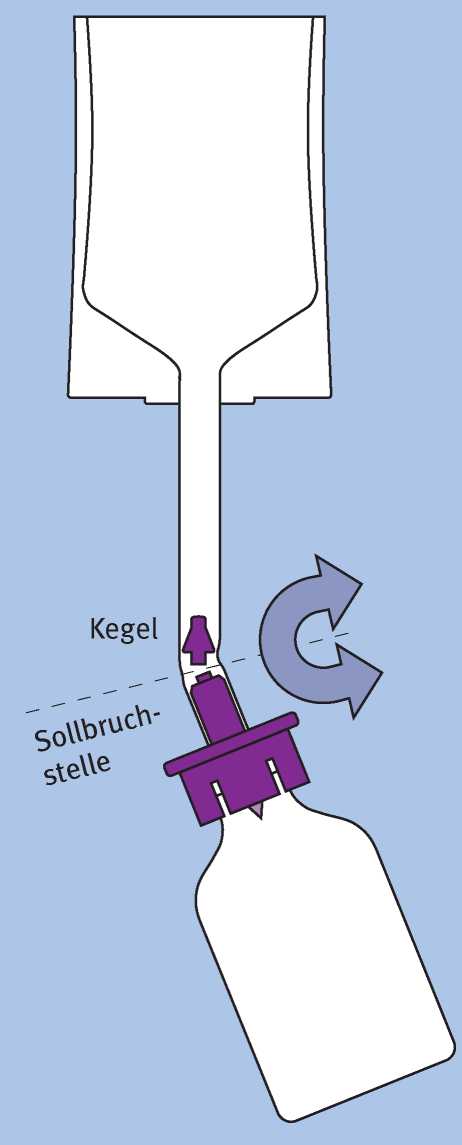
Biegen Sie den im Schlauch befindlichen Teil des violetten Adapters an der Sollbruchstelle solange hin und her, bis der Kegel abbricht und die Verbindung offen ist.
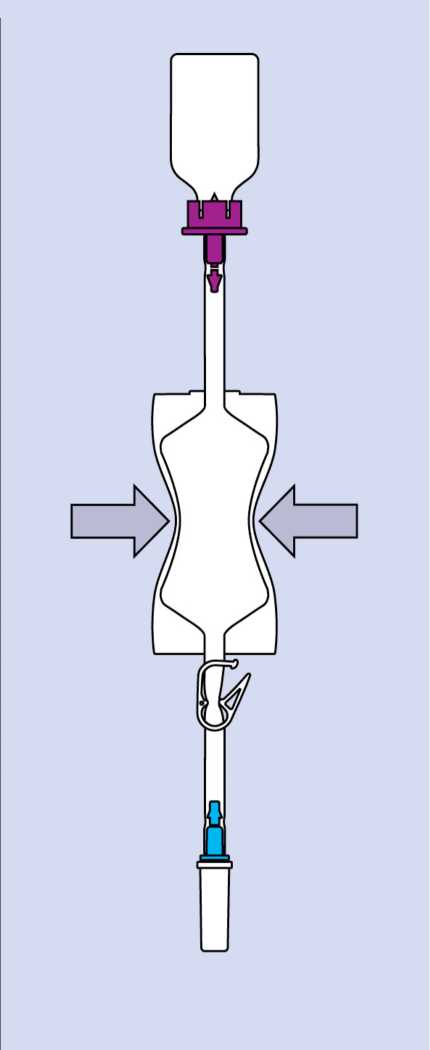
Drücken Sie den Beutel mehrfach zusammen, bis das Lösungsmittel in die Durchstechflasche geflossen ist.
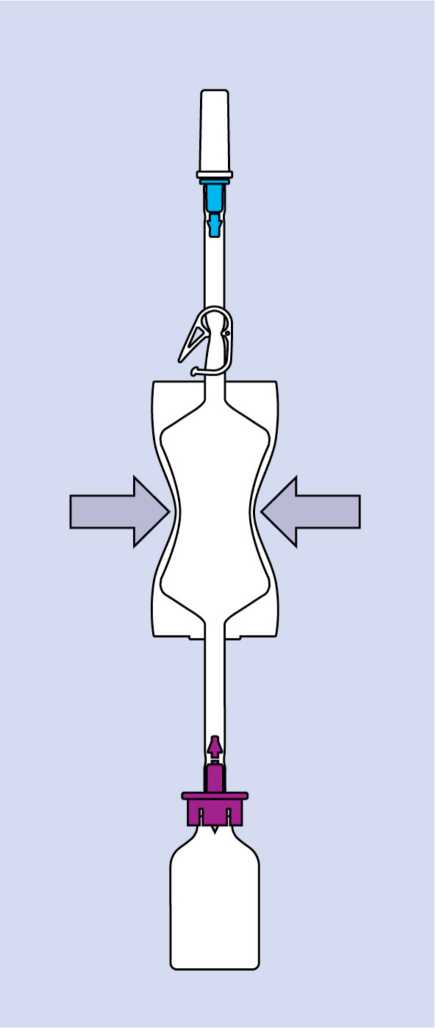
Drücken Sie die Luft aus dem Lösungsmittel-Beutel in die Durchstechflasche: Wenn der Druck nachlässt, sammelt sich die Mitomycin-Lösung im Beutel.
Diesen Schritt ggf. 1 - 2 mal wiederholen. Ein kleiner Rest der Flüssigkeit darf zum Schluss in der Mitocin-Durchstechflasche verbleiben.
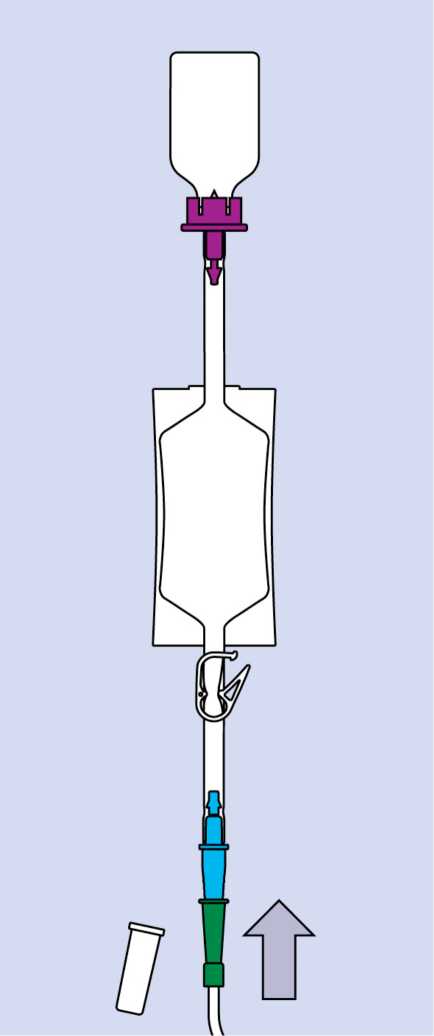
Wenn Sie den Katheter in die Harnröhre / Blase eingeführt haben und Sie mit der Instillation beginnen möchten, ziehen Sie die transparente Kappe von dem blauen Katheteradapter ab. Schieben Sie dann den blauen Katheteradapter fest in das grüne Ansatzstück des Katheters.
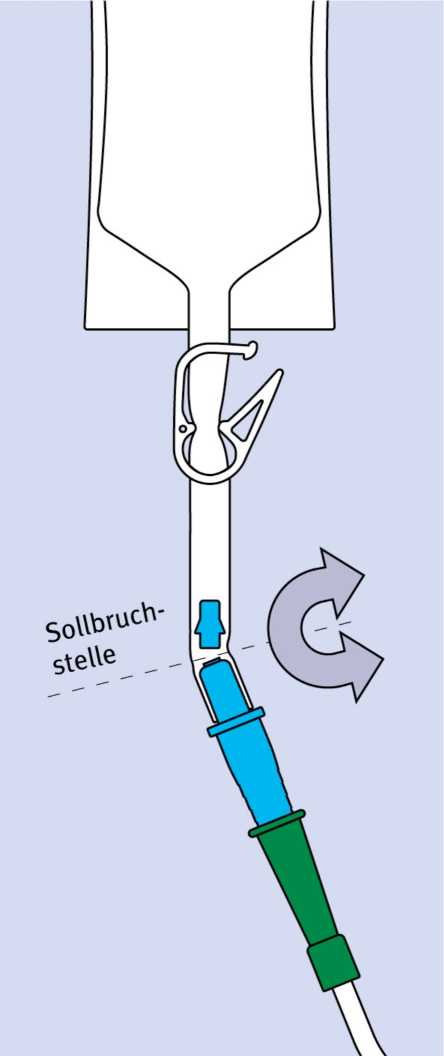
Brechen Sie den blauen Katheteradapter im Schlauchteil an der Sollbruchstelle durch, so dass die Mitomycin-Lösung durch den Katheter in die Blase fließen kann.
Um ein Nachträufeln zu verhindern, können Sie nach der Instillation die Klemme schließen.
Bitte entsorgen Sie alle Teile, die mit der Mitomycin-Lösung in Berührung gekommen sind, in dem beigefügten Entsorgungsbeutel im Sondermüll.
7. INHABER DER ZULASSUNG
Speciality European Pharma Limited 14 Took’s Court, London EC4A 1LB Vereinigtes Königreich
Tel: +44 (0)20 7421 7400 Fax: +44 (0)20 7421 7401
8. ZULASSUNGSNUMMER(N)
83383.00.00
9. DATUM DER ERTEILUNG DER ERSTZULASSUNG
10.06.2013
10. STAND DER INFORMATION
11/2013
16