Mivacron 10Mg
1
12.05.2014
Wortlaut der für die Gebrauchsinformation und Fachinformation vorgesehenen Angaben_
Gebrauchsinformation und Fachinformation
Mivacron 10 mg
Injektionslösung Mivacron® 20 mg
Injektionslösung
Mivacuriumchlorid
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich bitte an Ihren Arzt oder Apotheker.
- Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt oder Apotheker.
Diese Packungsbeilage beinhaltet:
1. Was ist Mivacron und wofür wird es angewendet?
2. Was müssen Sie vor der Anwendung von Mivacron beachten?
3. Wie ist Mivacron anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Mivacron aufzubewahren?
6. Weitere Informationen
1. WAS IST MIVACRON UND WOFÜR WIRD ES ANGEWENDET?
Mivacron ist ein kurzwirksames, nicht-depolarisierendes Muskelrelaxans zur Anwendung bei Allgemeinanästhesien, bei der Intubation und bei der künstlichen Beatmung von Erwachsenen, Kindern und Säuglingen über 2 Monaten.
2. WAS MÜSSEN SIE VOR DER ANWENDUNG VON MIVACRON BEACHTEN? Mivacron darf nicht angewendet werden bei
- Überempfindlichkeit gegen Mivacuriumchlorid oder einen der sonstigen Bestandteile
- Unmöglichkeit der künstlichen Beatmung
- Plasmacholinesterasemangel oder Patienten mit homozygot atypischer Plasmacholinesterase (siehe „Besondere Vorsicht bei der Anwendung von Mivacron ist erforderlich“)
Besondere Vorsicht bei der Anwendung von Mivacron ist erforderlich
Wie alle anderen Muskelrelaxantien lähmt Mivacron die Atem- und Skelettmuskulatur, ohne das Bewusstsein zu beeinträchtigen. Deshalb darf Mivacron erst nach Gabe hypnotisch wirkender Pharmaka angewendet werden. Ein Antidot sollte unmittelbar zur Verfügung stehen.
Mivacron darf nur von erfahrenen Anästhesisten oder unter strenger Aufsicht erfahrener Anästhesisten angewendet werden, die mit den Wirkungen von Mivacron vertraut sind und denen angemessene Möglichkeiten zur endotrachealen Intubation und künstlichen Beatmung und zur kardiopulmonalen Reanimation zur Verfügung stehen.
Mivacron darf nicht intraarteriell appliziert werden.
Eine verlängerte und verstärkte neuromuskuläre Blockade durch Mivacron kann sekundär, aufgrund einer reduzierten Plasmacholinesterase-Aktivität, bei folgenden Zuständen oder Erkrankungen auftreten:
- physiologischen Veränderungen in Schwangerschaft und Wochenbett (siehe „Schwangerschaft und Stillzeit“)
- genetisch bedingten Abnormalitäten der Plasmacholinesterase (siehe unten und "Mivacron darf nicht angewendet werden bei“)
- schwerwiegendem generalisiertem Wundstarrkrampf, Tuberkulose und anderen schweren oder chronischen Infektionen
- chronischen, beeinträchtigenden Erkrankungen, bösartigen Tumorerkrankungen, chronischer Anämie und Unterernährung
- Myxödem und Kollagenosen
- dekompensierter Herzkrankheit
- peptischem Ulkus
- Verbrennungen (siehe unten)
- Leberversagen im Endstadium (siehe „Wie ist Mivacron anzuwenden?“)
- akutem oder chronischem Nierenversagen oder Nierenversagen im Endstadium (siehe „Wie ist Mivacron anzuwenden?“)
- iatrogen: nach Plasma-Austausch, Plasmapherese, kardiopulmonärem Bypass und als Ergebnis einer zeitgleichen Arzneimitteltherapie (siehe „Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen“)
Homozygote Genträger für die atypische Pseudocholinesterase (1 von 2.500 Patienten) reagieren auf die Gabe von Mivacurium mit einer wesentlich verlängerten neuromuskulären Blockade. So führte bei 3 erwachsenen Patienten eine Mivacurium-Dosis von 0,03 mg/kg KG (etwa die EDJ0.20 bei genotypisch normalen Patienten) zu einer 26 bis 128 Minuten andauernden vollständigen neuromuskulären Blockade. Bei Patienten, die für das atypische Plasmacholinesterase-Gen heterozygot sind, ist die klinisch wirksame Dauer der neuromuskulären Blockade durch 0,15 mg Mivacurium/kg gegenüber Kontrollpatienten um etwa 10 Minuten verlängert. Nach Beginn der Spontanerholung wurde die neuromuskuläre Blockade bei diesen Patienten mit üblichen Dosen von Neostigmin aufgehoben.
Patienten mit Verbrennungen können gegen nicht-depolarisierende Muskelrelaxanzien resistent werden und erhöhte Dosen benötigen. Solche Patienten können jedoch auch eine herabgesetzte Plasmacholinesterase-Aktivität aufweisen, die eine Dosissenkung erforderlich macht. Patienten mit Verbrennungen sollte deshalb zuerst eine Testdosis von 0,015 bis 0,020 mg Mivacurium/kg KG verabreicht werden. Die sich daran anschließenden Dosen sollten unter neuromuskulärem Monitoring mit einem Nervenstimulator ermittelt werden.
Mivacron sollte nur mit Vorsicht an Patienten, deren Anamnese auf eine gesteigerte Empfindlichkeit gegenüber den Effekten von Histamin hinweist, z. B. Asthma, verabreicht werden. Falls Mivacron bei dieser Patientengruppe zur Anwendung kommt, sollte sich die Verabreichung über einen Zeitraum von 60 Sekunden erstrecken.
Mivacron sollte nur mit Vorsicht bei Patienten angewendet werden, bei denen Überempfindlichkeitsreaktionen gegenüber anderen Muskelrelaxanzien auftraten, da eine hohe Rate allergischer Kreuzreaktionen (mehr als 50 %) zwischen Muskelrelaxanzien berichtet wurde.
Bei Patienten, die besonders empfindlich auf einen Abfall des arteriellen Blutdrucks reagieren können, wie z. B. Patienten mit Hypovolämie, sollte Mivacron über einen Zeitraum von 60 Sekunden verabreicht werden.
Bei Erwachsenen wurde die Verabreichung von 0,2 mg Mivacurium/kg KG (das Dreifache der ED95) als schnelle Bolusinjektion mit einer Histaminfreisetzung in Zusammenhang gebracht. Diese Dosis entspricht der zweifachen ED95 bei Kindern im Alter von 2 bis 12 Jahren. Deshalb ist bei der Verabreichung von Mivacron bei dieser Altersgruppe Vorsicht geboten. Allerdings kann eine langsamere Verabreichung von 0,2 mg/kg KG Mivacurium und die geteilte Verabreichung der 0,25 mg/kg KG Mivacurium-Dosis (siehe „3. Wie ist Mivacron anzuwenden? I. Dosierungsempfehlungen für Erwachsene“) die kardiovaskulären Effekte dieser Dosen minimieren. Negative Auswirkungen auf das kardiovaskuläre System konnten bei Kindern, die diese Dosis als raschen Bolus im Rahmen klinischer Studien erhielten, nicht beobachtet werden.
Innerhalb des empfohlenen Dosisbereichs weist Mivacron keine signifikanten Vagus- oder Ganglienblockierenden Effekte auf. Infolgedessen hat Mivacron innerhalb dieses Bereichs keinen klinisch bedeutsamen Einfluss auf die Herzfrequenz. Bradykardien nach Gabe anderer bei der Anästhesie verwendeter Arzneimittel oder nach Vagusreizung im Laufe von chirurgischen Eingriffen werden durch Mivacron nicht maskiert.
Die neuromuskuläre Funktion sollte während der Anästhesie mittels eines Nervenstimulators überwacht werden. Die Dosierung kann so den operativen Erfordernissen genau angepasst und das Risiko einer Überdosierung minimal gehalten werden, insbesondere bei neuromuskulären Erkrankungen, bei Leber- und Nierenfunktionsstörungen sowie bei allen Erkrankungen, die den Arzneistoffwechsel beeinflussen.
Mivacron sollte bei allen Erkrankungen des neuromuskulären Systems mit größter Vorsicht eingesetzt werden, da bei diesen Patienten die Reaktion auf neuromuskulär blockierende Substanzen erheblich verändert sein kann. Ausmaß und Richtung dieser Veränderung können stark variieren.
Bei kachektischen Patienten ist eine erhöhte Empfindlichkeit gegenüber dem Wirkstoff zu erwarten.
Schwere Störungen des Säure-Basen- bzw. des Elektrolythaushaltes können die Empfindlichkeit gegen Mivacurium sowohl steigern als auch herabsetzen.
Die Mivacron-Lösung hat einen pH-Wert im sauren Bereich (etwa pH 4,5) und sollte nicht mit stark alkalischen Lösungen (z. B. Barbituratlösung) gemischt bzw. gleichzeitig durch denselben venösen Zugang verabreicht werden. Mivacron erwies sich mit den folgenden üblicherweise bei Operationen in Form von sauren Lösungen angewandten Arzneimitteln als verträglich: Fentanyl, Alfentanil, Sufentanil, Droperidol und Midazolam.
In Fällen, in denen andere Anästhetika durch die gleiche Verweilkanüle verabreicht werden sollen und die Verträglichkeit mit Mivacron nicht nachgewiesen ist, sollte vor und nach der Verabreichung von Mivacron eine Spülung des venösen Zugangs mit physiologischer Kochsalzlösung erfolgen.
Untersuchungen an für das Auftreten der malignen Hyperthermie empfindlichen Schweinen ergaben, dass Mivacron dieses Syndrom nicht auslöst. Ausreichende klinische Untersuchungen bei entsprechend empfindlichen Patienten liegen nicht vor.
Aufhebung der neuromuskulären Blockade:
Wie bei anderen Muskelrelaxanzien sollten Anzeichen einer Spontanerholung vorhanden sein, bevor ein Cholinesterasehemmstoff (z. B. Neostigmin) verabreicht wird. Der Gebrauch eines peripheren Nervenstimulators zur Bestimmung der Erholung vor und während der Aufhebung der neuromuskulären Blockade wird sehr empfohlen.
Über die Langzeitanwendung von Mivacron im intensivmedizinischen Bereich liegen keine Erfahrungen vor.
Säuglinge unter 2 Monaten:
Die Anwendung bei Neugeborenen und Säuglingen unter 2 Monaten wird nicht empfohlen, da nur begrenzte Daten in dieser Altersgruppe vorliegen (siehe auch Abschnitt 3.).
Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen / anwenden bzw. vor kurzem eingenommen / angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt.
Die Wirkung nachfolgend genannter Arzneistoffe bzw. Präparategruppen kann bei gleichzeitiger Behandlung mit Mivacron beeinflusst werden.
Die neuromuskuläre Blockade nach Anwendung von Mivacron kann durch die gleichzeitige Gabe von Inhalationsanästhetika (z. B. Enfluran, Isofluran, Sevofluran und Desfluran) und anderen nicht-depolarisierenden Muskelrelaxanzien verstärkt werden.
Mivacron ist nach einer mit Succinylcholin erfolgten Intubation sicher angewendet worden. Vor der Verabreichung von Mivacron sollten jedoch Anzeichen einer Spontanerholung von Succinylcholin abgewartet werden.
Bei gleichzeitiger Verabreichung mit nicht-depolarisierenden Muskelrelaxanzien ist eine Verstärkung und/oder Verlängerung der neuromuskulären Blockade durch folgende Arzneimittel nicht ausgeschlossen:
- Antibiotika (z. B. Aminoglykoside, Polymyxine, Spectinomycin, Tetracycline, Lincomycin, Clindamycin)
- Antiarrhythmika (z. B. Propranolol, Calcium-Antagonisten, Lidocain, Procainamid, Chinidin)
- Diuretika (z. B. Furosemid, Thiazid-Diuretika, Mannitol, Acetazolamid)
- Magnesiumsalze
- Ketamin
- Lithiumsalze
- Ganglienblocker (z. B. Trimethaphan, Hexamethonium)
Ein neuromuskuläres Monitoring ist empfohlen und ggf. eine entsprechende Dosisanpassung aus dem Monitoring abzuleiten.
Die durch Mivacuriumchlorid hervorgerufene neuromuskuläre Blockade kann durch vorhergehende oder begleitende Gabe von Arzneimitteln, die die Plasmacholinesterase-Aktivität reduzieren können, verlängert werden. Hierzu zählen antimitotische Präparate, Monoaminooxidase-Hemmer (MAOHemmer), Ecothiophat-Jodid, Pancuronium, Organophosphate, bestimmte Hormone, Bambuterol und selektive Serotonin-Wiederaufnahmehemmer (SSRI). Die vorhergehende Gabe von Acetylcholinesterasehemmern (Ausnahme: Edrophonium) kann auch die neuromuskuläre Blockade von Mivacurium aufgrund der Hemmung der Plasmacholinesterase verlängern.
In seltenen Fällen können bestimmte Arzneimittel das Krankheitsbild einer bestehenden Myasthenia gravis verschlechtern, einer latenten Myasthenia gravis zum Ausbruch verhelfen oder selbst diese Erkrankung auslösen. In diesen Fällen ist mit einer erhöhten Empfindlichkeit gegenüber Mivacron zu rechnen. Zu diesen Arzneimitteln, die die vorgenannten Ereignisse auslösen können, zählen:
- Verschiedene Antibiotika wie Aminoglykoside, Polymyxine, Spectinomycin, Tetracycline, Lincomycin und Clindamycin
- Betablocker: Propranolol, Oxprenolol
- Antiarrhythmika: Procainamid, Chinidin
- Antirheumatika: Chloroquin, D-Penicillamin
- Trimethaphan
- Chlorpromazin
- Steroide
- Phenytoin
- Lithium
Die Verabreichung von Kombinationen von anderen nicht-depolarisierenden Muskelrelaxanzien in Verbindung mit Mivacron kann einen Relaxationsgrad hervorrufen, dessen Ausmaß das übertrifft, was nach Gabe einer äquipotenten Mivacron-Dosis zu erwarten wäre. Diese synergistischen Effekte können von einer Arzneistoff-Kombination zur anderen variieren.
Ein mit Mivacron durchgeführter neuromuskulärer Block sollte nicht mit depolarisierenden Muskelrelaxanzien (z. B. Succinylcholin) verlängert werden. Dies kann zu einer verlängerten und komplexen neuromuskulären Blockade, die mit Cholinesterasehemmstoffen nur noch schwer zu antagonisieren ist, führen.
Nach bisheriger Kenntnis sind Wechselwirkungen zwischen Mivacron und den Antikonvulsiva Phenytoin und Carbamazepin in Form einer Verzögerung des Wirkungseintritts bzw. Verkürzung der Wirkungsdauer im Vergleich zu anderen nicht-depolarisierenden Muskelrelaxanzien eher unwahrscheinlich.
Schwangerschaft und Stillzeit
Von der Anwendung bei Kaiserschnittentbindungen abgesehen, liegen keine Erfahrungen mit der Anwendung von Mivacurium, dem Inhaltsstoff von Mivacron, in der Schwangerschaft vor. Mivacron sollte in der Schwangerschaft nicht verabreicht werden, es sei denn, der erwartete klinische Nutzen für die Mutter übersteigt ein mögliches Risiko für den sich entwickelnden Fötus.
Während der Schwangerschaft sinkt der Cholinesterase-Spiegel im Plasma. Es zeigte sich, dass dadurch eine Dosisanpassung der Infusionsrate bei Anwendung von Mivacurium zur neuromuskulären Blockade beim Kaiserschnitt erforderlich ist. Eine weitere Reduzierung der Infusionsrate während des Kaiserschnitts kann auch bei Patientinnen notwendig sein, die mit Magnesiumsulfat vorbehandelt sind, da Magnesium einen wirkungsverstärkenden Effekt hat.
Es ist nicht bekannt, ob Mivacurium in die Muttermilch übertritt. Daher sollte nach Anwendung von Mivacron mindestens 24 Stunden auf das Stillen verzichtet werden.
Verkehrstüchtigkeit und das Bedienen von Maschinen
Nach der Gabe von Mivacron im Rahmen einer Allgemeinanästhesie dürfen die Patienten 24 Stunden nicht aktiv am Straßenverkehr teilnehmen und keine Maschinen bedienen. Diese Warnung bezieht sich eher auf die gleichzeitig verwendeten Narkosemittel als auf das Muskelrelaxans.
3. WIE IST MIVACRON ANZUWENDEN?
Mivacron wird intravenös verabreicht.
Mivacron enthält keine Konservierungsstoffe und ist daher nur zum Einmalgebrauch bestimmt. Eine Verdünnung sollte unter aseptischen Bedingungen und unmittelbar vor der Anwendung erfolgen (siehe Abschnitt 5. „Wie ist Mivacron aufzubewahren?“).
Grundsätzlich gilt, dass nur die kleinste Dosis verabreicht werden sollte, mit der die gewünschte Muskelrelaxation erreicht werden kann.
Zur Ermittlung der individuellen Dosis wird bei der Verabreichung von Muskelrelaxanzien die Anwendung eines Nervenstimulators zur Überwachung des Relaxationsgrades empfohlen.
Falls hierzu die Möglichkeit nicht besteht, sind die nachfolgenden Dosierungsempfehlungen als allgemeine Richtlinie für Erwachsene und Kinder zu verstehen:
I. Dosierungsempfehlungen für Erwachsene
a) Anwendung als Injektionslösung
Relaxation
Unter Allgemeinanästhesie führt eine Dosis von 0,06 bis 0,09 mg Mivacurium/kg KG (mittlere Dosis
0. 07.mg Mivacurium/kg KG) nach Reizung des Nervus ulnaris zu einer 95 %igen Suppression der Einzelreizantwort des Musc. adductor pollicis (ED95).
Intubation
Die folgenden Dosierungsregime werden für die Trachealintubation empfohlen:
1. Nach i.v.-Injektion von 0,20 mg Mivacurium/kg KG, die über einen Zeitraum von 30 Sekunden verabreicht werden sollen, kann innerhalb von 2 bis 2 V Minuten eine Trachealintubation durchgeführt werden.
2. 0,25 mg Mivacurium/kg KG wird in 2 einzelnen i.v.-Injektionen, nämlich einer Initialdosis von 0,15 mg Mivacurium/kg KG und einer zweiten Injektion von 0,10 mg Mivacurium/kg KG
30 Sekunden nach der Initialdosis, verabreicht. Innerhalb von 1 V bis 2 Minuten nach der Initialdosis kann eine Trachealintubation durchgeführt werden.
Der empfohlene Dosisbereich für die Initial-Bolusinjektion bei gesunden Erwachsenen beträgt 0,07 bis 0,25 mg Mivacurium/kg KG. Die Dauer der neuromuskulären Blockade ist dosisabhängig. Nach Verabreichung von 0,07; 0,15; 0,20 bzw. 0,25 mg Mivacurium/kg KG wird eine klinisch wirksame neuromuskuläre Blockade von etwa 13; 16; 20 bzw. 23 Minuten erreicht. Dosierungen bis zu 0,15 mg/kg KG sind über einen Zeitraum von 5 bis 15 Sekunden, höhere Dosierungen über einen Zeitraum von 30 Sekunden zu verabreichen, um die Möglichkeit von auftretenden kardiovaskulären Nebenwirkungen zu minimieren.
Repetitions-Dosen
Die vollständige neuromuskuläre Blockade kann mit Erhaltungsdosen von Mivacron verlängert werden. 0,1 mg Mivacurium/kg KG verlängern die neuromuskuläre Blockade unter Allgemeinanästhesie um jeweils 15 Minuten. Aufeinanderfolgende Repetitionsdosen haben keine kumulativen Effekte in Bezug auf die neuromuskulär-blockierende Wirkung des Arzneimittels.
Die neuromuskulär-blockierende Wirkung von Mivacurium wird durch Isofluran- oder Enfluran-Anästhesie verstärkt. Nach Erreichen der Steady-State Anästhesie mit Isofluran bzw. Enfluran soll die empfohlene Initialdosis von Mivacurium um bis zu 25 % reduziert werden.
Bei Erwachsenen ist die Spontanerholung, gemessen als der Zeitraum T1 einer 5 bis 95 %igen Erholung, nach i.v.-Injektion ca. 15 Minuten nach ihrem Einsetzen unabhängig von der verabreichten Dosis vollständig abgeschlossen.
Die Wirkung von Mivacron kann rasch durch übliche Dosen von Cholinesterasehemmstoffen aufgehoben werden. Die Gabe von Cholinesterasehemmstoffen ist jedoch nicht routinemäßig erforderlich, da die Spontanerholung von Mivacron rasch erfolgt und die Erholungsphase nur um 5 bis 6 Minuten verkürzt werden würde.
b) Anwendung als Infusionslösung
Zur Aufrechterhaltung der neuromuskulären Blockade bei operativen Eingriffen von längerer Dauer sollten bei den ersten Anzeichen einer Spontanerholung 8 bis 10 ^g Mivacurium/kg KG/min (0,5 bis 0,6 mg Mivacurium/kg KG/Stunde) als kontinuierliche Infusion verabreicht werden. Die Höhe der initialen Infusionsrate sollte entsprechend der Reaktion des Patienten auf die periphere Nervenreizung sowie anhand klinischer Kriterien zur Abschätzung der neuromuskulären Blockade gewählt werden. Einstellungen der Infusionsrate sollten in Stufen von ca. 1 ^g Mivacurium/kg KG/min (0,06 mg
Mivacurium/kg KG/Stunde) erfolgen. Im Allgemeinen sollte eine einmal gewählte Infusionsrate über einen Zeitraum von mindestens 3 Minuten gegeben werden, ehe sie geändert wird. Unter Allgemeinanästhesie halten Infusionsraten von 6 bis 7 pg Mivacurium/kg KG/min die neuromuskuläre Blockade im Bereich von 89 bis 99 % über hinreichend lange Zeiträume aufrecht. Während einer Steady-State Isofluran- oder Enfluran-Narkose sollte eine Reduktion der Infusionsrate um bis zu 40 % in Betracht gezogen werden. Eine Studie hat gezeigt, dass die Infusionsrate von Mivacurium bei Sevofluran um bis zu 50 % reduziert werden sollte.
Die Spontanerholung nach der Infusion von Mivacron ist von der Dauer der Infusion unabhängig und mit der Erholung nach Verabreichung einer Einzeldosis vergleichbar.
Die Dauerinfusion von Mivacron ist weder mit der Entwicklung einer Tachyphylaxie noch mit kumulativen Effekten auf die neuromuskulären Blockade in Zusammenhang gebracht worden.
Mivacron kann unverdünnt verabreicht werden.
Die Mivacron-Injektionslösungen sind mit folgenden Infusionslösungen kompatibel:
0,9 %ige NaCl-Lösung (G/V = Gewicht/Volumen),
5 %ige Glukose-Lösung (G/V = Gewicht/Volumen),
Ringer-Lactat-Lösung.
II. Dosierungsempfehlungen für Säuglinge, Kleinkinder, Kinder von 2 Monaten bis 12 Jahren, ältere Patienten, Patienten mit kardiovaskulären Erkrankungen, Patienten mit beeinträchtigter Nieren- oder Leberfunktion, Patienten mit eingeschränkter Plasmacholinesterase-Aktivität, adipöse Patienten und Patienten mit Verbrennungen
1.) Altersgruppen von 7 Monaten bis 12 Jahren
Kinder haben einen schnelleren Wirkungseintritt sowie eine kürzere klinisch effektive Wirkungsdauer. Darüber hinaus tritt bei Kindern die Spontanerholung schneller ein als bei erwachsenen Patienten.
a) Anwendung als Injektionslösung
Initial werden Bolusinjektionen im Bereich von 0,1 bis 0,2 mg Mivacurium/kg KG, die über einen Zeitraum von 5 bis 15 Sekunden verabreicht werden sollen, empfohlen. Höhere Dosen sollten nicht verabreicht werden. Bei Gabe während einer stabilen balancierten Allgemeinanästhesie mit Narkotika bewirken Dosen von 0,2 mg Mivacurium/kg KG eine klinisch wirksame neuromuskuläre Blockade von ca. 9 Minuten.
Für eine Trachealintubation wird eine Mivacron-Dosis von 0,2 mg/kg KG empfohlen. Ca. 2 Minuten nach Verabreichung dieser Dosis wird eine maximale neuromuskuläre Blockade erzielt (A bis 1 Minute schneller als bei Erwachsenen). Eine Intubation sollte innerhalb dieses Zeitraums erfolgen können.
Erhaltungsdosen sind bei Kleinkindern und Kindern im Allgemeinen häufiger erforderlich als bei Erwachsenen. Eine Erhaltungsdosis von 0,1 mg/kg KG verlängert die klinisch wirksame neuromuskuläre Blockade während einer Allgemeinanästhesie mit Narkotika um ca. 6 bis 9 Minuten.
Bei Säuglingen, Kleinkindern und Kindern ist die Spontanerholung ca. 10 Minuten nach ihrem Einsetzen vollständig abgeschlossen.
b) Anwendung als Infusionslösung
Kinder benötigen im Allgemeinen höhere Infusionsraten von Mivacron als Erwachsene.
Während einer Allgemeinanästhesie mit Narkotika beträgt die zur Aufrechterhaltung einer 89 bis 99 %igen neuromuskulären Blockade erforderliche Infusionsrate für Säuglinge/Kleinkinder (7 bis 23 Monate) im Durchschnitt ca. 11 pg Mivacurium/kg KG/min (ca. 0,7 mg Mivacurium/kg KG/Stunde).
Für Kinder von 2 bis 12 Jahren beträgt die entsprechende Infusionsrate ca. 13 bis 14 pg Mivacurium/kg KG/min (ca. 0,8 mg Mivacurium/kg KG/Stunde) während einer Allgemeinanästhesie mit Narkotika.
Die neuromuskuläre Blockade von Mivacron wird durch die Anwendung von Inhalationsanästhetika potenziert. Während einer Steady-State Anästhesie mit Isofluran kann eine Reduzierung um bis zu 70 % verglichen mit der Infusionsrate während einer Anästhesie mit Narkotika erforderlich sein. Eine Studie hat gezeigt, dass die Infusionsrate von Mivacron bei Sevofluran bei Kindern von 2 bis 12 Jahren um bis zu 70 % reduziert werden sollte.
2. ) Säuglinge im Alter von 2 bis 6 Monaten
Im Vergleich zu Erwachsenen hat Mivacron bei Säuglingen (2 bis 6 Monate) eine ähnliche ED95 (0,07 mg Mivacurium/kg KG), aber einen schnelleren Wirkungseintritt sowie eine kürzere klinisch effektive Wirkungsdauer. Darüber hinaus tritt bei Säuglingen die Spontanerholung schneller ein als bei erwachsenen Patienten.
a) Anwendung als Injektionslösung
Initial werden Bolusinjektionen im Bereich von 0,1 bis 0,15 mg Mivacurium/kg KG, die über einen Zeitraum von 5 bis 15 Sekunden verabreicht werden sollen, empfohlen. Höhere Dosen sollten nicht verabreicht werden.
Für eine Trachealintubation wird eine Mivacurium-Dosis von 0,15 mg/kg KG empfohlen. Ca.
1,4 Minuten (84 Sekunden) nach Verabreichung dieser Dosis wird eine maximale neuromuskuläre Blockade erzielt. Eine Intubation sollte innerhalb dieses Zeitraums erfolgen können.
Erhaltungsdosen sind bei Säuglingen im Allgemeinen häufiger erforderlich als bei Erwachsenen.
Bei Säuglingen ist die Spontanerholung ca. 10 Minuten nach ihrem Einsetzen vollständig abgeschlossen.
b) Anwendung als Infusionslösung
Säuglinge benötigen im Allgemeinen höhere Infusionsraten von Mivacron als Erwachsene.
Während einer Steady-State Anästhesie mit Isofluran kann eine Reduzierung um bis zu 70 % verglichen mit der Infusionsrate während einer Anästhesie mit Narkotika erforderlich sein.
3. ) Ältere Patienten
Bei älteren Patienten, die Mivacron als Bolusinjektion erhalten, können die Zeit bis zum Wirkungseintritt sowie die Wirkungsdauer und die Erholungsrate im Vergleich zu jüngeren Patienten um 20 bis 30 % verlängert sein. Ältere Patienten können darüber hinaus verringerte Infusionsraten oder kleinere bzw. weniger häufige Erhaltungsdosen benötigen.
4. ) Patienten mit kardiovaskulären Erkrankungen
Bei Patienten mit einer klinisch signifikanten kardiovaskulären Erkrankung sollte die Anfangsdosis von Mivacron über einen Zeitraum von 60 Sekunden verabreicht werden. Mivacron wurde auf diese Weise Patienten verabreicht, bei denen ein chirurgischer Eingriff am Herzen durchgeführt wurde und hatte minimale hämodynamische Effekte zur Folge.
5. ) Patienten mit beeinträchtigter Nierenfunktion
Zur Durchführung der Trachealintubation bei Patienten mit eingeschränkter Nierenfunktion wird initial eine Mivacurium-Dosis von 0,15 mg/kg KG empfohlen. Bei Patienten, die sich im Endstadium der Niereninsuffizienz befinden, ist die klinisch wirksame Dauer der durch diese Dosis herbeigeführten neuromuskulären Blockade etwa 1,5-mal länger als bei Patienten mit normaler Nierenfunktion. Die sich an die Initialdosis anschließende Dosierung sollte entsprechend den individuellen klinischen Erfordernissen gewählt werden.
Bei Patienten mit akutem oder chronischem Nierenversagen kann eine verlängerte und stärkere neuromuskuläre Blockade als Ergebnis eines reduzierten Plasmacholinesterase-Spiegels auftreten.
6. ) Patienten mit eingeschränkter Leberfunktion
Zur Durchführung der Trachealintubation bei Patienten mit eingeschränkter Leberfunktion wird eine Initialdosis von 0,15 mg Mivacurium/kg KG empfohlen. Bei Patienten, die sich im Endstadium der Leberinsuffizienz befinden, ist die klinisch wirksame Dauer der durch diese Dosis herbeigeführten neuromuskulären Blockade etwa 3-mal so lang wie bei Patienten mit normaler Leberfunktion. Diese Verlängerung ist auf die bei diesen Patienten beobachtete, deutlich reduzierte PlasmacholinesteraseAktivität zurückzuführen. Die Höhe nachfolgender Dosen sollte entsprechend den individuellen klinischen Erfordernissen gewählt werden.
7. ) Patienten mit reduzierter Plasmacholinesterase-Aktivität
Mivacurium wird durch die Plasmacholinesterase metabolisiert. Die Aktivität der Plasmacholinesterase kann beim Vorliegen von genetischen Plasmacholinesterase-Anomalien (z. B. heterozygote oder homozygote Patienten für das atypische Plasmacholinesterase-Gen), bei verschiedenen pathologischen Zuständen (siehe „Besondere Vorsicht bei der Anwendung von Mivacron ist erforderlich“) und bei Verabreichung bestimmter anderer Arzneimittel (siehe „Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen") verringert sein. Bei Patienten mit reduzierter Plasmacholinesterase-Aktivität muss die Möglichkeit einer verlängerten neuromuskulären Blockade nach der Verabreichung von Mivacron in Betracht gezogen werden. Eine geringe Reduktion der Plasmacholinesterase-Aktivität (innerhalb von 20 % der unteren Grenze des Normbereichs) hat noch keinen klinisch signifikanten Effekt auf die Dauer der neuromuskulären Blockade (siehe „Mivacron darf nicht angewendet werden bei“ und „Besondere Vorsicht bei der Anwendung von Mivacron ist erforderlich“).
8. ) Adipöse Patienten
Bei adipösen Patienten (deren Gewicht 30 % oder mehr über dem Idealgewicht für ihre Größe liegt) ist die Anfangsdosis von Mivacurium entsprechend dem Idealgewicht und nicht dem tatsächlichen Körpergewicht zu wählen.
9. ) Patienten mit Verbrennungen
Zu Patienten mit Verbrennungen siehe Abschnitt „Besondere Vorsicht bei der Anwendung von Mivacron ist erforderlich“.
III. Dosierungsempfehlungen für Neugeborene und Säuglinge unter 2 Monaten
Die Sicherheit und Wirksamkeit von Mivacuriumchlorid bei Neugeborenen und Säuglingen unter 2 Monaten sind bisher noch nicht erwiesen. Es können keine Dosierungsempfehlungen gegeben werden.
Hinweis zur Überwachung der Patienten
Wie bei anderen Muskelrelaxanzien wird auch bei der Verwendung von Mivacron eine Überwachung der neuromuskulären Funktion empfohlen, um eine individuelle Dosisanpassung zu gewährleisten.
Zu Beginn einer Mivacron-Relaxation sieht man kein signifikantes Abnehmen der Antwort auf einen Vierfachreiz (Train-of-four-fade). Häufig ist es möglich, zu intubieren bevor eine vollständige Aufhebung der Antwort des M. adductor pollicis auf den Vierfachreiz eingetreten ist.
Art und Dauer der Anwendung Zur i.v.-Injektion und -Infusion
Die Dauer der Anwendung von Mivacron wird durch die Erfordernisse des operativen Eingriffs bestimmt.
Hinweise zum Öffnen der Ampulle
Die Ampullen sind mit dem OPC (One Point Cut)-System ausgestattet und müssen entsprechend der folgenden Anweisungen geöffnet werden:
- Halten Sie den unteren Teil der Ampulle in der Hand, wie in Bild 1 gezeigt.
- Legen Sie den Daumen der anderen Hand auf den farbigen Punkt auf dem Ampullenspieß und brechen Sie den Ampullenspieß nach unten ab, wie in Bild 2 gezeigt.
Bild 1: Bild 2:
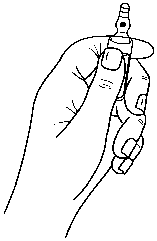

Überdosierung
Überdosierung führt zu verlängerter Muskelrelaxation mit deren Konsequenzen und verlängerter peripherer Ateminsuffizienz. Das Risiko hämodynamischer Nebenwirkungen, besonders von Blutdruckabfall, kann erhöht sein.
Behandlung:
Bis zum Wiedereintritt ausreichender Spontanatmung ist eine kontrollierte Beatmung mit positiven Atemwegsdrücken essentiell. Da das Bewusstsein nicht beeinträchtigt wird, ist eine vollständige Sedierung erforderlich.
Um die Erholung von der neuromuskulären Blockade zu beschleunigen, kann ein Cholinesterasehemmstoff, z. B. Neostigmin (gemeinsam mit Atropin oder Glycopyrronium), eingesetzt werden, vorausgesetzt, es sind bereits erste Anzeichen einer beginnenden Spontanerholung der neuromuskulären Funktion erkennbar. Das Herz-Kreislaufsystem kann je nach Erfordernissen durch richtige Lagerung des Patienten und die Verabreichung von Flüssigkeiten oder die Gabe von blutdrucksteigernden Arzneimitteln (Kreislaufmitteln) unterstützt werden.
Der Gebrauch eines peripheren Nervenstimulators zur Bestimmung der Erholung vor und während der Aufhebung der neuromuskulären Blockade wird sehr empfohlen.
4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH?
Wie alle Arzneimittel kann Mivacron Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen. Informieren Sie bitte Ihren Arzt oder Apotheker, wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt:
Sehr häufig: mehr als 1 von 10 Behandelten Häufig: weniger als 1 von 10, aber mehr als 1 von 100 Behandelten Gelegentlich: weniger als 1 von 100, aber mehr als 1 von 1.000 Behandelten Selten: weniger als 1 von 1.000, aber mehr als 1 von 10.000 Behandelten Sehr selten: weniger als 1 von 10.000 Behandelten, einschließlich Einzelfälle
Erkrankungen des Immunsystems
Sehr selten: Schwere anaphylaktische oder anaphylaktoide Reaktionen
Herzerkrankungen Gelegentlich: Tachykardie1
Gefäßerkrankungen
Sehr häufig: Hautrötungen (Flush)1
Gelegentlich: Hypotonie1
Erkrankungen der Atemwege, des Brustraums und des Mediastinums Gelegentlich: Bronchospasmus1
Erkrankungen der Haut und des Unterhautzellgewebes Gelegentlich: Erytheme1, Urtikaria1
Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
5. WIE IST MIVACRON AUFZUBEWAHREN?
Nicht über 25°C lagern.
Nicht einfrieren.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Arzneimittel für Kinder unzugänglich aufbewahren.
Dauer der Haltbarkeit: Die Dauer der Haltbarkeit von Mivacron-Injektionslösungen beträgt 18 Monate.
Sie dürfen das Arzneimittel nach dem auf dem Umkarton angegebenen Verfalldatum nicht mehr anwenden.
Die im Abschnitt „Art und Dauer der Anwendung“ genannten Infusionslösungen sind in Konzentrationen von 0,5 mg Mivacurium/ml mindestens 12 Stunden nach Herstellung chemisch und physikalisch stabil. Da Mivacron kein Konservierungsmittel enthält, sollte die Verdünnung von Mivacron unter aseptischen Bedingungen und unmittelbar vor der Anwendung erfolgen.
Restmengen bzw. angebrochene Ampullen sind zu verwerfen!
6. WEITERE INFORMATIONEN Was Mivacron enthält
Der Wirkstoff ist:
Mivacron 10 mg
Eine Ampulle mit 5 ml Injektionslösung enthält 10,7 mg Mivacuriumchlorid entsprechend 10 mg Mivacurium.
Mivacron 20 mg
Eine Ampulle mit 10 ml Injektionslösung enthält 21,4 mg Mivacuriumchlorid entsprechend 20 mg Mivacurium.
Die sonstigen Bestandteile sind:
Salzsäure 36 %, Wasser für Injektionszwecke.
Inhalt der Packung
Mivacron ist in Packungen mit 5 Ampullen zu je 5 ml Injektionslösung Mivacron 10 mg und in Packungen mit 5 Ampullen zu je 10 ml Injektionslösung Mivacron 20 mg erhältlich.
Pharmazeutischer Unternehmer
GlaxoSmithKline GmbH & Co. KG 80700 München Service Tel.: 0800 1 22 33 55 Service Fax: 0800 1 22 33 66 e-mail: produkt.info@gsk.com http ://www .glaxosmithkline. de
Hersteller
GlaxoSmithKline Manufacturing S.p.A.
Strada Provinciale Asolana, 90 43056 San Polo di Torrile Parma Italien
Diese Gebrauchsinformation wurde zuletzt genehmigt im Mai 2014.
Die folgenden Informationen sind nur für Ärzte bzw. medizinisches Fachpersonal bestimmt:
Verkaufsabgrenzung
Verschreibungspflichtig.
PHARMAKOLOGISCHE EIGENSCHAFTEN Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Muskelrelaxanzien, peripher wirkende Mittel, andere quartäre Ammonium-Verbindungen, ATC-Code: M03AC10
Mivacron ist ein kurzwirksames Muskelrelaxans vom kompetitiven oder nicht-depolarisierenden Typ. In Konkurrenz mit Acetylcholin besetzt es die cholinergen Rezeptoren an der motorischen Endplatte, unterbricht die physiologische Impulsübertragung von der Nerven- auf die Muskelzelle und führt zu einer schlaffen Lähmung (neuromuskuläre Blockade).
Pharmakokinetische Eigenschaften
Der Wirkungseintritt und die Wirkungsdauer von Mivacurium sind dosisabhängig.
Nach Gabe einer Bolusinjektion von 0,15 mg Mivacurium/kg an 8 sonst gesunde erwachsene Patienten wurde ein Verteilungsvolumen von 0,112±0,072 l/kg, eine Plasmaeliminationshalbwertzeit t1/2ß = 1,75±1,13 min sowie eine Plasmaclearance von 70,4±28,1 ml/kg/min ermittelt. 60 Sekunden nach der Injektion wurden Plasmaspitzenkonzentrationen von ca. 1 pg/ml gemessen. Für die Fläche unter der Konzentrationszeitkurve (AUC) wurden Werte von 2273±864 ng/ml x min ermittelt.
Plasmaproteinbindung
Aufgrund der schnellen Hydrolyse durch im Plasma vorhandene Esterasen, die auch für die kurze Halbwertzeit des Arzneimittels verantwortlich sind, kann die Plasmaproteinbindung nicht bestimmt werden. Aufgrund der vorliegenden Erfahrungen mit dem Arzneimittel ist jedoch nicht zu erwarten, dass Plasmaproteine ein Depot für das Arzneimittel darstellen.
Elimination und Metabolisierung
Der Abbau des Mivacuriums wird unter klinischen Bedingungen von der Geschwindigkeit der Injektion, dem Verteilungsvolumen sowie der Aktivität der Plasmacholinesterasen abhängig sein.
Die Inaktivierung von Mivacurium erfolgt hauptsächlich durch Hydrolyse der im menschlichen Plasma in hoher Konzentration vorhandenen Pseudocholinesterase, wobei als Metaboliten ein quarternärer Aminoalkohol, ein quarternärer Monoester und Dicarbonsäure entstehen.
Pharmakologische Untersuchungen bei Katzen und Hunden haben ergeben, dass ein quarternärer Alkohol und ein quarternärer Monoester in höheren als bei Menschen beobachteten Konzentrationen eine geringe neuromuskuläre, autonome oder kardiovaskuläre Aktivität besitzen.
Für den Abbau bzw. die Ausscheidung von Mivacurium gibt es offenbar mehrere Wege, z. B. Hydrolyse durch Esterasen in der Leber, Ausscheidung mit der Galle bzw. Ausscheidung über die Nieren. So werden 4 bis 8 % der Substanz unverändert, 29 bis 52 % als quarternärer Monoester und 20 bis 31 % als quarternärer Alkohol über die Nieren ausgeschieden.
Bioverfügbarkeit
100 %
Präklinische Daten zur Sicherheit
Bedingt durch die pharmakologische Wirkungsweise (neuromuskuläre Blockade) führte Mivacuriumchlorid bei der Ratte bereits in humantherapeutischer Dosierung ohne gleichzeitige Beatmung zum Tod durch Atemstillstand.
In Studien mit wiederholter intravenöser Verabreichung innerhalb eines Zeitraumes von 3 Wochen an künstlich beatmeten Hunden und Affen wurden keine toxischen Effekte festgestellt.
Bei Mäusen ist eine embryotoxische Wirkung (vermehrtes Auftreten einer rudimentären 14. Rippe) bei Dosen unterhalb einer muskelrelaxierenden Dosis beobachtet worden. An Ratten wurden keine Effekte festgestellt.
Mögliche Einflüsse auf Fertilität und Peri-Postnatalentwicklung wurden nicht untersucht. Standarduntersuchungen zur genetischen Toxikologie verliefen negativ.
Langzeituntersuchungen zur Abklärung des kanzerogenen Potentials wurden nicht durchgeführt.
Zulassungsnummern
Mivacron 10 mg: 31178.00.00 Mivacron 20 mg: 31178.01.00
Datum der Erteilung der Zulassung / Verlängerung der Zulassung
22.10.1996 / 20.03.2006
Ein Originalprodukt der GlaxoSmithKline Forschung
[GSK-Logo]
Hinweis:
Die auf eine Histaminfreisetzung zurückzuführenden Nebenwirkungen (Flush, Erythem, Urtikaria, Hypotonie, Tachykardie, Bronchospasmus) sind dosisabhängig. Sie wurden häufiger bei rascher Verabreichung von Initialdosen > 0,2 mg Mivacurium/kg KG beobachtet. Die Anfangsdosis Mivacron sollte deshalb über einen Zeitraum von 30 bis 60 Sekunden verabreicht werden oder in geteilten Dosen jeweils über 30 Sekunden.
Das Nebenwirkungsprofil bei Kindern ist vergleichbar mit dem bei Erwachsenen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem