Molsiket Retard 8 Mg Retardtabletten
1
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SPC)
1. BEZEICHNUNG DES ARZNEIMITTELS
molsiket® retard 8 mg Retardtabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Retardtablette enthält 8 mg Molsidomin.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM Retardtabletten
Weiße, runde beidseitig gewölbte Retardtabletten. Auf einer Seite ist „m" eingeprägt.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Prophylaxe und Langzeitbehandlung der Angina Pectoris, wenn andere Arzneimittel nicht angezeigt sind, nicht vertragen wurden oder nicht ausreichend wirksam waren, sowie bei Patienten in höherem Lebensalter.
Hinweis
Molsiket retard 8 mg ist wegen des verzögerten Wirkungseintritts nicht zur Kupierung eines akuten Angina-pectoris-Anfalls geeignet.
4.2 Dosierung und Art der Anwendung
Dosierung
Die Dosierung richtet sich nach dem Schweregrad der Erkrankung und danach, wie der Patient auf die Behandlung anspricht.
Es gelten folgende Dosierungsrichtlinien:
In der Regel beträgt die Tagesdosis 1 - 2-mal 1 Retardtablette (entsprechend 8 - 16 mg Molsidomin/Tag).
Bei unzureichender Wirksamkeit kann die Dosis auf 3-mal täglich 1 Retardtablette (entsprechend 24 mg Molsidomin/Tag) erhöht werden.
Bei bestimmten Patienten, z. B. Leber- und Nierenkranken oder Patienten mit dekompensierter Herzinsuffizienz oder bei einer Begleitbehandlung mit anderen vasoaktiven Arzneimitteln, kann die Verabreichung einer niedrigeren Initialdosis empfehlenswert sein.
Art der Anwendung
Die Retardtabletten sind in regelmäßigen Abständen unzerkaut mit ausreichend Flüssigkeit einzunehmen. Molsiket retard 8 mg kann unabhängig von den Mahlzeiten eingenommen werden.
Die Dauer der Anwendung von Molsiket retard 8 mg richtet sich nach Art, Schwere und Verlauf der Erkrankung.
4.3 Gegenanzeigen
Molsiket retard 8 mg darf nicht angewendet werden bei:
• Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
• akutem Kreislaufversagen (Schock, Kreislaufkollaps)
• schwerer Hypotonie (systolischer Blutdruck unter 100 mmHg)
Während der Behandlung mit Molsiket retard 8 mg dürfen keine Arzneimittel zur Behandlung von Erektionsstörungen eingenommen werden, die als arzneilich wirksamen Bestandteil Phosphodiesterase-5-Hemmer enthalten, wie z.B. Sildenafil, Vardenafil oder Tadalafil, da die Gefahr eines starken Blutdruckabfalls besteht, der schwerwiegende Folgen haben kann (z.B. Synkope, Myokardinfarkt).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Molsiket retard 8 mg darf nur mit Vorsicht angewendet werden bei:
• hypertropher obstruktiver Kardiomyopathie, konstriktiver Perikarditis oder Perikardtamponade
• niedrigen Füllungsdrücken, z.B. bei akutem Herzinfarkt, eingeschränkter Funktion der linken Herzkammer (Linksherzinsuffizienz)
• Aorten- und/oder Mitralstenose
Patienten, bei denen die Gefahr eines Blutdruckabfalls in den hypotonen Bereich erhöht ist, müssen sorgfältig überwacht werden und die Dosis muss ggf. dem Zustand des Patienten angepasst werden.
Beim frischen Herzinfarkt darf Molsiket retard 8 mg nur nach Kreislaufstabilisierung, unter strengster ärztlicher Überwachung und kontinuierlicher Kontrolle der Kreislaufverhältnisse angewendet werden.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Molsiket retard 8 mg nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Folgende Wechselwirkungen dieses Arzneimittels müssen beachtet werden:
Bei gleichzeitiger Anwendung von Molsiket retard 8 mg und anderen Arzneimitteln, die blutdrucksenkend wirken (z.B. Vasodilatatoren wie Nitrate, Beta-Rezeptorenblocker, Calciumantagonisten, andere Antihypertensiva), oder Alkohol kann deren blutdrucksenkende Wirkung verstärkt werden.
Bei gleichzeitiger Gabe von Stickstoffmonoxid-Donatoren, wie z.B. dem Wirkstoff von Molsiket retard 8 mg, und Arzneimitteln zur Behandlung von Erektionsstörungen, die als arzneilich wirksamen Bestandteil Phosphodiesterase-5-Hemmer enthalten, wie z.B.
Sildenafil, Vardenafil oder Tadalafil kann es zu einer erheblichen Verstärkung des blutdrucksenkenden Effektes kommen (siehe Abschnitt 4.3).
Sapropterin (Tetrahydrobiopterin, BH4) ist ein Kofaktor der NO-Synthase. Vorsicht ist geboten bei gleichzeitiger Anwendung von Sapropterin-haltigen Arzneimitteln mit allen Wirkstoffen, die durch Beeinflussung des Stickstoffmonoxid (NO)-Abbaus oder seiner Wirkung eine Vasodilatation hervorrufen, einschließlich der klassischen NO-Donatoren (z.B. Glyceroltrinitrat (GTN), Isosorbiddinitrat (ISDN), Isosorbidmononitrat und andere).
4.6 Schwangerschaft und Stillzeit
In der Schwangerschaft und Stillzeit sollte Molsiket retard 8 mg nicht eingenommen werden, da über die Sicherheit einer Anwendung beim Menschen keine Erfahrungen vorliegen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Dieses Arzneimittel kann auch bei bestimmungsgemäßem Gebrauch das Reaktionsvermögen so weit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt wird. Dies gilt in verstärktem Maße bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1000 bis < 1/100)
Selten (> 1/10000 bis < 1/1000)
Sehr selten (< 1/10000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) Erkrankungen des Immunsystems
Selten: Überempfindlichkeitsreaktionen (z. B. allergische Reaktionen der Haut, Bronchospasmus, Asthma)
Sehr selten: anaphylaktischer Schock
Erkrankungen des Nervensystems
Häufig: zu Beginn der Behandlung mit Molsiket retard 8 mg können Kopfschmerzen auftreten, die im weiteren Verlauf der Therapie meist abklingen.
Sehr selten: Schwindel
Herzerkrankungen
Der Ruheblutdruck wird unter Molsiket retard 8 mg bei normalen Ausgangswerten kaum und bei erhöhten mäßig gesenkt. Unter der Behandlung mit Molsiket retard 8 mg kann es zu Blutdruckabfall, selten bis hin zu Kollaps und Schock kommen. Dann kann eine Dosisreduktion oder das Absetzen des Arzneimittels erforderlich werden. Weiterhin kann es gelegentlich zu einer reflektorischen Tachykardie sowie orthostatischer Dysregulation kommen.
Erkrankungen des Gastrointestinaltrakts Selten: Übelkeit
Erkrankungen der Haut und des Unterhautzellgewebes Selten: allergische Reaktionen der Haut
Hinweis
In Tierversuchen hat Molsidomin, der Wirkstoff von Molsiket retard 8 mg, in hohen Dosen Krebs hervorgerufen. Solange die Übertragbarkeit dieser Befunde auf den Menschen nicht geklärt ist, bleibt ein Verdacht krebserregender Wirkungen bestehen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: http://www.bfarm.de/DE/Pharmakovigilanz/form/functions/formpv-node.html anzuzeigen.
4.9 Überdosierung
a) Symptome einer Überdosierung
Das klinische Bild zeigt abhängig vom Ausmaß der Überdosierung bzw. Intoxikation im Wesentlichen folgende Symptome:
Hypotonie, Bradykardie, Schwächegefühl, Schwindel, Benommenheit, Kollapszustände und Schock.
b) Therapiemaßnahmen bei Überdosierung
Neben allgemeinen Maßnahmen wie Magenspülung und Horizontallage des Patienten mit Hochlagern der Beine müssen unter intensivmedizinischen Bedingungen die vitalen Parameter überwacht und ggf. korrigiert werden.
Bei ausgeprägter Hypotonie und/oder Schock sollte eine Volumensubstitution erfolgen; zusätzlich kann zur Kreislauftherapie Norepinephrin, Dobutamin bzw. Dopamin infundiert werden.
Die Gabe von Epinephrin und Substanzen mit vergleichbarer Wirkung ist kontraindiziert.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: andere bei Herzerkrankungen eingesetzte Vasodilatatoren ATC-Code: C01DX12
Molsidomin besitzt eine vasodilatatorische Wirkung, die an den venösen Kapazitätsgefäßen (Reduktion der Vorlast) stärker als an den arteriellen Widerstandsgefäßen ausgeprägt ist. Als Folge nimmt der rechtsventrikuläre Füllungsdruck des Herzens ab. Daraus kann eine Senkung des myokardialen Sauerstoffverbrauchs resultieren.
In hohen Dosen bewirkt Molsidomin eine Dilatation der Gefäßwände auch im arteriellen System.
Auf molekularer Ebene wirkt Molsidomin durch direkte Freisetzung von Stickstoffmonoxid (NO) aus seinem aktiven hepatischen Metaboliten SIN-1 und imitiert so die Wirkung des physiologischen endothelabhängigen Relaxationsfaktors (endothelial-derived relaxing factor, EDRF), welcher sowohl die glatte Gefäßmuskulatur relaxiert als auch die Plättchenfunktion hemmt.
In pharmakologischen Experimenten zeigte sich ein additiver Effekt auf die Plättchenaggregation bei gleichzeitiger Anwendung von Iloprost und Molsidomin, dessen Metabolit SIN-1 eine Plättchenaggregation über die Freisetzung von Stickstoffmonoxid (NO) inhibiert. Die klinische Bedeutung dieses Phänomens ist noch nicht geklärt.
5.2 Pharmakokinetische Eigenschaften
Molsidomin ist ein Prodrug und wird erst in der Leber in seine eigentliche Wirkform, das aktive Derivat (SIN-1A), umgesetzt. Nach oraler Gabe wird Molsidomin zu über 90 % resorbiert, wodurch die maximale systemische Konzentration der Muttersubstanz und des aktiven Metaboliten SIN-1 innerhalb kurzer Zeit erreicht wird. Die Zeit bis zum Erreichen der Spitzenkonzentration im Plasma (tmax) beträgt 1 - 2 Stunden. Wegen des First-PassMetabolismus, aus dem der aktive Metabolit SIN-1 und schließlich das wirksame Endprodukt NO hervorgeht, werden nur 44 - 59 % der oralen Dosis von Molsidomin im Blut wiedergefunden. Die Halbwertszeit (t/2) für SIN-1 liegt bei 1 - 2 Stunden. Über 90 % der verabreichten Dosis werden renal ausgeschieden. Die Eiweißbindung der Muttersubstanz ist sehr gering (3 - 11 %).
Studien mit Einzeldosen (1, 2 und 4 mg) ergaben eine lineare Pharmakokinetik, und Studien mit Mehrfachapplikation (2 mg 3mal täglich über 7 Tage) an gesunden Probanden und Patienten mit koronarer Herzkrankheit (KHK) (4 mg 4mal täglich über 4 Wochen) zeigten keine Substanzkumulation.
Eine an jungen und älteren Probanden durchgeführte Studie zeigte, dass der hepatische First-Pass-Effekt mit zunehmendem Lebensalter herabgesetzt und die Halbwertszeit verlängert ist, was zu einer Zunahme der Fläche unter den Konzentrations-Zeit-Kurven (AUC) für Molsidomin und SIN-1 führt. Die Clearance war bei Leberkranken ebenfalls herabgesetzt. Bei Patienten mit Lebererkrankungen und dekompensierter Herzinsuffizienz wurden ähnliche Veränderungen beobachtet, bei Patienten mit KHK in wesentlich geringerem Umfang. Bei bestimmten Patienten, z.B. Leber- und Nierenkranken oder Patienten mit dekompensierter Herzinsuffizienz oder bei einer Begleitbehandlung mit anderen vasoaktiven Medikamenten, kann die Verabreichung einer niedrigeren Initialdosis empfehlenswert sein.
Bioverfügbarkeit
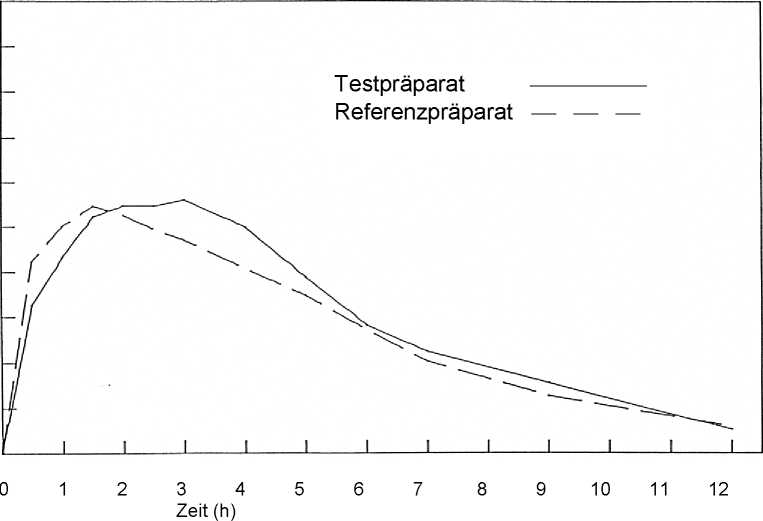
Für Molsiket retard 8 mg wurde im Jahr 1991 eine Bioverfügbarkeitsstudie an 16 Probanden im Vergleich zu einem Referenzpräparat durchgeführt. Die Studie brachte folgende Ergebnisse:
Untersucher
LAB, Gesellschaft für pharmakologische Untersuchungen mbH & Co., Neu-Ulm
Studiendurchführung
Klinik: Januar - Februar 1991
Analytik: Februar - Mai 1991
Hochdruckflüssigkeitschromatographie (HPLC) mit UV-Detektion Studiendesign
16 Probanden (alle männl.), mittleres Alter 30 Jahre (min. 19 Jahre, max. 50 Jahre), mittleres Körpergewicht 74 kg (min. 61 kg, max. 90 kg), mittlere Körpergröße 180 cm (min. 171 cm, max. 197 cm), randomisiert, single-dose, cross-over; Messzeitraum 12 Stunden (entspr. ca.
5 terminalen Halbwertszeiten), 13 Messzeitpunkte; Auswaschphase 7 Tage (entspr. ca. 70 terminalen Halbwertszeiten).
Ergebnisse
Pharmakokinetische Parameter von Molsidomin nach Einmalgabe von 1 Retardtablette Molsiket retard 8 mg bzw. Referenzpräparat:
|
Testpräparat |
Referenzpräparat | |
|
maximale Plasmakonzentration (Cmax) [ng/ml] |
14,98 ± 10,93 |
15,51 ± 8,28 |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax) [h] |
2,25 ± 0,95 |
1,53 ± 1,06 |
|
Fläche unter der KonzentrationsZeit-Kurve (AUC0'12) [ng/ml*h] |
89,24 ± 79,37 |
83,18 ± 60,19 |
Angaben der Werte als Mittelwert und Streubreite
Plasmaspiegel von Molsidomin (Mittel über 16 Probanden) Konzentration (ng/ml)
25.0
22.5
20.0
17.5
15.0
12.5
10.0
7.5
5.0
2.5 0.0
Statistische Bewertung
AUC0-12 Quotient d. geom. Mittel: 0,99
90 %-Konfidenzintervall d. Varianzanalyse
(ANOVA, Inklusionsregel, Lognormalverteilung): 0,88 - 1,12
Cmax Quotient d. geom. Mittel: 0,90
90 %-Konfidenzintervall d. Varianzanalyse
(ANOVA, Inklusionsregel, Lognormalverteilung): 0,78 - 1,04
tmax Arithm. Mittelwert Testpräparat: 2,25 Stunden
Arithm. Mittelwert Referenzpräparat: 1,53 Stunden Empfohlenes Dosisintervall: 8 - 24 Stunden Differenz d. arithm. Mittel in Stunden: 0,72 Differenz d. arithm. Mittel in % des Dosisintervalls:
9 % bei 8 h 3 % bei 24 h
Bioverfügbarkeit/Bioäquivalenzentscheid
Die mittlere relative Bioverfügbarkeit von Molsiket retard 8 mg im Vergleich zum Referenzpräparat beträgt 107,3 %. Bioäquivalenz bewiesen (substituierbar gegen Referenzpräparat).
5.3 Präklinische Daten zur Sicherheit
Molsidomin wurde in mehreren In-vitro- und In-vivo-Tests zur Mutagenität geprüft. Die sehr ausführliche Prüfung ergab keinen relevanten Hinweis auf eine mutagene Wirkung. Molsidomin wurde in Langzeituntersuchungen an Mäusen und Ratten getestet. Während bei Mäusen unter Molsidomin kein Anstieg von Tumoren gegenüber der Kontrollgruppe zu sehen ist, traten bei Ratten unter hohen Dosierungen und nach langen Expositionszeiten bösartige Tumore im Ethmoturbinalbereich der Nase auf. Ein genotoxischer Mechanismus konnte als Ursache ausgeschlossen werden, so dass eine Schwellendosis angenommen werden kann.
Untersuchungen an Ratten ergaben keine Hinweise auf Störungen der Fertilität bei Dosen bis 12 mg/kg. Bei Mäusen und Ratten wurden bis zur höchsten geprüften Dosis von 150 mg/kg bzw. 200 mg/kg keine Anzeichen für eine embryotoxische Wirkung gefunden. Bei
Kaninchen traten bei maternal toxischen Dosen (ab 15 mg/kg) vereinzelt Fehlbildungen des Handskeletts auf.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Lactose-Monohydrat, Hypromellose, Magnesiumstearat (Ph.Eur.), Hochdisperses Siliciumdioxid, Cellulosepulver
6.2 Inkompatibilitäten
Nicht zutreffend
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Molsidomin, der Wirkstoff von Molsiket retard 8 mg, ist lichtempfindlich.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen. Die Einwirkung von direktem Sonnenlicht vermeiden. Tablettenblister und aus dem Blister entnommene Tabletten vor Licht schützen.
6.5 Art und Inhalt des Behältnisses
Polypropylen-Blisterpackungen
Packungen mit 28, 30, 50, 56, 60, 98 und 100 Retardtabletten Klinikpackungen mit 350 (5 x 70) Retardtabletten
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen
7. INHABER DER ZULAS S UNG
UCB Pharma GmbH Alfred-Nobel-Straße 10 40789 Monheim Telefon: 02173/48-4848 Telefax: 02173/48-4841
Mitvertrieb SANOL GmbH Alfred-Nobel-Straße 10 40789 Monheim Telefon: 02173/48-4848 Telefax: 02173/48-4841
8. ZULASSUNGSNUMMER(N)
38391.00.00
9. DATUM DER ERTEILUNG DER ZULAS S UNG / VERLÄNGERUNG DER ZULAS S UNG
Datum der Erteilung der Zulassung: 31.10.1997
Datum der letzten Verlängerung der Zulassung: 25.09.2003
10. STAND DER INFORMATION April 2013
11. VERKAUFSABGRENZUNG Verschreibungspflichtig