Monoclair 40Mg Tabletten
Fachinformation
1. BEZEICHNUNG DER ARZNEIMITTEL
Monoclair® 20 mg Tabletten Monoclair® 40 mg Tabletten Monoclair® 60 mg Tabletten Monoclair® 40 mg retard Kapseln Monoclair® 50 mg retard Kapseln Monoclair® 60 mg retard Kapseln Monoclair 100 mg retard Retardtabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: Isosorbidmononitrat
Monoclair® 20 mg Tabletten
1 Tablette enthält 20 mg Isosorbidmononitrat.
Sonstiger Bestandteil: Lactose
Monoclair® 40 mg Tabletten
1 Tablette enthält 40 mg Isosorbidmononitrat.
Sonstiger Bestandteil: Lactose
Monoclair® 60 mg Tabletten
1 Tablette enthält 60 mg Isosorbidmononitrat.
Sonstiger Bestandteil: Lactose
Monoclair® 40 mg retard Kapseln
1 Hartkapsel, retardiert, enthält 40 mg Isosorbidmononitrat.
Sonstiger Bestandteil: Sucrose
Monoclair® 50 mg retard Kapseln
1 Hartkapsel, retardiert, enthält 50 mg Isosorbidmononitrat.
Sonstiger Bestandteil: Sucrose
Monoclair® 60 mg retard Kapseln
1 Hartkapsel, retardiert, enthält 60 mg Isosorbidmononitrat.
Sonstiger Bestandteil: Sucrose
Monoclair® 100 mg retard Retardtabletten
1 Retardtablette enthält 100 mg Isosorbidmononitrat Sonstiger Bestandteil: Lactose
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1
3. DARREICHUNGSFORM
Monoclair® 20 mg Tabletten
T ablette
Rosa, runde Tabletten mit Bruchrille
Die Tablette kann in gleiche Hälften geteilt werden.
Monoclair® 40 mg Tabletten
Tablette
Rosa, runde Tabletten mit Bruchrille
Die Tablette kann in gleiche Hälften geteilt werden.
Monoclair® 60 mg Tabletten
Tablette
Rosa, runde Tabletten mit Bruchrille
Die Tablette kann in gleiche Hälften geteilt werden.
Monoclair® 40 mg retard Kapseln
Hartkapsel, retardiert Caramelfarbene Hartkapseln, retardiert
Monoclair® 50 mg retard Kapseln
Hartkapsel, retardiert
Hartkapseln, retardiert mit gelben Oberteil und rotem Unterteil
Monoclair® 60 mg retard Kapseln
Hartkapsel, retardiert Rostbraune Hartkapseln, retardiert
®
Monoclair 100 mg retard Retardtabletten
Retardtablette
Weiße, oblonge Retardtabletten mit beidseitiger Bruchkerbe. Die Retardtablette kann in gleiche Hälften geteilt werden.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Prophylaxe und Langzeitbehandlung der Angina pectoris.
Monoclair® 20 mg Tabletten
Soweit nicht anders verordnet:
Es wird 2-mal 1 Tablette Monoclair® 20 mg Tabletten (entsprechend 40 mg Isosorbidmononitrat) pro Tag eingenommen.
Bei höherem Nitratbedarf kann die Dosis auf 3-mal 1 Tablette (entsprechend 3-mal 20 mg Isosorbidmononitrat) täglich erhöht werden.
Um die volle Wirkung des Arzneimittels zu erhalten, soll bei einer täglichen Dosierung von 2-mal 1 Tablette Monoclair® 20 mg Tabletten (entsprechend 2-mal 20 mg Isosorbidmononitrat) die zweite Tablette nicht später als 8 Stunden nach der ersten Tablette eingenommen werden.
Die Behandlung sollte mit niedriger Dosierung begonnen und langsam bis zur erforderlichen Höhe gesteigert werden.
Die Tabletten sind unzerkaut mit ausreichend Flüssigkeit (z. B. ein Glas Wasser) einzunehmen. Über die Dauer der Anwendung entscheidet der behandelnde Arzt.
Monoclair® 40 mg Tabletten
Es wird 1-mal 1 Tablette Monoclair® 40 mg Tabletten (entsprechend 40 mg Isosorbidmononitrat) oder 2-mal 1/2 Tablette Monoclair® 40 mg Tabletten (entsprechend 2-mal 20 mg Isosorbidmononitrat) pro Tag eingenommen. In Ausnahmefällen kann die Dosis auf 2-mal 1 Tablette Monoclair® 40 mg Tabletten (entsprechend 80 mg Isosorbidmononitrat) täglich erhöht werden.
Um die volle Wirkung des Arzneimittels zu erhalten, soll bei einer täglichen Dosierung von 2-mal 1 Tablette Monoclair® 40 mg Tabletten (entsprechend 80 mg Isosorbidmononitrat) die 2. Tablette nicht später als 8 Stunden nach der 1. Tablette eingenommen werden.
Die Behandlung sollte mit niedriger Dosierung begonnen und langsam bis zur erforderlichen Höhe gesteigert werden.
Die Tabletten sind unzerkaut mit ausreichend Flüssigkeit (z. B. ein Glas Wasser) einzunehmen. Über die Dauer der Anwendung entscheidet der behandelnde Arzt.
Monoclair® 60 mg Tabletten
Es wird 1-mal 1 Tablette Monoclair® 60 mg Tabletten (entsprechend 60 mg Isosorbidmononitrat) oder 2-mal 1/2 Tablette Monoclair® 60 mg Tabletten (entsprechend 2-mal 30 mg Isosorbidmononitrat) pro Tag eingenommen.
Um die volle Wirkung des Arzneimittels zu erhalten, soll bei einer täglichen Dosierung von 2-mal 1/2 Tablette Monoclair® 60 mg Tabletten (entsprechend 2-mal 30 mg Isosorbidmononitrat) die 2. Tablette nicht später als 8 Stunden nach der 1. Tablette eingenommen werden.
Die Behandlung sollte mit niedriger Dosierung begonnen und langsam bis zur erforderlichen Höhe gesteigert werden.
Die Tabletten sind unzerkaut mit ausreichend Flüssigkeit (z. B. ein Glas Wasser) einzunehmen. Über die Dauer der Anwendung entscheidet der behandelnde Arzt.
Monoclair® 40 mg retard Kapseln
Es wird 1-mal 1 Hartkapsel, retardiert, Monoclair® 40 mg retard Kapseln (entsprechend 40 mg Isosorbidmononitrat) pro Tag eingenommen.
Bei höherem Nitratbedarf kann die Dosis auf 2-mal 1 Hartkapsel, retardiert, Monoclair® 40 mg retard Kapseln (entsprechend 80 mg Isosorbidmononitrat) täglich erhöht werden.
Um die volle Wirkung des Arzneimittels zu erhalten, soll bei einer täglichen Dosierung von 2-mal 1 Hartkapsel, retardiert, Monoclair® 40 mg retard Kapseln (entsprechend 80 mg
Isosorbidmononitrat) die 2. Arzneimittelgabe nicht später als 6 Stunden nach der 1. Arzneimittelgabe eingenommen werden.
Die Behandlung sollte mit niedriger Dosierung begonnen und langsam bis zur erforderlichen Höhe gesteigert werden.
Die Hartkapseln, retardiert, sind unzerkaut mit ausreichend Flüssigkeit (z. B. ein Glas Wasser) einzunehmen.
Über die Dauer der Anwendung entscheidet der behandelnde Arzt.
Monoclair® 50 mg retard Kapseln
Es wird 1-mal 1 Hartkapsel, retardiert, Monoclair® 50 mg retard Kapseln (entsprechend 50 mg Isosorbidmononitrat) pro Tag eingenommen.
Die Behandlung sollte mit niedriger Dosierung begonnen und langsam bis zur erforderlichen Höhe gesteigert werden.
Die Hartkapseln, retardiert, sind unzerkaut mit ausreichend Flüssigkeit (z. B. ein Glas Wasser) einzunehmen.
Über die Dauer der Anwendung entscheidet der behandelnde Arzt.
Monoclair® 60 mg retard Kapseln
Es wird 1-mal 1 Hartkapsel, retardiert, Monoclair® 60 mg retard Kapseln (entsprechend 60 mg Isosorbidmononitrat) pro Tag eingenommen.
Die Behandlung sollte mit niedriger Dosierung begonnen und langsam bis zur erforderlichen Höhe gesteigert werden.
Die Hartkapseln, retardiert, sind unzerkaut mit ausreichend Flüssigkeit (z. B. ein Glas Wasser) einzunehmen.
Über die Dauer der Anwendung entscheidet der behandelnde Arzt.
Monoclair® 100 mg retard Retardtabletten
®
Es wird 1-mal 1 Retardtablette Monoclair 100 mg retard Retardtabletten (entsprechend 100 mg Isosorbidmononitrat) pro Tag eingenommen.
Die Behandlung sollte mit niedriger Dosierung begonnen und langsam bis zur erforderlichen Höhe gesteigert werden.
Zu diesem Zweck stehen Tabletten mit geringerer Wirkstärke zur Verfügung. Die Bruchkerbe dient nur zum Teilen der Tablette für ein erleichtertes Einnehmen und nicht zum Aufteilen in gleiche Dosen.
Die Retardtabletten sind unzerkaut mit ausreichend Flüssigkeit (z. B. ein Glas Wasser) einzunehmen.
Isosorbidmononitrat darf nicht eingenommen werden bei:
- Überempfindlichkeit gegen den Wirkstoff Isosorbidmononitrat, anderen Nitratverbindungen oder einen der sonstigen Bestandteile
- akutem Kreislaufversagen (Schock, Kreislaufkollaps)
- kardiogenem Schock, sofern nicht durch intraaortale Gegenpulsation oder positiv inotrope Pharmaka ein ausreichend hoher linksventrikulärer, enddiastolischer Druck gewährleistet ist
- ausgeprägter Hypotonie (systolischer Blutdruck unter 90 mmHg)
- schwerer Anämie, schwerer Hypovolämie
- hyperthropher obstruktiver Kardiomyopathie, konstriktiver Perikarditis, Perikardtamponade
- gleichzeitiger Einnahme von Phosphodiesterase-5-Hemmern, z. B. Sildenafil, Vardenafil und Tadalafil, weil es in diesem Fall zu einem erheblichen blutdrucksenkenden Effekt kommen kann.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Eine besonders sorgfältige Überwachung ist erforderlich bei:
- hypertropher obstruktiver Kardiomyopathie, konstriktiver Perikarditis und Perikardtamponade
- niedrigen Füllungsdrücken z. B. bei akutem Herzinfarkt, eingeschränkter Funktion der linken Herzkammer (Linksherzinsuffzienz). Eine Blutdrucksenkung unter 90 mmHg systolisch sollte vermieden werden
- Aorten- und/oder Mitralstenose
- Neigung zu orthostatischen Kreislaufregulationsstörungen
- Erkrankungen, die mit einem erhöhten intrakraniellen Druck einhergehen (bisher wurde nur bei hochdosierter i.v. Gabe von Glyceroltrinitrat eine weitere Drucksteigerung beobachtet).
Isosorbidmononitrat ist nicht geeignet zur Behandlung des akuten Angina-pectoris-Anfalls.
Monoclaii® 20 mg Tabletten, Monoclair® 40 mg Tabletten, Monoclair® 60 mg Tabletten,
Monoclair 100 mg retard Retardtabletten zusätzlich:
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-
Galactose-Malabsorption sollten Monoclair® 20 mg Tabletten, Monoclair® 40 mg Tabletten, Monoclair® 60 mg Tabletten und Monoclair 100 mg retard Retardtabletten nicht einnehmen.
Monoclair® 40 mg retard Kapseln, Monoclair® 50 mg retard Kapseln, Monoclair® 60 mg retard Kapseln zusätzlich:
Patienten mit der seltenen hereditären Fructose-Intoleranz, Glucose-Galactose-Malabsorption oder Saccharase-Isomaltase-Mangel sollten Monoclair® 40 mg retard Kapseln, Monoclair® 50 mg retard Kapseln und Monoclair® 60 mg retard Kapseln nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Folgende Wechselwirkungen dieses Arzneimittels müssen beachtet werden:
Die gleichzeitige Einnahme von anderen Vasodilatatoren, Antihypertensiva (z. B. BetaRezeptorenblockern, Diuretika, Kalziumantagonisten, ACE-Hemmer), Sapropterin, Neuroleptika oder trizyklischen Antidepressiva und Alkohol kann die blutdrucksenkende Wirkung von Isosorbidmononitrat verstärken.
Dies gilt insbesondere für die gleichzeitige Anwendung von Phosphodiesterase-5-Hemmern, z. B. Sildenafil, Vardenafil und Tadalafil (siehe Abschnitt Gegenanzeigen).
Isosorbitmononitrat kann bei gleichzeitiger Anwendung von Dihydroergotamin zum Anstieg des DHE-Spiegels führen und damit dessen blutdrucksteigernde Wirkung verstärken.
4.6 Schwangerschaft und Stillzeit
Schwangerschaft
In der Schwangerschaft sollte aus Gründen besonderer Vorsicht Monoclair® nur auf ausdrückliche Anordnung des Arztes eingenommen werden, da über die Anwendung bei Schwangeren keine ausreichenden Erfahrungen vorliegen. Tierexperimentelle Untersuchungen haben keinen Hinweis auf Fruchtschädigungen ergeben (siehe Abschnitt 5.3).
Stillzeit
In der Stillzeit sollte aus Gründen besonderer Vorsicht Monoclair® nur auf ausdrückliche Anordnung des Arztes eingenommen werden, da über die Anwendung bei Stillenden keine ausreichenden Erfahrungen vorliegen und nicht bekannt ist, ob Monoclair® in die Muttermilch übergehen. Bei einer Einnahme von Monoclair® in der Stillzeit ist beim Säugling auf mögliche Arzneimittelwirkungen zu achten.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Dieses Arzneimittel kann auch bei bestimmungsgemäßem Gebrauch das Reaktionsvermögen so weit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt wird. Dies gilt in verstärktem Maße bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenwirken mit Alkohol.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig Häufig Gelegentlich Selten Sehr selten Nicht bekannt
(> 1/10)
(> 1/100 bis < 1/10)
(> 1/1.000 bis < 1/100)
(> 1/10.000 bis < 1/1.000)
(<1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Erkrankungen des Nervensystems
Sehr häufig können bei Behandlungsbeginn Kopfschmerzen (”Nitratkopfschmerzen”) auftreten, die erfahrungsgemäß meistens nach einigen Tagen bei weiterer Einnahme abklingen.
Herzerkrankungen
Gelegentlich wurden beobachtet:
- starker Blutdruckabfall mit Verstärkung der Angina-pectoris-Symptomatik,
- Kollapszustände, auch mit bradykarden Herzrhythmusstörungen und Synkopen.
Gefäßerkrankungen
Häufig werden bei der Erstanwendung, aber auch bei einer Dosiserhöhung, ein Abfall des Blutdrucks und/oder orthostatische Hypotension beobachtet, die mit einer reflektorischen Erhöhung der Pulsfrequenz, Benommenheit sowie einem Schwindel- und Schwächegefühl einhergehen können.
Erkrankungen des Gastrointestinaltrakts
Gelegentlich wurden beobachtet:
- Übelkeit und Erbrechen.
Sehr selten wurde beobachtet:
- Sodbrennen.
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich wurden beobachtet:
- flüchtige Hautrötungen (Flush) und allergische Hautreaktionen.
Sehr selten kann eine exfoliative Dermatitis auftreten.
Eine Toleranzentwicklung sowie das Auftreten einer Kreuztoleranz gegenüber anderen Nitratverbindungen wurden beschrieben. Zur Vermeidung einer Wirkungsabschwächung oder eines Wirkungsverlustes sollten hohe kontinuierliche Dosierungen vermieden werden.
Hinweis:
Bei der Gabe von Isosorbidmononitrat kann, bedingt durch eine relative Umverteilung des Blutflusses in hypoventilierte Alveolargebiete, eine vorübergehende Hypoxämie auftreten und bei Patienten mit koronarer Herzkrankheit eine myokardiale Hypoxie auslösen.
Erhöhung der Dosis und/oder Veränderung des Einnahmeintervalls kann zu Wirkungsab-schwächung oder Wirkungsverlust führen.
4.9 Überdosierung
a) Symptome einer Überdosierung
Blutdruckabfall mit orthostatischen Regulationsstörungen, reflektorische Tachykardie und Kopfschmerzen, Schwächegefühl, Schwindel, Benommenheit, Flush, Übelkeit, Erbrechen und Durchfall können auftreten.
Bei hohen Dosen (größer 20 mg/kg Körpergewicht) ist infolge des beim ISMN-Abbau entstehenden Nitrit-Ions mit Methämoglobinbildung, Zyanose, Atemnot und Tachypnoe zu rechnen.
Bei sehr hohen Dosen kann es zur Erhöhung des intrakraniellen Druckes mit cerebralen Symptomen kommen.
Bei chronischer Überdosierung wurden erhöhte Methämoglobinspiegel gemessen, deren klinische Relevanz umstritten ist.
b) Therapiemaßnahmen bei Überdosierung
Neben allgemeinen Maßnahmen wie Magenspülung und Horizontallage des Patienten mit hochlegen der Beine müssen unter intensivmedizinischen Bedingungen die vitalen Parameter überwacht und ggf. korrigiert werden.
Bei ausgeprägter Hypotonie und/oder Schock sollte eine Volumensubstitution erfolgen; in Ausnahmefällen kann zur Kreislauftherapie Dobutamin infundiert werden.
Die Gabe von Epinephrin und verwandter Substanzen ist kontraindiziert.
Je nach Schweregrad bieten sich bei Methämoglobinämie folgende Antidote an:
1. Vitamin C:
1 g p.o.oder als Natriumsalz i.v.
2. Methylenblau:
bis zu 50 ml einer 1%igen Methylenblaulösung i.v.
3. Toluidinblau:
initial 2 - 4 mg/kg Körpergewicht streng intravenös; falls erforderlich mehrfache Wiederholung in einstündigem Abstand mit 2 mg/kg/Körpergewicht möglich.
4. Sauerstoffbehandlung, Hämodialyse, Blutaustausch.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Organisches Nitrat, Vasodilatatoren ATC-Code: C01 DA 14
Wirkungsweise
Isosorbidmononitrat wirkt direkt relaxierend auf die glatte Gefäßmuskulatur und führt zu einer Vasodilatation.
Die postkapillären Kapazitätsgefäße und die großen Arterien - insbesondere die noch reagiblen Teile von Koronararterien - sind hierbei stärker betroffen als die Widerstandsgefäße. Die Vasodilatation in der Strombahn führt zur Zunahme der venösen Kapazität ("pooling"), der Rückstrom zum Herzen wird vermindert, Ventrikelvolumina und Füllungsdrücke sinken ("preload"-Senkung).
Verkleinerter Ventrikelradius und verminderte systolische Wandspannung senken den myokardialen Energie- bzw. O2-Bedarf.
Die Abnahme der kardialen Füllungsdrücke begünstigt die Perfusion ischämiegefährdeter, subendokardialer Wandschichten, regionale Wandbewegung und Schlagvolumen können verbessert werden.
Die Dilatation der großen herznahen Arterien führt zu einer Abnahme sowohl des systemischen ("afterload-Senkung") als auch des pulmonalen Auswurfwiderstandes.
Isosorbidmononitrat bewirkt eine Relaxation der Bronchialmuskulatur, der ableitenden Harnwege, der Muskulatur der Gallenblase, des Gallenganges sowie des Ösophagus, des Dünn- und Dickdarmes einschließlich der Sphinkteren.
Auf molekularer Ebene wirken die Nitrate sehr wahrscheinlich über die Bildung von Stickoxid (NO) und zyklischem Guanosylmonophosphat (cGMP), das als Mediator der Relaxation gilt.
5.2 Pharmakokinetische Eigenschaften
5.2.1 Allgemeine Pharmakokinetik
Isosorbidmononitrat wird nach oraler Gabe rasch und vollständig resorbiert. Die systemische Verfügbarkeit beträgt 90 - 100 %. Isosorbidmononitrat wird in der Leber nahezu vollständig metabolisiert. Die gebildeten Metabolite sind inaktiv.
Die Plasmahalbwertszeit beträgt 4 - 5 Stunden. Isosorbidmononitrat wird fast ausschließlich in Form seiner Metabolite über die Niere ausgeschieden. Nur ca. 2% werden unverändert renal eliminiert.
Toleranz
Trotz gleichbleibender Dosierung und bei konstanten Nitratspiegeln wurde ein Nachlassen der Wirksamkeit beobachtet. Eine bestehende Toleranz klingt nach Absetzen der Therapie innerhalb von 24 Stunden ab.
Bei entsprechend intermittierender Verabreichung wurde keine Toleranzentwicklung beobachtet.
5.2.2 Bioverfügbarkeit
Monoclair9 20 mg Tabletten
Eine vom 28.11.1996 bis 21.01.1997 durchgeführte Bioverfügbarkeitsuntersuchung an 20 Probanden ergab im Vergleich zum Referenzpräparat:
Testpräparat Referenzpräparat
Monoclair®
20 mg Tabletten
maximale Plasma-
|
konzentration Cmax [ng/ml]: |
502,85 ± 134,16 |
492,45 ± 158,33 |
|
Zeitpunkt der maximalen Plasmakonzentration tmax [h]: |
0,47 ± 0,32 |
0,65 ± 0,32 |
|
Fläche unter der KonzentrationsZeit-Kurve AUC0-t [ng/ml-h]: |
2518,50 ± 394,35 |
2639,86 ± 258,49 |
|
Fläche unter der KonzentrationsZeit-Kurve AUC0-D [ng/ml-h]: |
2618,91 ± 431,91 |
2715,41 ± 263,97 |
|
MRT [h] |
6,79 ± 1,01 |
6,88 ± 0,68 |
|
t, [h] |
4,67 ± 0,88 |
4,55 ± 0,47 |
Angabe der Werte als Mittelwert und Streubreite
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem KonzentrationsZeit-Diagramm (siehe Abbildung 1):
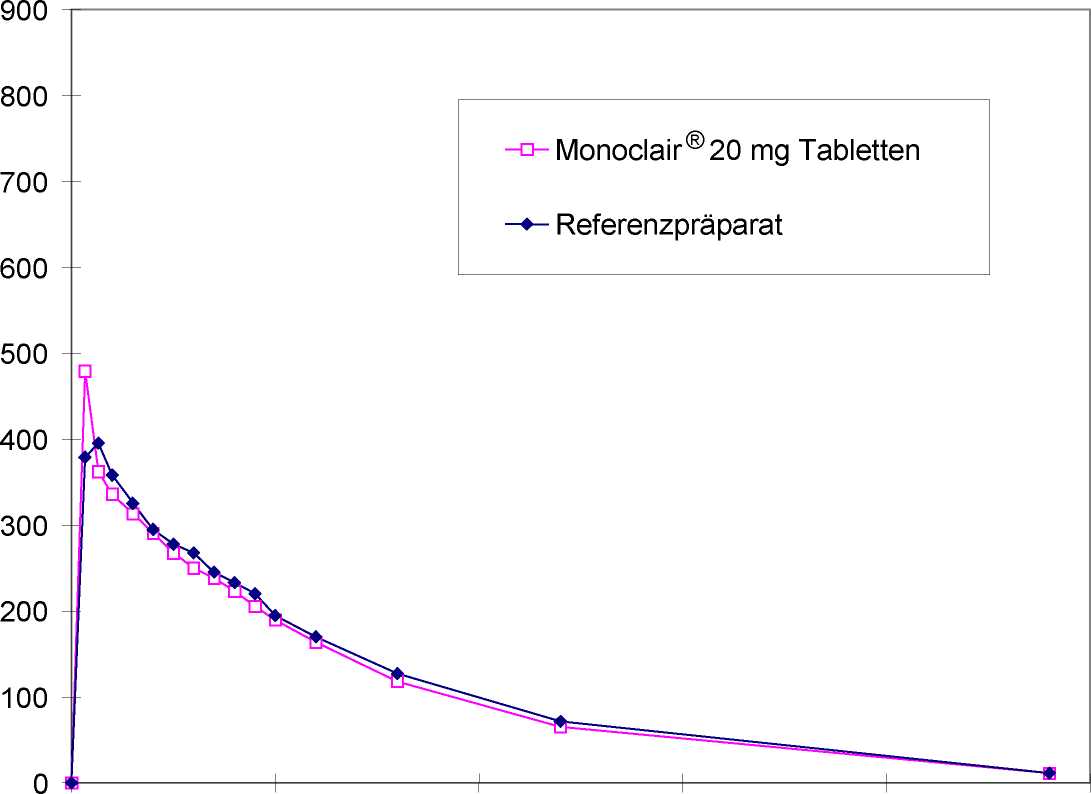
0 5 10 15 20 25
Zeit [h]
Abbildung 1: Mittlere Plasmakonzentrationen von Isosorbidmononitrat nach Einmalgabe von 1 Tablette Monoclair® 20 mg Tabletten bzw. Referenzpräparat (n = 20)
Studienergebnis:
Auf Bioäquivalenz zwischen Test- und Referenzpräparat kann geschlossen werden.
Monoclair9 40 mg retard Kapseln/Monoclair® 60 mg retard Kapseln
Eine im Jahre 1997 durchgeführte Bioverfügbarkeitsuntersuchung (offen, randomisiert, multiple-dose, cross-over, wash-out 8 Tage) an 24 Probanden ergab im Vergleich zum Referenzpräparat Corangin® 60 retard:
|
Testpräparat Monoclair® 60 mg retard Kapseln |
Referenzpräparat Corangin® 60 retard | |
|
maximale Plasmakonzentration Cmax [Pg/l]: |
533,0 ± 137,5 |
576,3 ± 107,9 |
|
Zeitpunkt der maximalen Plasmakonzentration tmax [h]: |
4,5 ± 1,77 |
5,34 ± 1,86 |
|
Fläche unter der KonzentrationsZeit-Kurve AUC(0-24) [Mg/l'h]: |
6209,4 ± 1598,9 |
7434,6 ± 1553,0 |
|
PTF[%] |
189,8 ± 47,2 |
165,9 ± 21,8 |
Angabe der Werte als Mittelwert und Streubreite
90 %-Konfidenzintervalle:
AUC(0-24) 80-89,4 %
Cmax 85,8 %-99,3 %
PTF 103,2-120,2 %
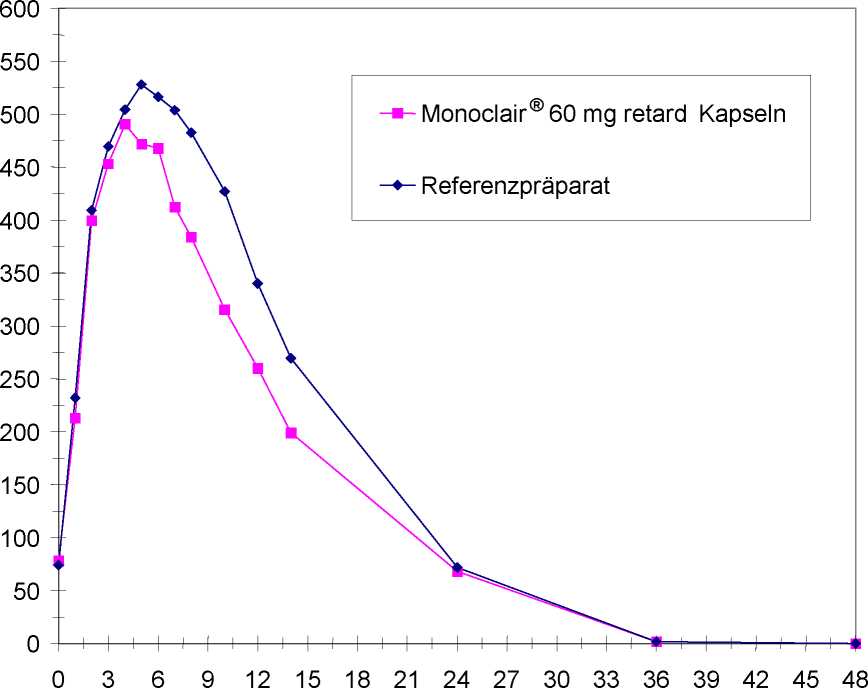
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem KonzentrationsZeit-Diagramm (siehe Abbildung 2):
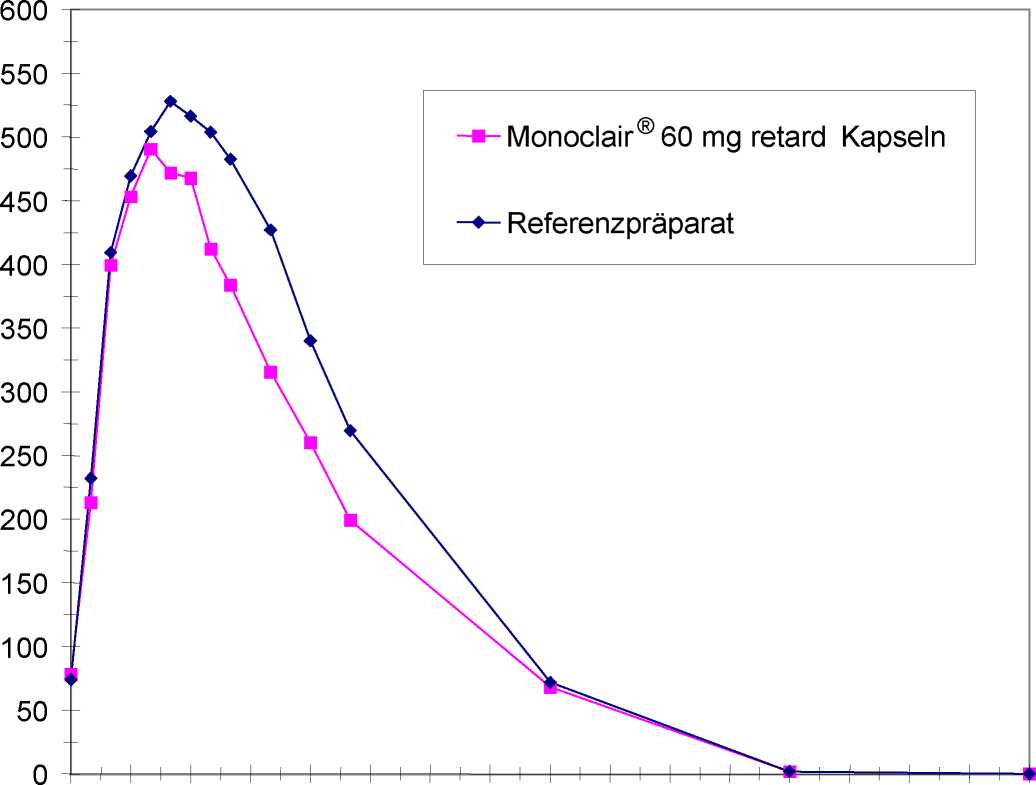
0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 45 48
Zeit [h]
Abbildung 2: Mittlere Plasmakonzentrationen von Isosorbidmononitrat nach Einmalgabe von täglich 1 Hartkapsel, retardiert, Monoclair® 60 mg retard Kapseln bzw. Referenzpräparat über 6 Tage, Messung am 6. Tag (n = 24)
Studienergebnis:
Auf Bioäquivalenz zwischen Test- und Referenzpräparat kann geschlossen werden.
Aufgrund der vergleichbaren qualitativen und quantitativen Zusammensetzung sind die pharmakokinetischen Daten von Monoclair® 60 mg retard Kapseln auf Monoclair® 40 mg retard Kapseln übertragbar.
Monoclair® 50 mg retard Kapseln
Eine im Jahre 1992 durchgeführte Bioverfügbarkeitsuntersuchung an 18 Probanden ergab im Vergleich zum Referenzpräparat:
|
Testpräparat Monoclair® 50 mg retard Kapseln |
Referenzpräparat | |
|
maximale Plasmakonzentration Cmax [ng/ml]: |
391,04 ± 45,48 |
380,77 ± 73,86 |
|
Zeitpunkt der maximalen Plasmakonzentration tmax [h]: |
4,22 ± 1,44 |
4,84 ± 1,53 |
|
Fläche unter der KonzentrationsZeit-Kurve AUC(0-24) [ng/ml-h]: |
5138,6 ± 623,08 |
5142,8 ± 1044,5 |
Angabe der Werte als Mittelwert und Streubreite
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem KonzentrationsZeit-Diagramm (siehe Abbildung 3):
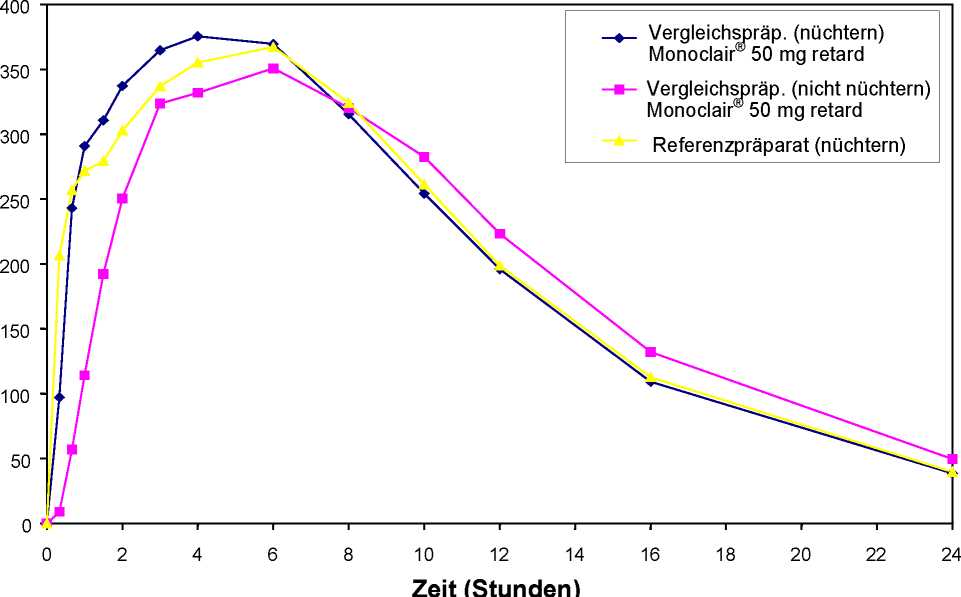
Abbildung 3: Mittlere Plasmakonzentrationen von Isosorbidmononitrat nach Einmalgabe von 1 Retardkapsel Monoclair® 50 mg retard Kapseln bzw. Referenzpräparat (n = 18)
Studienergebnis: Konzentration [pg/l]
Zeit [h]
Auf Bioäquivalenz zwischen Test- und Referenzpräparat kann geschlossen werden.
Monoclair® 100 mg retard Retardtabletten
Eine im Jahre 1998 durchgeführte Bioverfügbarkeitsstudie an 24 Probanden ergab im Vergleich zum Referenzpräparat:
|
Testpräparat Monoclair® 1oo mg retard Retardtabletten |
Referenzpräparat | |
|
maximale Plasmakonzentration Cmax [ng/ml]: |
786 ± 90 |
647 ± 98 |
|
Zeitpunkt der maximalen Plasmakonzentration tmax [h]: |
4,50 ± 1,02 |
4,42 ± 1,34 |
|
Fläche unter der KonzentrationsZeit-Kurve AUC(o-t) [ng/ml h]: |
10800 ± 1910 |
9560 ±1830 |
Angabe der Werte als Mittelwert und Streubreite
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem KonzentrationsZeit-Diagramm (siehe Abbildung 4):
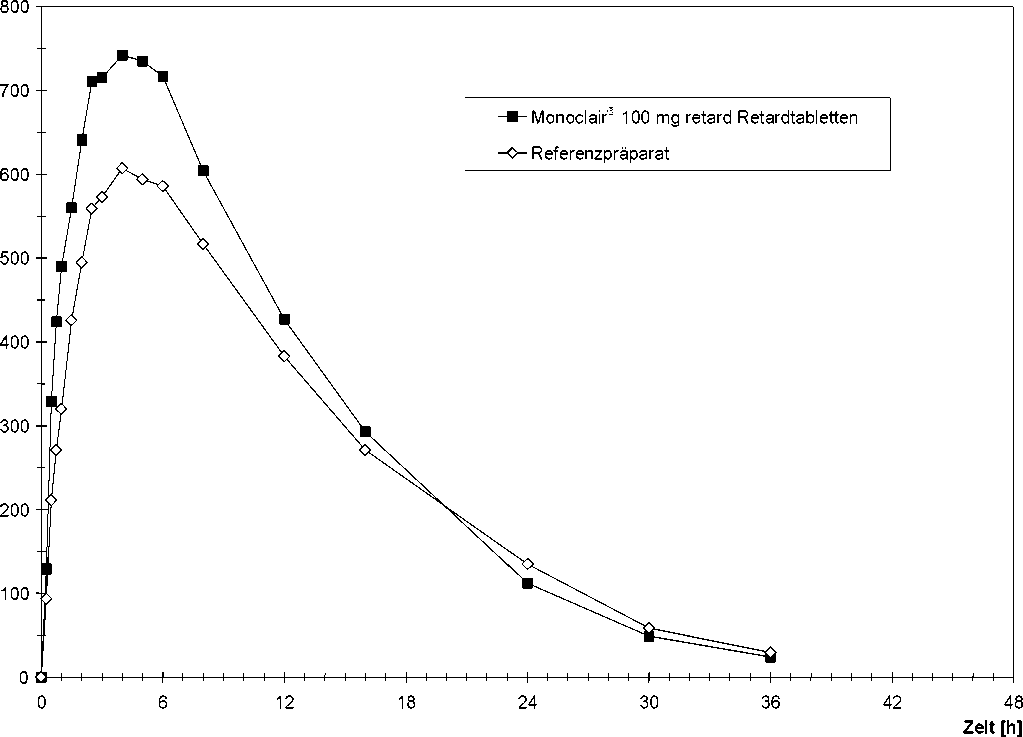
Abbildung 4: Mittlere Plasmakonzentrationen von Isosorbidmononitrat nach Einmalgabe von 1 Retardtablette Monoclair® 100 mg retard Retardtabletten bzw. Referenzpräparat (n=24)
Studienergebnis:
Auf Bioäquivalenz zwischen Test- und Referenzpräparat kann geschlossen werden.
5.3 Präklinische Daten zur Sicherheit
a) Chronische Toxizität
Untersuchungen zur chronischen Toxizität an Ratten ergaben keine Hinweise auf toxische Effekte. Nach oraler Gabe von 191 mg/kg Isosorbidmononitrat wurde beim Hund ein Anstieg des Methämoglobinspiegels um 2,6 % über den Ausgangswert gemessen. Die NitritSerum konzentration lag nach 191 mg/kg Isosorbidmononitrat per os an der Nachweisgrenze (weniger als 0,02 mg/l); alkalische Phosphatase und GPT änderten sich nicht.
b) Mutagenes und tumorerzeugendes Potential
Langzeituntersuchungen an der Ratte ergaben keinen Hinweis auf ein tumorerzeugendes Potential von Isosorbidmononitrat.
Untersuchungen in mehreren Mutagenitätstests (in vitro und in vivo) verliefen negativ.
c) Reproduktionstoxizität
Aus Untersuchungen am Tier ergaben sich keine Hinweise auf eine teratogene Wirkung von Isosorbidmononitrat.
In Studien zur peri-/postnatalen Toxizität zeigten sich fetotoxische Wirkungen nur nach sehr hohen Dosen im maternaltoxischen Bereich.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Monoclair® 20 mg Tabletten
Lactose-Monohydrat, Maisstärke, mikrokristalline Cellulose, hochdisperses Siliciumdioxid,
Magnesiumstearat (Ph.Eur.), Farbstoff E 172.
Monoclair® 40 mg Tabletten
Lactose-Monohydrat, Maisstärke, mikrokristalline Cellulose, hochdisperses Siliciumdioxid,
Magnesiumstearat (Ph.Eur.), Farbstoff E 172.
Monoclair® 60 mg Tabletten
Lactose-Monohydrat, Maisstärke, mikrokristalline Cellulose, hochdisperses Siliciumdioxid,
Magnesiumstearat (Ph.Eur.), Farbstoff E 172.
Monoclair® 40 mg retard Kapseln
Sucrose, Maisstärke, Gelatine, Ethylcellulose, Talkum, Stearinsäure (Ph.Eur.), Farbstoffe Titandioxid (E 171), Eisen(III)-hydroxid-oxid (E 172).
Monoclair® 50 mg retard Kapseln
Sucrose, Maisstärke, Schellack, Ethylcellulose, Talkum, Gelatine, Erythrosin (E 127), Eisen(III)-oxid (E 172), Eisen(II, IN)-oxid (E 172), Eisenoxidhydrat (E 172), Titandioxid (E 171).
Monoclair® 60 mg retard Kapseln
Sucrose, Maisstärke, Gelatine, Ethylcellulose, Talkum, Stearinsäure (Ph.Eur.), Farbstoffe Titandioxid (E 171), Eisen(III)-hydroxid-oxid (E 172).
Monoclair 100 mg retard Retardtabletten
Hypromellose, Lactose-Monohydrat, Magnesiumstearat (Ph.Eur.), Montanglycolwachs, hochdisperses Siliciumdioxid, Talkum.
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Monoclair® 20 mg Tabletten / Monoclair® 40 mg Tabletten / Monoclair® 60 mg Tabletten / Monoclair® 40 mg retard Kapseln / Monoclair® 50 mg retard Kapseln / Monoclair® 60 mg retard Kapseln
3 Jahre
Monoclair® 100 mg retard Retardtabletten
4 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
Monoclair® 20 mg Tabletten
OP mit 20 Tabletten OP mit 50 Tabletten OP mit 100 Tabletten
Monoclair® 40 mg Tabletten
OP mit 50 Tabletten OP mit 100 Tabletten
Monoclair® 60 mg Tabletten
OP mit 50 Tabletten OP mit 100 Tabletten
Monoclair® 40 mg retard Kapseln
OP mit 30 Hartkapseln, retardiert OP mit 60 Hartkapseln, retardiert OP mit 100 Hartkapseln, retardiert
Monoclair® 50 mg retard Kapseln
OP mit 30 Hartkapseln, retardiert OP mit 60 Hartkapseln, retardiert OP mit 100 Hartkapseln, retardiert
Monoclair® 60 mg retard Kapseln
OP mit 30 Hartkapseln, retardiert OP mit 60 Hartkapseln, retardiert OP mit 100 Hartkapseln, retardiert
Monoclair 100 mg retard Retardtabletten
OP mit 20 Retardtabletten OP mit 50 Retardtabletten OP mit 100 Retardtabletten
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Keine besonderen Anforderungen.
HENNIG ARZNEIMITTEL GmbH & Co. KG
Liebigstraße 1—2
65439 Flörsheim am Main
Telefon: (0 61 45) 5 08-0
Telefax: (0 61 45) 5 08-1 40
8. ZULASSUNGSNUMMERN
Monoclair® 20 mg Tabletten
2608.00.00
Monoclair® 40 mg Tabletten
2608.01.00
Monoclair® 60 mg Tabletten
2608.02.00
Monoclair® 40 mg retard Kapseln
32191.00. 00
Monoclair® 50 mg retard Kapseln
10228.00. 00
Monoclair® 60 mg retard Kapseln
32191.01.00
Monoclair 100 mg retard Retardtabletten
49854.00.00
Monoclair® 20 mg Tabletten
Datum der Zulassung: 13.12.1982
Datum der Verlängerung der Zulassung: 22.09.2003
Monoclair® 40 mg Tabletten
Datum der Zulassung: 13.12.1982
Datum der Verlängerung der Zulassung: 22.09.2003
Monoclair® 60 mg Tabletten
Datum der Zulassung: 13.12.1982
Datum der Verlängerung der Zulassung: 22.09.2003
Monoclair® 40 mg retard Kapseln
Datum der Zulassung: 27.06.1994
Datum der Verlängerung der Zulassung: 16.06.2004
Monoclair® 50 mg retard Kapseln
Datum der Z ulassung: 13.04.1995
Datum der Verlängerung der Zulassung: 31.08.2001
Monoclair® 60 mg retard Kapseln
Datum der Zulassung: 27.06.1994
Datum der Verlängerung der Zulassung: 16.06.2004
Monoclair 100 mg retard Retardtabletten
Datum der Zulassung: 04.04.2003
10. STAND DER INFORMATION
06 /2013
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
spcde-monoclair-2013-06.rtf 24