Mononine 1000
CSL Behring
Mononine®
1. BEZEICHNUNG DES ARZNEIMITTELS
Mononine 500/1000, 500/1000 I.E.,
Pulver und Lösungsmittel zur Herstellung einer Injektions- oder Infusionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Flasche enthält nominal:
500/1000 I.E. Blutgerinnungsfaktor IX (FIX) vom Menschen.
Mononine enthält 100 I.E./ml Faktor IX nach Rekonstitution mit 5/10 ml Wasser für Injektionszwecke.
Die Aktivität (I.E.) wird mittels Einphasen-Gerinnungstest gemäß Europäischem Arzneibuch bestimmt. Die mittlere spezifische Aktivität von Mononine beträgt nicht weniger als 190 I.E./mg Protein.
Hergestellt aus Plasma humaner Spender.
Sonstige Bestandteile mit bekannter Wirkung:
Natrium etwa 66 mmol/l (1,5 mg/ml).
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver und Lösungsmittel zur Herstellung einer Injektions- oder Infusionslösung.
Weißes Pulver und klares, farbloses Lösungsmittel zur Herstellung einer Injektions- oder Infusionslösung.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Therapie und Prophylaxe von Blutungen bei Patienten mit Hämophilie B (kongenitaler Faktor-IX-Mangel).
4.2 Dosierung und Art der Anwendung
Die Therapie soll unter der Aufsicht eines in der Hämophilie-Behandlung erfahrenen Arztes erfolgen.
Dosierung
Dosierung und Dauer der Substitutionstherapie richten sich nach dem Schweregrad des Faktor-IX-Mangels, nach Ort und Ausmaß der Blutung und nach dem klinischen Zustand des Patienten.
Die Menge des verabreichten Blutgerinnungsfaktors IX wird in Internationalen Einheiten (I.E.) angegeben, die dem gegenwärtigen WHO-Standard für Faktor-IX-Produkte entsprechen. Die Faktor-IX-Aktivität im Plasma wird entweder als Prozentsatz (in Bezug zu normalem Humanplasma) oder in Internationalen Einheiten (in Bezug zu einem internationalen Standard für Faktor IX im Plasma) angegeben.
Eine Internationale Einheit (I.E.) Faktor-IX-Aktivität entspricht dem Faktor-IX-Gehalt von 1 ml normalem Humanplasma.
Bedarfsbehandlung
Die Berechnung der benötigten Dosis von Faktor IX basiert auf dem empirischen Ergebnis, dass 1 I.E. Faktor IX pro kg Körpergewicht (KG) die Faktor-IX-Aktivität im Plasma um 1,0 % der normalen Aktivität anhebt. Die benötigte Dosis wird nach folgender Formel berechnet:
Erforderliche Einheiten = Körpergewicht [kg] x gewünschter Faktor-IX-Anstieg [% oder I.E./dl] x 1,0.
Dosierung, Art und Dauer der Anwendung sollen sich stets an der klinischen Wirksamkeit im Einzelfall orientieren.
Bei den folgenden Blutungsereignissen soll die Faktor-IX-Aktivität im Plasma (in % der Norm oder I.E./dl) im entsprechenden Zeitraum nicht unterschritten werden. Die folgenden Tabellen dienen als Empfehlung für die Dosierung bei Blutungsereignissen und chirurgischen Eingriffen:
|
Tabelle 1: Intravenöse Bolusinjektion | ||
|
Schweregrad der Blutung/Art des chirurgischen Eingriffs |
Benötigter Faktor-IXSpiegel (% oder I.E./dl) |
Häufigkeit der Dosen (Stunden)/Dauer der Behandlung (Tage) |
|
Blutung | ||
|
Beginnende Hämarthrosen, Muskelblutungen oder Blutungen in der Mundhöhle |
20 - 40 |
Wiederholung alle 24 Stunden. Mind. 1 Tag, bis Beendigung des Blutungsereignisses (durch Schmerz angezeigt) oder bis Abschluß der Wundheilung. |
|
Ausgedehntere Hämarthrosen, Muskelblutungen oder Hämatome |
30 - 60 |
Wiederholung alle 24 Stunden für 3 - 4 Tage oder länger, bis zur |
|
Beseitigung des Schmerzzustandes und der akuten Bewegungseinschränkung | ||
|
Lebensbedrohliche Blutungen |
60 - 100 |
Wiederholung alle 8 bis 24 Stunden bis zur Aufhebung des lebensbedrohlichen Zustandes. |
|
Chirurgische Eingriffe | ||
|
Kleinere Eingriffe einschließlich Zahnextraktion |
30 - 60 |
Alle 24 Stunden, mind. 1 Tag bis Abschluss der Wundheilung. |
|
Größere Eingriffe |
80 - 100 (prä- und postoperativ) |
Wiederholung alle 8 bis 24 Stunden bis zum adäquaten Abschluss der Wundheilung, dann Behandlung für mind. weitere 7 Tage zur Erhaltung einer Faktor-IX-Aktivität bei 30 bis 60 % (I.E./dl). |
|
Tabelle 2: Dauerinfusion bei chirurgischen Eingriffen | |
|
Gewünschte Faktor-IX-Spiegel für die Hämostase |
40 - 100 % (oder I.E./dl) |
|
Initialdosis zur Erreichung des gewünschten Spiegels |
Einzel-Bolusdosis 90 I.E. pro kg (Range 75-100 I.E./kg) KG oder PK-gestützte Dosierung |
|
Häufigkeit der Anwendung |
Intravenöse Dauerinfusion, in Abhängigkeit von der Clearance und gemessenen Faktor-IXSpiegeln |
|
Dauer der Behandlung |
Bis zu 5 Tage, weitere Behandlung kann notwendig sein, in Abhängigkeit von der Art des chirurgischen Eingriffs |
Prophylaxe
Bei der Langzeitprophylaxe von Blutungen bei Patienten mit schwerer Hämophilie B betragen die üblichen Dosen 20 bis 40 I.E. Faktor IX/kg KG in Intervallen von 3 bis 4 Tagen. In manchen Fällen, besonders bei jüngeren Patienten, können kürzere Dosierungsintervalle oder höhere Dosen notwendig sein.
Während der Behandlung sollten die Faktor-IX-Spiegel entsprechend bestimmt werden, um die zu verabreichende Dosis und die Häufigkeit wiederholter Infusionen zu steuern. Vor allem bei größeren chirurgischen Eingriffen ist eine genaue gerinnungsanalytische Überwachung (Faktor-IX-Aktivität im Plasma) der Substitutionstherapie unerlässlich.
Einzelne Patienten können in ihrem Ansprechen auf Faktor IX variieren, wobei unterschiedliche Werte der In-vivo-Recovery erreicht und unterschiedliche Halbwertszeiten gemessen werden.
Die Patienten sollen bezüglich einer Entwicklung von Antikörpern gegen Faktor IX (Hemmkörper) überwacht werden.
Siehe auch Abschnitt 4.4.
Zuvor unbehandelte Patienten
Die Sicherheit und Wirksamkeit von Mononine bei zuvor unbehandelten Patienten wurde bisher noch nicht nachgewiesen.
Kinder und Jugendliche
Die Dosierung bei Kindern richtet sich nach dem Körpergewicht und deshalb generell nach den gleichen Richtlinien wie für Erwachsene. Die Häufigkeit der Anwendung soll sich stets an der klinischen Wirksamkeit im Einzelfall orientieren.
Art der Anwendung
Zur intravenösen Anwendung.
Das Produkt ist wie unter 6.6 beschrieben zu lösen. Das Präparat soll vor der Anwendung auf Raum- oder Körpertemperatur angewärmt werden. Mononine soll langsam intravenös verabreicht werden, so dass der Patient auf spontane Reaktionen beobachtet werden kann. Wenn eine Reaktion erfolgt, die mit der Verabreichung von Mononine in Zusammenhang gebracht werden könnte, soll - in Abhängigkeit vom klinischen Zustand des Patienten - die Infusionsgeschwindigkeit gesenkt bzw. die Infusion abgebrochen werden (siehe auch Abschnitt 4.4).
Intravenöse Bolusinjektion:
Die Vene mit dem beigefügten Venenpunktionsbesteck punktieren. Die Spritze mit dem Luer-Ende des Schlauches verbinden.
Langsam intravenös mit einer für den Patienten angenehmen Geschwindigkeit (max.
2 ml/min) injizieren.
Dauerinfusion:
Mononine wie unter 6.6 beschrieben mit Wasser für Injektionszwecke rekonstituieren. Nach Rekonstitution kann Mononine als Dauerinfusion unverdünnt mittels Perfusor gegeben werden.
Nach Rekonstitution beträgt die Aktivität von unverdünntem Mononine ca. 100 I.E./ml.
Eine verdünnte Lösung wird wie folgt hergestellt:
• Unter aseptischen Bedingungen rekonstituierte und filtrierte Lösung durch Überführung der entsprechenden Menge Mononine 500/1000 in das gewünschte Volumen normale Kochsalzlösung verdünnen.
• Bei Verdünnungen von bis zu 1:10 (Konzentration 10 I.E. Faktor IX/ml) bleibt die Faktor-IX-Aktivität bis zu 24 Stunden stabil.
• Ein Abfall der Faktor-IX-Aktivität kann bei höheren Verdünnungen auftreten. Die Faktor-IX-Aktivität sollte kontrolliert werden, um den gewünschten Blutspiegel zu erhalten.
Beispiel für die Verdünnung von 1000 I.E. rekonstituiertem Mononine:
|
Angestrebter Gehalt an Faktor IX nach Verdünnung |
10 I.E./ml |
20 I.E./ml |
|
Volumen der rekonstituierten Mononine-Lösung |
10,0 ml |
10,0 ml |
|
Benötigtes Volumen an physiologischer Kochsalzlösung |
90,0 ml |
40,0 ml |
|
Erzielte Verdünnung |
1:10 |
1:5 |
• Die Verwendung von Polyvinylchlorid (PVC)-Beuteln und -schlauchsystemen zur intravenösen Anwendung wird empfohlen.
• Sorgfältig mischen und Beutel auf undichte Stellen prüfen.
• Es wird empfohlen, die Beutel mit frisch verdünntem Mononine alle 12 bis 24 Stunden auszutauschen.
Die empfohlene Infusionsrate für eine Dauerinfusion mit Mononine zur Erhaltung eines Faktor-IX-Spiegels im Fließgleichgewicht von ca. 80 % ist 4 I.E./kg KG/Stunde, hängt jedoch von dem pharmakokinetischen Profil des Patienten und dem gewünschten Faktor-IXZielspiegel ab. Bei Patienten, bei denen die Faktor-IX-Clearance bekannt ist, kann die Infusionsrate individuell berechnet werden.
Infusionsrate (I.E./kg KG/Stunde) = Clearance (ml/Stunde/kg KG) x gewünschter Faktor-IX-Anstieg (I.E./ml).
Die Sicherheit und Wirksamkeit bei Kindern wurde für die Dauerinfusion nicht untersucht (siehe Abschnitt 4.4). Deshalb sollte bei Kindern und Jugendlichen eine Dauerinfusion mit Mononine nur dann erwogen werden, wenn vor der Operation Phamakokinetik-Daten (z.B. inkrementelle Recovery und Clearance) zur Dosisberechnung ermittelt wurden und die Plasmaspiegel während der Operation sorgfältig beobachtet werden.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile..
Bekannte allergische Reaktion auf Mausprotein.
Hohes Risiko von Thrombose oder Verbrauchskoagulopathie (s. auch Abschnitt 4.4).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Überempfindlichkeit
Allergie-artige Überempfindlichkeitsreaktionen sind bei der Anwendung von Mononine möglich. Das Produkt enthält Spuren von Mausprotein (murine monoklonale Antikörper, die bei dem Reinigungsprozeß verwendet werden). Obwohl die Spiegel an Mausprotein extrem niedrig sind (< 50 ng Mausprotein/100 I.E.), kann die Infusion solcher Proteine theoretisch Überempfindlichkeitsreaktionen hervorrufen.
Falls Symptome einer Überempfindlichkeit auftreten, sollte den Patienten geraten werden die Anwendung des Arzneimittels sofort zu unterbrechen und ihren Arzt aufzusuchen. Die Patienten sollen über Frühzeichen von Überempfindlichkeitsreaktionen informiert werden, wie quaddelartiger Hautausschlag, generalisierte Nesselsucht, Angina pectoris, Stridor, Hypotension und Anaphylaxie.
Bei einem Schock sollen die aktuellen medizinischen Richtlinien zur Schockbehandlung beachtet werden.
Eine Standarddosis von 2000 I.E. Mononine enthält bis zu 30,36 mg. Dies sollte bei Patienten, die eine salzarme Diät einhalten müssen, berücksichtigt werden.
Inhibitoren
Nach wiederholter Behandlung mit Blutgerinnungsfaktor-IX-Produkten vom Menschen sollen die Patienten auf Entwicklung von neutralisierenden Antikörpern (Hemmkörper) durch Bestimmung in Bethesda-Einheiten (BU) mittels geeigneter biologischer Tests überwacht werden.
In der Literatur finden sich Berichte über eine Korrelation zwischen dem Auftreten eines Faktor-IX-Hemmkörpers und allergischen Reaktionen. Daher sollen Patienten mit allergischen Reaktionen auf das Vorhandensein eines Hemmkörpers getestet werden. Es sollte beachtet werden, dass bei Patienten mit Faktor-IX-Hemmkörpern ein höheres Risiko anaphylaktischer Reaktionen mit einem daraus entstehenden hohen Faktor-IX-Verbrauch besteht.
Wegen des Risikos allergischer Reaktionen durch Faktor-IX-Konzentrate sollen die initialen Anwendungen von Faktor IX nach Verordnung des behandelnden Arztes dort unter ärztlicher Beobachtung durchgeführt werden, wo eine geeignete medizinische Versorgung der allergischen Reaktionen sichergestellt werden kann.
Thromboembolie
Wegen der potentiellen Gefahr thrombotischer Komplikationen soll eine klinische Überwachung auf Frühzeichen thrombotischer Koagulopathie bzw. Verbrauchskoagulopathie mittels geeigneter biologischer Tests erfolgen, wenn dieses Produkt bei Patienten mit Lebererkrankungen, nach Operationen, bei Neugeborenen oder bei Patienten mit Risiko thrombotischer Ereignisse oder Verbrauchskoagulopathie angewendet wird. In jedem dieser Fälle soll der Nutzen einer Therapie mit Mononine gegen das Risiko dieser Komplikationen abgewogen werden.
Katheter-assoziierte Komplikationen
Wenn ein zentraler Venenkatheter (ZVK) erforderlich ist, sollte das Risiko von ZVK-assoziierten Komplikationen einschließlich lokaler Infektionen, Bakteriämie und Thrombosen an der Stelle des Katheters berücksichtigt werden.
Virussicherheit
Standardmethoden zur Vermeidung von Infektionskrankheiten, die im Rahmen der Anwendung von aus menschlichem Blut oder Plasma hergestellten Arzneimitteln auftreten können, umfassen die Auswahl der Spender, die Prüfung jeder einzelnen Spende und jedes Plasmapools auf spezifische Marker für Infektionen, sowie die Einbeziehung effektiver Herstellungsschritte zur Inaktivierung/Eliminierung von Viren. Trotz dieser Maßnahmen kann die Möglichkeit der Übertragung von Erregern bei der Anwendung von aus menschlichem Blut oder Plasma hergestellten Arzneimitteln nicht vollständig ausgeschlossen werden. Dies gilt auch für bisher unbekannte Viren und andere Pathogene.
Die getroffenen Maßnahmen werden als wirksam angesehen für umhüllte Viren wie z. B. das humane Immundefizienzvirus (HIV), das Hepatitis-B Virus (HBV) und das Hepatitis-C Virus (HCV) und für die nicht-umhüllten Hepatitis-A (HAV) und Parvovirus B19 Viren.
Für Patienten, die regelmäßig Präparate aus menschlichem Blut oder Plasma erhalten, wird grundsätzlich eine Impfung gegen Hepatitis A und B empfohlen.
Es wird auf die Dokumentationspflicht gemäß Transfusionsgesetz hingewiesen.
Kinder und Jugendliche
Die aufgeführten Warnhinweise und Vorsichtsmaßnahmen gelten für Erwachsene und für Kinder.
Es gibt keine Daten zur Sicherheit und Wirksamkeit bei Kindern für die Dauerinfusion, insbesondere die Möglichkeit der Entwicklung von Inhibitoren ist unbekannt (siehe Abschnitt 4.2)
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Wechselwirkungen von Blutgerinnungsfaktor-IX-Produkten vom Menschen mit anderen Arzneimitteln wurden nicht berichtet.
Nur wenige Daten liegen vor über die Anwendung von s-Aminocapronsäure nach initialer Infusion von Mononine zur Prophylaxe und Therapie von Blutungen in der Mundhöhle nach Traumen oder zahnärztlichen Eingriffen wie Zahnextraktionen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Reproduktionsstudien am Tier wurden mit Faktor IX nicht durchgeführt.
Schwangerschaft und Stillzeit
Aufgrund des seltenen Vorkommens der Hämophilie B bei Frauen liegen keine Erfahrungen über die Anwendung von Faktor IX während der Schwangerschaft und Stillzeit vor.
Daher soll Faktor IX in der Schwangerschaft und Stillzeit nur bei klarer Indikationsstellung angewendet werden.
Fertilität
Es liegen keine Daten zur Fertilität vor.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Mononine hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Die im folgenden genannten Nebenwirkungen beruhen auf Analysen von postmarketing Daten sowie der wissenschaftlichen Literatur.
Zusammenfassung des Sicherheitsprofils
Während der Behandlung mit Mononine können folgende Nebenwirkungen bei Erwachsenen und Jugendlichen auftreten:
Überempfindlichkeitsreaktionen oder allergische Reaktionen und Fieber. Außerdem können Patienten Hemmkörper gegen FIX entwickeln.
Tabellarische Aufstellung der Nebenwirkungen
Die unten aufgeführte Tabelle entspricht der MedDRA Systemorganklassifikation.
Die Häufigkeiten wurden entsprechend der nachfolgenden Konventionen berechnet: sehr häufig (> 1/10); häufig (> 1/100 und < 1/10); gelegentlich (> 1/1000 und < 1/100); selten (> 1/10000 und < 1/1000); sehr selten (< 1/10000); nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
|
MedDRA Systemorganklasse |
Nebenwirkung |
Häufigkeit |
|
Erkrankungen der Nieren-und Harnwege |
Nephrotisches Syndrom |
Sehr selten |
|
Gefäßerkrankungen |
Thromb oemb oli sche s Ereignis |
Nicht bekannt |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Fieber |
Selten |
|
Erkrankungen des |
Überempfindlichkeit |
Selten |
|
Immunsystems |
(allergische Reaktionen) | |
|
Erkrankungen des Blutes und des Lymphsystems |
FIX Hemmkörper |
Sehr selten |
Beschreibung ausgewählter Nebenwirkungen
Erkrankungen der Nieren- und Harnwege:
Sehr selten wurde über das Auftreten eines nephrotischen Syndroms nach versuchter Induktion einer Immuntoleranz bei Hämophilie-B-Patienten mit Faktor-IX-Hemmkörpern und bekannter allergischer Reaktion berichtet.
Gefäßerkrankungen:
Es besteht ein potentielles Risiko thromboembolischer Ereignisse nach Anwendung von Faktor-IX-Produkten, mit einem höheren Risiko bei wenig reinen Präparaten. Die Anwendung von wenig reinen Faktor-IX-Produkten wurde mit dem Vorkommen von Myokardinfarkt, Verbrauchskoagulopathie, venöser Thrombose und Lungenembolie in Verbindung gebracht. Die Anwendung von hochreinem Faktor IX ist selten mit solchen Nebenwirkungen verbunden.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
In seltenen Fällen wurde Fieber beobachtet.
Erkrankungen des Immunsystems:
Überempfindlichkeitsreaktionen oder allergische Reaktionen (die auch Angioödem,
Stechen, Brennen (Hautreizung) oder Phlebitis an der Injektions-/Infusionsstelle, Schüttelfrost, Hautrötung mit Hitzegefühl, generalisierte Nesselsucht, Kopfschmerzen, quaddelartiger Hautausschlag, Hypotension, Lethargie, Übelkeit, Unruhe, Tachykardie, Angina pectoris, Zittern, Erbrechen oder Stridor mit einschließen können) wurden selten bei Patienten beobachtet. In manchen Fällen entwickelten sich diese Reaktionen zu schwerer Anaphylaxie (inklusive Schock) und diese sind in engem zeitlichen Zusammenhang mit der Entwicklung von Faktor-IX-Hemmkörpern aufgetreten (s. auch Abschnitt 4.4).
Erkrankungen des Blutes und des Lymphsystems
Postmarketing Erfahrungen zeigen, dass Patienten mit Hämophilie B sehr selten neutralisierende Antikörper (Hemmkörper) gegen Faktor IX entwickeln können. Wenn solche Hemmkörper auftreten, manifestiert sich der Zustand als unzureichende klinische Antwort. In solchen Fällen wird empfohlen, ein spezialisiertes Hämophilie-Zentrum aufzusuchen. In einer klinischen Studie entwickelten 2 von 51 (4 %) der zuvor unbehandelten Patienten (PUPs) Hemmkörper, und bei einem dieser Patienten wurde dies zweimal mit einer anaphylaktoiden Reaktion in Verbindung gebracht.
Informationen zur Virussicherheit siehe Abschnitt 4.4.
Kinder und Jugendliche
Es wird erwartet, dass die Häufigkeit, Art und Schwere der Nebenwirkungen bei Kindern denen bei Erwachsenen entspricht.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Str. 51-59, 63225 Langen, Tel: +49 6103 770, Fax: +49 6103 77 1234, Webseite: www.pei.de anzuzeigen.
4.9 Überdosierung
Es wurden keine Symptome von Überdosierung mit Blutgerinnungsfaktor IX vom Menschen berichtet.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe
Antihämorrhagika: Blutgerinnungsfaktor IX.
ATC-Code: B02B D04
Faktor IX ist ein einkettiges Glykoprotein mit einem Molekulargewicht von etwa 68.000 Dalton. Er ist ein Vitamin-K-abhängiger Gerinnungsfaktor, der in der Leber gebildet wird. Faktor IX wird durch Faktor XIa im endogenen Gerinnungssystem, und durch Faktor VII/Gewebefaktorkomplex im exogenen Gerinnungssystem aktiviert.
Aktivierter Faktor IX aktiviert seinerseits im Zusammenwirken mit aktiviertem Faktor VIII den Faktor X. Aktivierter Faktor X wandelt Prothrombin in Thrombin um. Thrombin wandelt dann Fibrinogen in Fibrin um, und ein Gerinnsel wird gebildet.
Hämophilie B ist eine geschlechtsspezifische erbliche Blutgerinnungsstörung aufgrund niedriger Faktor-IX-Spiegel und mündet in schwere Blutungen in Gelenke, Muskeln oder innere Organe, entweder spontan oder als Folge akzidenteller oder chirurgischer Traumen. Durch Substitutionstherapie werden die Faktor-IX-Plasmaspiegel angehoben, wobei eine vorübergehende Korrektur des Faktor-IX-Mangels und Behebung der Blutungsneigungen herbeigeführt wird.
Wenn das Präparat wie beschrieben (siehe Abschnitt 6.6) gelöst wird, erhält man ein klares, farbloses, isotones und pH-neutrales Präparat mit einer ca. 100fachen Faktor-IX-Aktivität gegenüber der gleichen Menge Plasma.
5.2 Pharmakokinetische Eigenschaften
Eine Kurzzeit-Infusion von Mononine bei 38 Patienten mit Hämophilie B (Recovery-Studie) zeigte eine mittlere inkrementelle Recovery von 1,71 I.E./dl pro I.E./kg KG (Range: 0,85 - 4,66). Die mittlere terminale Halbwertszeit in einer Untergruppe von 28 Patienten betrug 14,9 Stunden (Range: 7,2 - 22,7).
Zusätzlich wurden pharmakokinetische Daten von Mononine bei 12 Patienten (elektive Chirurgie) vor einer Dauerinfusion mit Mononine erhoben.
|
Parameter |
Recovery-Studie (n=38) Mittel (Range) |
Elektive Chirurgie (n=12), Mittel (Range) |
|
Inkrementelle Recovery (I.E./dl pro I.E./kg) |
1,71 (0,85 - 4,66) |
1,21 (0,83 - 1,60) |
|
Terminale Halbwertszeit (Stunde) |
14,9 (7,2 - 22,7)++ |
16,4 (8,7 - 36,6) |
|
Initiale Halbwertszeit +++(h) |
n.v. |
2,46 (0,34 - 6,2) |
|
Fläche unter der Konzentrations-Zeitkurve+ (Stunde x kg/ml) |
n.v. |
0,254 (0,147 - 0,408) |
|
Volumen im Fließgleichgewicht (ml/kg) |
n.v. |
111 (77 - 146) |
|
Clearance (ml/Stunde/kg) |
n.v. |
4,27 (2,45 - 6,78) |
|
Mittlere Verweildauer (Stunde) |
n.v. |
27,4 (17,7 - 42,6) |
+ Standardisiert auf 1 I.E./kg der Dosis n.v.: nicht verfügbar
++ Basierend auf einer Untergruppe von 28 Patienten
+++ Daten von nur 4 von 12 Patienten. Die restlichen 8 Patienten folgtem einem einfachen Ein-
Kompartiment-Modell. Ein Verteilungsprozess von Mononine wird daher nur gelegentlich beobachtet. Kinder und Jugendliche
Es liegen keine pharmakokinetische Daten für Kinder jünger als 12 Jahre vor.
5.3 Präklinische Daten zur Sicherheit
Blutgerinnungsfaktor IX vom Menschen ist ein normaler Bestandteil des menschlichen Plasmas und verhält sich wie der körpereigene Faktor IX. Eine Prüfung auf Toxizität der Einzeldosis im Tiermodell ist aufgrund der Volumenüberlastung bei Gabe höherer Dosen irrelevant.
Prüfungen auf Toxizität wiederholter Gaben sind im Tierversuch nicht durchführbar, da die Tiere Antikörper gegen heterologes (menschliches) Protein entwickeln.
Da klinische Erfahrungen keinen Hinweis auf onkogene oder mutagene Wirkungen des Blutgerinnungsfaktors IX vom Menschen ergeben, werden Tierversuche, besonders bei heterologen Spezies, als nicht sinnvoll erachtet.
6. PHARMAZEUTISCHE ANGABEN
6.1
Liste der sonstigen Bestandteile
Histidin,
Mannitol,
Natriumchlorid,
HCl bzw. NaOH (in geringen Mengen zur Einstellung des pH-Wertes)
Beigefügtes Lösungsmittel:
Wasser für Injektionszwecke 5/10 ml
6.2 Inkompatibilitäten
Dieses Arzneimittel darf, außer mit den unter Abschnitt 6.1 aufgeführten Lösungsmitteln und physiologischer Kochsalzlösung, nicht mit anderen Arzneimitteln, Lösungs- oder Verdünnungsmitteln vermischt werden.
6.3 Dauer der Haltbarkeit
2 Jahre.
Die physiko-chemische Stabilität wurde für 24 Stunden bei < 25 °C belegt. Aus mikrobiologischer Sicht sollte das gelöste Produkt sofort verbraucht werden.
Nach Verdünnung (bis zu 1:10) der rekonstituierten Mononine Lösung wurde eine Stabilität über 24 Stunden gezeigt.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (2 °C - 8 °C). Nicht einfrieren. Die Flasche in der Faltschachtel aufbewahren um den Inhalt vor Licht zu schützen.
Während der Haltbarkeitsdauer darf das Produkt (vorausgesetzt es wird in der Faltschachtel aufbewahrt) für einen einmaligen Zeitraum von max. 1 Monat bei Raumtemperatur (bis zu 25 °C) gelagert werden, ohne dass es während diesem Zeitraum wieder in den Kühlschrank zurückgestellt wird. Der Beginn der Lagerung bei Raumtemperatur und das Ende des einmonatigen Zeitraums soll auf der Faltschachtel vermerkt werden. Nach Ablauf dieses Zeitraumes muss das Produkt verbraucht oder fachgerecht entsorgt werden.
6.5 Art und Inhalt des Behältnisses Primärbehältnisse
500 bzw. 1000 I.E. Pulver und 5 bzw. 10 ml Lösungsmittel in Flaschen (Typ I Glas) mit Stopfen (Chlorobutyl Gummi).
Packungsgrößen
Eine Packung mit 500 I.E. enthält: 1 Flasche mit Pulver
1 Flasche mit 5 ml Wasser für Injektionszwecke Eine Packung mit Zubehör enthält:
- 1 Filter Transfer Set 20/20
- 1 Einmalspritze (10 ml)
- 1 Venenpunktionsbesteck
- 2 Alkoholtupfer
- 1 unsteriles Pflaster
Eine Packung mit 10001.E. enthält:
1 Flasche mit Pulver
1 Flasche mit 10 ml Wasser für Injektionszwecke Eine Packung mit Zubehör enthält:
- 1 Filter Transfer Set 20/20
- 1 Einmalspritze (10 ml)
- 1 Venenpunktionsbesteck
- 2 Alkoholtupfer
- 1 unsteriles Pflaster
Möglicherweise werden nicht alle Packungsgrößen angeboten.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Allgemeine Hinweise
- Zubereitung und Verabreichung müssen unter aseptischen Bedingungen erfolgen.
- In der Regel ist die Lösung klar oder leicht opaleszent. Rekonstituiertes Produkt sollte nach der Filtrierung/Aufziehen der Lösung in die Spritze (siehe unten) und vor der Anwendung auf Partikel und Verfärbungen visuell überprüft werden. Trübe Lösungen oder Lösungen mit Rückständen (Niederschlägen/Partikeln) sind nicht zu verwenden.
Zubereitung
Erwärmen Sie das Lösungsmittel auf Raumtemperatur. Stellen Sie sicher, dass vor dem Öffnen der Mix2Vial Packung die Flip-Off-Kappen der Lösungsmittel- und Produktflaschen entfernt, die Stopfen mit einer antiseptischen Lösung behandelt und anschließend getrocknet wurden.
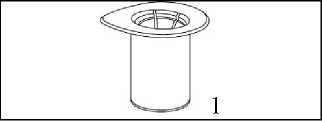
1. Entfernen Sie das Deckpapier von der Mix2Vial Packung. Das Mix2Vial nicht aus dem Blister entnehmen!
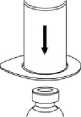
3
2
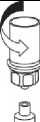
2. Die Lösungsmittelflasche auf eine ebene, saubere Fläche stellen und festhalten. Das Mix2Vial Set mit dem Blister greifen und den Dorn des blauen Adapters senkrecht in den Stopfen der Lösungsmittelflasche einstechen.

4
5

6
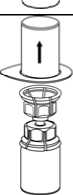
3. Vorsichtig die Verpackung vom Mix2Vial Set entfernen, indem man den Blister am Siegelrand fasst und ihn senkrecht nach oben abzieht. Dabei ist darauf zu achten, dass nur der Blister und nicht das Mix2Vial entfernt wird.
4. Die Produktflasche auf eine feste
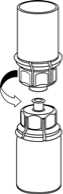
Unterlage stellen. Die Lösungsmittelflasche mit dem aufgesetzten Mix2Vial Set herumdrehen und den Dorn des transparenten Adapters senkrecht in den Stopfen der Produktflasche einstechen. Das Lösungsmittel läuft automatisch in die Produktflasche über._
5. Mit der einen Hand die Produktseite und
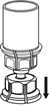
mit der anderen Hand die Lösungsmittelseite des Mix2Vial greifen und das Set vorsichtig gegen den Uhrzeigersinn auseinander schrauben. Entsorgen Sie die Lösungsmittelflasche mit dem blauen Mix2Vial Adapter._
6. Die Produktflasche mit dem transparenten Adapter vorsichtig schwenken, bis das Produkt vollständig gelöst ist. Nicht schütteln.
7
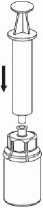
7. Luft in eine leere, sterile Spritze aufziehen. Die Produktflasche aufrecht halten, die Spritze mit dem Luer Lock Anschluss des Mix2Vial Set verbinden indem man sie im Uhrzeigersinn aufschraubt und die Luft in die Produktflasche injizieren.
Aufziehen der Lösung in die Spritze und Anwendung

8

9
8. Den Stempel der Spritze gedrückt halten, das gesamte System herumdrehen und die Lösung durch langsames Zurückziehen der Kolbenstange in die Spritze aufziehen.
9. Nachdem die Lösung vollständig in die Spritze überführt ist, den Spritzenzylinder fassen (dabei die Kolbenstange in ihrer Position halten) und die Spritze vom transparenten Mix2Vial Adapter gegen den Uhrzeigersinn abdrehen.
Verabreichen Sie die Lösung unverzüglich durch langsame intravenöse Injektion oder Infusion (siehe Abschnitt 4.2).
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den lokalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
CSL Behring GmbH
- Emil-von-Behring-Str. 76 35041 Marburg
- Verkauf Deutschland Philipp-Reis-Str. 2 65795 Hattersheim Tel.: (069) 305 - 8 44 37 Fax: (069) 305 - 1 71 29
8. ZULASSUNGSNUMMERN
Mononine® 500 Zul.-Nr. 26218.01.00 Mononine® 1000 Zul.-Nr. 26218.02.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/ VERLÄNGERUNG DER ZULASSUNG
10. August 1993
10. STAND DER INFORMATION
November 2014
11. HERKUNFTSLÄNDER DES BLUTPLASMAS
USA
12. VERSCHREIBUNGSSTATUS
Verschreibungspflichtig