Mononine 500
CSL Behring
Mononine® 500
Gebrauchsinformation: Information für den Anwender
Mononine® 500
500 IU
Pulver und Lösungsmittel zur Herstellung einer Injektions- oder Infusionslösung, Blutgerinnungsfaktor IX vom Menschen
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
• Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
• Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
• Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
• Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht:
1. Was ist Mononine und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von Mononine beachten?
3. Wie ist Mononine anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Mononine aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist Mononine und wofür wird es angewendet?
Was ist Mononine?
Mononine wird aus menschlichem Blutplasma (der flüssige Teil des Blutes) gewonnen und enthält den Blutgerinnungsfaktor IX vom Menschen. Es wird angewendet zur Vorbeugung und Therapie von Blutungen, die durch den angeborenen Mangel des Gerinnungsfaktor IX (Hämophilie B) entstehen.
Wofür wird Mononine angewendet?
Faktor IX spielt eine wichtige Rolle in der Blutgerinnung. Ein Mangel an Faktor IX bedeutet, dass das Blut nicht so schnell wie üblich gerinnt und es deshalb zu einer erhöhten Blutungsneigung kommt. Ein Ersatz des Faktor IX mit Mononine 500 korrigiert vorübergehend den Mechanismus der Blutgerinnung.
Die fertige Lösung soll als Injektion oder Infusion in eine Vene gegeben werden.
2. Was sollten Sie vor der Anwendung von Mononine beachten?
Die folgenden Abschnitte enthalten Informationen die Sie oder Ihr Arzt vor der Anwendung von Mononine berücksichtigen sollten.
Mononine darf nicht angewendet werden,
• wenn Sie allergisch gegen Blutgerinnungsfaktor IX vom Menschen, einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses Arzneimittels oder Mausprotein sind. Bitte informieren Sie Ihren Arzt oder Apotheker über alle Arzneimittel oder Lebensmittel, auf die Sie allergisch reagieren.
• wenn Sie ein hohes Risiko oder eine gesteigerte/erhöhte Neigung zur Blutgerinnselbildung (Thrombose) haben (siehe nächster Abschnitt).
Warnhinweise und Vorsichtsmaßnahmen
• Überempfindlichkeitsreaktionen gegen den Wirkstoff. Wie bei jeder Injektion eines Eiweißproduktes sind allergieartige Überempfindlichkeitsreaktionen möglich. Die ersten Anzeichen können z.B. quaddelartiger Hautausschlag, generalisierte Nesselsucht, Engegefühl in der Brust, pfeifendes Atemgeräusch, niedriger Blutdruck und Anaphylaxie (schwerwiegende allergische Reaktion, die Atembeschwerden oder Schwindel bis hin zum Kollaps verursacht) sein. Bei Auftreten dieser Symptome müssen Sie die Anwendung des Produktes sofort unterbrechen und ihren Arzt aufsuchen.
• Überempfindlichkeitsreaktionen gegen Mausprotein. Mononine enthält aufgrund eines speziellen Reinigungsschrittes Spuren von Mausprotein. Obwohl der Anteil an Mausprotein extrem niedrig ist, kann die Infusion solcher Eiweiße zu Überempfindlichkeitsreaktionen führen.
• Hemmkörpern (Antikörpern) gegen Faktor IX. Die Bildung von Hemmkörpern (neutralisierende Antikörper) gegen Faktor IX ist eine bekannte Komplikation bei der Behandlung und bedeutet, dass die Behandlung nicht mehr wirksam ist. Informieren Sie Ihren Arzt sofort, falls Ihre Blutung mit Mononine nicht unter Kontrolle gebracht werden kann. Ihr Arzt sollte Sie in diesem Fall sorgfältig auf das Vorhandensein von Hemmkörpern untersuchen.
• Blutgerinnseln in einem Blutgefäß (thromboembolische Komplikationen), speziell
> bei Patienten mit Lebererkrankungen,
> nach Operationen,
> bei Neugeborenen
> wenn zusätzliche Risikofaktoren, wie z.B. Schwangerschaft, Einnahme von Verhütungsmitteln, Fettleibigkeit, Rauchen vorliegen.
• Wenn ein zentraler Venenkatheter erforderlich ist, sollte das Risiko von Katheter-assoziierten Komplikationen einschließlich lokaler Infektionen, Bakteriämie und Thrombosen an der Stelle des Katheters berücksichtigt werden.
• Es liegen keine Daten zur Sicherheit und Wirksamkeit einer Dauerinfusion bei Kindern vor, speziell das Risiko einer Hemmkörperbildung ist unbekannt.
Ihr Arzt wird den Nutzen einer Therapie mit Mononine gegen das Risiko dieser Komplikationen abwägen.
Information zum Infektionsrisiko von Mononine
Bei der Herstellung von Arzneimitteln aus menschlichem Blut oder Plasma werden bestimmte Maßnahmen ergriffen, um eine Übertragung von Infektionen auf den Patienten zu verhindern. Diese Maßnahmen umfassen
• die sorgfältige Auswahl von Blut- und Plasmaspendern um sicherzustellen, dass diejenigen ausgeschlossen werden, die ein infektiöses Risiko tragen,
• die Testung jeder einzelnen Spende und jedes Plasmapools auf Anzeichen für Viren/Infektionen
• die Durchführung von Schritten zur Inaktivierung oder Entfernung von Viren während der Verarbeitung von Blut oder Plasma.
Trotz dieser Maßnahmen kann die Möglichkeit der Übertragung von Erregern bei der Anwendung von aus menschlichem Blut oder Plasma hergestellten Arzneimitteln nicht vollständig ausgeschlossen werden. Dies gilt auch für bisher unbekannte oder neu auftretende Viren und für andere Arten von Krankheitserregern.
Die getroffenen Maßnahmen werden als wirksam angesehen für umhüllte Viren, wie z. B. das humane Immunschwächevirus (HIV, das AIDS-Virus), das Hepatitis B- und das Hepatitis C-Virus (Leberentzündung) und für die nicht-umhüllten Hepatitis A (Leberentzündung) und Parvovirus B19 (Ringelröteln) Viren.
Ihr Arzt wird Ihnen empfehlen, eine Impfung gegen Hepatitis A und B in Betracht zu ziehen, falls Sie regelmäßig Präparate aus menschlichem Blut oder Plasma erhalten (z.B. Faktor IX).
Jedes Mal wenn Sie Mononine anwenden, sollten Sie Datum der Verabreichung, Chargennummer sowie die verabreichte Menge in Ihr persönliches Behandlungstagebuch eintragen.
Anwendung von Mononine zusammen mit anderen Arzneimitteln:
• Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel nehmen bzw. vor kurzem genommen haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt.
• Faktor IX und s-Aminocapronsäure (eine chemische Substanz, die den Abbau von Blutgerinnseln unterbindet) können bei Blutungen in der Mundhöhle eingesetzt werden, sowohl nach Verletzungen als auch nach zahnärztlichen Eingriffen (wie Zähne ziehen). Es liegen aber nur wenige Daten über die gleichzeitige Anwendung von s-Aminocapronsäure und Mononine vor.
• Mononine darf nicht mit anderen Arzneimitteln, Lösungs- oder Verdünnungsmitteln, als den vom Hersteller vorgegebenen, vermischt werden (siehe Kapitel 6.).
Schwangerschaft , Stillzeit und Zeugungs-/Gebährfähigkeit
• Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt oder Apotheker um Rat.
• Mononine sollte in der Schwangerschaft und Stillzeit nur angewendet werden, wenn es eindeutig benötigt wird.
• Es liegen keine Daten über die Beeinflussung der Zeugungs-/Gebärfähigkeit vor.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Mononine beeinträchtigt nicht Ihre Teilnahme am Straßenverkehr oder das Bedienen von Maschinen.
Mononine enthält Natrium
Eine Standarddosis von 2000 I.E. Mononine enthält bis zu 30,36 mg Natrium. Dies sollte bei Patienten, die eine salzarme Diät einhalten müssen, berücksichtigt werden.
3. Wie ist Mononine anzuwenden?
Nehmen Sie Mononine immer genau nach Absprache mit Ihrem Arzt ein. Fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht ganz sicher sind.
Die Therapie der Hämophilie B soll von einem in der Behandlung von Gerinnungsstörungen erfahrenen Arzt eingeleitet und überwacht werden.
Dosierung
Die benötigte Menge an Faktor IX sowie die Behandlungsdauer hängen von verschiedenen Faktoren ab, wie z.B. Körpergewicht, Schweregrad Ihrer Erkrankung, Ort und Ausmaß der Blutung oder der Notwendigkeit, Blutungen bei Operationen oder Untersuchungen vorzubeugen. Im Falle von Heimtherapie wird Ihr Arzt Sie entsprechend anleiten, wie Sie Mononine anwenden und wie viel Sie sich verabreichen müssen.
Folgen Sie den Anweisungen Ihres Arztes oder Ihrer Krankenschwester des HämophilieZentrums.
Wenn Sie eine größere Menge von Mononine angewendet haben, als Sie sollten Es wurden keine Symptome von Überdosierung mit Faktor IX beobachtet.
Zubereitung und Anwendung Allgemeine Hinweise
- Das Pulver muss unter keimarmen (aseptischen) Bedingungen gelöst und aufgezogen werden.
- Die fertige Lösung sollte klar oder leicht opaleszent sein, d.h. sie kann leicht schillern wenn Sie sie gegen das Licht halten, darf aber keine deutlich sichtbaren Partikel enthalten. Das gelöste Produkt sollte nach der Filtration/dem Aufziehen der Lösung in die Spritze (siehe unten) und vor der Anwendung auf sichtbare Partikel und Verfärbungen überprüft werden.
Trübe Lösungen oder Lösungen mit Rückständen (Flocken/Partikeln) sind nicht zu verwenden.
- Nach der Anwendung sollen ungebrauchtes Produkt und Abfallmaterial fachgerecht, gemäß den nationalen Anforderungen und den Anweisungen Ihres Arztes, entsorgt werden.
Zubereitung
Erwärmen Sie das Mononine Pulver und das Lösungsmittel auf Raum- oder Körpertemperatur ohne die Flaschen zu öffnen. Lassen Sie dazu die beiden Flaschen entweder ca. 1 Stunde bei Raumtemperatur stehen, oder halten Sie sie ein paar Minuten in Ihren Händen. Setzen Sie die Flaschen nicht direkter Hitze aus. Die Flaschen sollen nicht über Körpertemperatur (37 °C) erwärmt werden.
Stellen Sie sicher, dass vor dem Öffnen der Mix2Vial Packung die Flip-Off-Kappen der Lösungsmittel- und Produktflaschen entfernt, und die Stopfen mit einem Alkoholtupfer abgewischt wurden. Lassen Sie diese anschließend trocknen bevor Sie die Mix2Vial Packung öffnen. Befolgen Sie dann die nachstehenden Anweisungen.
1
2
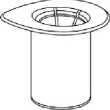
1. Entfernen Sie das Deckpapier von der Mix2Vial Packung. Das Mix2Vial nicht aus dem Blister entnehmen!
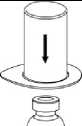
2. Die Lösungsmittelflasche auf eine ebene, saubere Fläche stellen und festhalten. Das Mix2Vial Set mit dem Blister greifen und den Dorn des blauen Adapters senkrecht in den Stopfen der Lösungsmittelflasche einstechen.
3
4
3. Vorsichtig die Verpackung vom Mix2Vial Set entfernen, indem man den Blister am Siegelrand fasst und ihn senkrecht nach oben abzieht. Dabei ist darauf zu achten, dass nur der Blister und nicht das Mix2Vial entfernt wird.
4. Die Produktflasche auf eine feste Unterlage stellen. Die Lösungsmittelflasche mit dem aufgesetzten Mix2Vial Set herumdrehen und den Dorn des transparenten Adapters senkrecht in den Stopfen der Produktflasche einstechen. Das Lösungsmittel läuft automatisch in die Produktflasche über.
Aufziehen der Lösung in die Spritze und Anwendung
|
f |
Ti p8 |
8. Den Stempel der Spritze gedrückt halten, das gesamte System herumdrehen und die Lösung durch langsames Zurückziehen der Kolbenstange in die Spritze aufziehen. |
|
A |
9. Nachdem die Lösung vollständig in die Spritze überführt ist, den Spritzenzylinder fassen (dabei die Kolbenstange in ihrer Position halten) und die Spritze vom | |
|
1 |
Is |
transparenten Mix2Vial Adapter gegen den Uhrzeigersinn abdrehen. |
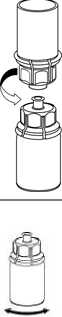
5
6
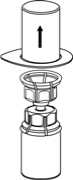
5. Mit der einen Hand die Produktseite und
mit der anderen Hand die Lösungsmittelseite des Mix2Vial greifen und das Set vorsichtig gegen den Uhrzeigersinn auseinander schrauben. Entsorgen Sie die Lösungsmittelflasche mit dem blauen Mix2Vial Adapter._
6. Die Produktflasche mit dem transparenten Adapter vorsichtig schwenken, bis das Produkt vollständig gelöst ist. Nicht schütteln.
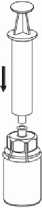
7
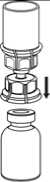
7. Luft in eine leere, sterile Spritze aufziehen. Die Produktflasche aufrecht halten, die Spritze mit dem Luer Lock Anschluss des Mix2Vial Set verbinden indem man sie im Uhrzeigersinn aufschraubt und die Luft in die Produktflasche injizieren.
Intravenöse Bolusinjektion:
Verwenden Sie hierzu das beiliegende Venenpunktionsbesteck, führen Sie die Nadel in eine Vene. Lassen Sie das Blut bis zum Ende des Schlauchs fließen. Befestigen Sie die Spritze an dem Luer-Ende des Venenpunktionsbestecks. Injizieren Sie langsam intravenös entsprechend den
Anweisungen Ihres Arztes. Achten Sie sorgfältig darauf, dass kein Blut in die mit der Lösung gefüllte Spritze gelangt. Die Injektionsgeschwindigkeit sollte nicht mehr als 2 ml pro Minute betragen.
Dauerinfusion:
Mononine kann auch als Dauerinfusion über mehrere Stunden oder Tage gegeben werden. Die Anwendung muss von Ihrem Arzt durchgeführt und kontrolliert werden.
Beobachten Sie sich auf jegliche sofort eintretende Überempfindlichkeitsreaktion. Wenn eine Nebenwirkung erfolgt, die mit der Verabreichung von Mononine in Zusammenhang gebracht werden könnte, müssen Sie die Injektion/Infusion abbrechen (siehe auch Kapitel „Warnhinweise und Vorsichtsmaßnahme^").
Wenn Sie weitere Fragen zur Anwendung des Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Wenden Sie sich sofort an Ihren Arzt, die Notaufnahme oder das Hämophilie-Zentrum in Ihrem nächstgelegenen Krankenhaus, wenn eine der folgenden Reaktionen auftritt:
• Eine plötzliche allergische Reaktion (wie z.B. Hautrötung oder quaddelartiger Nesselausschlag, Jucken, Schwellungen im Gesicht, der Lippen, Zunge oder anderer Körperteile),
• Kurzatmigkeit, pfeifendes Atemgeräusch oder Atemprobleme,
• Krampfanfälle
• Mangelnde Wirksamkeit (anhaltende Blutung)
Andere Nebenwirkungen sind:
• Allergische (Überempfindlichkeits-) Reaktionen wie z. B.:
> Brennen und Stechen, Rötung und Schwellung der Vene an der Injektions-/ Infusionsstelle
> Schwellungen des Gesichtes, Halses oder an anderen Stellen des Körpers, Schüttelfrost, Nesselsucht (Hautrötung mit Hitzegefühl, generalisierte am ganzen Körper), quaddelartiger Hautausschlag
> Kopfschmerzen
> Blutdruckabfall, Unruhe, Herzrasen, Engegefühl in der Brust, pfeifendes Atemgeräusch
> Müdigkeit (Lethargie)
> Übelkeit, Erbrechen
> Prickeln
Diese Nebenwirkungen wurden selten beobachtet. In manchen Fällen entwickelten sich diese Reaktionen zu schwerer Anaphylaxie (einschließlich Schock), was in einem engen zeitlichen Zusammenhang mit der Entwicklung von Faktor-IX-Hemmkörpern steht.
• In seltenen Fällen wurde Fieber beobachtet.
• Sehr selten wurde das Auftreten einer speziellen Form von Nierenentzündung (nephrotisches Syndrom) nach der Behandlung von Hämophilie-B-Patienten berichtet, die Faktor-IXHemmkörper bilden und eine bekannte Neigung zu allergischen Reaktionen haben.
• Nach Anwendung von Faktor-IX-Produkten besteht ein potentielles Risiko einer erhöhten Blutgerinnselbildung die zu einem Herzinfarkt, einem Blutgerinnsel im Bein (venöse Thrombose) oder zu einem Blutgerinnsel in der Lunge (Lungenembolie) führen kann. Die Anwendung von Mononine ist selten mit solchen Nebenwirkungen verbunden.
• Sehr selten können Sie Hemmkörper (neutralisierende Antikörper) gegen Faktor IX entwickeln, wodurch Faktor IX nicht mehr richtig wirken kann. In solchen Fällen wird empfohlen, ein spezialisiertes Hämophilie-Zentrum aufzusuchen.
Nebenwirkungen bei Kindern und Jugendlichen
Es wird erwartet, dass die Häufigkeit, Art und Schwere der Nebenwirkungen bei Kindern denen bei Erwachsenen entspricht.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Str. 51-59, 63225 Langen, Tel: +49 6103 770, Fax: +49 6103 77 1234, Webseite: www.pei.de anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist Mononine aufzubewahren?
Sie dürfen Mononine nach dem auf dem Etikett und dem Umkarton angegebenen Verfallsdatum nicht mehr anwenden.
• Arzneimittel für Kinder unzugänglich aufbewahren.
• Nicht einfrieren.
• Flasche in der geschlossenen Faltschachtel aufbewahren, um den Inhalt vor Licht zu schützen.
• Im Kühlschrank bei +2 bis +8 °C aufbewahren.
• Während der Haltbarkeitsdauer darf das Produkt (vorausgesetzt es wird in der Faltschachtel aufbewahrt) für einen einmaligen Zeitraum von max. 1 Monat bei Raumtemperatur (bis zu +25 °C) gelagert werden, ohne dass es während diesem Zeitraum wieder in den Kühlschrank gestellt wird. Der Beginn der Lagerung bei Raumtemperatur und das Ende des einmonatigen Zeitraumes soll auf der Faltschachtel vermerkt werden. Nach Ablauf dieses Zeitraumes muss das Produkt verbraucht oder fachgerecht entsorgt werden.
• Mononine 500 enthält kein Konservierungsmittel. Die fertige Lösung soll deshalb sofort verbraucht werden.
• Wenn fertig gelöstes Mononine 500 verdünnt wird (bis zu 1:10) muss die Lösung innerhalb von 24 Stunden aufgebraucht werden.
• Ihr Arzt wird Sie informieren, wie Sie unbenutztes Produkt oder Abfallmaterial entsorgen sollen.
6. Inhalt der Packung und weitere Informationen Was Mononine enthält
Der Wirkstoff ist: Blutgerinnungsfaktor IX 500 I.E. vom Menschen.
Nach Auflösung der Trockensubstanz mit 5 ml des Lösungsmittels enthält die fertige Lösung ca. 100 I.E. Gerinnungsfaktor IX vom Menschen pro ml.
Die sonstigen Bestandteile sind: Histidin, Mannitol, Natriumchlorid, Salzsäure bzw. Natriumhydroxid (in geringen Mengen) zur Einstellung des pH-Wertes. Lösungsmittel: Wasser für Injektionszwecke.
Wie Mononine aussieht und Inhalt der Packung
Mononine ist ein weißes Pulver und wird mit Wasser für Injektionszwecke als Lösungsmittel geliefert.
Die fertige Lösung sollte klar bis leicht opaleszent sein, d.h. sie kann leicht schillern wenn Sie sie gegen das Licht halten, darf aber keine deutlich sichtbaren Partikel enthalten.
Packungsgrößen
Eine Packung mit 500 I.E. enthält:
- 1 Flasche mit Pulver
- 1 Flasche mit 5 ml Wasser für Injektionszwecke Eine Packung mit Zubehör enthält:
- 1 Filter Transfer Set 20/20
- 1 Einmalspritze (10 ml)
- 1 Venenpunktionsbesteck
- 2 Alkoholtupfer
- 1 unsteriles Pflaster
Pharmazeutischer Unternehmer und Hersteller
CSL Behring GmbH
- Emil-von-Behring-Str. 76 35041 Marburg
- Verkauf Deutschland Philipp-Reis-Str.2 65795 Hattersheim
Dieses Arzneimittel ist in den Mitgliedsstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen: Mononine 500: Deutschland, Frankreich, Großbritannien, Italien, Luxemburg, Niederlande, Österreich, Polen, Portugal, Schweden, Slowenien, Spanien, Ungarn.
Mononine 500 IU: Slowakei, Tschechische Republik
Diese Gebrauchsinformation wurde zuletzt überarbeitet im November 2014
Es wird auf die Dokumentationspflicht gemäß Transfusionsgesetz hingewiesen. Zul.-Nr.: Mononine® 500 26218.01.00
Herkunftsländer des Blutplasmas: USA
Die folgenden Informationen sind für medizinisches Fachpersonal bestimmt:
Dosierung
Die Menge des verabreichten Blutgerinnungsfaktors IX wird in Internationalen Einheiten (I.E.) angegeben, die dem gegenwärtigen WHO-Standard für Faktor-IX-Produkte entsprechen. Die Faktor-IX-Aktivität im Plasma wird entweder als Prozentsatz (in Bezug zu normalem Humanplasma) oder in Internationalen Einheiten (in Bezug zu einem internationalen Standard für Faktor IX im Plasma) angegeben.
Eine Internationale Einheit (I.E.) Faktor-IX-Aktivität entspricht dem Faktor-IX-Gehalt von 1 ml normalem Humanplasma.
Bedarfsbehandlung
Die Berechnung der benötigten Dosis von Faktor IX basiert auf dem empirischen Ergebnis, dass 1 I.E. Faktor IX pro kg Körpergewicht (KG) die Faktor-IX-Aktivität im Plasma um 1,0 % der normalen Aktivität anhebt. Die benötigte Dosis wird nach folgender Formel berechnet:
Erforderliche Einheiten = Körpergewicht [kg] x gewünschter Faktor-IX-Anstieg [% oder I.E./dl]
X 1,0*.
Dosierung, Art und Dauer der Anwendung sollen sich stets an der klinischen Wirksamkeit im Einzelfall orientieren.
Bei den folgenden Blutungsereignissen soll die Faktor-IX-Aktivität im Plasma (in % der Norm oder I.E./dl) im entsprechenden Zeitraum nicht unterschritten werden. Die folgenden Tabellen dienen als Empfehlung für die Dosierung bei Blutungsereignissen und chirurgischen Eingriffen:
|
Tabelle 1: Intravenöse Bolusinjektion | ||
|
Schweregrad der Blutung/Art des chirurgischen Eingriffs |
Benötigter Faktor-IXSpiegel (% oder I.E./dl) |
Häufigkeit der Dosen (Stunden)/Dauer der Behandlung (Tage) |
|
Blutung | ||
|
Beginnende Hämarthrosen, Muskelblutungen oder Blutungen in der Mundhöhle |
20 - 40 |
Wiederholung alle 24 Stunden. Mind. 1 Tag, bis Beendigung des Blutungsereignisses (durch Schmerz angezeigt) oder bis Abschluss der Wundheilung. |
|
Ausgedehntere Hämarthrosen, Muskelblutungen oder Hämatome |
30 - 60 |
Wiederholung alle 24 Stunden für 3 - 4 Tage oder länger, bis zur Beseitigung des Schmerzzustandes und der akuten Bewegungseinschränkung |
|
Lebensbedrohliche Blutungen |
60 - 100 |
Wiederholung alle 8 bis 24 Stunden bis zur Aufhebung des lebensbedrohlichen Zustandes. |
|
Chirurgische Eingriffe | ||
|
Kleinere Eingriffe einschließlich Zahnextraktion |
30 - 60 |
Alle 24 Stunden, mind. 1 Tag bis Abschluss der Wundheilung. |
|
Größere Eingriffe |
80 - 100 (prä- und postoperativ) |
Wiederholung alle 8 bis 24 Stunden bis zum adäquaten Abschluss der Wundheilung, dann Behandlung für mind. weitere 7 Tage zur Erhaltung einer Faktor-IXAktivität bei 30 bis 60 % (I.E./dl). |
|
Tabelle 2: Dauerinfusion bei chirurgischen Eingriffen | |
|
Gewünschte Faktor-IX-Spiegel für die Hämostase |
40 - 100 % (oder I.E./dl) |
|
Initialdosis zur Erreichung des gewünschten Spiegels |
Einzel-Bolusdosis 90 I.E. pro kg (Range 75-100 I.E./kg) KG oder PK-gestützte Dosierung |
|
Häufigkeit der Anwendung |
Intravenöse Dauerinfusion, in Abhängigkeit von der Clearance und gemessenen Faktor-IX-Spiegeln |
|
Dauer der Behandlung |
Bis zu 5 Tage, weitere Behandlung kann notwendig sein, in Abhängigkeit von der Art des chirurgischen Eingriffs |
Prophylaxe
Bei der Langzeitprophylaxe von Blutungen bei Patienten mit schwerer Hämophilie B betragen die üblichen Dosen 20 bis 40 I.E. Faktor IX/kg KG in Intervallen von 3 bis 4 Tagen. In manchen Fällen, besonders bei jüngeren Patienten, können kürzere Dosierungsintervalle oder höhere Dosen notwendig sein.
Während der Behandlung sollten die Faktor-IX-Spiegel entsprechend bestimmt werden, um die zu verabreichende Dosis und die Häufigkeit wiederholter Infusionen zu steuern. Vor allem bei größeren chirurgischen Eingriffen ist eine genaue gerinnungsanalytische Überwachung (Faktor-IX-Aktivität im Plasma) der Substitutionstherapie unerlässlich. Einzelne Patienten können in ihrem Ansprechen auf Faktor IX variieren, wobei unterschiedliche Werte der In-vivo-Recovery erreicht und unterschiedliche Halbwertszeiten gemessen werden.
Die Patienten sollen bezüglich einer Entwicklung von Antikörpern gegen Faktor IX (Hemmkörper) überwacht werden.
Zuvor unbehandelte Patienten
Die Sicherheit und Wirksamkeit von Mononine bei zuvor unbehandelten Patienten wurde bisher noch nicht nachgewiesen.
Kinder und Jugendliche
Die Dosierung bei Kindern richtet sich nach dem Körpergewicht und deshalb generell nach den gleichen Richtlinien wie für Erwachsene. Die Häufigkeit der Anwendung soll sich stets an der klinischen Wirksamkeit im Einzelfall orientieren.
Anwendung
Mononine kann entweder als intravenöse Bolusinjektion (siehe Anweisungen in Kapitel 3.), oder als Dauerinfusion (siehe nachfolgende Anweisungen) gegeben werden.
Dauerinfusion:
Mononine soll mit Wasser für Injektionszwecke wie in Abschnitt "Zubereitung und Anwendung" beschrieben gelöst werden. Nach Rekonstitution kann Mononine als Dauerinfusion verdünnt oder unverdünnt mittels Perfusor oder einem zugelassenen Infusionsset gegeben werden.
Nach Rekonstitution beträgt die Aktivität von unverdünntem Mononine ca. 100 I.E./ml.
Eine verdünnte Lösung wird wie folgt hergestellt:
• Unter aseptischen Bedingungen rekonstituierte und filtrierte Lösung durch Überführung der entsprechenden Menge Mononine in das gewünschte Volumen normale Kochsalzlösung verdünnen.
• Bei Verdünnungen von bis zu 1:10 (Konzentration 10 I.E. Faktor IX/ml) bleibt die Faktor-IXAktivität bis zu 24 Stunden stabil.
• Ein Abfall der Faktor-IX-Aktivität kann bei höheren Verdünnungen auftreten. Die Faktor-IXAktivität sollte kontrolliert werden, um den gewünschten Blutspiegel zu erhalten.
Beispiel für die Verdünnung von 500 I.E. rekonstituiertem Mononine:
|
Angestrebter Gehalt an Faktor IX nach Verdünnung |
10 I.E./ml |
20 I.E./ml |
|
Volumen der Mononine-Lösung |
5,0 ml |
5,0 ml |
|
Benötigtes Volumen der physiologischen Kochsalzlösung |
45,0 ml |
20,0 ml |
|
Erzielte Verdünnung |
1:10 |
1:5 |
• Die Verwendung von Polyvinylchlorid (PVC)-Beuteln und -schlauchsystemen zur intravenösen Anwendung wird empfohlen.
• Sorgfältig mischen und Beutel auf undichte Stellen prüfen.
• Es wird empfohlen, die Beutel mit frisch verdünntem Mononine alle 12 bis 24 Stunden auszutauschen.
Die empfohlene Infusionsrate für eine Dauerinfusion mit Mononine zur Erhaltung eines Faktor-IX-Spiegels im Fließgleichgewicht von ca. 80 % ist 4 I.E./kg KG/Stunde, hängt jedoch von dem pharmakokinetischen Profil des Patienten und dem gewünschten Faktor-IX-Zielspiegel ab. Bei Patienten, bei denen die Faktor-IX-Clearance bekannt ist, kann die Infusionsrate individuell berechnet werden.
Infusionsrate (I.E./kg KG/Stunde) = Clearance (ml/Stunde/kg KG) x gewünschter Faktor-IXAnstieg (I.E./ml).
Die Sicherheit und Wirksamkeit bei Kindern wurde für die Dauerinfusion nicht untersucht. Deshalb sollte bei Kindern und Jugendlichen eine Dauerinfusion mit Mononine nur dann erwogen werden, wenn vor der Operation Phamakokinetik-Daten (z.B. inkrementelle Recovery und Clearance) zur Dosisberechnung ermittelt wurden und die Plasmaspiegel während der Operation sorgfältig beobachtet werden.