Mtx Hexal 2,5 Mg Tabletten
Fachinformation
Wichtiger Warnhinweis zur Dosierung von Methotrexat:
Methotrexat zur Therapie von rheumatologischen oder dermatologischen Erkrankungen darf nur 1 x wöchentlich eingenommen werden.
Fehlerhafte Dosierung von Methotrexat kann zu schwerwiegenden Nebenwirkungen, einschließlich tödlich verlaufender, führen. Das medizinische Personal und die Patienten sind entsprechend zu unterweisen.
1. Bezeichnung des Arzneimittels
MTX HEXAL 2,5 mg Tabletten
2. Qualitative und quantitative Zusammensetzung
1 Tablette enthält 2,74 mg Methotrexat-Dinatrium, entsprechend 2,5 mg Methotrexat. Sonstiger Bestandteil mit bekannter Wirkung: Lactose-Monohydrat Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Tabletten
Aussehen: gelb, rund, Bruchkerbe auf einer Seite
4. Klinische Angaben
4.1 Anwendungsgebiete
- Schwere Formen der aktiven rheumatoiden Arthritis (chronischen Polyarthritis)
a) wenn eine Therapie mit anderen Basistherapeutika oder mit nicht-steroidalen Antiphlogistika (non-steroidal anti-inflammatory drugs, NSAIDs) nicht ausreichend wirksam ist oder nicht vertragen wird
b) bei primär besonders aggressiv verlaufenden („malignen") Formen der rheumatoiden Arthritis (chronischen Polyarthritis).
- Polyarthritische Formen der schweren aktiven juvenilen idiopathischen Arthritis (JIA) ab dem 3. Lebensjahr bei mangelndem Ansprechen auf NSAIDs
- Schwere Formen der Psoriasis vulgaris, insbesondere vom Plaque-Typ, und der Psoriasis arthropathica, die mit einer konventionellen Therapie nicht ausreichend behandelbar sind.
4.2 Dosierung und Art der Anwendung
• Dieses Arzneimittel darf nur einmal wöchentlich eingenommen werden. Auf die Besonderheit der einmal wöchentlichen Gabe ist der Patient/die Patientin ausdrücklich hinzuweisen!
• Es empfiehlt sich, einen bestimmten, geeigneten Wochentag als Tag der Einnahme ausdrücklich festzulegen. Der Verordner sollte den Wochentag der Einnahme auf der Verordnung vermerken.
Aufgrund der im Alter verminderten Leber- und Nierenfunktionsleistungen und niedriger Folatreserven sollen in höherem Lebensalter relativ niedrige Dosierungen angewendet werden.
Dosierung bei rheumatoider Arthritis
Die empfohlene Initialdosis beträgt 7,5 mg Methotrexat einmal wöchentlich als orale Applikation (siehe Abschnitt „Art der Anwendung"). Die orale Dosis kann auch auf drei Einzelgaben zu je 2,5 mg Methotrexat verteilt werden, die einmal wöchentlich jeweils im Abstand von 12 Stunden genommen werden.
Je nach Krankheitsaktivität kann bei guter Verträglichkeit die Initialdosis schrittweise um 2,5 mg gesteigert werden. Alternativ kann auch mit einer höheren Dosis begonnen werden. Die mittlere wöchentliche Dosis beträgt 15-20 mg Methotrexat. Eine Wochendosis von 20 mg Methotrexat sollte im Allgemeinen nicht überschritten werden. Nach Erreichen des gewünschten Therapieergebnisses sollte - soweit möglich - die Dosierung schrittweise reduziert werden bis zur niedrigsten noch wirksamen Erhaltungsdosis.
Dosierung bei Kindern (ab dem 3. Lebensjahr) und Jugendlichen mit polyarthritischen Formen der juvenilen idiopathischen Arthritis
Die empfohlene Dosierung beträgt 10-15 mg/m2 Körperoberfläche/Woche. Eine höhere Dosis von 20-30 mg/m2 Körperoberfläche/Woche ist in Ausnahmefällen bei therapierefraktären Fällen möglich, wobei eine höhere Frequenz von Kontrolluntersuchungen angezeigt ist.
Dosierung bei schweren Formen der Psoriasis vulgaris und der Psoriasis arthropathica Empfohlene Initialdosis (bezogen auf einen durchschnittlichen Erwachsenen von 70 kg Körpergewicht): Es wird eine einmalige oral eingenommene Testdosis von 2,5 bis 5 mg zur Abschätzung der T oxizität empfohlen (siehe Abschnitt „Art der Anwendung").
Bei unveränderten Laborparametern eine Woche später Fortführung mit ca. 7,5 mg. Die Dosis wird unter Überwachung der Laborparameter schrittweise (in Schritten von 5-7,5 mg pro Woche) gesteigert, bis ein optimales Therapieergebnis erreicht wird. Eine Wochendosis von 30 mg Methotrexat sollte im Allgemeinen nicht überschritten werden.
Nach Erreichen des gewünschten Therapieergebnisses sollte, soweit möglich, die Dosierung schrittweise bis zur niedrigsten beim einzelnen Patienten noch wirksamen Erhaltungsdosis reduziert werden.
Dosierung bei Patienten mit eingeschränkter Nierenfunktion
Bei verminderter Nierenfunktionsleistung sollte die Methotrexat-Dosis wie folgt angepasst werden:
Kreatinin-Clearance > 80 ml/min angegebene
Standarddosis
Kreatinin-Clearance = 80 ml/min
75 % der angegebenen
Standarddosis
63 % der angegebenen
Standarddosis
Verwendung einer
Alternativtherapie
Kreatinin-Clearance = 60 ml/min
Kreatinin-Clearance < 60 ml/min
Art der Anwendung
MTX HEXAL wird unzerkaut mit reichlich Flüssigkeit vorzugsweise am Abend und möglichst nicht zu den Mahlzeiten eingenommen.
Die orale Dosis kann auch auf drei Einzelgaben verteilt werden, die einmal wöchentlich jeweils im Abstand von 12 Stunden genommen werden.
Über die Dauer der Anwendung entscheidet der behandelnde Arzt.
Die MTX HEXAL-Behandlung schwerer Formen der rheumatoiden Arthritis, der juvenilen idiopathischen Arthritis, Psoriasis vulgaris und der Psoriasis arthropathica stellen eine längerfristige Behandlung dar.
Rheumatoide Arthritis
Mit einem Ansprechen auf die Therapie bei rheumatoider Arthritis ist etwa nach 4-8 Wochen zu rechnen. Nach Absetzen der Behandlung kann es zu einem Wiederauftreten der Symptome kommen.
Schwere Formen der Psoriasis vulgaris und Psoriasis arthropathica Ein Ansprechen der Therapie tritt im Allgemeinen nach 2-6 Wochen ein. Danach wird die Therapie entsprechend des klinischen Bildes und den Laborparameterveränderungen weitergeführt oder abgesetzt.
4.3 Gegenanzeigen
MTX HEXAL darf nicht angewendet werden bei:
• bekannter Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile des Arzneimittels
• Nierenfunktionsstörungen (Kreatinin-Clearance < 60 ml/min)
• Leberschäden (alkoholbedingte Lebererkrankung oder andere chronische Lebererkrankungen)
• vorbestehenden Erkrankungen des blutbildenden Systems
• erhöhtem Alkoholkonsum
• Immundefizienz
• schweren oder bestehenden Infektionen
• Ulzera (Geschwüre) des Magen-Darm-Traktes
• Schwangerschaft, Stillzeit (siehe auch Abschnitt 4.6)
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
• Der Verordner sollte den Wochentag der Einnahme auf der Verordnung vermerken.
• Die Patienten müssen darauf hingewiesen werden, dass es wichtig ist, dieses Arzneimittel nicht öfters als einmal wöchentlich einzunehmen.
Besonders bei älteren Patienten wurden nach der versehentlich täglichen Anwendung der Wochendosis Todesfälle gemeldet.
Wegen seiner potenziell lebertoxischen Wirkung wird empfohlen, während der Methotrexat-Therapie keine zusätzlich leberschädigenden Arzneimittel einzunehmen und auf Alkohol zu verzichten bzw. den Alkoholkonsum deutlich einzuschränken.
Bei Vorliegen von Risikofaktoren, wie z. B. einer - auch grenzwertig - eingeschränkten Nierenfunktion, wird von der gleichzeitigen Gabe nicht-steroidaler Antiphlogistika abgeraten (Verstärkung der Toxizität möglich).
Bei Patienten mit eingeschränkter Nierenfunktion sollte aufgrund einer bei diesen Patienten verzögerten Methotrexat-Elimination die Methotrexat-Therapie nur mit erhöhter Vorsicht und niedriger Dosierung durchgeführt werden (siehe Abschnitt 4.2).
Da Methotrexat vorwiegend über die Nieren ausgeschieden wird, ist bei Niereninsuffizienz mit erhöhten, länger anhaltenden Serumkonzentrationen zu rechnen, die schwere Nebenwirkungen zur Folge haben können, wie Störungen der Nierenfunktion bis zum akuten Nierenversagen. Im Zusammenhang mit der Gabe nicht-steroidaler Antiphlogistika ist über schwere Nebenwirkungen einschließlich Todesfällen berichtet worden.
Auch Zustände (Erbrechen, Diarrhö, Stomatitis), die zu Dehydratation führen, können die Toxizität von Methotrexat aufgrund erhöhter Wirkstoffspiegel steigern.
In solchen Fällen sollte die Anwendung mit Methotrexat bis zum Sistieren der Symptome unterbrochen werden.
Methotrexat wird nur langsam aus pathologischen Flüssigkeitsansammlungen in Körperhöhlen (sog. „third space"), wie Aszites oder Pleuraergüsse, ausgeschieden, was zu einer verlängerten Plasmaeliminations-Halbwertszeit und unerwarteter Toxizität führt. Diese sind vor einer Methotrexat-Therapie möglichst durch Punktion zu entfernen.
Besondere Vorsicht ist geboten bei bestehendem insulinpflichtigem Diabetes mellitus sowie bei einer Einschränkung der Lungenfunktion.
Während einer Therapie mit MTX HEXAL sollen keine Impfungen mit Lebendimpfstoffen durchgeführt werden. Es gibt Berichte über disseminierte KuhpockenInfektionen nach der Pockenschutzimpfung von Patienten unter Methotrexat-Therapie.
Methotrexat kann aufgrund seiner möglichen Wirkung auf das Immunsystem Impf- und Testergebnisse (immunologische Testverfahren zur Erfassung der Immunreaktivität) verfälschen.
Weiterhin ist bei Vorliegen einer inaktiven, chronischen Infektion (z. B. Herpes zoster, Tuberkulose, Hepatitis B oder C) besondere Vorsicht aufgrund einer möglichen Aktivierung geboten.
Während der Methotrexat-Therapie können opportunistische Infektionen einschließlich einer Pneumocystis carinii-Pneumonie auftreten, die tödlich verlaufen können.
Pulmonale Komplikationen, Pleuraerguss, Alveolitis oder Pneumonitis mit Symptomen, die Veränderungen im Röntgenbild vorausgehen können, wie allgemeines Krankheitsgefühl, trockener Reizhusten, Kurzatmigkeit bis hin zur Ruhedyspnoe, Husten, Brustschmerzen, Fieber, Hypoxämie und Infiltration im Thorax-Röntgenbild können Anzeichen für eine eventuell gefährliche Schädigung mit möglichem tödlichem Ausgang sein. Durch Methotrexat induzierte Lungenerkrankungen können zu jeder Zeit der Therapie auftreten, waren nicht immer vollständig reversibel und traten schon bei geringen Dosen von 7,5 mg/Woche auf.
Bereits beim Verdacht auf diese Komplikationen ist die Behandlung mit MTX HEXAL sofort abzubrechen und die Abgrenzung gegenüber Infektionen (einschließlich Pneumonie) erforderlich.
Es traten schwere, gelegentlich tödlich verlaufende allergische Hautreaktionen wie Ste-vens-Johnson-Syndrom und toxisch epidermale Nekrolyse (Lyell-Syndrom) auf.
Psoriatische Läsionen können sich durch UV-Bestrahlung unter gleichzeitiger Methotrexat-Therapie verschlimmern. Durch Bestrahlung hervorgerufene Dermatitis und Sonnenbrand können bei Anwendung von Methotrexat wieder auftreten (sog. „Recall"-Reaktionen).
Gelegentlich wurde bei der Anwendung von niedrig dosiertem Methotrexat über das Auftreten von malignen Lymphomen berichtet, die sich in einigen Fällen nach dem Absetzen der Therapie mit Methotrexat zurückgebildet haben. Beim Auftreten von Lymphomen sollte daher zunächst die Methotrexat-Therapie abgebrochen werden und erst, wenn das Lymphom nicht zurückgeht, eine geeignete Therapie eingeleitet werden.
Eine erhöhte Inzidenz für das Auftreten von Lymphomen bei einer MethotrexatBehandlung konnte in einer neueren Untersuchung nicht festgestellt werden.
Anwendung bei älteren Menschen
Besonders bei älteren Menschen wurden nach einer versehentlichen täglichen Anwendung der Wochendosis Todesfälle gemeldet. Ferner sollen insbesondere ältere Patienten in kurzen zeitlichen Abständen auf frühe Zeichen einer Toxizität untersucht werden. Die Dosierung von Methotrexat sollte an die aufgrund des höheren Alters verminderte Leber- und Nierenfunktionsleistung angepasst werden (siehe Abschnitt 4.2).
Kinder und Jugendliche
Die Behandlung mit MTX HEXAL sollte bei Kindern und Jugendlichen nur von Fachärzten eingeleitet und überwacht werden, die über ausreichende Erfahrung in der Diagnose und Behandlung der betreffenden Erkrankung verfügen.
Anwendung bei Frauen und Männern
Methotrexat kann erbgutschädigend wirken. Frauen dürfen daher während und mindestens 6 Monate nach der Therapie mit Methotrexat nicht schwanger werden (siehe 4.6 „Fertilität, Schwangerschaft und Stillzeit").
Männer müssen während der Behandlung mit Methotrexat und mindestens 6 Monate nach dem Ende der Behandlung vermeiden, ein Kind zu zeugen. Da eine Behandlung mit Methotrexat zu Unfruchtbarkeit führen kann, kann es für männliche Patienten ratsam sein vor Behandlungsbeginn die Möglichkeit einer Spermakonservierung in Betracht zu ziehen.
Ein möglicher Einfluss auf die Fertilität sollte sowohl mit männlichen als auch mit weiblichen Patienten (siehe 4.6 „Fertilität, Schwangerschaft und Stillzeit"), die mit Methotrexat behandelt werden, besprochen werden.
Hinweise
Die Patienten sollten über den möglichen Nutzen und die Risiken (einschließlich der frühen Anzeichen und Symptome von Toxizität) einer Methotrexat-Therapie aufgeklärt werden. Ferner sind sie über die Notwendigkeit zu unterrichten, beim Auftreten von Vergiftungserscheinungen unmittelbar den Arzt aufzusuchen sowie über die nachfolgend notwendige Überwachung der Vergiftungserscheinungen (inklusive regelmäßiger Labortests) zu informieren.
Empfohlene Kontrolluntersuchungen und Sicherheitsmaßnahmen Während einer Methotrexat-Behandlung müssen die Patienten engmaschig beobachtet werden, einschließlich adäquater Hydratation, Urin-Alkalisation sowie Messungen des Methotrexatspiegels im Serum und der Nierenfunktionsleistung, damit Vergiftungserscheinungen schnell wahrgenommen werden können.
Vor Therapiebeginn:
• Komplettes Blutbild mit Differenzialblutbild und Thrombozyten
• Leberenzyme (ALT [GPT], AST [GOT], AP), Bilirubin
• Serumalbumin
• Nierenretentionsparameter (ggf. mit Kreatinin-Clearance)
• Hepatitis-Serologie (A, B, C)
• ggf. Tuberkulose-Ausschluss
• ggf. Thorax-Röntgen.
Während der Therapie: (in den ersten beiden Wochen wöchentlich, dann 2-wöchentlich für den nächsten Monat. Danach, abhängig von der Leukozytenzahl und der Stabilität des Patienten, ca. monatlich. Bei Dosierungsänderung oder aufgrund erhöhter Wirkstoffspiegel [z. B. durch Dehydratation], gesteigerter Toxizität von Methotrexat kann auch eine häufigere Untersuchung erforderlich sein):
1. Inspektionen der Mundhöhle und des Rachens auf Schleimhautveränderungen.
2. Komplettes Blutbild mit Differenzialblutbild und Thrombozyten.
3. Kontrolle der leberbezogenen Enzyme im Serum
Vorübergehende Anstiege der Transaminasen auf das 2- bis 3fache der Norm werden in einer Häufigkeit von 13-20 % der Patienten angegeben. Die Enzyme haben im Allgemeinen 4 bis 5 Tage nach Methotrexat-Gabe ihren Höchstwert erreicht und sind nach 1-2 Wochen wieder normalisiert. Anhaltende Anomalien der leberbezogenen Enzyme und/oder ein Abfall des Serumalbumins können Anzeichen für eine schwere Lebertoxizität sein. Die Enzymbestimmung erlaubt keine verlässliche Voraussage der Entwicklung einer morphologisch fassbaren Leberschädigung, d. h., auch bei normalen Transaminasen kann eine nur histologisch nachweisbare Leberfibrose, seltener auch eine Leberzirrhose vorliegen. Im Falle anhaltender Erhöhung der leberbezogenen Enzyme sollten Dosisreduktion bzw. weitere Therapiepausen erwogen werden. Für schwere Formen der Psoriasis vulgaris siehe auch Punkt 6. „Leberbiopsie“.
4. Kontrolle der Nierenfunktion/Kreatinin-Werte im Serum
Bei Erhöhung des Serum-Kreatinins sollte die Dosis reduziert werden. Bei SerumKreatinin-Werten von über 2 mg/dl sollte keine Therapie mit Methotrexat erfolgen.
Bei grenzwertiger Nierenfunktionsleistung (z. B. im höheren Alter) sollte die Überwachung häufiger (engmaschig) erfolgen. Dies gilt insbesondere, wenn zusätzlich Arzneimittel gegeben werden, die die Ausscheidung von Methotrexat beeinträchtigen, Nierenschädigungen verursachen (z. B. nicht-steroidale Antiphlogistika) oder potenziell zu Blutbildungsstörungen führen können.
5. Befragung des Patienten bezüglich etwaiger Lungenfunktionsstörungen, ggf. Lungenfunktionsprüfung.
6. Leberbiopsie
Bei der längerfristigen Behandlung schwerer Formen der Psoriasis vulgaris mit MTX HEXAL sollten aufgrund des hepatotoxischen Potenzials Leberbiopsien durchgeführt werden.
Es hat sich als sinnvoll erwiesen, zwischen Patienten mit normalem und erhöhtem Risiko für Leberschäden zu unterscheiden.
a) Patienten ohne Risikofaktoren
Eine Leberbiopsie vor dem Erreichen einer Kumulativdosis von 1,0-1,5 g ist nach gegenwärtigem medizinischen Wissensstand nicht erforderlich.
b) Patienten mit Risikofaktoren Dazu gehören primär:
• Anamnestischer Alkoholabusus
• Persistierende Erhöhung der Leberenzyme
• Anamnestische Lebererkrankung einschließlich chronischer Hepatitis B oder C
• Familienanamnese einer erblichen Lebererkrankung
und sekundär (mit wahrscheinlich geringerer Relevanz):
• Diabetes mellitus
• Adipositas
• Anamnestische Exposition gegenüber hepatotoxischen Arzneimitteln oder Chemikalien
Für diese Patienten wird eine Leberbiopsie bei bzw. kurz nach der Initiierung einer Therapie mit MTX HEXAL empfohlen. Da ein kleiner Prozentsatz der Patienten aus verschiedenen Gründen die Therapie nach 2-4 Monaten abbricht, kann die erste Biopsie bis zu einem Zeitpunkt nach dieser Initialphase aufgeschoben werden. Sie sollte dann erfolgen, wenn eine längerfristige Therapie angenommen werden kann.
Wiederholte Leberbiopsien nach Erreichen einer Kumulativdosis von jeweils 1,0-1,5 g werden empfohlen.
Bei schweren Formen der rheumatoiden Arthritis und Psoriasis arthropathica stellen das Patientenalter bei Erstanwendung und die Therapiedauer Risikofaktoren für Hepatotoxizität dar. Andauernde Anomalien im Leberfunktionstest können Vorboten für eine Fibrose oder Zirrhose bei Patienten mit rheumatoider Arthritis sein.
Nur bei Patienten mit vermuteter vorbestehender Lebererkrankung sollte vor Therapiebeginn eine Leberbiopsie durchgeführt werden.
Die Durchführung einer Leberbiopsie während der Therapie wird bei Patienten mit Anomalien im Leberfunktionstest, die während der Behandlung mit Methotrexat oder nach dessen Absetzen andauern, empfohlen.
Im Fall einer mittelschweren Fibrose oder einer Zirrhose muss die Anwendung unterbrochen werden; bei einer leichten Fibrose wird eine erneute Biopsie nach 6 Monaten empfohlen.
In den folgenden Fällen kann von einer Leberbiopsie abgesehen werden:
• Ältere Patienten
• Patienten mit einer akuten Erkrankung
• Patienten mit Kontraindikation für eine Leberbiopsie (z. B. kardiale Instabilität,
Veränderung der Blutgerinnungsparameter)
• Patienten mit geringer Lebenserwartung
Häufigere Kontrolluntersuchungen können erforderlich werden
• während der Initialphase der Behandlung
• bei Dosiserhöhung
• während Episoden eines größeren Risikos für erhöhte Methotrexat-Blutspiegel (z. B. Dehydratation, eingeschränkte Nierenfunktion, zusätzlicher oder erhöhter Dosis gleichzeitig verabreichter Medikamente, wie z. B. nicht-steroidale Antirheumatika)
MTX HEXAL sollte nur von Ärzten verordnet werden, die über ausreichende Erfahrung in der Behandlung der betreffenden Krankheit mit Methotrexat verfügen.
Hinweis zu den sonstigen Bestandteilen
Diese Arzneimittel enthalten Lactose. Patienten mit der seltenen, hereditären Galactose-Intoleranz; Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten MTX HEXAL nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Im Tierversuch führten nicht-steroidale Antiphlogistika (NSAIDs) einschließlich Sa-licylsäure zu einer Reduzierung der tubulären Sekretion von Methotrexat und damit zu einer Erhöhung seiner Toxizität. In klinischen Studien, bei denen nicht-steroidale Antiphlogistika und Salicylsäure als Begleitmedikation bei rheumatoider Arthritis eingesetzt wurden, kam es jedoch nicht zu vermehrten Nebenwirkungen. Die Behandlung der rheumatoiden Arthritis mit derartigen Medikamenten kann unter strenger ärztlicher Überwachung während der Therapie mit Methotrexat fortgesetzt werden.
Die Wahrscheinlichkeit einer hepatotoxischen Wirkung von Methotrexat wird durch regelmäßigen Alkoholkonsum und die Einnahme hepatotoxischer Arzneimittel erhöht.
Daher sollten Patienten, die während der Methotrexat-Therapie potenziell hepatotoxi-sche Arzneimittel (z. B. Leflunomid, Azathioprin, Sulfasalazin, Retinoide) einnehmen, engmaschig bzgl. eines möglichen Auftretens von erhöhter Hepatotoxizität überwacht werden. Alkoholkonsum sollte während der Behandlung mit MTX HEXAL vermieden werden.
Salicylate, Phenylbutazon, Phenytoin, Barbiturate, Tranquilizer, orale Kontrazeptiva, Tetrazykline, Amidopyrin-Derivate, Sulfonamide und p-Aminobenzoesäure
verdrängen Methotrexat aus der Serumalbuminbindung und steigern so die biologische Verfügbarkeit (indirekte Dosiserhöhung).
Probenecid und schwache organische Säuren können die Ausscheidung von Methotrexat herabsetzen und damit ebenfalls eine indirekte Dosiserhöhung bewirken.
Die gleichzeitige Gabe von Protonenpumpenhemmern (Omeprazol, Pantoprazol, Lansoprazol) kann zu einer Verzögerung oder Hemmung der renalen Elimination von Methotrexat und damit zu einer indirekten Dosiserhöhung führen.
Penicilline und Sulfonamide können die renale Clearance von Methotrexat im Einzelfall reduzieren, so dass erhöhte Serumkonzentrationen von Methotrexat mit gleichzeitiger hämatologischer und gastrointestinaler Toxizität auftreten können.
Die tubuläre Sekretion in den Nieren wird durch Ciprofloxacin verringert; die Anwendung von Methotrexat mit diesem Arzneimittel sollte sorgfältig überwacht werden.
Orale Antibiotika wie Tetrazykline, Chloramphenicol und nicht resorbierbare Breitbandantibiotika können die intestinale Resorption von Methotrexat herabsetzen oder den enterohepatischen Kreislauf beeinflussen, indem sie die Darmflora und die Metabolisierung von Methotrexat durch Bakterien hemmen.
Bei einer (Vor-)Behandlung mit Arzneimitteln, die mögliche Nebenwirkungen auf das Knochenmark aufweisen (z. B. Sulfonamide, Trimethoprim-Sulfamethoxazol, Chloramphenicol, Pyrimethamin) ist die Möglichkeit ausgeprägter Störungen der Blutbildung zu beachten.
Die gleichzeitige Verabreichung von Arzneimitteln, die einen Folatmangel verursachen (z. B. Sulfonamide, Trimethoprim-Sulfamethoxazol) kann zu erhöhter Methotrexat-Toxizität führen. Besondere Vorsicht ist deshalb auch bei einem bereits bestehenden Folsäuremangel geboten. Andererseits kann die gleichzeitige Verabreichung von Folinsäure-haltigen Arzneimitteln sowie Vitaminzubereitungen, die Folsäure oder ihre Derivate enthalten, die Wirksamkeit von Methotrexat beeinträchtigen.
Bei gleichzeitiger Gabe von Methotrexat und Basistherapeutika (z. B. Goldverbindungen, Penicillamin, Hydroxychloroquin, Sulfasalazin, Azathioprin, Ciclosporin) ist mit einer Verstärkung der toxischen Wirkungen von Methotrexat im Allgemeinen nicht zu rechnen.
Obwohl die Kombination von Methotrexat und Sulfasalazin wegen der Hemmung der Folsäure-Synthese durch Sulfasalazin eine Wirkungsverstärkung von Methotrexat und damit vermehrt Nebenwirkungen verursachen kann, wurden solche in mehreren Untersuchungen an Patienten nur in seltenen Einzelfällen beobachtet.
Methotrexat kann die Theophyllin-Clearance reduzieren. Daher sollten bei gleichzeitiger Anwendung mit Methotrexat die Theophyllin-Spiegel beobachtet werden.
Übermäßiger Genuss koffein- oder theophyllinhaltiger Getränke (Kaffee, koffeinhaltige Kaltgetränke, schwarzer Tee) sollte während der Methotrexat-Therapie vermieden werden, da es über eine mögliche Interaktion zwischen Methotrexat und Methylxanthin-en an Adenosin-Rezeptoren zu einer Reduzierung der Wirksamkeit von Methotrexat kommen kann.
Die kombinierte Anwendung von Methotrexat mit Leflunomid kann das Risiko für Panzytopenie erhöhen.
Methotrexat führt zu erhöhten Plasmaspiegeln von Mercaptopurinen. Die Kombination von beiden kann deshalb eine Dosisanpassung erfordern.
Während einer Therapie mit MTX HEXAL sollen keine Impfungen mit Lebendimpfstoffen durchgeführt werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Die Einnahme von Methotrexat ist während der gesamten Schwangerschaft kontraindiziert (siehe 4.3).
In tierexperimentellen Studien hat Methotrexat Reproduktionstoxizität gezeigt, besonders im ersten Trimester (siehe Abschnitt 5.3).
Methotrexat erwies sich beim Menschen als teratogen. Es wurde berichtet Fehlgeburten und/oder kongenitale Anomalien zu verursachen. Daten über eine begrenzte Anzahl (42) von exponierten Schwangeren ergaben eine erhöhte Inzidenz (1:14) von Missbildungen (kranial, kardiovaskulär und an den Extremitäten). Bei Absetzen von Methotrexat vor der Empfängnis wurde über normale Schwangerschaften berichet.
Bei Frauen im gebärfähigen Alter muss deshalb vor Beginn der Therapie mit geeigneten Maßnahmen, z. B. Schwangerschaftstests, eine bestehende Schwangerschaft sicher ausgeschlossen werden.
Da Frauen während und mindestens 6 Monate nach einer Behandlung mit Methotrexat nicht schwanger werden dürfen, muss während dieses Zeitraums eine wirksame Form der
Empfängnisverhütung praktiziert werden. Tritt während dieses Zeitraums trotzdem eine Schwangerschaft ein, sollte eine medizinische Beratung über das mit der Behandlung verbundene Risiko von schädigenden Wirkungen für das Kind erfolgen. Es ist zu berücksichtigen, dass die optimale Zeitspanne zwischen Beendigung der MethotrexatBehandlung eines Partners und einer Schwangerschaft nicht genau bekannt ist. Veröffentlichte Literaturempfehlungen zu den Zeitabständen variieren zwischen 3 Monaten und 1 Jahr.
Da Methotrexat erbgutschädigend wirken kann, wird Frauen und Männern (siehe 4.4) mit Kinderwunsch empfohlen, möglichst bereits vor Therapiebeginn eine genetische Beratungsstelle zu konsultieren.
Stillzeit
Da Methotrexat in die Muttermilch übergeht, ist eine Behandlung während der Stillzeit kontraindiziert (siehe 4.3). Daher ist vor einer Behandlung mit Methotrexat abzustillen.
Fertilität
Methotrexat kann erbgutschädigend wirken. Frauen dürfen daher während und mindestens 6 Monate nach der Therapie mit Methotrexat nicht schwanger werden.
Männer müssen während der Behandlung mit Methotrexat und mindestens 6 Monate nach dem Ende der Behandlung vermeiden, ein Kind zu zeugen. Da eine Behandlung mit Methotrexat zu Unfruchtbarkeit führen kann, kann es für männliche Patienten ratsam sein vor Behandlungsbeginn die Möglichkeit einer Spermakonservierung in Betracht zu ziehen.
Ein möglicher Einfluss auf die Fertilität sollte sowohl mit männlichen als auch mit weiblichen Patienten, die mit Methotrexat behandelt werden, besprochen werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Da bei der Anwendung von MTX HEXAL zentralnervöse Nebenwirkungen wie Müdigkeit und Schwindel auftreten können, kann im Einzelfall die Fähigkeit zum Fahren eines Kraftfahrzeuges und/oder zum Bedienen von Maschinen eingeschränkt sein (siehe Abschnitt 4.8). Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Das Auftreten und der Schweregrad von unerwünschten Arzneimittelwirkungen hängen von der Höhe der Dosierung und der Häufigkeit der Anwendung von MTX HEXAL ab. Da es jedoch auch bei niedriger Dosierung zu schwerwiegenden Nebenwirkungen kommen kann ist eine regelmäßige Überwachung durch den Arzt in kurzen zeitlichen Abständen unerlässlich.
Die meisten Nebenwirkungen sind reversibel, wenn sie frühzeitig erkannt werden. Bei Auftreten dieser Nebenwirkungen sollte die Dosierung reduziert oder die Therapie unterbrochen und geeignete Gegenmaßnahmen ergriffen werden (siehe Abschnitt 4.9). Bei Wiederaufnahme einer Methotrexat-Therapie sollte diese mit Vorsicht weitergeführt werden unter eingehender Begutachtung der Notwendigkeit der Therapie und mit erhöhter Wachsam für das mögliche Wiederauftreten von Toxizität.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) Die folgenden Nebenwirkungen können auftreten:
Infektionen und parasitäre Erkrankungen
Gelegentlich:
Selten:
Sehr selten: Nicht bekannt:
Herpes zoster Sepsis
Herpes simplex-Hepatitis
opportunistische Infektionen, die teilweise tödlich verlaufen, tödlich verlaufende Sepsis, Nokardiose, Histoplasma- und Cryptococcus-Mykosen, disseminierter Herpes simplex, durch Cytomegalievirus hervorgerufene Infektionen einschließlich Pneumonie
Gutartige, bösartige und unspezifische Neubildungen
Gelegentlich: maligne Lymphome, die sich in einigen Fällen nach dem Absetzen der
Therapie mit Methotrexat zurückgebildet haben
Erkrankungen des Blut- und Lymphsystems
Häufig: Leukopenie, Thrombopenie, Anämie
Gelegentlich: Panzytopenie, Agranulozytose, Störungen der Hämatopoese
Selten: megaloblastäre Anämie
Sehr selten: schwere Verläufe von Knochenmarkdepression, aplastische Anämie
Nicht bekannt: Lymphadenopathie, lymphoproliferative Erkrankungen, z. T. reversibel, Eosinophilie und Neutropenie
Erste Anzeichen für diese lebensbedrohlichen Komplikationen können sein: Fieber, Halsschmerzen, Ulzerationen der Mundschleimhaut, grippeartige Beschwerden, starke Abgeschlagenheit, Nasenbluten und Hautblutungen.
Die Anwendung von Methotrexat sollte sofort unterbrochen werden, wenn es zu einer signifikant verminderten Zahl von Blutzellen kommt.
Erkrankungen des Immunsystems
Gelegentlich: schwere allergische Reaktionen bis hin zum anaphylaktischen Schock
Sehr selten: Hypogammaglobulinämie
Nicht bekannt: allergische Vaskulitis, Fieber (bedarf Abklärung gegenüber bakterieller
oder mykotischer Septikämie!), Immunsuppression (Infektionsbegünstigung)
Stoffwechsel- und Ernährungsstörungen
Gelegentlich: diabetische Stoffwechsellage
Erkrankungen
Sehr häufig:
Häufig:
Gelegentlich:
Selten:
Sehr selten:
des Gastrointestinaltrakts
Anorexie, Übelkeit, Erbrechen, Bauchschmerzen, Entzündungen und Ulzerationen der Mund- und Rachenschleimhaut (vor allem innerhalb der ersten 24-48 Stunden nach Gabe von MTX HEXAL)
Durchfall (vor allem innerhalb der ersten 24-48 Stunden nach Gabe von Methotrexat)
gastrointestinale Ulzerationen und Blutungen, Pankreatitis
Enteritis, Melaena, Gingivitis
Hämatemesis
Bei Auftreten von Diarrhöen oder Ulzerationen im Mund- und Rachenbereich kann wegen der Gefahr einer gastrointestinalen Perforation oder hämorrhagischen Enteritis eine Unterbrechung der Behandlung erforderlich werden.
Erkrankungen der Niere und der Harnwege
Gelegentlich: Zystitis mit Ulzerationen (evtl. mit Hämaturie), Dysurie
Selten: Azotämie
Nicht bekannt: Proteinurie
Unter einer Therapie mit Methotrexat kann sich eine Verschlechterung der Nierenleistung mit einem Anstieg bestimmter Laborwerte (Kreatinin, Harnstoff und Harnsäure im Serum) entwickeln. Ein akutes Nierenversagen ist in Einzelfällen möglich.
Leber- und Gallenerkrankungen
Sehr häufig: Anstieg der Leberenzyme (ALAT [GPT], ASAT [GOT]), alkalische
Phosphatase und Bilirubin)
Gelegentlich: Leberverfettung, chronische Leberfibrose und Leberzirrhose (in diesen
Fällen häufig trotz regelmäßig überwachter, normaler Werte der leberbezogenen Enzyme), Abfall des Serumalbumins Selten: akute Hepatitis und Hepatotoxizität
Sehr selten: Reaktivierung einer chronischen Hepatitis, akute Lebernekrose
Nicht bekannt: Herpes-simplex-Hepatitis sowie Leberinsuffizienz (siehe auch Hinweise zur Leberbiopsie im Abschnitt 4.4)
Erkrankungen der Atemwege, des Brustraums und des Mediastinums
Häufig: Lungenkomplikationen auf der Grundlage einer interstitiellen Alveoli-
tis/Pneumonitis und hierdurch bedingte Todesfälle (unabhängig von Dosis und Dauer der Behandlung mit Methotrexat)
Gelegentlich: Lungenfibrose, Pleuraerguss
Selten: Pharyngitis, Atemstillstand
Sehr selten: Pneumocystis-carinii-Pneumonie, Luftnot, Asthma bronchiale und
chronisch obstruktive Lungenerkrankung
Erkrankungen der Haut und des Unterhautzellgewebes Häufig: Exantheme, Erytheme, Juckreiz
Gelegentlich: Urtikaria, Photosensibilität, verstärkte Pigmentierung der Haut, Haar
ausfall, Nodulosis, schmerzhafte Erosionen von psoriatischer Plaque; als schwere toxische Erscheinungen: herpetiforme Hauteruptionen, Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse (LyellSyndrom)
Selten: verstärkte Pigmentierung der Nägel, Akne, Petechien, Ekchymosen,
Erythema multiforme, erythematöse Hautausschläge Sehr selten: akute Paronychie, Furunkulose, Teleangiektasie
Nicht bekannt: Wundheilungsstörungen
Gefäßerkrankungen
Gelegentlich: Vaskulitis
Selten: thromboembolische Ereignisse (einschließlich arterieller und zerebraler
Thrombose, Thrombophlebitis, tiefe Venenthrombose, RetinaVenenthrombose, Lungenembolie)
Psychiatrische Erkrankungen
Gelegentlich: Depressionen
Selten: Stimmungsschwankungen, vorübergehende Wahrnehmungsstörungen
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen, Müdigkeit, Benommenheit, Parästhesie
Gelegentlich: Hemiparese, Schwindel, Verwirrtheit
Selten: Parese, Sprachstörungen, einschließlich Dysarthrie und Aphasie, Leu-
kenzephalopathie (bei oraler Anwendung)
Sehr selten: Schmerzen, Muskelschwäche, Geschmacksveränderungen (metalli
scher Geschmack), Meningismus (Lähmungen, Erbrechen), akute aseptische Meningitis
A ugenerkrankungen
Selten: Sehstörungen (verschwommenes Sehen, Schleiersehen), schwerwie
gende Sehstörungen von unbekannter Ätiologie
Sehr selten: Konjunktivitis
Herzerkrankungen
Selten: Hypotonie
Sehr selten: Perikarditis, Perikardtamponade, Perikarderguss
Schwangerschaft, Wochenbett und perinatale Erkrankungen
Gelegentlich: fetale Missbildungen
Selten: Abort
Sehr selten: fetaler Tod
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Gelegentlich: vaginale Entzündungen und Ulzerationen
Selten: Oligospermie sowie Menstruationsstörungen, die sich jedoch nach
Ende der Behandlung zurückbilden
Sehr selten: gestörte Ovogenese, Spermatogenese, Libidoverlust, Impotenz, Un
fruchtbarkeit, Scheidenausfluss
Erkrankungen der Skelettmuskulatur, des Bindegewebes und der Knochen
Gelegentlich: Arthralgie, Myalgie und Osteoporose
Selten: Belastungsfraktur
Nebenwirkungen, die bei der in der Regel höher dosierten Anwendung von Methotrexat in der Onkologie beobachtet wurden, schließen ein:
Gelegentlich: schwere Nephropathie, Nierenversagen
Sehr selten: ungewöhnliche kraniale Sinneswahrnehmungen, vorübergehende Erblin-
dung/Sehverlust
4.9 Überdosierung
a) Symptome einer Überdosierung
Es liegen Berichte über Überdosierung auf Grund irrtümlicher täglicher Einnahme von Methotrexat an Stelle von wöchentlicher Einnahme vor - manchmal mit tödlichem Ausgang. In diesen Fällen betrafen die häufig berichteten Symptome häma-tologische und gastrointestinale Reaktionen.
Die Erfahrung seit Markteinführung zeigte, dass eine Methotrexat-Überdosierung im Allgemeinen nach oraler Anwendung, aber auch nach intravenöser oder intramuskulärer Anwendung auftraten. In den Berichten zur oralen Überdosierung wurde versehentlich die Wochendosis täglich eingenommen (als Gesamtdosis oder in mehreren Einzelgaben unterteilt). Die einer oralen Überdosierung folgenden Symptome betreffen hauptsächlich das hämatopoetische und gastrointestinale System.
Es traten z. B. Leukopenie, Thrombopenie, Anämie, Panzytopenie, Knochenmarkdepression, Mukositis, Stomatitis, Mundgeschwüre, Übelkeit, Erbrechen, gastrointestinale Ulzerationen und gastrointestinale Blutungen auf. In einigen Fällen gab es keine Anzeichen einer Intoxikation. Es gibt Berichte über Todesfälle aufgrund einer Überdosierung. In diesen Fällen wurde auch über Sepsis, septischen Schock, Nierenversagen und aplastische Anämie berichtet.
b) Therapiemaßnahmen bei Überdosierung
Als spezifisches Antidot zur Neutralisation toxischer Nebenwirkungen von Methotrexat steht Calciumfolinat zur Verfügung. So können bei einem Abfall der Leukozyten unter niedriger Methotrexat-Dosierung sobald als möglich z. B. 6-12 mg Calciumfolinat i.v. oder i.m. injiziert werden, anschließend mehrfach (mindestens 4-mal) die gleiche Dosis in 3- bis 6-stündigen Abständen.
Bei einer massiven Überdosierung kann eine Hydratation und Alkalisierung des Urins notwendig sein, um eine Ausfällung von Methotrexat und/oder seiner Metabolite in den renalen Tubuli zu vermeiden. Weder eine Standardhämodialyse noch eine peritoneale Dialyse führen zu einer verbesserten Methotrexat-Elimination. Eine wirksame Methotrexat-Clearance wurde durch eine akute, intermittierende Hämodialyse mit einem High-flux-Dialysator erreicht.
Bei Patienten mit rheumatoider Arthritis, polyartikulärer juveniler idiopathischer Arthritis, Psoriasis-Arthritis oder Psoriasis vulgaris kann die Gabe von Fol- oder Folinsäure die Toxizität von Methotrexat (Magen-Darm-Symptome, Entzündung der Mundschleimhaut, Haarausfall und Anstieg der Leberenzyme) verringern (siehe Abschnitt
4.5 „Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen“).
Vor der Einnahme von Folsäurepräparaten empfiehlt sich eine Kontrolle der Vitamin B12-Spiegel, da durch die Folatgabe insbesondere bei Erwachsenen über 50 Jahre ein Vitamin B12-Mangelzustand maskiert werden kann.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Spezifische Antirheumatika ATC-Code: M01CX01
Methotrexat gehört als Folsäureanalogon in die Reihe der Antimetaboliten. Es hemmt kompetitiv das Enzym Dihydrofolat-Reduktase und inhibiert die DNS- und RNS-Synthese. Bisher ist nicht geklärt, ob die Wirksamkeit von Methotrexat bei der rheumatoiden Arthritis auf einem antiphlogistischen oder immunsuppressiven Effekt beruht.
Bei der Psoriasis vulgaris ist die Produktionsrate von Epithelzellen der Haut stark erhöht gegenüber der normalen Haut. Diese unterschiedliche Proliferationsrate bildet die Basis für die Anwendung von Methotrexat zur Kontrolle des psoriatischen Prozesses.
5.2 Pharmakokinetische Eigenschaften
Nach oraler Applikation wird Methotrexat aus dem Magen-Darm-Trakt resorbiert. Bei niedrig dosierter Gabe (Dosierungen zwischen 7,5 mg/m2 und 80 mg/m2 Körperoberfläche) beträgt die mittlere Bioverfügbarkeit ca. 70 %, jedoch sind inter- und intraindividuell erhebliche Schwankungen möglich (25-100 %). Maximale Serumkonzentrationen werden nach 1-2 Stunden erreicht. Die Bioverfügbarkeit der subkutanen, intravenösen und der intramuskulären Applikation ist vergleichbar.
Die Plasmaproteinbindung von Methotrexat beträgt ca. 50 %. Bei der Verteilung erfolgt eine Anreicherung vor allem in Leber, Nieren und Milz in Form von Polyglutamaten, die zum Teil wochen- bis monatelang retiniert werden können. Methotrexat tritt in niedriger Dosierung nur in minimalen Mengen in den Liquor über, bei hoher Dosierung (300 mg/kg Körpergewicht) wurden im Liquor Konzentrationen zwischen 4 und 7 pg/ml gemessen. Methotrexat passiert bei Ratten und Affen die Plazentaschranke.
Die terminale Halbwertszeit beträgt im Mittel 6-7 Stunden, sie weist eine erhebliche Schwankungsbreite (3-17 Stunden) auf. Bei Patienten mit einem dritten Verteilungsraum (Pleuraerguss, Aszites) kann die Halbwertszeit bis um das 4-Fache verlängert sein.
Ca. 10 % der verabreichten Methotrexat-Dosis werden intrahepatisch metabolisiert. Der Hauptmetabolit ist 7-Hydroxymethotrexat.
Die Ausscheidung erfolgt überwiegend unverändert renal durch Filtration und aktive Sekretion im proximalen Tubulus.
Ca. 5-20 % Methotrexat und 1-5 % 7-Hydroxymethotrexat werden biliär eliminiert. Es besteht ein ausgeprägter enterohepatischer Kreislauf.
Die Elimination bei eingeschränkter Nierenfunktion verläuft deutlich verzögert. Einschränkungen der Ausscheidung bei eingeschränkter Leberfunktion sind derzeit nicht bekannt.
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität
Die LD50 beträgt:
Orale Gabe
Ratte: 317 mg/kg Körpergewicht Hund: 120 mg/kg Körpergewicht Maus: 65-70 mg/kg Körpergewicht
Intravenöse Gabe
Maus: 65-70 mg/kg Körpergewicht
Hund: 15-60 mg/kg Körpergewicht
Intraperitoneale Gabe
Maus: 36-90 mg/kg Körpergewicht
Ratte: 80-100 mg/kg Körpergewicht
Subkutane Gabe
Ratte: 58 mg/kg Körpergewicht
Chronische Toxizität
In Untersuchungen zur chronischen Toxizität an Maus, Ratte und Hund zeigten sich toxische Effekte in Form von gastrointestinalen Läsionen, Myelosuppression und Hepato-toxizität.
Mutagenes und tumorerzeugendes Potenzial
In Langzeituntersuchungen an Ratten, Mäusen und Hamstern ergaben sich keine Hinweise auf ein tumorerzeugendes Potenzial von Methotrexat. Methotrexat induziert in vitro und in vivo Gen- und Chromosomenmutationen. Es besteht der Verdacht einer mutagenen Wirkung beim Menschen.
Reproduktionstoxikologie
Teratogene Wirkungen sind bei vier Spezies (Ratte, Maus, Kaninchen, Katze) festgestellt worden. Bei Rhesusaffen traten keine dem Menschen vergleichbaren Fehlbildungen auf.
Methotrexat geht in geringen Mengen in die Muttermilch über. Nach Gaben von
22,5 mg/Tag wurde ein Milch/Plasma-Konzentrationsverhältnis von 0,08 gefunden. Sollte eine Anwendung während der Stillzeit erforderlich werden, ist abzustillen.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Lactose-Monohydrat, Maisstärke, Magnesiumstearat (Ph.Eur.)
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Die Dauer der Haltbarkeit in Braunglasflaschen beträgt 5 Jahre.
Die Dauer der Haltbarkeit in PVC/Aluminium-Blister beträgt 3 Jahre.
Dieses Arzneimittel soll nach Ablauf des Verfallsdatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 30 °C lagern.
Die Blister im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
6.5 Art und Inhalt des Behältnisses
Braunglasflaschen mit Aluminium- bzw. PP-Schraubverschluss PVC/Aluminium-Blister
Originalpackungen mit 10, 20, 30, 50 und 100 Tabletten
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Handhaben Sie Methotrexat nicht, wenn Sie schwanger sind oder schwanger werden wollen.
Nicht verwendetes Arzneimittel ist entsprechend den nationalen Anforderungen zu beseitigen (Entsorgungsvorschriften für Zytostatika beachten!).
7. Inhaber der Zulassung
Hexal AG Industriestraße 25 83607 Holzkirchen Telefon: (08024) 908-0 Telefax: (08024) 908-1290 E-Mail: medwiss@hexal.com
8. Zulassungsnummer(n)
12887.00.02
9. Datum der Erteilung der Zulassung / Verlängerung der Zulassung
14.08.1990 / 15.12.2008
10. Stand der Information
Juli 2014
11. Verkaufsabgrenzung
Verschreibungspflichtig
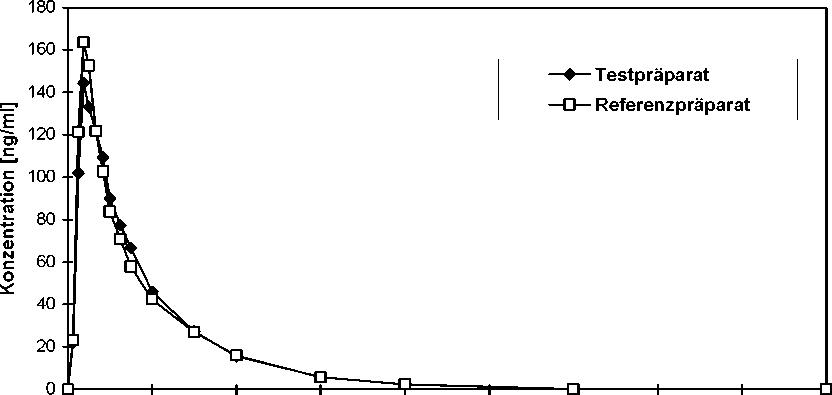
Zusätzliche Angaben der HEXAL AG zur Bioverfügbarkeit von MTX HEXAL 2,5 mg Tabletten
Eine im Jahr 2000 durchgeführte vergleichende Bioverfügbarkeitsuntersuchung (offen, cross-over, randomisiert) an 26 gesunden männlichen Probanden (18-43 Jahre) ergab nach Einmalgabe von 2 Tabletten zu je 2,5 mg Methotrexat im Vergleich zum Referenzpräparat:
Testpräparat
Referenzpräparat
Cmax [ng/ml] 163,29 ± 35,82 161,43 ± 28,91
maximale Plasmakonzentration
tmax [h] 0,94 ± 0,25 1,03 ± 0,38
Zeitpunkt der maximalen
Plasmakonzentration
AUC0-t [ng/ml*h] 521,8 ± 139,2 518,3 ± 119,3
Fläche unter der
Konzentrations-Zeit-Kurve
AUC0-» [ng/ml*h] 534,9 ± 108,6 534,3 ± 81,54
Fläche unter der
Konzentrations-Zeit-Kurve
Angabe der Werte als Mittelwerte und Streubreite
Mittlere Plasmaspiegelverläufe von Methotrexat im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm
0 4 8 12 16 20 24 28 32 36
Zeit [h]