Mysteclin
Fachinformation
Dermapharm AG Mysteclin®
Genitalcreme/Vaginaltabletten
1. BEZEICHNUNG DER ARZNEIMITTEL
Mysteclin Genitalcreme, 25,9 mg/g, 12,5 mg/g Mysteclin, Vaginaltabletten 104 mg / 50 mg
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Mysteclin Genitalcreme
1 g Vaginalcreme enthält 25,9 mg Tetracyclin 3H2O und 12,5 mg Amphotericin B.
Sonstige Bestandteile mit bekannter Wirkung: 2,28 mg Methyl-4-hydroxybenzoat, 0,24 mg Propyl-4-hydroxybenzoat (Parabene E 216, E 218), 2,5 mg Propylenglycol, 91,4 mg Cetylstearylalkohol (Ph.Eur.).
Mysteclin Vaginaltabletten
1 Vaginaltablette enthält 104 mg Tetracyclin 3H2O und 50 mg Amphotericin B. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Mysteclin Genitalcreme
gelb bis gelblichbraune Vaginalcreme
Mysteclin Vaginaltabletten
gelb bis gelblichbraune Vaginaltabletten
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Fluor vaginalis und Kolpitis infolge Infektionen durch Tetracyclin-empfindliche Krankheitserreger. Infektionen der Scheide durch Candida. Mischinfektionen der Scheide durch Tetracyclin-empfindliche Krankheitserreger und Hefepilze (Candida).
4.2 Dosierung und Art der Anwendung
Dosierung
1. Bei Scheidenentzündungen wird eine Applikatorfüllung von Mysteclin Genitalcreme täglich abends vor dem Einschlafen im Liegen in die Scheide eingebracht (siehe Abbildung im Abschnitt „Art und Dauer der Anwendung").
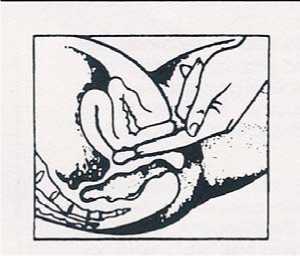
Alternativ kann täglich abends vor dem Einschlafen im Liegen eine Mysteclin Vaginaltablette behutsam in die Scheide eingeführt werden. Die Tablette ist vorher mit Wasser anzufeuchten. Die Wirkung ist am besten, wenn die Tablette -mit der gebotenen Vorsicht - möglichst tief in die Scheide eingeführt wird. Das Einführen der Tablette erfolgt mit dem Finger (siehe Abbildung in Abschnitt „Art und Dauer der Anwendung").
2. Bei Erkrankungen am äußeren Geschlechtsorgan wird, soweit nicht anders verordnet, Mysteclin Genitalcreme morgens und abends, bei Bedarf auch häufiger, auf die erkrankten Bereiche und 1-2 cm darüber hinaus aufgetragen.
Art und Dauer der Anwendung Zur vaginalen Anwendung
Mysteclin Genitalcreme wird, je nach Infektionsort, mittels des beiliegenden Applikators in die Scheide eingeführt bzw. am äußeren Geschlechtsorgan aufgetragen. Für die Genitalcreme liegen der Packung Einmalapplikatoren bei.
Gebrauch des Scheiden-Einmalapplikators
Den Kolben des Einmalapplikators durch leichtes Ziehen an der weißen Kappe lösen. Dann die Tube öffnen und den Applikator auf der der weißen Kappe gegenüberliegenden Seite aufsetzen.
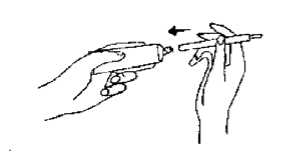
Durch vorsichtiges Drücken der Tube wird der Einmalapplikator so lange gefüllt, bis der Kolben bis zum Anschlag herausgedrückt ist.
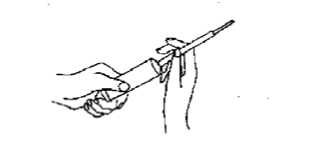
Einmalapplikator von der Tube abnehmen, möglichst tief in die Scheide einführen (am besten in Rückenlage) und durch Druck auf den Kolben entleeren.
Applikator entfernen und wegwerfen.
Art und Dauer der Anwendung Zur vaginalen Anwendung
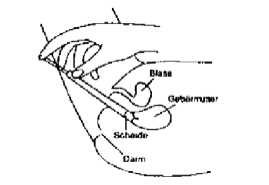
Mysteclin Vaginaltabletten werden tief in die Scheide eingeführt (siehe Abbildung).
Von wesentlicher Bedeutung bei der Behandlung der oft hartnäckigen Scheidenentzündungen ist die regelmäßige Anwendung des Heilmittels. Im Allgemeinen ist eine Behandlungsdauer von 10 Tagen zur Abheilung ausreichend. Über eine evtl. erforderliche Weiterbehandlung muss nach dem Befund entschieden werden.
Hinweise
Die Behandlung sollte zweckmäßigerweise nicht während der Menstruation durchgeführt werden bzw. vor deren Beginn abgeschlossen sein. Eine Behandlung während der Menstruation sollte nur bei ausgeprägter klinischer Symptomatik durchgeführt werden.
Bei ärztlich diagnostizierten Entzündungen von Eichel und Vorhaut des Partners durch Hefepilze sollte bei dem Partner eine zusätzliche lokale Behandlung mit der dafür geeigneten Anwendungsform, der Creme, erfolgen. Zur Vermeidung einer möglichen Reinfektion sollte daher gleichzeitig der Partner ärztlich untersucht werden.
4.3 Gegenanzeigen
Mysteclin Vaginaltabletten
Mysteclin Vaginaltabletten dürfen nicht angewendet werden bei bekannter Überempfindlichkeit gegen einen der Wirkstoffe (Amphotericin B, Tetracyclin) oder einen der sonstigen Bestandteile des Arzneimittels.
Mysteclin Vaginaltabletten dürfen während der Schwangerschaft und Stillzeit nicht angewendet werden (siehe Abschnitte 4.6 und 5.3).
Mysteclin Genitalcreme
Mysteclin Genitalcreme darf nicht angewendet werden bei bekannter
Überempfindlichkeit gegen einen der Wirkstoffe (Amphotericin B, Tetracyclin) oder einen der sonstigen Bestandteile des Arzneimittels, insbesondere gegenüber Propylenglycol und Alkyl-4-hydroxybenzoaten (Parabene).
Mysteclin Genitalcreme darf während der Schwangerschaft und Stillzeit nicht angewendet werden (siehe Abschnitte 4.6 und 5.3).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Hinweis
Da keine Untersuchungen zum Einfluss von Mysteclin auf männliche Samenzellen vorliegen, sind während der Behandlung von Frauen im gebärfähigen Alter empfängnisverhütende Maßnahmen zu ergreifen.
Hinweis für Mysteclin Genitalcreme
Bei gleichzeitiger Anwendung von Mysteclin Genitalcreme und Kondomen kann es zu einer Verminderung der Reißfestigkeit und damit zur Beeinträchtigung der Sicherheit von Kondomen kommen.
Cetylstearylalkohol kann örtlich begrenzt Hautreizungen (z.B. Kontaktdermatitis) hervorrufen.
Propylenglycol kann Hautreizungen hervorrufen.
Es wird empfohlen, dass die Patientin während der Zeit der Erkrankung kochfeste Unterwäsche trägt. Um eine Wiederansteckung zu vermeiden, sollte die Unterwäsche nach jedem Wechsel ausgekocht werden. Das Medikament enthält den gelb gefärbten Wirkstoff Amphotericin B. Der Kontakt dieses Wirkstoffes mit Kleidungs- und Wäschestücken kann zu einer Verfärbung führen, die sich - je nach Stoffbeschaffenheit - unter Umständen durch Waschen allein nicht entfernen lässt. Daher sollte nach Möglichkeit ein direkter Kontakt des Wirkstoffes mit der Wäsche vermieden werden (z.B. durch Einlegen von Damenbinden, Tragen von Einmal-Unterwäsche). Diese Maßnahme wirkt im Übrigen auch einer Wiederansteckung entgegen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Tetracyclin, eine der beiden Komponenten von Mysteclin, wird nach vaginaler Applikation in sehr geringer Menge resorbiert (vgl. toxikologische Eigenschaften). Daher sind die für systemische Anwendung von Tetracyclin bekannten
Wechselwirkungen zwar denkbar, im Rahmen der langjährigen Anwendung von Mysteclin aber noch nicht berichtet. So kann bei gleichzeitiger Gabe von Methoxyfluran die Nephrotoxizität verstärkt sein. Orale Antikoagulanzien werden in ihrer antikoagulativen Wirkung, Sulfonylharnstoffe in ihrer blutzuckersenkenden Wirkung verstärkt. In Gegenwart von Tetracyclin ist die Toxizität von Methotrexat stärker ausgeprägt, in der Kombination Tetracyclin und Digoxin kann der
Digoxinplasmaspiegel erhöht sein.
Für Amphotericin B, die zweite Komponente von Mysteclin, sind nach parenteraler Anwendung ebenfalls Wechselwirkungen beschrieben. Nach dem gegenwärtigen Stand des Wissens ist eine Resorption von Amphotericin B durch Haut und Schleimhaut jedoch nicht gegeben und daher mit systemischen Wechselwirkungen nicht zu rechnen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Während der Schwangerschaft und Stillzeit dürfen Mysteclin Genitalcreme und Vaginaltabletten wegen einer möglichen Beeinflussung des kindlichen Knochen- und Zahnaufbaus nicht angewendet werden (siehe Abschnitte 4.3 und 5.3).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es sind keine besonderen Vorsichtsmaßnahmen erforderlich.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zu Grunde gelegt:
Sehr häufig (>1/10)
Häufig (>1/100 bis <1/10)
(>1/1.000 bis <1/100)
Gelegentlich Selten Sehr selten Nicht bekannt
(>1/10.000 bis <1/1.000)
(<1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
In den gelegentlich vorkommenden Fällen einer Überempfindlichkeit gegen Mysteclin Vaginaltabletten und Genitalcreme ist von der Anwendung des Präparats Abstand zu nehmen.
Methyl-4-hydroxybenzoat und Propyl-4-hydroxybenzoat können Überempfindlichkeitsreaktionen, auch Spätreaktionen, hervorrufen
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Bei Auftreten von Überempfindlichkeitsreaktionen sollen die Präparate abgesetzt und eine geeignete Behandlung durchgeführt werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antiinfektiva und Antiseptika, Kombinationen,
Tetracyclin 3 H2O und Amphotericin B ATC-Code: G01AA20
Amphotericin B
Amphotericin B wirkt gegen zahlreiche menschen- und tierpathogene Blastomyceten (Hefen). Vom klinischen Standpunkt ist für mitteleuropäische Verhältnisse jedoch nur die Wirkung gegen Candida-Arten und Aspergillus fumigatus interessant. Amphotericin B wirkt nicht gegen Bakterien, Rickettsien, Viren oder Dermatophyten.
Je nach Konzentration wirkt Amphotericin B fungistatisch oder fungizid. Primäre Resistenzen gegen Amphotericin B wurden seit der Isolierung im Jahre 1956 nicht berichtet.
Trotz der weit verbreiteten Anwendung von Amphotericin B zur Behandlung von Hefeinfektionen wurden keine resistenten Stämme beobachtet. In vitro können unter extremen Versuchsbedingungen resistente Candidastämme mit Kreuzresistenz gegen Nystatin gezüchtet werden. In der klinischen Praxis konnte bisher jedoch noch kein resistenter Stamm gefunden werden.
Resistenzentwicklung von Candida gegen Amphotericin B ist unter klinischen Bedingungen bisher nicht bekannt geworden.
Amphotericin B wird wahrscheinlich an die Sterole der Pilz-Zellmembran gebunden und führt in der Folge zu einer Veränderung der Zellpermeabilität und so zu einem Verlust von Kaliumionen und anderen Molekülen.
Tetracyclin
Tetracyclin wirkt gegen grampositive und gramnegative Bakterien, Mykoplasmen, Chlamydien, Rickettsien und auch gegen die mit Bakterien in Symbiose lebenden Trichomonaden.
Es besteht eine Kreuzresistenz zwischen Tetracyclin und den verschiedenen Tetracyclin-Derivaten.
Resistenzentwicklung von Erregern gegen Tetracyclin geht, wenn überhaupt, unter der Therapie nur sehr langsam vor sich.
Synergistische Wirkung:
Der hemmende Einfluss von Tetracyclin auf den Bau der Zellwand und auf die RNS-Synthese wird durch Amphotericin B in synergistischer Weise unterstützt.
5.2 Pharmakokinetische Eigenschaften
Tetracycline können im Gegensatz zu Amphotericin B, abhängig vom Zustand der Schleimhaut, bei der Anwendung im Genitalbereich absorbiert werden.
5.3 Präklinische Daten zur Sicherheit
I. Daten zur topischen Verträglichkeit
Hinsichtlich der topischen Verträglichkeit von Mysteclin Vaginaltabletten und Genitalcreme wurden keine Unterschiede gefunden. Beide Applikationsformen erwiesen sich als gut verträglich, ganz selten wurden Urtikaria und lokale Irritationen beobachtet.
Nach einmaliger vaginaler Applikation von Mysteclin beim Menschen wurde festgestellt, daß das Amphotericin B nicht und das Tetracyclin nur in sehr geringen Mengen im Urin nachzuweisen war (im Blut wurde nichts gefunden).
II. Daten zur systemischen Verträglichkeit 1. Amphotericin B
Da bei vaginaler Applikation von Amphotericin B eine Resorption nicht nachgewiesen werden konnte, ist nicht mit systemischer Toxizität der Substanz zu rechnen.
Akute Toxizität
Nach intravenöser Applikation einer Amphotericin B-Suspension in 5%-iger Dextrose wurde der LD50-Wert an Mäusen bestimmt: Er schwankte zwischen 5,4 und 17,0 mg/kg Körpergewicht.
Bei Verwendung von mikropulverisiertem Amphotericin B (eine 5%-ige wässrige Suspension von mikropulverisiertem Amphotericin B wurde 1 : 50 mit dest. Wasser verdünnt und Mäusen intravenös appliziert) wurde eine LD50 von 8 ± 1 mg/kg Körpergewicht gefunden.
Chronische Toxizität
Bei wiederholter parenteraler Gabe führte Amphotericin B im Tierversuch bei Hunden zu gastrointestinalen Störungen (i.v.-Infusion von 1,6 bis 3,5 mg Amphotericin B/kg Körpergewicht an 2 bis 5 aufeinanderfolgenden Tagen).
Bei Menschen wurden ebenfalls gastrointestinale Störungen, bei wiederholter i.v.-Verabreichung ferner Nephrotoxizität, neurologische Symptome, Leberschäden und Thrombophlebitis beobachtet.
Mutagenes und tumorerzeugendes Potenzial
Angaben zur Kanzerogenität und Mutagenität von Amphotericin B liegen nicht vor. Diese Daten sind nicht erforderlich, da Amphotericin B nach vaginaler Applikation einerseits nicht resorbiert wird und andererseits Mysteclin Vaginaltabletten/Genitalcreme nicht zur Langzeitbehandlung bestimmt sind.
Reproduktionstoxizität
Untersuchungen zur Reproduktionstoxizität von Amphotericin B bei Ratten, Mäusen und Kaninchen zeigten keine Hinweise auf Teratogenität.
2. Tetracyclin Akute Toxizität
Die akute Toxizität von Tetracyclin wurde nach oraler, intraperitonealer und intravenöser Applikation an Mäusen und Ratten bestimmt. Für die intraperitoneale und intravenöse Applikation wurden 0,5-1,0 %ige Tetracyclinhydrochlorid-Lösungen (pH 7,8 bis 8,2) verwendet, für die orale akute Toxizität wurde Tetracyclinhydrochlorid (4-6 % und 20 %) in Stärke (2 %) suspendiert.
Akute Toxizität (LD50) von Tetracyclinhydrochlorid
|
Spezies |
Art der Anwendung |
LD50 (mg Tetracyclinhydrochlorid/kg) | |
|
Maus |
Intravenös |
170 |
(156-185) |
|
Intraperitoneal Oral |
330 >3000 |
(298-365) | |
|
Ratte |
Intravenös |
220 |
(202-330) |
|
Intraperitoneal Oral |
320 >3000 |
(310-330) | |
Chronische Toxizität
Die chronische Toxizität wurde an Hunden nach oraler Gabe von 10 mg/100 mg Tetracyclinhydrochlorid/kg Körpergewicht bestimmt. Sämtliche getesteten Körperfunktionen blieben unverändert.
Als Unverträglichkeitsreaktionen von Tetracyclin wurden beim Menschen
gastrointestinale Störungen, Haut- und Schleimhautveränderungen, Photosensibilisierung und Blutbildveränderungen beobachtet. Bei Kindern können eine Gelbfärbung der Zähne sowie eine reversible Knochenwachstumsverzögerung auftreten.
Mutagenes und tumorerzeugendes Potenzial
Untersuchungen zur Kanzerogenität liegen nicht vor; da die empfohlene Behandlungsdauer nur 10 Tage beträgt und Mysteclin Genitalcreme/Vaginaltabletten damit nicht zur Langzeittherapie vorgesehen sind, sind Kanzerogenitäts-untersuchungen nicht erforderlich.
In-vitro-Untersuchungen an kultivierten Mäusekarzinomzellen, Leukozyten vom Menschen, menschlichen Embryonalfibroblasten und intestinalen Bakterien sowie In-vivo-Untersuchungen beim syrischen Hamster zeigten, dass Tetracyclin eine mutagene Wirkung besitzt. Trotz breiter Anwendung von Mysteclin ist eine klinische Relevanz dieser Mutagenitätsuntersuchungen nicht erkennbar geworden.
Reproduktionstoxizität
Ausreichende Erfahrungen über die Anwendung von Tetracyclin während der Schwangerschaft liegen beim Menschen nicht vor. Tetracycline lagern sich in der
Mineralisationsphase an Calciumionen von Zahnanlagen und Knochen ab. Dies führt zu Schädigung der Zähne und zu Wachstumsstörungen der Knochen. Tierversuche erbrachten Hinweise auf embryotoxische / teratogene Wirkungen.
Tetracyclin geht in die Muttermilch über; die Behandlung der Mutter während der Stillzeit kann zu einer ernsthaften Schädigung des Säuglings führen (Einlagerung in Zähne - Zahnverfärbung -, Störungen der Darmflora möglich), ferner kann eine intrakranielle Drucksteigerung auftreten.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Mysteclin Genitalcreme Methyl-4-hydroxybenzoat (Paraben: E 218) Propyl-4-hydroxybenzoat (Paraben: E 216)
Propylenglycol Citronensäure Natriumdisulfit Cetylstearylalkohol (Ph.Eur.)
Ceteareth-20 weißes Vaselin Sorbitol Simeticon
Macrogolstearat 400 Glycerolstearat gereinigtes Wasser
Mysteclin Vaginaltabletten
Magnesiumstearat
Carnaubawachs
Natriumdodecylsulfat
Citronensäure
Natriumhydrogencarbonat
Povidon
Cellulose
6.2 Inkompatibilitäten
Bisher nicht bekannt.
6.3 Dauer der Haltbarkeit
Mysteclin Genitalcreme: 2 Jahre
Mysteclin Vaginaltabletten: 3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Keine.
6.5 Art und Inhalt des Behältnisses
Mysteclin Genitalcreme
Tuben zu 50 g Vaginalcreme und 12 Einmalapplikatoren
Mysteclin Vaginaltabletten Blister mit 10 Vaginaltabletten
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Dermapharm AG
Lil-Dagover-Ring 7
82031 Grünwald
Tel.: 089/641 86-0
Fax: 089/641 86-130
E-Mail: service@dermapharm.de
8. ZULASSUNGNUMMERN
Mysteclin Genitalcreme: 3469.00.00
Mysteclin Vaginaltabletten: 3469.00.01
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
13.03.1984 / 22.06.2010
10. STAND DER INFORMATION
Mai 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Seite 9 von 9