Nebido 1000 Mg Injektionslösung
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Nebido® 1000 mg Injektionslösung Testosteronundecanoat
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 ml Injektionslösung enthält 250 mg Testosteronundecanoat, entsprechend 157,9 mg Testosteron. 1 Ampulle / Durchstechflasche mit 4 ml Injektionslösung enthält 1000 mg Testosteronundecanoat. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Injektionslösung
Klare, gelbliche ölige Lösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Testosteronersatztherapie bei männlichem Hypogonadismus, wenn der Testosteronmangel klinisch und labormedizinisch bestätigt wurde (siehe Abschnitt 4.4).
4.2 Dosierung und Art der Anwendung Dosierung
Der Inhalt einer Ampulle / Durchstechflasche Nebido (entsprechend 1000 mg Testosteronundecanoat) wird im Abstand von 10 bis 14 Wochen injiziert. Injektionen in dieser Häufigkeit können ausreichende Testosteronspiegel aufrechterhalten und führen nicht zur Kumulation.
Beginn der Therapie
Vor Beginn und während der Einleitung der Therapie sind die Testosteron-Serumspiegel zu bestimmen. In Abhängigkeit von der Höhe der Testosteron-Serumspiegel und den klinischen Symptomen kann das erste Injektionsintervall im Vergleich zu dem für die Erhaltungstherapie empfohlenen Intervall von 10 bis 14 Wochen bis auf minimal 6 Wochen reduziert werden. Mit einer solchen Aufsättigungsdosis können schneller ausreichende Steady-state-Testosteronspiegel erreicht werden.
Erhaltungstherapie und Individualisierung der Therapie
Das Injektionsintervall sollte innerhalb des empfohlenen Bereichs von 10 bis 14 Wochen bleiben. Während der Erhaltungstherapie ist eine sorgfältige Kontrolle der Testosteron-Serumspiegel erforderlich. Es ist ratsam, die Testosteron-Serumspiegel regelmäßig zu bestimmen. Die Bestimmungen sollten am Ende eines jeden Injektionsintervalls unter Berücksichtigung der klinischen Symptome durchgeführt werden. Diese Testosteron-Serumspiegel sollten im unteren Drittel des Normbereiches liegen. Serumspiegel unter dem Normbereich würden anzeigen, dass das Injektionsintervall verkürzt werden muss. Bei zu hohen Serumspiegeln kann eine Verlängerung des Injektionsintervalls in Betracht gezogen werden.
Besondere Gruppen
Kinder und Jugendliche
Nebido ist bei Kindern und Jugendlichen nicht indiziert.
Die Anwendung von Nebido bei männlichen Jugendlichen unter 18 Jahren ist in klinischen Studien nicht untersucht worden (siehe Abschnitt 4.4).
Ältere Patienten
Begrenzte Daten deuten daraufhin, dass eine Dosisanpassung bei älteren Patienten nicht notwendig ist (siehe Abschnitt 4.4).
Patienten mit einer Leberschädigung
Es wurden keine formalen Studien bei Patienten mit eingeschränkter Leberfunktion durchgeführt. Die Anwendung von Nebido ist kontraindiziert bei Männern mit früheren oder bestehenden Lebertumoren (siehe Abschnitt 4.3).
Patienten mit einer Nierenschädigung
Es wurden keine formalen Studien bei Patienten mit eingeschränkter Nierenfunktion durchgeführt.
Art der Anwendung
Zur intramuskulären Anwendung.
Die Injektion muss sehr langsam (über zwei Minuten) erfolgen. Nebido ist nur zur intramuskulären Injektion bestimmt. Es ist darauf zu achten, dass Nebido unter Einhaltung der für intramuskuläre Injektionen üblichen Vorsichtsmaßnahmen tief in den Gesäßmuskel injiziert wird. Dabei muss besonders darauf geachtet werden, dass intravasale Injektionen vermieden werden (siehe Abschnitt 4.4 „Anwendung“). Die intramuskuläre Injektion muss unmittelbar nach dem Öffnen der Ampulle / Durchstechflasche erfolgen. (Hinweise zur Ampulle siehe Abschnitt 6.6: Anleitung zum sicheren Öffnen der Ampulle).
4.3 Gegenanzeigen
Die Anwendung von Nebido ist kontraindiziert bei Männern mit:
- androgenabhängigem Karzinom der Prostata oder der männlichen Brustdrüse
- früheren oder bestehenden Lebertumoren
- Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
Die Anwendung von Nebido bei Frauen ist kontraindiziert.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die Anwendung von Nebido bei Kindern und Jugendlichen wird nicht empfohlen.
Nebido darf nur bei einem nachgewiesenen (hyper- oder hypogonadotropen) Hypogonadismus und nach vorherigem Ausschluss anderer Ursachen, die der Symptomatik zugrunde liegen können, angewendet werden. Der Testosteronmangel muss eindeutig durch klinische Symptome (Rückbildung der sekundären Geschlechtsmerkmale, Veränderung der Körperzusammensetzung, Asthenie,
Abnahme der Libido, erektile Dysfunktion usw.) nachgewiesen und durch zwei voneinander unabhängige Bestimmungen des Testosteron im Blut bestätigt werden.
Es liegen nur wenige Erfahrungen mit der Anwendung von Nebido bei Patienten über 65 Jahren vor. Derzeit gibt es keinen Konsens über altersspezifische Testosteron-Referenzwerte. Es sollte jedoch berücksichtigt werden, dass die physiologischen Testosteron-Serumspiegel mit zunehmendem Alter absinken.
Medizinische Untersuchung
Vor Beginn der Therapie mit Testosteron müssen sich alle Patienten einer gründlichen ärztlichen Untersuchung unterziehen, um das Risiko eines vorbestehenden Prostatakarzinoms auszuschließen. Bei mit Testosteron behandelten Patienten müssen sorgfältige und regelmäßige Kontrolluntersuchungen der Prostata und der Brust mit den gegenwärtig etablierten Methoden (digitale rektale Untersuchung und Überprüfung des PSA-Serumspiegels) mindestens einmal jährlich durchgeführt werden, bei älteren Patienten und bei Risikopatienten (mit bestimmten klinisch oder familiär bedingten Risikofaktoren) zweimal pro Jahr. Nationale Richtlinien zur Überwachung der Sicherheit unter Testosteronersatztherapie müssen berücksichtigt werden.
Neben den Laborkontrollen der Testosteron-Konzentrationen sollen bei Patienten unter AndrogenLangzeittherapie auch die folgenden Laborparameter regelmäßig überprüft werden: Hämoglobin, Hämatokrit sowie Leberfunktionstests (siehe Abschnitt 4.8).
Aufgrund der Variabilität von Laborwerten sollten alle Testosteronmessungen im selben Labor durchgeführt werden.
Tumore
Androgene können die Entwicklung eines subklinischen Prostatakrebses und einer benignen Prostatahyperplasie beschleunigen.
Nebido sollte bei Krebspatienten, bei denen aufgrund von Knochenmetastasen ein Risiko für eine Hyperkalzämie (und eine damit verbundene Hyperkalzurie) besteht, mit Vorsicht angewandt werden. Es wird empfohlen, bei diesen Patienten regelmäßig den Kalziumspiegel im Serum zu kontrollieren.
Es wurden Fälle von benignen und malignen Lebertumoren bei Anwendern von hormonalen Substanzen, z. B. androgenen Verbindungen, berichtet. Wenn bei Männern, die Nebido anwenden, schwere Oberbauchbeschwerden, eine Lebervergrößerung oder Anzeichen einer intraabdominellen Blutung auftreten, sollte ein Lebertumor in die differentialdiagnostischen Überlegungen einbezogen werden.
Andere Erkrankungen
Bei Patienten, die an einer schweren Herz-, Leber- oder Niereninsuffizienz oder einer ischämischen Herzerkrankung leiden, kann die Therapie mit Testosteron ernsthafte Komplikationen verursachen, charakterisiert durch Ödeme, die mit oder ohne kongestiver Herzinsuffizienz einhergehen können. In diesem Fall muss die Therapie sofort abgebrochen werden. Studien zur Wirksamkeit und Unbedenklichkeit des Arzneimittels bei Patienten mit eingeschränkter Nieren- oder Leberfunktion wurden nicht durchgeführt. Daher darf eine Testosteronersatztherapie bei diesen Patienten nur mit Vorsicht erfolgen.
Vorsicht ist geboten bei Patienten, die zu Ödemen neigen, da die Behandlung mit Androgenen die Natriumretention verstärken kann (siehe Abschnitt 4.8).
Grundsätzlich müssen die für Patienten mit erworbenen oder angeborenen Blutgerinnungsstörungen geltenden Einschränkungen bei der Anwendung intramuskulärer Injektionen stets eingehalten werden.
Nebido sollte bei Patienten mit Epilepsie oder Migräne nur mit Vorsicht angewandt werden, da sich diese Erkrankungen verschlimmern können.
Bei androgenbehandelten Patienten, die nach der Testosteronersatztherapie normale TestosteronPlasmaspiegel erreichen, kann es zu einer verbesserten Insulinempfindlichkeit kommen.
Bestimmte klinische Symptome, wie Reizbarkeit, Nervosität, Gewichtszunahme, lang anhaltende oder häufige Erektionen, können auf eine übermäßige Androgenexposition hinweisen und erfordern eine Dosisanpassung.
Eine vorbestehende Schlafapnoe kann sich verstärken.
Nebido sollte auf Dauer abgesetzt werden, wenn die Symptome einer übermäßigen Androgenexposition persistieren oder während der Therapie in dem empfohlenen Dosierungsregime wieder auftreten.
Anwendung
Wie alle öligen Lösungen muss Nebido exakt intramuskulär und sehr langsam (über zwei Minuten) injiziert werden. Eine pulmonale Mikroembolie mit öligen Lösungen kann in seltenen Fällen zu Symptomen wie Husten, Dyspnoe, Unwohlsein, Hyperhidrosis, thorakale Schmerzen, Schwindel, Parästhesie oder Synkope führen. Diese Reaktionen können während oder unmittelbar nach der Injektion auftreten und sind reversibel. Der Patient muss deshalb während und unmittelbar nach jeder Injektion beobachtet werden, damit eine rechtzeitige Erkennung von Anzeichen und Symptomen einer öligen pulmonalen Mikroembolie möglich ist. Die Behandlung erfolgt gewöhnlich mit unterstützenden Maßnahmen, z. B. durch zusätzliche Sauerstoffgabe.
Es wurden Verdachtsfälle von anaphylaktischen Reaktionen im Anschluss an eine Nebido-Injektion berichtet.
Die Anwendung von Nebido kann bei Dopingkontrollen zu positiven Ergebnissen führen.
Androgene, wie in Nebido enthalten, sind nicht dazu geeignet, bei gesunden Personen die Muskelentwicklung zu fördern oder die körperliche Leistungsfähigkeit zu steigern.
Die gesundheitlichen Folgen der Anwendung von Nebido als Dopingmittel können nicht abgesehen werden, schwerwiegende Gesundheitsgefährdungen sind nicht auszuschließen (siehe Abschnitt 4.8).
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Orale Antikoagulanzien
Es wurde berichtet, dass Testosteron und seine Derivate die Wirkung oraler Antikoagulanzien steigern. Bei Patienten, die orale Antikoagulanzien erhalten, ist daher eine engmaschige Überwachung erforderlich, insbesondere zu Beginn und am Ende der Androgen-Therapie. Eine häufigere Überprüfung von Prothrombinzeit und häufigere INR-Bestimmungen werden empfohlen.
Andere Wechselwirkungen
Die gleichzeitige Gabe von Testosteron mit ACTH oder Corticosteroiden kann die Ödembildung fördern. Daher sind diese Wirkstoffe, insbesondere bei Patienten mit Herz- oder Lebererkrankungen oder bei Patienten, die zu Ödemen neigen, mit Vorsicht anzuwenden.
Beeinflussung von Laboruntersuchungen: Androgene können die Spiegel des thyroxinbindenden Globulins herabsetzen und somit zu verringerten Gesamt-T4-Serumspiegel und einer erhöhten T3- und T4-Harzaufnahme führen. Die Spiegel der freien Schilddrüsenhormone bleiben jedoch unverändert. Es gibt keine klinischen Hinweise auf eine Beeinträchtigung der Schilddrüsenfunktion.
4.6 Fertilität, Schwangerschaft und Stillzeit
Fertilität
Testosteronersatztherapie kann die Spermatogenese reversibel unterdrücken (siehe Abschnitte 4.8 und 5.3).
Schwangerschaft und Stillzeit
Nebido ist bei Frauen nicht indiziert und darf bei schwangeren oder stillenden Frauen nicht angewendet werden, siehe Abschnitt 4.3.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nebido hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Unerwünschte Wirkungen, die bei Anwendung von Androgenen auftreten können, siehe auch Abschnitt 4.4.
Die am häufigsten berichteten unerwünschten Wirkungen während der Behandlung mit Nebido sind Akne und Schmerzen an der Injektionsstelle.
Eine pulmonale Mikroembolie mit öligen Lösungen kann in seltenen Fällen zu Symptomen wie Husten, Dyspnoe, Unwohlsein, Hyperhidrosis, thorakale Schmerzen, Schwindel, Parästhesie oder Synkope führen. Diese Reaktionen können während oder unmittelbar nach der Injektion auftreten und sind reversibel. Es wurden selten Verdachtsfälle von öligen pulmonalen Mikroembolien von der Firma oder den Berichterstattern sowohl aus klinischen Studien (bei > 1/10.000 und < 1/1.000 Injektionen) als auch aus Post-Marketing-Erfahrungen berichtet (siehe Abschnitt 4.4 „Besondere Wamhinweise und Vorsichtsmaßnahmen für die Anwendung“).
Es wurden Verdachtsfalle von anaphylaktischen Reaktionen im Anschluss an eine Nebido-Injektion berichtet.
Androgene können die Entwicklung eines subklinischen Prostatakrebses und einer benignen Prostatahyperplasie beschleunigen.
In der nachstehenden Tabelle 1 sind die Nebenwirkungen (ADRs) nach Systemorganklassen gemäß MedDRA aufgeführt (MedDRA SOCs). Die Häufigkeiten basieren auf klinischen Studiendaten und sind definiert als Häufig (> 1/100 bis < 1/10) und Gelegentlich (> 1/1.000 bis < 1/100). Die Nebenwirkungen wurden in 6 klinischen Studien dokumentiert (N=422) und mindestens als „möglicherweise hervorgerufen durch Nebido“ eingestuft.
Tabelle 1: Relative Häufigkeiten von Nebenwirkungen bei Männern, kategorisiert nach MedDRA SOC, basierend auf den zusammengefassten Daten von sechs klinischen Studien, N=422 (100,0 %), das heißt N=302 Männer mit Hypogonadismus wurden mit 4 ml von 250 mg/ml Testosteronundecanoat i. m. Injektionen behandelt und N=120 mit 3 ml von 250 mg/ml Testosteronundecanoat.
|
System organklasse |
Häufig (> 1/100 bis < 1/10) |
Gelegentlich (> 1/1.000 bis < 1/100) |
|
Erkrankungen des Blutes und des Lymphsystems |
Polyzythämie |
Anstieg des Hämatokrit Anstieg der Erythrozyten Anstieg des Hämoglobin |
|
Erkrankungen des Immunsystems |
Überempfindlichkeitsreaktionen | |
|
Stoffwechsel- und |
Gewichtszunahme |
Appetitzunahme |
|
Ernährungs störungen |
Anstieg des Glykohämoglobin Hypercholesterinämie Anstieg der Triglyceride im Blut Anstieg des Cholesterin im Blut | |
|
Psychiatrische Erkrankungen |
Depression Emotionale Störung Schlaflosigkeit Ruhelosigkeit Aggression Reizbarkeit | |
|
Erkrankungen des Nerven- |
Kopfschmerzen Migräne | |
|
systems |
Tremor | |
|
Gefäßerkrankun- |
Hitzewallung |
Kardiovaskuläre Störung |
|
gen |
Hypertonie Schwindel | |
|
Erkrankungen der Atemwege, des Brustraums |
Bronchitis Sinusitis Husten | |
|
und Mediastinums |
Dyspnoe Schnarchen Dysphonie | |
|
Erkrankungen des Gastrointestinaltrakts |
Diarrhoe Übelkeit | |
|
Leber- und |
Anormale Leberfunktionswerte | |
|
Gallenerkran kungen |
Anstieg der Glutamatoxalacetattransaminase | |
|
Erkrankungen der Haut und des |
Akne |
Alopezie Erythem |
|
Unterhautzell gewebes |
Hautausschlag 1 Pruritus Trockene Haut | |
|
Skelettmuskulatur-, Binde- |
Arthralgie Schmerzen in den Extremitäten | |
|
gewebs- und Knochenerkran- |
Muskelstörungen 2 Steifigkeit in der Skelettmuskulatur | |
|
kungen |
Anstieg der Kreatinphosphokinase im Blut | |
|
Erkrankungen der Nieren und Harnwege |
Abnahme des Harnflusses Harnverhaltung Harnwegsstörung |
|
Nykturie Dysurie | ||
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Anstieg des prostataspezifischen Antigens Abnormaler Untersuchungsbefund der Prostata Benigne Prostatahyperplasie |
Intraepitheliale Neoplasie der Prostata Verhärtung der Prostata Prostatitis Prostata-Störungen Libidoveränderungen Hodenschmerzen Verhärtung der Brust Brustschmerz Gynäkomastie Anstieg des Estradiol Anstieg des Testosteron |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Verschiedene Arten von Reaktionen an der Injektionsstelle 3 |
Müdigkeit Asthenie Hyperhidrosis 4 |
Der MedDRA-Begriff, der sich am besten eignet, um eine bestimmte Nebenwirkung zu beschreiben, ist aufgeführt. Synonyme und in Zusammenhang stehende Erkrankungen sind nicht aufgeführt, sollten jedoch auch berücksichtigt werden.
1 Hautausschlag, einschließlich papulöser Hautausschlag
2 Muskelstörungen: Muskelkrampf, Muskelzerrung und Muskelschmerzen
3 Verschiedene Arten von Reaktionen an der Injektionsstelle: Schmerzen an der Injektionsstelle, Beschwerden an der Injektionsstelle, Pruritus an der Injektionsstelle, Rötung an der Injektionsstelle, Hämatome an der Injektionsstelle, Reizung an der Injektionsstelle, Reaktion an der Injektionsstelle
4 Hyperhidrosis: Hyperhidrosis und Nachtschweiß
Eine pulmonale Mikroembolie mit öligen Lösungen kann in seltenen Fällen zu Symptomen wie Husten, Dyspnoe, Unwohlsein, Hyperhidrosis, thorakale Schmerzen, Schwindel, Parästhesie oder Synkope führen. Diese Reaktionen können während oder unmittelbar nach der Injektion auftreten und sind reversibel. Es wurden selten Verdachtsfälle von öligen pulmonalen Mikroembolien von der Firma oder den Berichterstattern sowohl aus klinischen Studien (bei > 1/10.000 und < 1/1.000 Injektionen) als auch aus Post-Marketing-Erfahrungen berichtet (siehe Abschnitt 4.4 „Besondere Wamhinweise und Vorsichtsmaßnahmen für die Anwendung“).
Zusätzlich zu den oben aufgeführten Nebenwirkungen wurde während der Behandlung mit testosteronhaltigen Präparaten über Nervosität, Feindseligkeit, Schlafapnoe, verschiedene Hautreaktionen einschließlich Seborrhoe, erhöhte Erektionshäufigkeit und sehr selten über Gelbsucht berichtet.
Eine hoch dosierte Anwendung von Testosteronpräparaten bewirkt im Allgemeinen eine reversible Unterbrechung oder Verminderung der Spermatogenese und dadurch eine Abnahme der Hodengröße. Eine Testosteronersatztherapie bei Hypogonadismus kann in seltenen Fällen schmerzhafte Dauererektionen (Priapismus) verursachen. Hoch dosierte Therapie oder Langzeittherapie mit Testosteron führt gelegentlich zu gehäuftem Auftreten von Wasserretention und Ödemen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Bei Überdosierung sind außer dem Absetzen des Arzneimittels oder einer Reduzierung der Dosis keine speziellen therapeutischen Maßnahmen erforderlich.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Androgene, 3-Oxoandrosten(4)-Derivate, ATC-Code: G03B A03
Testosteronundecanoat ist ein Ester des natürlich vorkommenden Androgens Testosteron. Die Wirkform Testosteron wird durch Abspaltung der Seitenkette gebildet.
Testosteron ist das wichtigste männliche Androgen. Es wird hauptsächlich in den Hoden und in geringem Umfang auch in der Nebennierenrinde gebildet.
Testosteron ist für die Ausbildung der männlichen Geschlechtsmerkmale während der fetalen, frühkindlichen und pubertären Entwicklung verantwortlich und erhält danach den maskulinen Phänotyp und die androgenabhängigen Funktionen (z. B. Spermatogenese, akzessorische Geschlechtsdrüsen) aufrecht. Darüber hinaus übt es weitere Funktionen aus, beispielsweise in Haut, Muskeln, Skelett, Nieren, Leber, Knochenmark und ZNS.
In Abhängigkeit vom Zielorgan zeigt Testosteron hauptsächlich ein androgenes (z. B. Prostata, Samenbläschen, Epididymis) oder proteinanaboles Wirkungsspektrum (Muskeln, Knochen, Hämatopoese, Nieren, Leber).
In einigen Organen wirkt Testosteron nach peripherer Umwandlung zu Estradiol. Dieses wird dann von den Estrogenrezeptoren des Zellkerns in der Zielzelle gebunden, wie z. B. in den Hypophysen-, Fett-, Gehirn- und Knochenzellen sowie in den Leydig-Zellen des Hodens.
5.2 Pharmakokinetische Eigenschaften
Resorption
Nebido ist ein Depotpräparat mit Testosteronundecanoat. Es wird intramuskulär appliziert, wodurch der First-pass-Effekt umgangen wird. Nach intramuskulärer Injektion der öligen Lösung wird Testosteronundecanoat allmählich aus dem Depot freigesetzt und von Serumesterasen nahezu vollständig in Testosteron und Undecansäure gespalten. Einen Tag nach der Anwendung kann ein Anstieg des Testosteron-Serumspiegels über den Basalwert gemessen werden.
Steady-state-Bedingungen
Bei hypogonadalen Männern wurden nach der ersten intramuskulären Injektion von 1000 mg Testosteronundecanoat mittlere Cmax-Werte von 38 nmol/l (11 ng/ml) nach 7 Tagen erreicht. Die zweite Injektion erfolgte 6 Wochen nach der ersten; danach wurden maximale Testosteronwerte von ca. 50 nmol/l (15 ng/ml) erreicht. Bei den drei darauf folgenden Injektionen wurde ein gleich bleibendes Dosierungsintervall von 10 Wochen eingehalten. Der Steady-state wurde zwischen der dritten und fünften Injektion erreicht. Die mittleren Cmax- und Cmm-Testosteronwerte unter Steady-state-Bedingungen betrugen ca. 37 nmol/l (11 ng/ml) bzw. 16 nmol/l (5 ng/ml). Die mediane intra-und interindividuelle Variabilität (Variationskoeffizient, Angabe in %) der Cmin-Werte betrug 22 % (Variationsbreite: 9 - 28 %) bzw. 34 % (Variationsbreite: 25 - 48 %).
Verteilung
Im Serum von Männern sind ca. 98 % des zirkulierenden Testosterons an sexualhormonbindendes Globulin (SHBG) und Albumin gebunden. Nur der ungebundene Testosteronanteil gilt als biologisch wirksam. Nach intravenöser Infusion von Testosteron bei älteren Männern betrug die Eliminationshalbwertszeit etwa eine Stunde und das scheinbare Verteilungsvolumen ca. 1,0 l/kg.
Biotransformation
Testosteronundecanoat wird nach Spaltung des Esters als Testosteron auf dem gleichen Weg wie endogen gebildetes Testosteron metabolisiert und ausgeschieden. Die Undecansäure wird durch ß-Oxidation auf dem gleichen Weg wie andere aliphatische Carbonsäuren metabolisiert. Die aktiven Hauptmetaboliten von Testosteron sind Estradiol und Dihydrotestosteron.
Elimination
Testosteron unterliegt einer extensiven hepatischen und extrahepatischen Metabolisierung. Nach Gabe von radioaktiv markiertem Testosteron erscheinen ca. 90 % der Radioaktivität im Urin als Glukuron-und Schwefelsäurekonjugate; 6 % erscheinen nach Durchlaufen des enterohepatischen Kreislaufs in den Fäzes. Die renal ausgeschiedenen Produkte enthalten Androsteron und Etiocholanolon. Nach intramuskulärer Anwendung dieser Depotformulierung beträgt die Halbwertszeit der Freisetzungsrate 90 ± 40 Tage.
5.3 Präklinische Daten zur Sicherheit
Toxizitätsstudien ergaben keine anderen Wirkungen als jene, die auf der Basis des hormonellen Profils von Nebido erklärt werden können.
Testosteron erwies sich in vitro im Reverse-Mutations-Test (Ames-Test) und im HamsterovarzellenTest als nicht mutagen. In tierexperimentellen Studien wurde ein Zusammenhang zwischen Androgenbehandlung und der Entwicklung bestimmter Krebsarten gefunden. Experimentelle Daten bei Ratten zeigten nach Behandlung mit Testosteron eine erhöhte Inzidenz von Prostatakarzinomen.
Es ist bekannt, dass Sexualhormone die Entwicklung bestimmter, durch bekannte Kanzerogene hervorgerufene Tumore fördern. Die klinische Relevanz dieser Beobachtung ist nicht bekannt.
Fertilitätsstudien mit Nagetieren und Primaten zeigten, dass die Behandlung mit Testosteron die Fertilität dosisabhängig durch Unterdrücken der Spermatogenese beeinträchtigen kann.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Benzylbenzoat,
Raffiniertes Rizinusöl
6.2 Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
5 Jahre
Das Arzneimittel muss unmittelbar nach dem Öffnen angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
Ampulle
5-ml-Braunglasampulle (Typ I) mit einem Füllvolumen von 4 ml Packungsgröße: 1 x 4 ml
Durchstechflasche
6-ml-Braunglasdurchstechflasche (Typ I) mit grauem Bromobutylinjektionsstopfen (mit Folie beschichtetes ETFE) und Bördelkappe mit einem Füllvolumen von 4 ml Packungsgröße: 1 x 4 ml
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Die zur intramuskulären Injektion bestimmte Lösung ist vor der Anwendung visuell zu prüfen; nur klare, partikelfreie Lösungen dürfen verwendet werden.
Dieses Arzneimittel ist nur für den einmaligen Gebrauch bestimmt. Nicht verbrauchte Reste sind entsprechend den nationalen Anforderungen zu entsorgen.
Ampulle
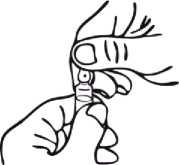
Hinweise zur Handhabung der OPC (One-Point-Cut) Brech-Punkt-Ampulle:
Aufgrund der vorgeritzten Kerbe unterhalb des farbigen Punktes der Ampulle ist es nicht erforderlich, den Ampullenhals zu feilen. Vor dem Öffnen der Ampulle ist sicherzustellen, dass die gesamte Lösung aus dem oberen Teil der Ampulle in den unteren Teil geflossen ist. Beide Hände sind zum Öffnen zu benutzen; während der untere Teil der Ampulle von einer Hand gehalten wird, bricht die andere Hand den oberen Teil der Ampulle entgegen der Punktrichtung ab.
Durchstechflasche
Die Durchstechflasche ist nur zur Einmalentnahme bestimmt.
7. INHABER DER ZULASSUNG
Jenapharm GmbH & Co. KG Otto-Schott-Straße 15 07745 Jena Tel.: 03641 648888 Fax: 03641 648889
E-Mail: maennergesundheit@j enapharm .de
Mitvertrieb1:
Bayer Vital GmbH
51368 Leverkusen
Telefon: (0214) 30-5 13 48
Telefax: (0214) 30-5 16 03
E-Mail: maennergesundheit@bayerhealthcare.com
8. ZULASSUNGSNUMMER(N) 60074.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER
ZULASSUNG
Datum der Erteilung der Zulassung: 29. September 2004 Datum der Verlängerung der Zulassung: 08. Januar 2009
10. STAND DER INFORMATION
Dezember 2014
11. VERKAUFSABGRENZUNG V erschreibungspflichtig
12
Angabe des Mitvertriebs je nach Charge