Nifeclair 20 Mg Retard Retardtabletten
alt informationenHENNIG ARZNEIMITTEL Nifeclair 20 mg retard Retardtabletten
Module 1.3.1.2
SPC - National Version
Wortlaut der für die Fachinformation vorgesehenen Angaben
Zusammenfassung der Merkmale des Arzneimittels/SPC
1. Bezeichnung des Arzneimittels
Nifeclair 20 mg retard Retardtabletten
2. Qualitative und quantitative Zusammensetzung
Wirkstoff: Nifedipin
1 Retardtablette enthält 20 mg Nifedipin.
Sonstiger Bestandteil: Lactose
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1
3. Darreichungsform
Retardtablette
Rosa, oblonge Retardtabletten mit beidseitiger Bruchrille Die Retardtablette kann in gleiche Hälften geteilt werden.
4. Klinische Angaben
4.1 Anwendungsgebiete
- Chronisch stabile Angina pectoris
- Vasospastische Angina pectoris (Prinzmetal-Angina, Variant-Angina)
- Essenzielle Hypertonie.
Module 1.3.1.2 SPC - National Version
4.2 Dosierung, Art und Dauer der Anwendung
Die Behandlung sollte möglichst individuell nach dem Schweregrad der Erkrankung und dem Ansprechen des Patienten durchgeführt werden.
In Abhängigkeit vom jeweiligen Krankheitsbild sollte die Richtdosis einschleichend erreicht werden.
Patienten mit eingeschränkter Leberfunktion sollten sorgfältig überwacht werden; ggf. kann eine Dosisreduktion notwendig sein.
Patienten mit schwerer cerebrovaskulärer Erkrankung sollten mit einer niedrigen Dosis behandelt werden.
Chronisch stabile Angina pectoris
2-mal täglich 1Retardtablette Nifedipin 20 mg.
Bei Bedarf kann die Dosis auf 2-mal täglich 40 mg Nifedipin erhöht werden.
Vasospastische Angina pectoris (Prinzmetal-Angina, Variant-Angina)
2-mal täglich 1 Retardtablette Nifedipin 20 mg.
Bei Bedarf kann die Dosis auf 2-mal täglich 40 mg Nifedipin erhöht werden.
Essenzielle Hypertonie
2-mal täglich 1 Retardtablette Nifedipin 20 mg.
Bei Bedarf kann die Dosis auf 2-mal täglich 40 mg Nifedipin erhöht werden.
Nifedipin wird nach den Mahlzeiten unzerkaut mit ausreichend Flüssigkeit (z. B. 1 Glas Wasser, kein Grapefruitsaft!), am Besten morgens und abends, möglichst immer zur selben Uhrzeit, eingenommen.
Wegen der Lichtempfindlichkeit des Wirkstoffes Nifedipin sollen die Retardtabletten nicht geteilt werden, da sonst der durch die Lackierung erreichte Lichtschutz nicht immer gewährleistet ist.
Gleichzeitige Nahrungsaufnahme kann zu einer verzögerten, jedoch nicht verminderten Resoption führen.
Das Absetzen von Nifedipin - insbesondere bei hoher Dosierung - sollte schrittweise erfolgen.
Module 1.3.1.2 SPC - National Version
4.3 Gegenanzeigen
Nifedipin darf nicht angewendet werden bei:
- Überempfindlichkeit (Allergie) gegen den Wirkstoff Nifedipin oder einen der sonstigen Bestandteile
- Herz-Kreislauf-Schock
- höhergradiger Aortenstenose
- instabiler Angina pectoris
- akutem Myokardinfarkt (innerhalb der ersten 4 Wochen)
- gleichzeitiger Anwendung mit Rifampicin (siehe Abschnitt 4.5)
- Schwangerschaft und Stillzeit (siehe Abschnitt 4.6).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Eine besonders sorgfältige ärztliche Überwachung ist erforderlich bei:
- schwerer Hypotension mit weniger als 90 mmHg systolisch
- dekompensierter Herzinsuffizienz.
- Dialysepatienten mit maligner Hypertonie und Hypovolämie (ein deutlicher Blutdruckabfall kann entstehen).
Die spektrophotometrische Bestimmung von Vanillinmandelsäure im Urin kann unter Nifedipin zu falsch erhöhten Werten führen; die Bestimmung mittels HPLC bleibt unbeeinflusst.
In Einzelfällen von in-vitro-Fertilisation wurden Calciumantagonisten wie Nifedipin mit reversiblen biochemischen Veränderungen in der Kopfregion von Spermatozoen in Verbindung gebracht, die zu einer Beeinträchtigung der Spermienfunktion führen können. In Fällen, bei denen wiederholte in-vitro-Fertilisationen erfolglos blieben, ohne dass eine andere Erklärung dafür gefunden werden kann, sollten Calciumantagonisten wie Nifedipin als mögliche Ursache in Betracht gezogen werden.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Nifeclair 20 mg retard Retardtabletten nicht einnehmen.
Module 1.3.1.2 SPC - National Version
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Folgende Wechselwirkungen dieser Arzneimittel müssen beachtet werden:
Antihypertensiva, trizyklische Antidepressiva, Vasodilatatoren Verstärkung des blutdrucksenkenden Effekts.
Betarezeptorenblocker
Verstärkte Blutdrucksenkung und gelegentlich Auftreten einer Herzinsuffizienz.
Diltiazem
Diltiazem vermindert den Abbau von Nifedipin, evtl Dosisreduktion von Nifedipin.
Chinidin
Abfall des Chinidin-Plasmaspiegels bzw. nach Absetzen von Nifedipin deutlicher Anstieg des Chinidin-Plasmaspiegels.
Digoxin, Theophyllin
Erhöhung des Digoxin- und Theophyllin-Plasmaspiegels (auf Symptome einer Digoxin-Überdosierung achten, evtl. nach Bestimmung der Digoxin Plasmaspiegels Reduktion der Glykosiddosis).
Quinupristin, Dalfopristin, Cimetidin Erhöhung des Nifedipin Plasmaspiegels.
Rifampicin
Aufgrund seiner enzyminduzierenden Wirkung beschleunigt Rifampicin die Metabolisierung von Nifedipin. Es werden keine wirksamen Blutspiegel von Nifedipin erreicht.
Vincristin
Verminderung der Ausscheidung von Vincristin, Dosisreduktion.
Cephalosporine
Erhöhung der Cephalosporin-Plasmaspiegel.
Phenytoin
Wirkungsabschwächung von Nifedipin, evtl. Dosiserhöhung.
Tacrolimus
Erhöhung der Tacrolimus-Plasmaspiegels.
Module 1.3.1.2 SPC - National Version
Wechselwirkungen aufgrund von Cytochrom P450 Isoenzym 3A4
Nifedipin wird über das Cytochrom P450 3A4-System metabolisiert. Daher kann die gleichzeitige Anwendung von Arzneimitteln, die dieses System induzieren oder hemmen, grundsätzlich zu Wechselwirkungen dieser Arzneimittel mit Nifedipin führen.
Inhibitoren des Cytochrom P450 3A4 Systems wie Makrolide (z. B. Erythromycin), Fluoxetin, Nefazodon, Protease-Inhibitoren (z. B. Amprenavir, Indinavir, Nelfinavir, Ritonavir oder Saquinavir), Antimykotika (Ketoconazol, Itraconazol oder Fluconazol)
Erhöhung der Nifedipin-Plasmaspiegels.
Nach Erfahrungen mit dem Calciumantagonisten Nimodipin können folgende Wechselwirkungen mit Nifedipin nicht ausgeschlossen werden:
Carbamazepin, Phenobarbital Abnahme des Nifedipin-Plasmaspiegels.
Valproinsäure
Erhöhung des Nifedipin-Plasmaspiegels.
Grapefruitsaft hemmt den oxidativen Abbau von Nifedipin, so dass erhöhte NifedipinPlasmaspiegel auftreten können.
4.6 Schwangerschaft und Stillzeit
Es liegen keine hinreichenden Daten für die Anwendung von Nifedipin, insbesondere im ersten Trimester der Schwangerschaft, vor. Da tierexperimentelle Studien Hinweise auf teratogene Effekte ergeben haben (siehe Abschnitt 5.3), darf Nifedipin in der Schwangerschaft nur bei vitaler Indikation und wenn keine Alternativtherapie zur Verfügung steht, angewendet werden. Dabei sind Mutter und Kind sorgfältig zu überwachen. Sollte es zu einer Exposition während des ersten Trimesters gekommen sein, sollte der Schwangeren eine Ultraschallfeindiagnostik angeboten werden.
Während der Stillzeit darf Nifedipin nicht angewendet werden, da der Wirkstoff aus Nifedipin in die Muttermilch übergeht und nur unzureichende Erfahrungen mit einer Anwendung in der Stillperiode vorliegen. Ist eine Behandlung mit Nifedipin während der Stillzeit zwingend erforderlich, muss abgestillt werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Die Behandlung mit diesem Arzneimittel bedarf der regelmäßigen ärztlichen Kontrolle. Durch individuell auftretende unterschiedliche Reaktionen kann das Reaktionsvermögen so weit verändert sein, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr, zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt wird. Dies gilt in verstärktem Maße bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenwirken mit Alkohol.
C o n f i d e n t i a l Page 1.3.1.2 - 5
spcde-nif20r-aend-060109.pdf
Module 1.3.1.2 SPC - National Version
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (<1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) Erkrankungen des Blutes und des Lymphsystems
Selten: Blutbildveränderungen wie Anämie, Leukopenie, Thrombozytopenie,
thrombozytopenische Purpura.
Sehr selten: Agranulozytose.
Stoffwechsel- und Ernährungsstörungen Selten: Hyperglykämie.
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen insbesondere zu Beginn der Behandlung.
Häufig: Schwindel, Benommenheit, Schwächegefühl.
Gelegentlich: Nervosität, Schlafstörungen oder Schläfrigkeit, Parästhesien, Hypästhesien, Tremor.
Augenerkrankungen
Gelegentlich: Geringfügige, vorübergehende Änderung der optischen Wahrnehmung.
Selten: Schwachsichtigkeit.
Herzerkrankungen Häufig: Palpitationen.
Gelegentlich: Tachykardie, Synkopen, hypotone Kreislaufreaktion.
Insbesondere zu Beginn der Behandlung kann es zum Auftreten von Angina-pectoris-Anfällen bzw. bei Patienten mit bestender Angina pectoris zu einer Zunahme von Häufigkeit, Dauer und Schweregrad der Anfälle kommen.
Sehr selten: Myokardinfarkt.
Module 1.3.1.2 SPC - National Version
Gefäßerkrankungen
Sehr häufig: Periphere Ödeme (aufgrund der Vasodilatation) insbesondere zu Beginn der Behandlung.
Erkrankungen der Atemwege, des Brustraums und Mediastinums Gelegentlich: Dyspnoe.
Erkrankungen des Gastrointestinaltrakts Häufig: Übelkeit.
Gelegentlich: Magen-Darm-Störungen wie Dyspepsie, Diarrhö, Bauschmerzen, Obstipation, Blähungen, Erbrechen, Mundtrockenheit.
Selten: Völlegefühl, Aufstoßen und Anorexie.
Leber- und Gallenerkrankungen
Gelegentlich: Leberfunktionsstörungen (intrahepatische Cholestase, Transaminasen-anstiege).
Selten: Ikterus.
Erkrankungen der Haut und des Unterhautzellgewebes:
Häufig:
Gelegentlich:
Selten:
Sehr selten:
Flush, Erythem, Erythromelalgie insbesondere zu Beginn der Behandlung. Hautüberempfindlichkeitsreaktionen wie Pruritus, Exanthem, eine Schwellung von Haut und Schleimhaut (Angioödem, Gesichtsödem), Schwitzen.
Urtikaria, Photodermatitis, Purpura.
Unter längerer Behandlung mit Nifedipin kann es zu
Zahnfleischveränderungen (z. B. Gingiva-Hyperplasie) kommen, die sich nach Absetzen der Therapie völlig zurückbilden.
Exfoliative Dermatitis.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen Gelegentlich: Myalgien, Arthralgien, Muskelkrämpfe.
Erkrankungen der Nieren und Harnwege:
Gelegentlich: Bei Niereninsuffizienz vorübergehende Verschlechterung der Nierenfunktion. Vermehrter Harndrang sowie eine vermehrte tägliche Urinausscheidung.
Erkrankungen der Geschlechtsorgane und Brustdrüse
Selten: Gynäkomastie, die nach Absetzen von Nifedipin reversibel ist.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Gelegentlich: Müdigkeit, Unwohlsein.
Selten: allergische Allgemeinreaktionen wie z. B. Fieber, Schwellung des Kehlkopfes
(Kehlkopfödem), Krampfzustand der Bronchialmuskulatur bis hin zu lebensbedrohlicher Atemnot, die nach Absetzen der Therapie reversibel sind.
Module 1.3.1.2 SPC - National Version
4.9 Überdosierung
Symptome der Intoxikation
Folgende Symptome werden bei einer schweren Vergiftung mit Nifedipin beobachtet:
Bewusstseinseintrübung bis zum Koma, Blutdruckabfall, tachykarde/bradykarde Herzrhythmusstörungen, Hyperglykämie, metabolische Azidose, Hypoxie, kardiogener Schock mit Lungenödem.
Therapie von Intoxikationen
Therapeutisch stehen die Giftelimination und die Wiederherstellung stabiler Herz-KreislaufVerhältnisse im Vordergrund.
Nach oraler Ingestion ist eine ausgiebige Magenspülung - evtl. in Kombination mit einer Dünndarmspülung - indiziert.
lnsbesondere bei einer Vergiftung mit Retard-Präparaten ist eine möglichst vollständige Elimination, auch aus dem Dünndarm anzustreben, um die sonst unvermeidliche Nachresorption der Wirksubstanz zu verhindern.
Bei der Gabe von Laxantien ist allerdings die Hemmung der Darmmuskulatur bis zur Darmatonie unter Calciumantagonisten zu beachten. Nifedipin ist nicht dialysierbar; eine Plasmapherese (hohe Plasmaeiweißbindung, relativ kleines Verteilungsvolumen) wird jedoch empfohlen.
Bradykarde Herzrhythmusstörungen werden symptomatisch mit Atropin und/oder Beta-Sympathikomimetika behandelt, bei bedrohlichen bradykarden Herzrhythmusstörungen ist eine temporäre Schrittmachertherapie erforderlich.
Die Hypotonie als Folge von kardiogenem Schock und arterieller Vasodilatation wird mit Calcium (1-2 g Calciumgluconat intravenös), Dopamin (bis 25 ^g je kg Körpergewicht je Minute), Dobutamin (bis 15 ^g je kg Körpergewicht je Minute), Epinephrin bzw. Norepinephrin behandelt. Die Dosierung dieser Medikamente orientiert sich allein an der erzielten Wirkung. Der Serum-Calciumspiegel sollte hochnormal bis leicht erhöht sein.
Die zusätzliche Flüssigkeits- oder Volumenzufuhr sollte zurückhaltend und wegen der drohenden kardialen Überlastung unter hämodynamischer Kontrolle erfolgen.
Module 1.3.1.2 SPC - National Version
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: 1,4-Dihydropyridin-Derivat, Calciumantagonist
ATC-Code: C08CA05
Nifedipin ist ein Calciumantagonist vom 1,4-Dihydropyridintyp. Calciumantagonisten hemmen den Calciumionen-Einstrom durch den langsamen Calciumkanal in der Zelle. Nifedipin wirkt vor allem an den glatten Muskelzellen der Koronararterien und an den peripheren Widerstandsgefäßen. Dieser Effekt hat eine Vasodilatation zur Folge. In therapeutischen Dosen hat Nifedipin praktisch keine direkte Wirkung auf das Myokard.
Am Herzen erweitert Nifedipin vor allem die großen Koronararterien durch Erniedrigung des Muskeltonus, wodurch die Durchblutung verbessert werden kann. Der periphere Widerstand wird gesenkt.
Zu Beginn der Behandlung mit dem Calciumantagonisten kann es reflektorisch zu einer Zunahme der Herzfrequenz und des Herzminutenvolumens kommen. Diese Zunahme ist jedoch nicht ausgeprägt genug, um die Vasodilatation zu kompensieren.
Bei Langzeitbehandlung mit Nifedipin kehrt das anfangs erhöhte Herzminutenvolumen wieder auf den Ausgangswert zurück. Eine besonders deutliche Blutdruckabnahme nach Nifedipin ist beim Hypertoniker zu beobachten.
5.2 Pharmakokinetische Eigenschaften
5.2.1 Allgemeine Pharmakokinetik
Der Wirkstoff Nifedipin wird nach peroraler Nüchterneinnahme rasch und nahezu vollständig resorbiert. Nifedipin unterliegt einem "First-pass-Effekt" in der Leber, so dass die systemische Verfügbarkeit oral verabreichten Nifedipins bei 50-70% liegt. Maximale Plasma- bzw. Serumkonzentrationen werden bei Gabe einer Nifedipin-haltigen Lösung nach ca. 15 Minuten, bei Gabe anderer Zubereitungen mit nicht retardierter Freisetzung nach 30 bis 85 Minuten erreicht.
Nifedipin wird zu ca. 95-98% an Plasmaeiweiß (Albumin) gebunden. Für Nifedipin wurde ein mittleres Verteilungsvolumen VSS von 0,77-1,12 l/kg gefunden.
Nifedipin wird in der Leber nahezu vollständig (hoher "First-pass-Effekt") vor allem über oxidative Prozesse metabolisiert. Diese Metaboliten zeigen keine pharmakodynamischen Aktivitäten. Weder die unveränderte Substanz noch der Metabolit M-1 werden in nennenswertem Maße renal eliminiert (< 0,1% der Dosis). Die polaren Metaboliten M-2 und M-3 werden zu etwa 50% der Dosis im Urin gefunden (zum Teil in konjugierter Form), wobei der überwiegende Teil innerhalb von 24 Stunden ausgeschieden wird. Der Rest wird mit den Faeces ausgeschieden.
Die Eliminationshalbwertszeit liegt bei 1,7-3,4 Stunden (nicht retardierte Zubereitung).
C o n f i d e n t i a l Page 1.3.1.2 - 9
Module 1.3.1.2 SPC - National Version
Eine Kumulation der Substanz bei Dauertherapie nach üblicher Dosierung wurde nicht beschrieben.
Bei eingeschränkter Leberfunktion kommt es zu einer deutlichen Verlängerung der Eliminationshalbwertszeit und zu einer Verminderung der Gesamt-Clearance. Eine Dosisreduzierung kann gegebenenfalls erforderlich sein.
5.2.2 Bioverfügbarkeit
Eine im Jahr 1991 durchgeführte Bioverfügbarkeitsuntersuchung an 24 Probanden ergab im Vergleich zum Referenzpräparat:
Testpräparat/ Referenzpräparat
Nifeclair® 20 mg retard Retardtabletten
maximale Plasmakonzentration
Css, max (ng/ml): 36,3 ± 12,1 39,8 ± 15,9
Peak-through-
Fluctuation
PTF (%): 182,1 ± 40,3 204,6 ± 66,7
Fläche unter der KonzentrationsZeit-Kurve
AUCss, 0 - t (ng/ml-h): 196,9 ± 80,4 208,4 ± 96,2
Angabe der Werte als Mittelwert und Streubreite
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm (siehe Abbildung):
Module 1.3.1.2 SPC - National Version
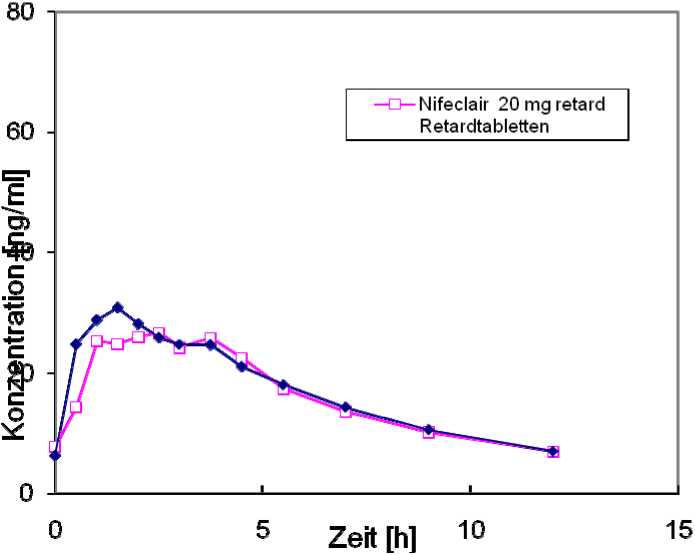
Studienergebnis:
Bioäquivalenz zwischen Test- und Referenzpräparat
5.3 Präklinische Daten zur Sicherheit
In-vivo- und In-vitro-Untersuchungen zur Mutagenität verliefen negativ, so dass eine mutagene Wirkung im Menschen hinreichend sicher ausgeschlossen werden kann.
Eine Langzeituntersuchung (2 Jahre) an der Ratte ergab keine Hinweise auf tumorerzeugende Effekte von Nifedipin.
Experimentelle Studien haben bei drei Tierspezies (Ratte, Kaninchen, Maus) Hinweise auf teratogene Effekte (Gaumenspalten, kardiovaskuläre und digitale Anomalien) ergeben. Die Behandlung von Affen führte zu kleinen Plazenten und einer Unterentwicklung der Chorionzotten. Hypoxien und Azidosen wurden bei dieser Tierart ebenfalls beobachtet.
Module 1.3.1.2 SPC - National Version
6. Pharmazeutische Angaben 6.1 Liste der sonstigen Bestandteile
Mikrokristalline Cellulose, Maisstärke, Lactose-Monohydrat, Polysorbat 80, Magnesiumstearat (Ph.Eur.), Hypromellose, Macrogol (6000), Talkum, Farbstoffe E 171 und E 172
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Den Blister im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen. Nicht über 25 °C lagern.
6.5 Art und Inhalt des Behältnisses
Originalpackungen mit 50 Retardtabletten (N2)
100 Retardtabletten (N3)
"Unverkäufliches Muster“ mit 20 Retardtabletten.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
HENNIG ARZNEIMITTEL GmbH & Co. KG
Liebigstraße 1-2
65439 Flörsheim am Main
Telefon: (06145) 508-0
Telefax: (06145) 508-140
Module 1.3.1.2 SPC - National Version
8. Zulassungsnummer
11126.00.00
9. Datum der Erteilung der Zulassung / Verlängerung der Zulassung
Datum der Zulassung: 23.02.1990
Datum der Verlängerung der Zulassung: 09.02.2001
10. Stand der Information
Januar 2009
11. Verkaufsabgrenzung
Verschreibungspflichtig
C o n f i d e n t i a l Page 1.3.1.2 - 13
spcde-nif20r-aend-060109.pdf