Nimbex 5Mg
22.08.2014
Wortlaut der für die Fachinformation vorgesehenen Angaben
1. BEZEICHNUNG DER ARZNEIMITTEL
NIMBEX® 5 mg Injektions-/Infusionslösung NIMBEX® 10 mg Injektions-/Infusionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Cisatracurium 2 mg/ml (entsprechend Cisatracuriumbesilat 2,68 mg/ml)
NIMBEX 5 mg Injektions-/Infusionslösung:
1 Ampulle mit 2,5 ml Injektions-/Infusionslösung enthält 5 mg Cisatracurium (entsprechend 6,7 mg Cisatracuriumbesilat)
NIMBEX 10 mg Injektions-/Infusionslösung:
1 Ampulle mit 5 ml Injektions-/Infusionslösung enthält 10 mg Cisatracurium (entsprechend 13,4 mg Cisatracuriumbesilat)
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Inj ektions-/Infusionslösung.
Die Lösung ist farblos bis schwach gelb oder grünlich-gelb und praktisch frei von sichtbaren Teilchen.
4. KLINISCHE ANGABEN
Nimbex ist ein nicht-depolarisierendes Muskelrelaxans von mittlerer Wirkdauer zur intravenösen Anwendung.
4.1 Anwendungsgebiete
Nimbex ist indiziert bei operativen und anderen Eingriffen bei Erwachsenen und Kindern ab einem Alter von 1 Monat. Nimbex ist auch indiziert zur Anwendung bei Erwachsenen während Intensivtherapie.
Nimbex kann als Zusatz bei Allgemeinanästhesie oder im Rahmen der Sedierung im intensivmedizinischen Bereich zur Relaxierung der Muskulatur sowie zur Erleichterung der endotrachealen Intubation und der künstlichen Beatmung angewendet werden.
4.2 Dosierung und Art der Anwendung
Nimbex sollte nur von einem Anästhesisten oder unter Aufsicht eines Anästhesisten oder eines anderen Arztes, der mit der Anwendung und Wirkung von Muskelrelaxanzien vertraut ist, verabreicht werden. Die Möglichkeiten zur endotrachealen Intubation, zum Erhalt der Lungenventilation und zur angemessenen arteriellen Oxygenierung müssen zur Verfügung stehen.
Bitte beachten Sie, dass Nimbex weder mit Propofol-Injektionsemulsion noch mit alkalischen Lösungen wie Thiopental-Natrium in derselben Spritze oder gleichzeitig durch dieselbe Nadel verabreicht werden sollte (siehe Abschnitt 6.2).
Nimbex enthält keine Konservierungsmittel und ist daher nur zum Einmalgebrauch indiziert. Hinweis zur Überwachung der Patienten
Wie bei anderen Muskelrelaxanzien wird auch bei der Verwendung von Nimbex eine Überwachung der neuromuskulären Funktion empfohlen, um eine individuelle Dosisanpassung zu gewährleisten.
Anwendung durch intravenöse Bolusinjektion
Dosierung bei Erwachsenen Endotracheale Intubation:
Die empfohlene Dosis Nimbex zur Intubation von Erwachsenen beträgt 0,15 mg/kg KG (KG = Körpergewicht). Bei dieser Dosierung lässt sich die endotracheale Intubation 120 Sekunden nach der Verabreichung von Nimbex gut vornehmen, wenn die Anästhesie mit Propofol eingeleitet wurde.
Höhere Dosen verkürzen die Zeit bis zum Einsetzen der neuromuskulären Blockade.
Tabelle 1 fasst die mittleren pharmakodynamischen Daten zusammen, die bei der Anwendung von Nimbex in Dosen von 0,1 bis 0,4 mg/kg KG bei gesunden erwachsenen Patienten während einer Opioid- (Thiopental/Fentanyl/Midazolam) oder Propofol-Anästhesie gewonnen wurden.
abelle 1: Pharmakodynamische Mittelwerte nach verschiedenen Cisatracurium-Dosen
|
Initialdosis Nimbex |
Art der Anästhesie |
Zeitspanne bis zu einer 90 %igen T1*-Suppression |
Zeitspanne bis zu einer maximalen T1*-Suppression |
Zeitspanne bis zu einer 25 %igen T1*-Spontanerholung |
|
mg/kg KG |
(Minuten) |
(Minuten) |
(Minuten) | |
|
0,1 |
Opioid |
3,4 |
4,8 |
45 |
|
0,15 |
Propofol |
2,6 |
3,5 |
55 |
|
0,2 |
Opioid |
2,4 |
2,9 |
65 |
|
0,4 |
Opioid |
1,5 |
1,9 |
91 |
*T1 Einzelne Zuckung des Daumenadduktors bzw. die erste Zuckung eines Vierfachreizes ("Train-of-four") als Antwort auf eine supramaximale elektrische Stimulation des Nervus ulnaris.
Bei einer Enfluran- oder Isofluran-Anästhesie kann die Wirkdauer einer Anfangsdosis Nimbex bis zu 15% verlängert sein.
Erhaltung der Relaxation:
Die neuromuskuläre Blockade kann durch wiederholte Gaben von Nimbex verlängert werden. Eine Dosis von 0,03 mg/kg KG verlängert die neuromuskuläre Blockade während einer Opioid- oder Propofol-Anästhesie um ca. 20 Minuten.
Aufeinanderfolgende Erhaltungsdosen haben keinen kumulativen Effekt auf die neuromuskuläre Blockade.
Sobald sich erste Anzeichen einer Aufhebung der neuromuskulären Blockade bemerkbar machen, ist die Zeitspanne bis zur vollständigen Erholung unabhängig von der verabreichten Nimbex-Dosis. Während einer Opioid- oder Propofol-Anästhesie betragen die durchschnittlichen Zeiten von einer 25 %igen bis zu einer 75 %igen Erholung bzw. von einer 5 %igen bis zu einer 95 %igen Erholung ca. 13 bzw. 30 Minuten.
Aufhebung der neuromuskulären Blockade:
Die neuromuskuläre Blockade nach der Verabreichung von Nimbex kann durch übliche Dosen von Cholinesterase-Hemmstoffen vollständig aufgehoben werden. Die mittleren Zeiten von einer 25 %igen bis zu einer 75 %igen Erholung bzw. bis zur vollständigen klinischen Erholung (T4:T1-Verhältnis > 0,7) betragen ca. 4 bzw. 9 Minuten nach Verabreichung des Antidots bei einer durchschnittlichen T1-Erholung von 10 %.
Dosierung bei Kindern
Endotracheale Intubation bei Kindern im Alter von 1 Monat bis 12 Jahren:
Wie bei Erwachsenen beträgt die empfohlene Intubationsdosis von Nimbex 0,15 mg/kg KG, die schnell über 5 bis 10 Sekunden verabreicht werden soll. 120 Sekunden nach der Verabreichung dieser Dosis lässt sich die endotracheale Intubation gut vornehmen. Pharmakodynamische Daten für diese Dosierung werden in den Tabellen 2, 3 und 4 aufgeführt.
Nimbex wurde nicht bei Intubationen von Kindern der ASA-Klassen III und IV untersucht.
Zur Anwendung bei Kindern unter 2 Jahren bei lang andauernden oder großen operativen Eingriffen liegen nur begrenzte Daten vor.
Nimbex hat bei Kindern im Alter von 1 Monat bis 12 Jahren eine kürzere klinische Wirkungsdauer und ein schnelleres Spontanerholungsprofil als bei Erwachsenen unter ähnlichen Anästhesiebedingungen. Geringe Unterschiede im pharmakodynamischen Profil wurden in der Altersgruppe von 1 bis 11 Monaten und 1 bis 12 Jahren beobachtet, die in den Tabellen 2 und 3 zusammengefasst werden.
Tabelle 2: Säuglinge im Alter von 1 bis 11 Monaten
|
Initialdosis Nimbex |
Art der Anästhesi e |
Zeitspanne bis zu einer 90 %igen T1*-Suppression |
Zeitspanne bis zu einer maximalen T1*- Suppression |
Zeitspanne bis zu einer 25 %igen T1*-Spontanerholung |
|
mg/kg KG |
(Minuten) |
(Minuten) |
(Minuten) | |
|
0,15 |
Halothan |
1,4 |
2,0 |
52 |
|
0,15 |
Opioid |
1,4 |
1,9 |
47 |
Tabelle 3: Kleinkinder und Kinder im Alter von 1 bis 12 Jahren
|
Initialdosis |
Art |
Zeitspanne bis zu |
Zeitspanne bis zu |
Zeitspanne bis zu |
|
Nimbex |
der |
einer 90 %igen |
einer maximalen |
einer 25 %igen |
|
Anästhesie |
T1*- Suppression |
T1*-Suppression |
T1*- Spontanerholung | |
|
mg/kg KG |
(Minuten) |
(Minuten) |
(Minuten) | |
|
0,15 |
Halothan |
2,3 |
3,0 |
43 |
|
0,15 |
Opioid |
2,6 |
3,6 |
38 |
Wenn Nimbex nicht zur Intubation erforderlich ist: Eine Dosis von weniger als 0,15 mg/kg KG kann verabreicht werden. Pharmakodynamische Daten für Dosen von 0,08 und 0,1 mg/kg KG bei Kindern von 2 bis 12 Jahren sind in Tabelle 4 zusammengefasst.
Tabelle 4: Kinder im Alter von 2 bis 12 Jahren
|
Initialdosis |
Art |
Zeitspanne bis zu |
Zeitspanne bis zu |
Zeitspanne bis zu |
|
Nimbex |
der |
einer 90 %igen |
einer maximalen |
einer 25 %igen |
|
mg/kg KG |
Anästhesie |
T1*- Suppression (Minuten) |
T1*-Suppression (Minuten) |
T1*- Spontanerholung (Minuten) |
|
0,08 |
Halothan |
1,7 |
2,5 |
31 |
|
0,1 |
Opioid |
1,7 |
2,8 |
28 |
*T1 Einzelne Zuckung des Daumenadduktors bzw. die erste Zuckung eines Vierfachreizes ("Train-of-four") als Antwort auf eine supramaximale elektrische Stimulation des Nervus ulnaris.
Die Verabreichung von Nimbex nach einer Succhinylcholin-Gabe wurde bei Kindern bisher nicht untersucht (siehe Abschnitt 4.5).
Es besteht die Möglichkeit, dass Halothan die klinische Wirkungsdauer einer Nimbex-Dosis um bis zu 20 % verlängert. Es liegen keine Erkenntnisse zur Verwendung von Nimbex bei Kindern während einer Anästhesie mit anderen halogenierten Fluorkohlenwasserstoff-Anästhetika vor. Es kann aber davon ausgegangen werden, dass auch diese Substanzen die effektive klinische Wirkungsdauer von Nimbex verlängern.
Erhaltung der Relaxation bei Kindern im Alter von 2 bis 12 Jahren:
Die neuromuskuläre Blockade kann durch wiederholte Gaben von Nimbex verlängert werden. Bei Kindern im Alter von 2 bis 12 Jahren verlängert eine Dosis von 0,02 mg/kg KG die klinisch effektive neuromuskuläre Blockade während einer Halothan-Anästhesie um ca. 9 weitere Minuten. Aufeinanderfolgende Erhaltungsdosen haben keinen kumulativen Effekt auf die neuromuskuläre Blockade.
Für Kinder unter 2 Jahren sind keine ausreichenden Daten für eine entsprechende Empfehlung zur Erhaltungsdosis vorhanden. Es liegen jedoch sehr begrenzte Daten aus klinischen Studien bei Kindern unter 2 Jahren vor, die darauf schließen lassen, dass eine Erhaltungsdosis von 0,03 mg/kg KG die klinisch effektive neuromuskuläre Blockade möglicherweise um eine Dauer von bis zu 25 Minuten während einer Opioid-Anästhesie verlängert.
Spontanerholung:
Sobald sich erste Anzeichen einer Aufhebung der neuromuskulären Blockade bemerkbar machen, ist die Zeitspanne bis zur vollständigen Erholung unabhängig von der verabreichten Nimbex-Dosis. Während einer Opioid- oder Halothan-Anästhesie beträgt die durchschnittliche Dauer von einer 25 %igen bis zu einer 75 %igen Erholung bzw. von einer 5 %igen bis zu einer 95 %igen Erholung ca. 11 bzw. 28 Minuten.
Aufhebung der Blockade:
Die neuromuskuläre Blockade nach der Verabreichung von Nimbex kann durch Gabe der üblichen Dosen von Cholinesterase-Hemmstoffen vollständig aufgehoben werden. Die mittlere Zeit von einer 25 %igen bis zu einer 75 %igen Erholung bzw. bis zur vollständigen klinischen Erholung (T4:Tj-Verhältnis > 0,7) beträgt ca. 2 bzw. 5 Minuten nach Verabreichung des Antagonisten bei einer durchschnittlichen Tj-Erholung von 13 %.
Anwendung durch intravenöse Infusion
Dosierung bei Erwachsenen und Kindern im Alter von 2 bis 12 Jahren
Die neuromuskuläre Blockade kann durch Infusion von Nimbex aufrechterhalten werden. Nach den ersten Anzeichen einer Spontanerholung wird eine anfängliche Infusionsrate von 3 ^g/kg KG/min (0,18 mg/kg KG/h) empfohlen, um eine 89 %ige bis 99 %ige Tj-Unterdrückung zu erzielen. Nach der anfänglichen Stabilisierungsphase der neuromuskulären Blockade sollte eine Infusionsrate von 1 bis 2 ^g/kg KG/min (0,06 bis 0,12 mg/kg KG/h) ausreichen, um die neuromuskuläre Blockade in diesem Bereich bei den meisten Patienten aufrechtzuerhalten.
Bei Anwendung während einer Isofluran- oder Enfluran-Anästhesie kann eine Reduktion der Infusionsrate um bis zu 40 % erforderlich sein (siehe Abschnitt 4.5).
Die Infusionsrate hängt von der Konzentration von Cisatracurium in der Infusionslösung, dem gewünschten Grad der neuromuskulären Blockade und dem Gewicht des Patienten ab. Tabelle 5 enthält Richtlinien für die Infusion der unverdünnten Nimbex-Lösung.
Tabelle 5: Infusionsrate für Nimbex Injektions-/Infusionslösung (2 mg/ml)
|
Gewicht des Patienten (kg) |
Infusionsrate bei Dosen (^g/kg/min) von | |||
|
1,0 |
1,5 |
2,0 |
3,0 | |
|
20 |
0,6 ml/h |
0,9 ml/h |
1,2 ml/h |
1,8 ml/h |
|
70 |
2,1 ml/h |
3,2 ml/h |
4,2 ml/h |
6,3 ml/h |
|
100 |
3,0 ml/h |
4,5 ml/h |
6,0 ml/h |
9,0 ml/h |
Eine kontinuierliche Infusion mit konstanter Infusionsrate von Nimbex ist nicht mit einer progressiven Zu- oder Abnahme der neuromuskulären Blockade verbunden.
Nach der Beendigung der Infusion von Nimbex ist die Zeitspanne bis zur Spontanerholung von der neuromuskulären Blockade vergleichbar mit der nach einer einzelnen Bolusinjektion.
Dosierung bei Neugeborenen (unter 1 Monat)
Die Anwendung von Nimbex bei Neugeborenen wird nicht empfohlen, da Nimbex bei dieser Patientengruppe nicht untersucht wurde.
Dosierung bei älteren Patienten
Eine Änderung der Dosierung ist bei älteren Patienten nicht nötig. Bei diesen Patienten wird ein ähnliches pharmakodynamisches Profil wie bei jungen erwachsenen Patienten beobachtet, aber - wie bei anderen Muskelrelaxanzien - ist ein leicht verzögerter Wirkungseintritt möglich.
Dosierung bei Patienten mit eingeschränkter Nieren funktion
Eine Änderung der Dosierung ist bei Patienten mit eingeschränkter Nierenfunktion nicht notwendig. Nimbex weist bei diesen Patienten ein ähnliches pharmakodynamisches Profil auf wie bei Patienten mit normaler Nierenfunktion, wobei der Wirkungseintritt möglicherweise leicht verzögert ist.
Dosierung bei Patienten mit eingeschränkter Leberfunktion
Änderungen der Dosierung bei Patienten im Endstadium einer Leberinsuffizienz sind nicht notwendig. Nimbex weist bei diesen Patienten ein ähnliches pharmakodynamisches Profil auf wie bei Patienten mit normaler Leberfunktion, wobei ein leicht beschleunigter Wirkungseintritt möglich ist.
Wenn Nimbex erwachsenen Patienten mit schweren kardiovaskulären Erkrankungen (New York Heart Association (NYHA)-Klasse I-III), die sich einer koronararteriellen Bypass-Operation unterziehen, als schnelle Bolusinjektion (über 5 bis 10 Sekunden) verabreicht wurde, traten bei keiner der untersuchten Dosierungen (bis einschl. 0,4 mg/kg KG (8 x ED95)) klinisch signifikante kardiovaskuläre Effekte auf. Jedoch gibt es nur wenige klinische Daten für Dosierungen über 0,3 mg/kg KG in dieser Patientengruppe.
Der Einsatz von Nimbex bei Kindern in der Herzchirurgie wurde bisher nicht untersucht.
Dosierung bei Patienten in der Intensivmedizin
Nimbex kann sowohl durch Bolusinjektion und/oder durch Infusion bei erwachsenen Patienten auf der Intensivstation angewendet werden.
Für erwachsene Patienten auf der Intensivstation wird eine Anfangsdosis Nimbex von 3 ^g/kg KG/min (0,18 mg/kg KG/h) empfohlen. Die erforderlichen Dosen können von Patient zu Patient erheblich schwanken und auch während der Behandlung steigen oder fallen. In klinischen Studien betrug die durchschnittliche Infusionsrate 3 ^g/kg KG/min [Bereich 0,5 bis 10,2 ^g/kg KG/min (0,03 bis 0,6 mg/kg KG/h)].
Die durchschnittliche Zeit bis zur vollständigen Spontanerholung betrug nach Langzeitinfusion (bis zu 6 Tagen) von Nimbex bei Patienten auf der Intensivstation ungefähr 50 Minuten.
Das Erholungsprofil nach Infusion von Nimbex bei Patienten auf der Intensivstation ist unabhängig von der Dauer der Infusion.
4.3 Gegenanzeigen
Nimbex ist kontraindiziert bei Patienten mit einer bekannten Überempfindlichkeit gegenüber Cisatracurium, Atracurium oder Benzolsulfonsäure.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Produktspezifische Hinweise
Cisatracurium lähmt die Atem- und Skelettmuskulatur, ohne das Bewusstsein oder die Schmerzwahrnehmung zu beeinträchtigen. Nimbex sollte nur von einem Anästhesisten oder unter Aufsicht eines Anästhesisten oder eines anderen Arztes, der mit der Anwendung und Wirkung von Muskelrelaxanzien vertraut ist, verabreicht werden. Die Möglichkeiten zur endotrachealen Intubation, zum Erhalt der Lungenventilation und zur angemessenen arteriellen Oxygenierung müssen zur Verfügung stehen.
Nimbex sollte nur mit Vorsicht an Patienten verabreicht werden, die eine Überempfindlichkeit gegenüber anderen Muskelrelaxanzien gezeigt haben, da von einer hohen Rate (größer als 50 %) einer Kreuzüberempfindlichkeit zwischen Muskelrelaxanzien berichtet wurde (siehe Abschnitt 4.3).
Cisatracurium weist keine signifikanten Vagus- oder Ganglien-blockierenden Effekte auf. Infolge dessen hat Nimbex keinen klinisch relevanten Einfluss auf die Herzfrequenz. Es wirkt nicht Bradykardien entgegen, die durch Gabe anderer bei der Anästhesie verwendeter Arzneimittel, oder die nach Vagusreizung im Laufe von chirurgischen Eingriffen eventuell verursacht worden sind.
Patienten mit Myasthenia gravis oder anderen neuromuskulären Erkrankungen zeigen eine stark erhöhte Empfindlichkeit gegenüber nicht-depolarisierenden Muskelrelaxanzien. Bei diesen Patienten wird eine Anfangsdosis von nicht mehr als 0,02 mg/kg KG empfohlen.
Schwere Störungen im Säure-Basen- und/oder Serumelektrolyt-Haushalt können die Empfindlichkeit von Patienten gegenüber Muskelrelaxanzien herauf- oder herabsetzen.
Es liegen keine Erfahrungen zur Anwendung von Nimbex bei Neugeborenen unter 1 Monat vor, da in dieser Patientengruppe keine klinischen Prüfungen durchgeführt wurden.
Studien über die Anwendung von Nimbex bei Patienten, bei denen in der Vergangenheit eine maligne Hyperthermie aufgetreten ist, liegen nicht vor. Studien an für maligne Hyperthermie empfindlichen Schweinen haben gezeigt, dass Cisatracurium dieses Syndrom bei dieser Spezies nicht auslöst.
Es existieren keine Studien zur Anwendung von Nimbex bei Patienten, die einer Operation mit induzierter Unterkühlung (25 °C bis 28 °C) unterzogen werden. Wie bei anderen Muskelrelaxanzien kann die Infusionsrate, die benötigt wird, um eine angemessene Relaxierung während des operativen Eingriffs zu erhalten, unter diesen Bedingungen signifikant reduziert sein.
Cisatracurium wurde nicht bei Patienten mit Verbrennungen untersucht; aber wie bei anderen nicht-depolarisierenden Muskelrelaxanzien muss die Möglichkeit einer Dosiserhöhung und einer verkürzten Wirkungsdauer berücksichtigt werden, wenn Nimbex diesen Patienten verabreicht wird.
Cisatracurium-Lösung ist hypoton und darf nicht in die Infusionsleitung einer Bluttransfusion eingebracht werden.
Patienten auf der Intensivstation
Nach Verabreichung hoher Dosen in Tierstudien wurde Laudanosin, ein Metabolit von Cisatracurium und Atracurium, mit einer vorübergehenden Hypotonie und bei einigen Arten mit zerebral erregenden Effekten in Verbindung gebracht. Bei der empfindlichsten Tierart traten diese Effekte bei PlasmaLaudanosin-Konzentrationen auf, die vergleichbar zu denjenigen waren, die bei einigen Patienten auf der Intensivstation nach längerer Infusion von Atracurium gemessen wurden.
Entsprechend der niedrigeren Infusionsrate von Cisatracurium betragen die Plasma-LaudanosinKonzentrationen ungefähr ein Drittel gegenüber denen nach einer Atracurium-Infusion.
Meldungen über Krämpfe bei Patienten auf Intensivstationen, die neben anderen Arzneimitteln Atracurium erhalten haben, sind selten. Diese Patienten hatten gewöhnlich eine oder mehrere medizinische Prädispositionen für Krämpfe (z. B. ein Schädeltrauma, hypoxische Enzephalopathie, Hirnödem, virale Enzephalitis, Urämie). Ein kausaler Zusammenhang mit Laudanosin wurde nicht festgestellt.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es hat sich gezeigt, dass viele Arzneimittel die Wirkstärke und/oder die Wirkdauer von nicht-depolarisierenden Muskelrelaxanzien beeinflussen. Hierzu gehören:
Verstärkung der Wirkung
- durch Anästhetika wie Enfluran, Isofluran, Halothan (siehe Abschnitt 4.2) und Ketamin;
- durch andere, nicht-depolarisierende Muskelrelaxanzien;
- durch Antibiotika (einschließlich Aminoglykoside, Polymyxine, Spectinomycin, Tetracycline, Lincomycin und Clindamycin);
- durch Antiarrhythmika (einschließlich Propranolol, Calciumkanalblocker, Lidocain, Procainamid und Chinidin);
- durch Diuretika (einschließlich Furosemid und möglicherweise Thiazide, Mannitol und Acetazolamid);
- durch Magnesium- und Lithiumsalze;
- durch Ganglien-blockierende Arzneimittel (Trimetaphan, Hexamethonium).
In seltenen Fällen können bestimmte Arzneimittel eine latente Myasthenia gravis auslösen oder verschlimmern oder ein Myasthenie-Syndrom aktuell induzieren; eine erhöhte Empfindlichkeit gegenüber nicht-depolarisierenden Muskelrelaxanzien kann das Ergebnis sein. Zu diesen Arzneimitteln gehören verschiedene Antibiotika, Beta-Blocker (Propranolol, Oxprenolol), Antiarrhythmika (Procainamid, Chinidin), Antirheumatika (Chloroquin, D-Penicillamin), Trimetaphan, Chlorpromazin, Steroide, Phenytoin und Lithium.
Die Verabreichung von Succhinylcholin zur Verlängerung der Wirkung nicht-depolarisierender Muskelrelaxanzien kann zu einer verlängerten und komplexen Blockade führen, die nur noch schwer mit Cholinesterase-Hemmstoffen zu antagonisieren ist.
Herabsetzung der Wirkung
Eine Herabsetzung der Wirkung wurde nach vorhergehender chronischer Verabreichung von Phenytoin oder Carbamazepin beobachtet.
Die Behandlung mit Cholinesterase-Hemmstoffen, die häufig bei der Behandlung der AlzheimerErkrankung verwendet werden (z. B. Donepezil) kann die Dauer und Stärke der neuromuskulären Blockade mit Cisatracurium verkürzen bzw. abschwächen.
Keine Wechselwirkung
Eine vorhergehende Verabreichung von Succhinylcholin hat keine Auswirkung auf die Dauer der neuromuskulären Blockade nach einer Bolusinjektion von Nimbex oder auf dessen Infusionsrate.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen keine ausreichenden Daten zur Anwendung von Nimbex bei schwangeren Frauen vor. Studien an Tieren zu Auswirkungen auf die Schwangerschaft, auf die embryonale und fötale Entwicklung, auf die Geburt und auf die postnatale Entwicklung sind unzureichend (siehe Abschnitt 5.3). Das mögliche Risiko für Menschen ist unbekannt.
Nimbex sollte nicht während der Schwangerschaft angewendet werden.
Stillzeit
Es ist nicht bekannt, ob Cisatracurium oder seine Metaboliten in die Muttermilch übergehen. Fertilität
Studien zur Fertilität wurden nicht durchgeführt.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Diesbezügliche Vorsichtsmaßnahmen sind bei der Anwendung von Nimbex nicht relevant. Nimbex wird immer in Kombination mit einem Allgemeinanästhetikum verwendet und daher gelten die üblichen Vorsichtsmaßnahmen nach Allgemeinanästhesie.
4.8 Nebenwirkungen
Um die Häufigkeit der Nebenwirkungen, die sehr häufig bis gelegentlich auftreten, zu bestimmen, wurden Daten aus gepoolten, internen klinischen Prüfungen verwendet.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100, < 1/10)
Gelegentlich (> 1/1.000, < 1/100)
Selten (> 1/10.000, < 1/1.000) Sehr selten (< 1/10.000)
Daten aus klinischen Prüfungen
Herzerkrankungen
Häufig
Bradykardie
Gefäßerkrankungen
Häufig
Hypotonie
Gelegentlich
Hautrötung (Flush)
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich
Bronchospasmus
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich
Hautausschlag
Daten aus der Spontanerfassung
Erkrankungen des Immunsystems
Sehr selten
Anaphylaktische Reaktionen
Nach der Verabreichung von Muskelrelaxanzien sind anaphylaktische Reaktionen verschiedener Schweregrade beobachtet worden. Sehr selten wurde über schwere anaphylaktische Reaktionen bei Patienten berichtet, denen Nimbex in Verbindung mit einem oder mehreren Anästhetika verabreicht wurde.
Skelettmuskulatur-. Bindegewebs- und Knochenerkrankungen
Sehr selten
Myopathie, Muskelschwäche
Nach längerer Anwendung von Muskelrelaxanzien bei schwerkranken Patienten auf der Intensivstation wurden einige Fälle von Muskelschwäche und/oder Myopathie berichtet. Die meisten Patienten erhielten begleitend Kortikosteroide. Diese Ereignisse traten in wenigen Fällen mit Nimbex auf und ein kausaler Zusammenhang wurde nicht nachgewiesen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert. jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte. Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3. D-53175 Bonn. Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome und Zeichen
Verlängerte Muskellähmung und deren Folgen sind die hauptsächlichen Erscheinungsbilder einer Überdosierung.
Behandlung
Es ist notwendig, bis zum Einsetzen der Spontanatmung die Lungenventilation und damit die arterielle Oxygenierung aufrechtzuerhalten.
Da das Bewusstsein durch Nimbex nicht beeinträchtigt wird, ist der Patient vollständig zu sedieren. Die Erholung kann durch die Verabreichung von Cholinesterase-Hemmstoffen beschleunigt werden, sobald Anzeichen einer Spontanerholung erkennbar sind.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Cisatracurium ist ein Muskelrelaxans, ATC-Code: M03AC11. Wirkmechanismus
Cisatracurium ist ein nicht-depolarisierendes Benzylisochinolinium-Muskelrelaxans mit mittlerer Wirkungsdauer.
Pharmakodynamische Wirkungen
Klinische Studien haben gezeigt, dass Nimbex selbst bei Dosen bis einschließlich zur 8-fachen ED95 nicht mit einer dosisabhängigen Histaminfreisetzung assoziiert ist.
Cisatracurium bindet an die cholinergen Rezeptoren der motorischen Endplatte und antagonisiert die Wirkung von Acetylcholin, wodurch die neuromuskuläre Übertragung kompetitiv gehemmt wird. Dieser Vorgang ist durch die Gabe von Cholinesterase-Hemmstoffen wie Neostigmin oder Edrophonium vollständig umkehrbar.
Die ED95 (Dosis, die benötigt wird, um eine 95 %ige Unterdrückung der Zuckung des Daumenadduktors als Antwort auf die Stimulation des Nervus ulnaris zu erzielen) von Cisatracurium wird auf 0,05 mg/kg KG während einer Opioid-Anästhesie (Thiopental/Fentanyl/Midazolam) geschätzt.
Die ED95 von Cisatracurium bei Kindern während einer Halothan-Anästhesie beträgt 0,04 mg/kg KG.
5.2 Pharmakokinetische Eigenschaften
Biotransformation/Elimination
Cisatracurium wird im Körper bei physiologischem pH und physiologischer Temperatur durch Hofmann-Eliminierung (ein chemischer Prozess) zu Laudanosin und einem monoquarternären Acrylatmetaboliten abgebaut. Das monoquarternäre Acrylat wird durch nicht-spezifische Plasmaesterasen zum monoquarternären Alkoholmetaboliten hydrolysiert.
Die Elimination von Cisatracurium erfolgt zum großen Teil organunabhängig, die Metaboliten werden aber hauptsächlich über die Leber und die Niere ausgeschieden.
Die Metaboliten besitzen keine neuromuskulär-blockierende Aktivität.
Pharmakokinetik bei erwachsenen Patienten
Die nicht auf Kompartimente bezogene Pharmakokinetik von Cisatracurium ist im untersuchten Dosierungsbereich (0,1 bis 0,2 mg/kg KG, d. h. 2 bis 4 x ED95) unabhängig von der Dosis.
Im Populations-pharmakokinetischen Modell werden diese Ergebnisse bestätigt und auf bis zu 0,4 mg/kg KG (8 x ED95) ausgedehnt. Die pharmakokinetischen Parameter nach Anwendung von 0,1 und 0,2 mg/kg KG Nimbex im Rahmen von operativen Eingriffen bei gesunden Erwachsenen werden in der folgenden Tabelle zusammengefasst.
|
Parameter |
Bereich der Mittelwerte |
|
Clearance |
4,7 bis 5,7 ml/min/kg |
|
Verteilungsvolumen im Steady State |
121 bis 161 ml/kg |
|
Eliminationshalbwertszeit |
22 bis 29 min |
Pharmakokinetik bei älteren Patienten
Es bestehen keine klinisch relevanten Unterschiede in der Pharmakokinetik von Cisatracurium bei älteren und jungen erwachsenen Patienten. Das Erholungsprofil ist ebenfalls unverändert.
Pharmakokinetik bei Patienten mit eingeschränkter Nieren-/Leberfunktion
Es bestehen keine klinisch relevanten Unterschiede in der Pharmakokinetik von Cisatracurium zwischen Patienten im Endstadium einer Nieren- oder Leberinsuffizienz und gesunden erwachsenen Patienten. Das Erholungsprofil ist ebenfalls unverändert.
Pharmakokinetik während der Infusion
Die Pharmakokinetik von Cisatracurium nach Infusion von Nimbex ähnelt der nach einer einzelnen Bolusinjektion. Das Erholungsprofil nach Infusion von Nimbex ist unabhängig von der Dauer der Infusion und ähnelt dem nach einer einzelnen Bolusinjektion.
Pharmakokinetik bei Patienten auf der Intensivstation
Die Pharmakokinetik von Cisatracurium bei Patienten auf der Intensivstation, die über längere Zeit Infusionen erhalten, ähnelt der bei gesunden Erwachsenen, die Infusionen oder einzelne Bolusinjektionen während einer Operation erhalten. Das Erholungsprofil nach der Infusion von Nimbex bei Patienten auf der Intensivstation ist unabhängig von der Dauer der Infusion.
Bei Patienten auf der Intensivstation mit eingeschränkter Nieren- und/oder Leberfunktion ist die Konzentration an Metaboliten erhöht (siehe Abschnitt 4.4). Diese Metaboliten besitzen keine neuromuskulär-blockierende Aktivität.
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität
Aussagekräftige Studien zur akuten Toxizität konnten mit Cisatracurium nicht durchgeführt werden. Hinsichtlich der Symptome siehe Abschnitt 4.9.
Subakute Toxizität:
Dreiwöchige Studien mit wiederholter Anwendung von Cisatracurium bei Hunden und Affen lieferten keinen Hinweis auf eine Cisatracurium-spezifische Toxizität.
Mutagenität
Nimbex war in einem mikrobiellen In-vitro-Test in Konzentrationen bis zu 5000 ^g/Platte nicht mutagen.
In vivo wurden in einer zytogenetischen Studie an der Ratte keine signifikanten Chromosomenschäden bei subkutanen Dosen von bis zu 4 mg/kg beobachtet.
In einem In-vitro-Mutagenitätstest an Maus-Lymphomazellen war Cisatracurium in Konzentrationen von 40 ^g/ml und höher mutagen.
Der positive Befund aus dem In-vitro-Test erscheint für Nimbex, das nur selten und/oder kurzzeitig angewendet wird, von fragwürdiger klinischer Relevanz.
Kanzerogenität
Studien zur Kanzerogenität wurden nicht durchgeführt.
Reproduktionstoxizität
Fertilitätsstudien wurden nicht durchgeführt. Reproduktionsstudien an Ratten haben keinen negativen Einfluss von Cisatracurium auf die Fötalentwicklung dieser Spezies gezeigt.
Lokale Verträglichkeit
Die Ergebnisse einer Studie an Kaninchen mit intraarterieller Applikation von Cisatracurium zeigten eine gute Verträglichkeit. Es wurden keine arzneimittelbedingten Veränderungen beobachtet.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Benzolsulfonsäure 32 % G/V, Wasser für Injektionszwecke.
6.2 Inkompatibilitäten
Es hat sich gezeigt, dass Cisatracuriumbesilat in Ringer-Laktat-Lösung und Ringer-Laktat-Lösung mit 5 %iger Glucoselösung schneller abgebaut wird als in den Infusionslösungen, die im Abschnitt 6.6 aufgelistet sind.
Daher wird empfohlen, dass Ringer-Laktat-Lösung und Ringer-Laktat-Lösung mit 5%iger Glucoselösung nicht als Verdünnungsmittel bei der Bereitung von Nimbex-Lösung zur Infusion verwendet werden.
Da Nimbex nur in sauren Lösungen stabil ist, sollte es nicht mit alkalischen Lösungen, z. B. Thiopental-Natrium in derselben Spritze gemischt oder durch dieselbe Nadel verabreicht werden. Nimbex ist nicht mischbar mit Ketorolac, Trometamol oder Propofol-Injektionsemulsion.
6.3 Dauer der Haltbarkeit
Dauer der Haltbarkeit im ungeöffneten Behältnis: 2 Jahre
Die chemische und physikalische Stabilität nach Anbruch wurde für mindestens 24 Stunden bei 5°C und 25°C gezeigt (siehe Abschnitt 6.6).
Das Arzneimittel sollte aus mikrobiologischen Gründen sofort nach Anbruch verwendet werden. Wenn es nicht sofort verwendet wird, ist der Anwender dafür verantwortlich, wie lange und unter welchen Bedingungen er das Arzneimittel nach Anbruch lagert bzw. verwendet. Die verdünnte Lösung sollte nicht länger als 24 Stunden bei 2°C bis 8°C aufbewahrt werden, wenn die Verdünnung nicht unter kontrollierten und validierten aseptischen Bedingungen erfolgte.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (2°C - 8°C).
Nicht einfrieren.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Zu Aufbewahrungsbedingungen der verdünnten Lösung siehe Abschnitt 6.3.
6.5 Art und Inhalt der Behältnisse
NIMBEX 5 mg Injektions-/Infusionslösung
Packungen mit 5 Ampullen mit je 2,5 ml Injektions-/Infusionslösung
NIMBEX 10 mg Injektions-/Infusionslösung
Packungen mit 5 Ampullen mit je 5 ml Injektions-/Infusionslösung
Die Ampullen sind aus klarem Neutralglas (Typ I).
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Das Produkt ist nur zum Einmalgebrauch bestimmt. Nur klare, annähernd farblose bis leicht gelbe oder grünlich-gelbe Lösungen sind zu verwenden. Das Arzneimittel sollte vor der Anwendung per Augenschein geprüft werden; wenn sich das Aussehen verändert hat oder das Behältnis beschädigt ist, muss das Arzneimittel verworfen werden.
Verdünnte Nimbex Injektions-/Infusionslösung ist physikalisch und chemisch für mindestens 24 h bei 5°C und bei 25°C in Konzentrationen zwischen 0,1 und 2 mg/ml in den folgenden Infusionslösungen bei einer Aufbewahrung in Behältern aus Polyvinylchlorid oder Polypropylen stabil:
0,9 %ige (G/V) Natriumchlorid-Lösung,
5 %ige (G/V) Glucose-Lösung,
0,18 %ige (G/V) Natriumchlorid-Lösung mit 4 %iger (G/V) Glucose-Lösung,
0,45 %ige (G/V) Natriumchlorid-Lösung mit 2,5 %iger (G/V) Glucose-Lösung.
Da das Produkt keine Konservierungsmittel enthält, sollte die Verdünnung unmittelbar vor der Anwendung vorgenommen werden, oder aber die verdünnte Lösung wie unter Abschnitt 6.3 beschrieben, aufbewahrt werden.
Nimbex erwies sich mit den folgenden üblicherweise bei Operationen angewandten Arzneimitteln als verträglich, wenn es unter Bedingungen gemischt wurde, die eine Verabreichung über einen y-förmigen Zugang in eine laufende intravenöse Infusion simulierten: Alfentanilhydrochlorid, Droperidol, Fentanylcitrat, Midazolamhydrochlorid und Sufentanilcitrat.
Wenn andere Arzneimittel durch dieselbe Verweilnadel oder -kanüle verabreicht werden wie Nimbex, wird empfohlen, dass jedes Arzneimittel mit einer adäquaten Menge einer geeigneten Infusionslösung ausgespült wird, z. B. 0,9 %ige (G/V) Natriumchlorid-Lösung.
Wenn Nimbex in eine kleine Vene injiziert wird, sollte es, wie bei anderen intravenös verabreichten Arzneimitteln, mit einer geeigneten Infusionslösung z. B. 0,9 %iger (G/V) Natriumchlorid-Lösung, durch die Vene gespült werden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
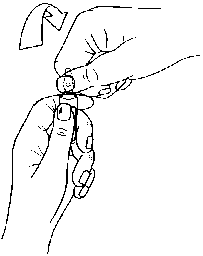
Hinweise zum Öffnen der Ampulle
Die Ampullen sind mit dem OPC-(One Point Cut) System ausgestattet und müssen entsprechend der folgenden Anweisungen geöffnet werden:
- Halten Sie den unteren Teil der Ampulle in der Hand, wie in Bild 1 gezeigt.
- Legen Sie den Daumen der anderen Hand auf den farbigen Punkt auf dem Ampullenspieß und brechen Sie den Ampullenspieß nach unten ab, wie in Bild 2 gezeigt.
Bild 1:
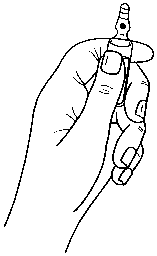
Bild 2:
7. INHABER DER ZULASSUNGEN
GlaxoSmithKline GmbH & Co. KG 80700 München Service Tel.: 0800 1 22 33 55 Service Fax: 0800 1 22 33 66 E-Mail: produkt.info@gsk.com http ://www. glaxo smithkline. de
8. ZULASSUNGSNUMMERN
NIMBEX 5 mg: 36267.00.00 NIMBEX 10 mg: 36267.01.00
9. DATUM DER ERTEILUNG DER ZULASSUNGEN/VERLÄNGERUNG DER ZULASSUNGEN
Datum der Erteilung der Zulassung: 13.02.1996
Datum der letzten Verlängerung der Zulassung: 20.09.2010
10. STAND DER INFORMATION
August 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig