Novial
ANHANG I
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
1. BEZEICHNUNG DES ARZNEIMITTELS
Novial, Filmtabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
• jede gelbe Filmtablette enthält 0,050 mg Desogestrel und 0,035 mg Ethinylestradiol;
• jede rote Filmtablette enthält 0,100 mg Desogestrel und 0,030 mg Ethinylestradiol;
• jede weiße Filmtablette enthält 0,150 mg Desogestrel und 0,030 mg Ethinylestradiol.
Sonstige Bestandteile mit bekannter Wirkung: Lactose-Monohydrat < 65 mg Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Filmtablette.
Die Tabletten sind rund, bikonvex und 5 mm im Durchmesser.
Die gelben Filmtabletten sind auf einer Seite mit dem Wort Organon und einem Stern "*", auf der anderen Seite mit dem Code ”VR 4” gekennzeichnet.
Die roten Filmtabletten sind auf einer Seite mit dem Wort Organon und einem Stern"*", auf der anderen Seite mit dem Code ”VR 2” gekennzeichnet.
Die weißen Filmtabletten sind auf einer Seite mit dem Wort Organon und einem Stern"*", auf der anderen Seite mit dem Code ”TR 5” gekennzeichnet.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Kontrazeption.
Bei der Entscheidung, Novial zu verschreiben, sollten die aktuellen, individuellen Risikofaktoren der einzelnen Frauen, insbesondere im Hinblick auf venöse Thromboembolien (VTE), berücksichtigt werden., Auch sollte das Risiko für eine VTE bei Anwendung von Novial mit dem anderer kombinierter hormonaler Kontrazeptiva (KHK) verglichen werden (siehe Abschnitte 4.3 und 4.4).
4.2 Dosierung und Art der Anwendung
Dosierung
An 21 aufeinander folgenden Tagen wird täglich eine Filmtablette eingenommen. Begonnen wird mit der Einnahme der gelben Filmtabletten über 7 Tage, dann folgen die roten über 7 Tage und schließlich die weißen Filmtabletten über weitere 7 Tage. Vor jeder weiteren Packung ist jeweils ein 7-tägiges einnahmefreies Intervall einzulegen, während dessen es üblicherweise zu einer Entzugsblutung kommt. Diese beginnt normalerweise 2 bis 3 Tage nach der letzten Tabletteneinnahme und kann noch andauern, wenn bereits mit der nächsten Packung begonnen wird.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Desogestrel bei Jugendlichen unter 18 Jahren ist bisher noch nicht erwiesen. Es liegen keine Daten vor.
Art der Anwendung Zum Einnehmen.
Anwendung von Novial
Die Filmtabletten sind in der auf der Packung angegebenen Reihenfolge täglich möglichst zur gleichen Tageszeit mit ausreichend Flüssigkeit einzunehmen.
Besinn der Einnahme von Novial
Frauen, die im letzten Monat keine hormonalen Kontrazeptiva angewendet haben Mit der Filmtabletteneinnahme ist am 1. Tag des normalen Menstruationszyklus (also am 1. Tag der Regelblutung) zu beginnen. Ein Beginn ist auch vom 2. bis 5. Tag an möglich, wobei während der ersten 7 Tage der Filmtabletteneinnahme im 1. Zyklus die zusätzliche Anwendung eines mechanischen Verhütungsmittels empfohlen wird.
Umstellung von einem kombinierten hormonalen Kontrazeptivum (kombiniertes orales Kontrazeptivum (KOK), Vaginalring oder transdermales Pflaster)
Mit der Einnahme von Novial ist vorzugsweise am folgenden Tag nach der letzten Einnahme der letzten wirkstoffhaltigen Tablette des bisher eingenommenen KHK, spätestens jedoch am Tag nach dem üblichen einnahmefreien Intervall bzw. der Placebophase des vorhergehenden KHK zu beginnen. Wurde bisher ein Vaginalring oder ein transdermales Pflaster verwendet, so sollte mit der Einnahme von Novial vorzugsweise am Tag der Entfernung begonnen werden, jedoch spätestens dann, wenn die nächste Anwendung fällig wäre.
Wenn die Anwenderin ihre bisherige Methode konsequent und korrekt angewendet hat und wenn eine Schwangerschaft mit Sicherheit ausgeschlossen werden kann, kann sie auch an jedem beliebigen Zyklustag von ihrem bisher angewandten kombinierten hormonalen Kontrazeptivum wechseln.
Das hormonfreie Intervall der bisherigen Methode sollte niemals über den empfohlenen Zeitraum hinaus ausgedehnt werden.
Es könnte sein, dass nicht alle kontrazeptiven Methoden (transdermales Pflaster, Vaginalring) in jedem Land der Europäischen Union vermarktet werden.
Umstellung von einem Gestagenmonopräparat (Minipille, Injektion, Implantat) oder einem intrauterinen Gestagen-Freisetzungssystem [IUS]
Die Umstellung von der Minipille kann an jedem beliebigen Tag erfolgen, von einem Implantat oder einem IUS am Tag der Entfernung und von einem Injektionspräparat zum Zeitpunkt, an dem die nächste Injektion fällig wäre. In all diesen Fällen ist während der ersten 7 Tage der Tabletteneinnahme zusätzlich ein mechanisches Verhütungsmittel anzuwenden.
Nach einem Abort im 1. Trimenon
Mit der Einnahme von Novial kann sofort begonnen werden. Zusätzliche Verhütungsmaßnahmen sind in diesem Fall nicht erforderlich.
Nach einer Geburt oder einem Abort im 2. Trimenon Hinweise für stillende Frauen siehe Abschnitt 4.6.
Mit der Einnahme von Novial sollte zwischen dem 21. und 28. Tag nach einer Geburt oder einem Abort im 2. Trimenon begonnen werden. Bei einem späteren Beginn ist an den ersten 7 Tagen der Tabletteneinnahme zusätzlich ein mechanisches Verhütungsmittel anzuwenden. Hat in der Zwischenzeit bereits Geschlechtsverkehr stattgefunden, ist vor dem Beginn der Einnahme eine Schwangerschaft auszuschließen oder die erste Monatsblutung abzuwarten.
Vorgehen bei vergessener Tabletteneinnahme
Wird innerhalb von 12 Stunden nach dem üblichen Einnahmezeitpunkt bemerkt, dass die Einnahme einer Filmtablette vergessen wurde, soll die Filmtablette sofort eingenommen werden. Alle darauf folgenden Filmtabletten sind dann wieder zur gewohnten Tageszeit einzunehmen. Der kontrazeptive Schutz ist dann nicht eingeschränkt.
Wurde die Tabletteneinnahme länger als 12 Stunden über den üblichen Einnahmezeitpunkt hinaus vergessen, ist möglicherweise kein vollständiger Konzeptionsschutz mehr gegeben.
Für das Vorgehen bei vergessener Tabletteneinnahme gelten die folgenden zwei Grundregeln:
1. Die Einnahme darf nicht länger als 7 Tage unterbrochen werden.2. Eine regelmäßige
Einnahme über mindestens 7 Tage ist erforderlich, um wirkungsvoll die Hypothalamus-Hypophysen-Ovar-Achse zu unterdrücken.
Daraus ergibt sich in Abhängigkeit von der Einnahmewoche folgendes Vorgehen:
• 1. Einnahmewoche (gelbe Filmtabletten)
Die vergessene Filmtablette soll sofort eingenommen werden, sobald die vergessene Einnahme bemerkt wird - auch dann, wenn dadurch gleichzeitig 2 Filmtabletten einzunehmen sind. Die darauf folgenden Filmtabletten sollen zur gewohnten Zeit eingenommen werden. Während der nächsten 7 Tage ist zusätzlich ein mechanisches Verhütungsmittel, wie z. B. ein Kondom, anzuwenden. Hat jedoch in den vorausgegangenen 7 Tagen bereits Geschlechtsverkehr stattgefunden, muss die Möglichkeit einer Schwangerschaft berücksichtigt werden. Je mehr Filmtabletten vergessen wurden und je näher dies am regelmäßigen einnahmefreien Intervall lag, desto größer ist das Risiko einer Schwangerschaft.
• 2. Einnahmewoche (rote Filmtabletten)
Die vergessene Filmtablette soll sofort eingenommen werden, sobald die vergessene Einnahme bemerkt wird - auch dann, wenn dadurch gleichzeitig 2 Filmtabletten einzunehmen sind. Die darauf folgenden Filmtabletten sollen zur gewohnten Zeit eingenommen werden. Vorausgesetzt, dass an den 7 vorangegangenen Tagen eine regelmäßige Einnahme erfolgte, ist keine zusätzliche Anwendung eines mechanischen Verhütungsmittels erforderlich. War dies nicht der Fall oder wurde mehr als 1 Filmtablette vergessen, ist während der nächsten 7 Tage zusätzlich ein mechanisches Verhütungsmittel anzuwenden.
• 3. Einnahmewoche (weiße Filmtabletten)
Es besteht in Anbetracht des bevorstehenden einnahmefreien Intervalls ein erhöhtes Schwangerschaftsrisiko, das aber bei entsprechender Anpassung des Einnahmemodus verringert werden kann. Wird eine der beiden folgenden Einnahmemöglichkeiten angewendet, sind keine zusätzlichen kontrazeptiven Maßnahmen erforderlich, sofern die Einnahme an den 7 Tagen vor der ersten ausgelassenen Filmtablette regelmäßig erfolgte. Andernfalls muss die Patientin angewiesen werden, die erste der beiden Einnahmemöglichkeiten zu befolgen und während der nächsten 7 Tage zusätzlich ein mechanisches Verhütungsmittel anzuwenden.
1. Die vergessene Filmtablette soll sofort eingenommen werden, sobald die vergessene
Einnahme bemerkt wird - auch dann, wenn dadurch gleichzeitig 2 Filmtabletten einzunehmen sind. Die weiteren Filmtabletten sollen zur gewohnten Zeit eingenommen werden. Mit der Einnahme der Filmtabletten aus der nächsten Packung ist unmittelbar nach Ende der aktuellen Packung, d. h. ohne Einhaltung des einnahmefreien Intervalls, fortzufahren. Es wird dabei wahrscheinlich nicht zur üblichen Entzugsblutung bis zum Aufbrauchen dieser zweiten Packung kommen. Es können aber gehäuft Durchbruchblutungen bzw. Schmierblutungen während der Tabletteneinnahme auftreten.
2. Alternativ kann die weitere Einnahme von Filmtabletten aus der aktuellen Packung abgebrochen werden. Nach einem einnahmefreien Intervall von bis zu 7 Tagen, einschließlich jener Tage, an denen die Einnahme vergessen wurde, wird die Einnahme mit Filmtabletten aus der nächsten Packung fortgesetzt.
Sollte es nach vergessener Einnahme im nächsten regulären einnahmefreien Intervall zu keiner Entzugsblutung kommen, muss die Möglichkeit einer Schwangerschaft in Betracht gezogen werden.
Verhalten bei gastrointestinalen Beschwerden
Bei schweren gastrointestinalen Beschwerden kann die Resorption möglicherweise unvollständig sein. Es sind dann zusätzliche kontrazeptive Schutzmaßnahmen zu treffen.
Bei Erbrechen innerhalb von 3 bis 4 Stunden nach der Tabletteneinnahme ist gemäß den Anleitungen in Abschnitt 4.2 "Vorgehen bei vergessener Tabletteneinnahme" zu verfahren. Wenn das gewohnte Einnahmeschema beibehalten werden soll, muss die zusätzlich einzunehmende Filmtablette aus einer anderen Packung eingenommen werden.
Verschiebung oder Verzögerung der Menstruation
Die Verschiebung der Menstruation ist keine Indikation für Novial. Um die Menstruation in Ausnahmefällen zu verschieben, ist die Einnahme mit den weißen Filmtabletten aus der nächsten Packung ohne einnahmefreies Intervall fortzusetzen. Dabei kann die Menstruation längstens 7 Tage, d. h. bis zum Ende der zweiten Packung, hinausgezögert werden. Während dieser Zeit kann es zu Schmier- und Durchbruchblutungen kommen. Die regelmäßige Einnahme von Novial wird dann nach dem üblichen 7-tägigen einnahmefreien Intervall fortgesetzt.
Der Beginn der Menstruation im nächsten Zyklus kann auf einen anderen Wochentag vorgezogen werden, indem das einnahmefreie Intervall beliebig verkürzt wird. Je kürzer das einnahmefreie Intervall ist, desto unwahrscheinlicher kommt es zu einer Entzugsblutung bzw. desto häufiger können während der Einnahme der nächsten Packung Schmier- bzw. Durchbruchblutungen auftreten (ähnlich wie beim Hinausschieben der Menstruation).
4.3 Gegenanzeigen
Kombinierte hormonale Kontrazeptiva (KHK) dürfen unter den folgenden Bedingungen nicht angewendet werden. Tritt während der Anwendung des KHK erstmalig eine der Bedingungen ein, ist das Präparat unverzüglich abzusetzen.
• Vorliegen einer oder Risiko für eine venöse Thromboembolie (VTE)
o Venöse Thromboembolie - bestehende VTE (auch unter Therapie mit Antikoagulanzien) oder VTE in der Vorgeschichte (z. B. tiefe Venenthrombose [TVT] oder Lungenembolie [LE]) o Bekannte erbliche oder erworbene Prädisposition für eine venöse Thromboembolie, wie z. B. APC-Resistenz (einschließlich Faktor-V-Leiden), Antithrombin-III-Mangel, Protein-C-Mangel oder Protein-S-Mangel o Größere Operationen mit längerer Immobilisierung (siehe Abschnitt 4.4) o Hohes Risiko für eine venöse Thromboembolie aufgrund mehrerer Risikofaktoren (siehe Abschnitt 4.4)
• Vorliegen einer oder Risiko für eine arterielle Thromboembolie (ATE)
o Arterielle Thromboembolie - bestehende ATE, ATE in der Vorgeschichte (z. B.
Myokardinfarkt) oder Erkrankung im Prodromalstadium (z. B. Angina pectoris) o Zerebrovaskuläre Erkrankung - bestehender Schlaganfall, Schlaganfall oder prodromale Erkrankung (z. B. transitorische ischämische Attacke [TIA]) in der Vorgeschichte o Bekannte erbliche oder erworbene Prädisposition für eine arterielle Thromboembolie, wie
z. B. Hyperhomocysteinämie und Antiphospholipid-Antikörper (Anticardiolipin-Antikörper, Lupusantikoagulans)
o Migräne mit fokalen neurologischen Symptomen in der Vorgeschichte o Hohes Risiko für eine arterielle Thromboembolie aufgrund mehrerer Risikofaktoren (siehe Abschnitt 4.4) oder eines schwerwiegenden Risikofaktors wie:
• Diabetes mellitus mit Gefäßschädigung
• Schwere Hypertonie
• Schwere Dyslipoproteinämie
• Bestehende oder vorausgegangene Pankreatitis, falls verbunden mit schwerer Hypertriglyzeridämie
• Bestehende oder vorausgegangene schwere Lebererkrankung, solange abnorme Leberfunktionsparameter bestehen
• Bestehende oder vorausgegangene benigne oder maligne Lebertumoren
• Bestehende oder vermutete sexualhormonabhängige maligne Erkrankungen (z. B. der Genitale oder der Mammae)
• Endometriumhyperplasie
• Nicht abgeklärte vaginale Blutungen
• Schwangerschaft (bestehend oder vermutet)
• Überempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Warnhinweise
Die Eignung von Novial sollte mit der Frau besprochen werden, falls eine der im Folgenden aufgeführten
Erkrankungen oder Risikofaktoren vorliegt.
Bei einer Verschlechterung oder dem ersten Auftreten einer dieser Erkrankungen oder Risikofaktoren ist
der Anwenderin anzuraten, sich an ihren Arzt zu wenden, um zu entscheiden, ob die Anwendung von
Novial beendet werden sollte.
1. Venöses und arterielles Thromboembolierisiko
Risiko für eine venöse Thromboembolie (VTE)
• Die Anwendung jedes kombinierten hormonalen Kontrazeptivums (KHK) erhöht das Risiko für eine venöse Thromboembolie (VTE) im Vergleich zur Nichtanwendung. Arzneimittel, die Levonorgestrel, Norgestimat oder Norethisteron enthalten, sind mit dem geringsten Risiko für eine VTE verbunden. Andere Arzneimittel, wie Novial, können ein bis zu doppelt so hohes Risiko aufweisen. Die Entscheidung, ein Arzneimittel anzuwenden, das nicht zu denen mit dem geringsten VTE-Risiko gehört, sollte nur nach einem Gespräch mit der Frau getroffen werden, bei dem sicherzustellen ist, dass sie Folgendes versteht: das Risiko für eine VTE bei Anwendung von Novial, wie ihre vorliegenden individuellen Risikofaktoren dieses Risiko beeinflussen, und dass ihr Risiko für VTE in ihrem allerersten Anwendungsjahr am höchsten ist. Es gibt zudem Hinweise, dass das Risiko erhöht ist, wenn die Anwendung eines KHK nach einer Unterbrechung von 4 oder mehr Wochen wieder aufgenommen wird.
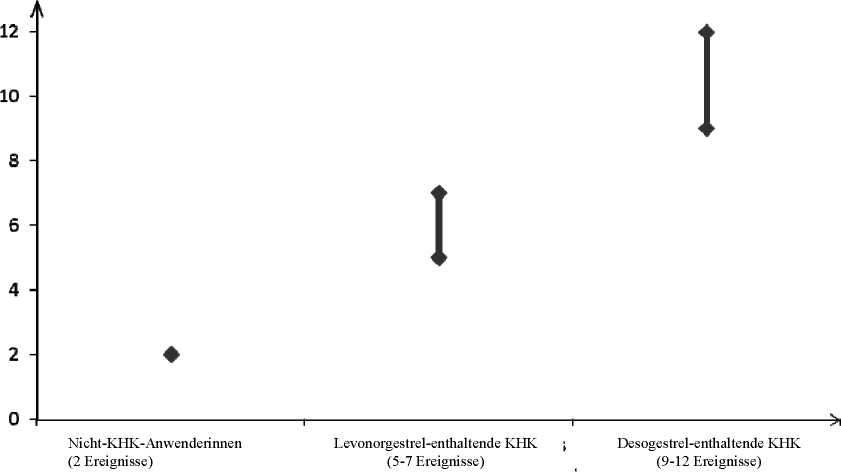
• Ungefähr 2 von 10.000 Frauen, die kein KHK anwenden und nicht schwanger sind, erleiden im Verlauf eines Jahres eine VTE. Bei jeder einzelnen Frau kann das Risiko jedoch in Abhängigkeit von ihren zugrunde liegenden Risikofaktoren bedeutend höher sein (siehe unten).
• Es wird geschätzt1, dass im Verlauf eines Jahres 9 bis 12 von 10.000 Frauen, die ein Desogestrel-haltiges KHK anwenden, eine VTE erleiden; im Vergleich hierzu kommt es pro Jahr bei ungefähr 62 von 10.000 Frauen, die ein Levonorgestrel-haltiges KHK anwenden, zu einer VTE.
• In beiden Fällen ist die Anzahl an VTE pro Jahr geringer als die erwartete Anzahl während der Schwangerschaft oder in der Zeit nach der Geburt.
• VTE verlaufen in 1-2 % der Fälle tödlich.
Jährliche Anzahl an VTE-Ereignissen pro 10.000 Frauen
Anzahl an VTE-Ereignissen
Äußerst selten wurde bei Anwenderinnen von KHK über eine Thrombose in anderen Blutgefäßen berichtet, wie z. B. in Venen und Arterien von Leber, Mesenterium, Nieren oder Retina.
Risikofaktoren für VTE
Das Risiko für venöse thromboembolische Komplikationen bei Anwenderinnen von KHK kann deutlich ansteigen, wenn bei der Anwenderin zusätzliche Risikofaktoren bestehen, insbesondere wenn mehrere Risikofaktoren vorliegen (siehe Tabelle).
Novial ist kontraindiziert, wenn bei einer Frau mehrere Risikofaktoren gleichzeitig bestehen, die insgesamt zu einem hohen Risiko für eine Venenthrombose führen (siehe Abschnitt 4.3). Weist eine Frau mehr als einen Risikofaktor auf, ist es möglich, dass der Anstieg des Risikos das Risiko der Summe der einzelnen Faktoren übersteigt- in diesem Fall muss ihr Gesamtrisiko für eine VTE in Betracht gezogen werden. Wenn das Nutzen/Risiko-Verhältnis als ungünstig erachtet wird, darf ein KHK nicht verschrieben werden (siehe Abschnitt 4.3).
Tabelle: Risikofaktoren für VTE
|
Risikofaktor |
Anmerkung |
|
Adipositas (Body-Mass-Index über 30 kg/m2) |
Das Risiko nimmt mit steigendem BMI deutlich zu. Besonders wichtig, wenn weitere Risikofaktoren vorliegen. |
|
Längere Immobilisierung, größere Operationen, jede Operation an Beinen oder Hüfte, neurochirurgische Operation oder schweres Trauma |
In diesen Fällen ist es ratsam, die Anwendung des Pflasters/der Pille/des Rings (bei einer geplanten Operation mindestens vier Wochen vorher) zu unterbrechen und erst zwei Wochen nach der kompletten Mobilisierung wieder aufzunehmen. Es ist eine andere Verhütungsmethode anzuwenden, um eine ungewollte Schwangerschaft zu verhindern. |
|
Eine antithrombotische Therapie muss erwogen werden, wenn Novial nicht vorab abgesetzt wurde. | |
|
Hinweis: Eine vorübergehende Immobilisierung einschließlich einer Flugreise von > 4 Stunden Dauer kann ebenfalls einen Risikofaktor für eine VTE darstellen, insbesondere bei Frauen mit weiteren Risikofaktoren. | |
|
Familiäre Vorbelastung (jede venöse Thromboembolie bei einem Geschwister- oder Elternteil, insbesondere in relativ jungen Jahren, z. B. jünger als 50 Jahre). |
Bei Verdacht auf eine genetische Prädisposition ist die Frau zur Beratung an einen Spezialisten zu überweisen, bevor eine Entscheidung über die Anwendung eines KHKs getroffen wird. |
|
Andere Erkrankungen, die mit einer VTE verknüpft sind. |
Krebs, systemischer Lupus erythematodes, hämolytisches urämisches Syndrom, chronisch entzündliche Darmerkrankung (Morbus Crohn oder Colitis ulcerosa) und Sichelzellkrankheit. |
|
Zunehmendes Alter |
Insbesondere älter als 35 Jahre. |
Es besteht kein Konsens über die mögliche Rolle von Varizen und oberflächlicher Thrombophlebitis bezüglich des Beginns oder Fortschreitens einer Venenthrombose.
Das erhöhte Risiko einer Thromboembolie in der Schwangerschaft und insbesondere während der 6-wöchigen Dauer des Wochenbetts muss berücksichtigt werden (Informationen zur „Schwangerschaft und Stillzeit“ siehe Abschnitt 4.6).
Symptome einer VTE (tiefe Beinvenenthrombose und Lungenembolie)
Beim Auftreten von Symptomen ist den Anwenderinnen anzuraten, unverzüglich ärztliche Hilfe in Anspruch zu nehmen und das medizinische Fachpersonal darüber zu informieren, dass sie ein KHK anwenden.
Bei einer tiefen Beinvenenthrombose (TVT) können folgende Symptome auftreten:
- unilaterale Schwellung des Beins und/oder Fußes oder entlang einer Beinvene;
- Schmerz oder Druckschmerz im Bein, der möglicherweise nur beim Stehen oder Gehen bemerkt
wird;
- Erwärmung des betroffenen Beins; gerötete oder entfärbte Haut am Bein.
Bei einer Lungenembolie (LE) können folgende Symptome auftreten:
- plötzliches Auftreten unerklärlicher Kurzatmigkeit oder schnellen Atmens;
- plötzlich auftretender Husten, möglicherweise in Verbindung mit Hämoptyse;
- stechender Brustschmerz;
- starke Benommenheit oder Schwindelgefühl;
- schneller oder unregelmäßiger Herzschlag.
Einige dieser Symptome (z. B. „Kurzatmigkeit“, „Husten“) sind unspezifisch und können als häufiger vorkommende und weniger schwerwiegende Ereignisse fehlinterpretiert werden (z. B. als Atemwegsinfektionen).
Andere Anzeichen für einen Gefäßverschluss können plötzlicher Schmerz sowie Schwellung und leicht bläuliche Verfärbung einer Extremität sein.
Tritt der Gefäßverschluss im Auge auf, können die Symptome von einem schmerzlosen verschwommenen Sehen bis zu einem Verlust des Sehvermögens reichen. In manchen Fällen tritt der Verlust des Sehvermögens sehr plötzlich auf.
Risiko für eine arterielle Thromboembolie (ATE)
Epidemiologische Studien haben die Anwendung von KHK mit einem erhöhten Risiko für arterielle Thromboembolie (Myokardinfarkt) oder apoplektischen Insult (z. B. transitorische ischämische Attacke, Schlaganfall) in Verbindung gebracht. Arterielle thromboembolische Ereignisse können tödlich verlaufen.
Risikofaktoren für ATE
Das Risiko für arterielle thromboembolische Komplikationen oder einen apoplektischen Insult bei Anwenderinnen von KHK erhöht sich bei Frauen, die Risikofaktoren aufweisen (siehe Tabelle). Novial ist kontraindiziert bei Frauen, die einen schwerwiegenden oder mehrere Risikofaktoren für eine ATE haben, die sie einem hohen Risiko für eine Arterienthrombose aussetzen (siehe Abschnitt 4.3). Weist eine Frau mehr als einen Risikofaktor auf, ist es möglich, dass der Anstieg des Risikos das Risiko der Summe der einzelnen Faktoren übersteigt- in diesem Fall muss ihr Gesamtrisiko betrachtet werden. Bei Vorliegen eines ungünstigen Nutzen/Risiko-Verhältnisses darf ein KHK nicht verschrieben werden (siehe Abschnitt 4.3).
Tabelle: Risikofaktoren für ATE
|
Risikofaktor |
Anmerkung |
|
Zunehmendes Alter |
Insbesondere älter als 35 Jahre |
|
Rauchen |
Frauen ist anzuraten, nicht zu rauchen, wenn sie ein KHK anwenden möchten. Frauen über 35 Jahre, die weiterhin rauchen, ist dringend zu empfehlen, eine andere Verhütungsmethode anzuwenden. |
|
Hypertonie | |
|
Adipositas (Body-Mass-Index über 30 kg/m2) |
Das Risiko nimmt mit steigendem BMI deutlich zu. Besonders wichtig bei Frauen mit zusätzlichen Risikofaktoren. |
|
Familiäre Vorbelastung (jede arterielle Thromboembolie bei einem Geschwister- oder Elternteil, insbesondere in relativ jungen Jahren, d. h. jünger als 50 Jahre) |
Bei Verdacht auf eine genetische Prädisposition ist die Frau zur Beratung an einen Spezialisten zu überweisen, bevor eine Entscheidung über die Anwendung eines KHKs getroffen wird. |
|
Migräne |
Ein Anstieg der Häufigkeit oder des Schweregrads der Migräne während der Anwendung von KHK (die einem zerebrovaskulären Ereignis vorausgehen kann) kann ein Grund für ein sofortiges Absetzen sein. |
|
Andere Erkrankungen, die mit unerwünschten Gefäßereignissen |
Diabetes mellitus, Hyperhomocysteinämie, Erkrankung der Herzklappen und Vorhofflimmern, |
|
verknüpft sind. |
Dyslipoproteinämie und systemischer Lupus |
|
erythematodes. |
Symptome einer ATE
Beim Auftreten von Symptomen ist den Frauen anzuraten, unverzüglich ärztliche Hilfe in Anspruch zu
nehmen und das medizinische Fachpersonal darüber zu informieren, dass sie ein KHK anwenden.
Bei einem apoplektischen Insult können folgende Symptome auftreten:
- plötzliches Taubheitsgefühl oder Schwäche in Gesicht, Arm oder Bein, besonders auf einer Körperseite;
- plötzliche Gehschwierigkeiten, Schwindelgefühl, Gleichgewichtsverlust oder Koordinationsstörungen;
- plötzliche Verwirrtheit, Sprech- oder Verständnisschwierigkeiten;
- plötzliche Sehstörungen in einem oder beiden Augen;
- plötzliche, schwere oder länger anhaltende Kopfschmerzen unbekannter Ursache;
- Verlust des Bewusstseins oder Ohnmacht mit oder ohne Krampfanfall.
Vorübergehende Symptome deuten auf eine transitorische ischämische Attacke (TIA) hin.
Bei einem Myokardinfarkt (MI) können folgende Symptome auftreten:
- Schmerz, Unbehagen, Druck, Schweregefühl, Enge- oder Völlegefühl in Brust, Arm oder unterhalb des Sternums;
- in den Rücken, Kiefer, Hals, Arm, Magen ausstrahlende Beschwerden;
- Völlegefühl, Indigestion oder Erstickungsgefühl;
- Schwitzen, Übelkeit, Erbrechen oder Schwindelgefühl;
- extreme Schwäche, Angst oder Kurzatmigkeit;
- schnelle oder unregelmäßige Herzschläge.
2. Tumorerkrankungen
• Epidemiologische Studien deuten darauf hin, dass die Langzeiteinnahme oraler Kontrazeptiva für Frauen, die mit dem humanen Papillomavirus (HPV) infiziert sind, das Risiko in sich birgt, ein Zervixkarzinom zu entwickeln. Es ist allerdings noch ungewiss, inwieweit dieser Befund durch andere Faktoren (wie z. B. Anzahl der Sexualpartner oder Verwendung von mechanischen Verhütungsmitteln) beeinflusst wird.
• Eine Metaanalyse von 54 epidemiologischen Studien hat ergeben, dass das relative Risiko der Diagnosestellung eines Mammakarzinoms bei Frauen, die kombinierte orale Kontrazeptiva einnehmen, geringfügig erhöht (RR = 1,24) ist. Nach Absetzen kombinierter oraler Kontrazeptiva sinkt das erhöhte Risiko kontinuierlich und verschwindet innerhalb von 10 Jahren. Da Mammakarzinome bei Frauen vor dem 40. Lebensjahr selten sind, ist bei Frauen, die ein kombiniertes orales Kontrazeptivum einnehmen oder bis vor kurzem eingenommen haben, die zusätzlich diagnostizierte Anzahl an Mammakarzinomen im Verhältnis zum MammakarzinomGesamtrisiko gering. Diese Studien liefern keine Hinweise auf eine Kausalität. Die beobachtete Risikoerhöhung kann sowohl auf eine bei Anwenderinnen von kombinierten oralen Kontrazeptiva frühzeitigere Erkennung als auch auf biologische Wirkungen von kombinierten oralen Kontrazeptiva oder auf beide Faktoren gemeinsam zurückzuführen sein. Mammakarzinome bei Frauen, die ein kombiniertes orales Kontrazeptivum eingenommen haben, waren zum Zeitpunkt der Diagnosestellung tendenziell weniger weit fortgeschritten als bei Frauen, die nie ein kombiniertes orales Kontrazeptivum eingenommen haben.
• In seltenen Fällen wurde unter Anwendung von KHK über das Auftreten von gutartigen und noch seltener bösartigen Lebertumoren berichtet. In Einzelfällen haben diese Tumoren zu lebensbedrohlichen intraabdominalen Blutungen geführt. Kommt es unter der Anwendung von KHK zu starken Schmerzen im Oberbauch, zu einer Lebervergrößerung oder zu Hinweisen auf intraabdominale Blutungen, muss differentialdiagnostisch ein Lebertumor in Erwägung gezogen werden.
• 3. Sonstige Erkrankungen
Bei Frauen mit bestehender oder familiärer Hypertriglyzeridämie ist unter der Anwendung von KHK möglicherweise mit einem erhöhten Pankreatitis-Risiko zu rechnen.
• Obwohl unter der Anwendung von KHK relativ häufig über geringfügigen Blutdruckanstieg berichtet wird, sind klinisch relevant erhöhte Blutdruckwerte selten. Es gibt keinen gesicherten Zusammenhang zwischen der Anwendung von KHK und Hypertonie. Kommt es jedoch unter Anwendung von KHK zu einer deutlichen Blutdruckerhöhung, sollten diese abgesetzt und eine antihypertensive Behandlung eingeleitet werden. Die neuerliche Anwendung von KHK kann erwogen werden, sobald sich die Blutdruckwerte unter antihypertensiver Behandlung normalisiert haben.
• Über Auftreten oder Verschlechterung folgender Erkrankungen wurde sowohl bei Schwangeren als auch unter Anwendung von KHK berichtet, doch lassen die verfügbaren Daten keine klaren kausalen Schlüsse zu: Cholestatischer Ikterus und/oder Pruritus; Cholelithiasis; Porphyrie; systemischer Lupus erythematodes; hämolytisch-urämisches Syndrom; Chorea minor; Herpes gestationis; Otosklerose-bedingter Hörverlust; (hereditäres) Angioödem.
• Akute und chronische Leberfunktionsstörungen können ein Absetzen von KHK erforderlich machen, bis sich die Leberfunktionsparameter wieder normalisiert haben. Beim Wiederauftreten eines cholestatischen Ikterus, der erstmalig während einer Schwangerschaft oder während einer früheren Einnahme von Sexualsteroidhormonen aufgetreten ist, müssen KHK abgesetzt werden.
• Obwohl es unter der Anwendung von KHK zu einer Beeinflussung der peripheren Insulinresistenz und der Glukosetoleranz kommen kann, scheint eine Änderung des Therapieschemas bei Diabetikerinnen nicht erforderlich. Dennoch sollten Frauen mit Diabetes, die KHK anwenden, sorgfältig überwacht werden.
• M. Crohn und Colitis ulcerosa sind in Zusammenhang mit der Anwendung von KHK gebracht worden.
• Insbesondere bei Frauen mit anamnestisch bekanntem Chloasma gravidarum kann es gelegentlich zu einem Chloasma kommen. Bei Chloasma-Neigung sind daher unter der Anwendung von KHK Sonnenlicht und UV-Strahlung zu meiden.
• Novial enthält weniger als 65 mg Lactose pro Tablette. Diese Menge sollte bei Anwenderinnen mit der selten auftretenden, angeborenen Galactose-Intoleranz, mit Lactase-Mangel oder mit Glucose-Galactose-Malabsorption, die eine Lactose-freie Diät einhalten müssen, berücksichtigt werden.
Alle oben aufgeführten Informationen müssen bei der Abwägung und Auswahl einer geeigneten kontrazeptiven Methode Berücksichtigung finden.
Ärztliche Untersuchung/Beratung
Vor der Einleitung oder Wiederaufnahme der Behandlung mit Novial muss eine vollständige Anamnese (mit Erhebung der Familienanamnese), erfolgen und eine Schwangerschaft ausgeschlossen werden. Der Blutdruck sollte gemessen und eine körperliche Untersuchung durchgeführt werden, die sich an den Gegenanzeigen (siehe Abschnitt 4.3) und Warnhinweisen (siehe Abschnitt 4.4) orientiert. Es ist wichtig, die Frau auf die Informationen zu venösen und arteriellen Thrombosen hinzuweisen, einschließlich des Risikos von Novial im Vergleich zu anderen KHK, die Symptome einer VTE und ATE, die bekannten Risikofaktoren und darauf, was im Falle einer vermuteten Thrombose zu tun ist.
Die Anwenderin ist zudem anzuweisen, die Packungsbeilage sorgfältig zu lesen und die darin gegebenen Ratschläge zu befolgen. Die Häufigkeit und Art der Untersuchungen sollte den gängigen Untersuchungsleitlinien entsprechen und individuell auf die Frau abgestimmt werden.
Die Anwenderinnen sind darüber aufzuklären, dass hormonale Kontrazeptiva nicht vor HIV-Infektionen (AIDS) und anderen sexuell übertragbaren Krankheiten schützen.
Verminderte Wirksamkeit
Die Wirksamkeit von KHK kann beeinträchtigt sein z. B. bei vergessener Tabletteneinnahme (siehe Abschnitt 4.2 "Vorgehen bei vergessener Tabletteneinnahme"), gastrointestinalen Beschwerden (siehe Abschnitt 4.2 " Verhalten bei gastrointestinalen Beschwerden") oder gleichzeitiger Anwendung weiterer Arzneimittel (siehe Abschnitt "4.5"Wechselwirkungen").
Pflanzliche Arzneimittel, die Johanniskraut (Hypericum perforatum) enthalten, sollten nicht gleichzeitig mit Novial angewendet werden, da das Risiko besteht, dass die Plasmakonzentrationen erniedrigt werden und die Wirksamkeit von Novial eingeschränkt wird (siehe Abschnitt 4.5).
Beeinträchtigung der Zykluskontrolle
Bei allen KHK kann es, insbesondere in den ersten Monaten der Anwendung, zu unregelmäßigen Blutungen (Schmier- bzw. Durchbruchblutungen) kommen. Daher ist eine diagnostische Abklärung unregelmäßiger Blutungen erst nach einer Anpassungsphase von ca. 3 Zyklen sinnvoll.
Persistieren die Blutungsunregelmäßigkeiten oder treten sie nach zuvor regelmäßigen Zyklen auf, müssen auch nicht hormonal bedingte Ursachen in Betracht gezogen werden. Demnach sind entsprechende diagnostische Maßnahmen zum Ausschluss einer Schwangerschaft oder einer malignen Erkrankung, ggf. auch eine Kürettage, angezeigt.
Bei manchen Frauen kann die Entzugsblutung während des einnahmefreien Intervalls ausbleiben. Falls das KHK entsprechend den in Abschnitt 4.2 gegebenen Anweisungen angewendet wurde, ist eine Schwangerschaft unwahrscheinlich. Wurden KHK allerdings vor der ersten ausgebliebenen Entzugsblutung nicht vorschriftsmäßig angewendet oder sind zwei Entzugsblutungen ausgeblieben, muss vor der weiteren Anwendung von KHK eine Schwangerschaft ausgeschlossen werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Hinweis: Die Fachinformationen der gleichzeitig verwendeten Arzneimittel sollten hinzugezogen werden, um potentielle Wechselwirkungen zu identifizieren.
Wirkungen anderer Arzneimittel auf Novial
Wechselwirkungen können mit Arzneimitteln auftreten, die mikrosomale Enzyme induzieren, was zu einer erhöhten Clearance von Sexualhormonen und damit zu Durchbruchblutungen und/oder Ausbleiben der kontrazeptiven Wirkung führen kann.
Management
Eine Enzyminduktion kann bereits nach wenigen Behandlungstagen beobachtet werden. Die maximale Enzyminduktion tritt üblicherweise innerhalb weniger Wochen auf. Nach der Beendigung der Arzneimitteltherapie kann die Enzyminduktion für ca. 4 Wochen anhalten.
Kurzzeitbehandlung
Frauen, die eine Behandlung mit enzyminduzierenden Arzneimitteln erhalten, sollten zusätzlich zu dem KOK vorübergehend eine mechanische oder eine andere Verhütungsmethode verwenden. Die mechanische Verhütungsmethode muss während der ganzen Zeit der gleichzeitigen medikamentösen Therapie und für 28 Tage nach Beendigung der Therapie angewendet werden.
Wenn die medikamentöse Behandlung länger dauert, als Tabletten in der aktuellen KOK-Packung enthalten sind, sollte mit der nächsten KOK-Packung unmittelbar nach der vorherigen ohne die übliche Einnahmepause begonnen werden.
Langzeitbehandlung
Bei Frauen, die eine langfristige Behandlung mit leberenzyminduzierenden Wirkstoffen erhalten, werden andere zuverlässige, nicht-hormonelle Verhütungsmethoden empfohlen.
In der Literatur wurden folgende Wechselwirkungen berichtet.
Wirkstoffe, die die Clearance von KOK erhöhen (verringerte Wirksamkeit von KOK durch Enzyminduktion), z. B.:
Barbiturate, Bosentan, Carbamazepin, Phenytoin, Primidon, Rifabutin, Rifampicin und die HIV-Medikamente Ritonavir, Nelfinavir Nevirapin und Efavirenz und möglicherweise auch Felbamat, Griseofulvin, Oxcarbazepin, Modafinil, Topiramat und Produkte, die das pflanzliche Arzneimittel Johanniskraut (Hypericum perforatum) enthalten.
Wirkstoffe mit unterschiedlichen Auswirkungen auf die Clearance von KOK
Bei gleichzeitiger Verabreichung mit KOK können viele Kombinationen von HIV-Protease-Inhibitoren und Nicht-nukleosidischen Reverse-Transkriptase-Inhibitoren, einschließlich Kombinationen mit HCV-Hemmern die Plasmakonzentrationen von Östrogen oder Gestagenen erhöhen oder verringern. In einigen Fällen können die Nettoeffekte dieser Veränderungen klinisch relevant sein.
Daher sollten die Fachinformationen der gleichzeitig verabreichten HIV/HCV-Arzneimittel konsultiert werden, um sich über mögliche Wechselwirkungen und alle damit verbundenen Empfehlungen zu informieren. Im Zweifelsfall sollten Frauen eine zusätzliche mechanische Verhütungsmethode anwenden, wenn sie mit einem Protease-Inhibitor oder Nicht-nukleosidischen Reverse-Transkriptase-Inhibitoren behandelt werden.
Wirkungen von Novial auf andere Arzneimittel
Orale Kontrazeptiva können den Metabolismus anderer Arzneimittel beeinflussen. Plasma- und Gewebskonzentrationen können folglich ansteigen (z. B. Cyclosporin) oder abnehmen (z. B. Lamotrigin).
Labortests
Die Anwendung kontrazeptiver Steroide kann die Ergebnisse bestimmter Labortests beeinflussen, u. a. biochemische Parameter der Leber-, Schilddrüsen-, Nebennieren- und Nierenfunktion, ferner Plasmaspiegel von (Carrier-)Proteinen, wie Transcortin (CBG) und Lipid- bzw. Lipoproteinfraktionen, Parameter des Kohlenhydratstoffwechsels sowie der Blutgerinnung und Fibrinolyse. Diese Änderungen bewegen sich im Allgemeinen innerhalb des entsprechenden Normalbereichs.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Novial ist während der Schwangerschaft nicht angezeigt. Tritt während der Anwendung von Novial eine Schwangerschaft ein, ist das Präparat abzusetzen. In den meisten epidemiologischen Untersuchungen fand sich jedoch weder ein erhöhtes Risiko für Missbildungen bei Kindern, deren Mütter vor der Schwangerschaft KHK eingenommen hatten, noch eine teratogene Wirkung bei versehentlicher Anwendung von KHK in der Frühschwangerschaft.
Das erhöhte VTE-Risiko in der Zeit nach der Geburt sollte vor der erneuten Anwendung nach einer Anwendungspause bedacht werden (siehe Abschnitte 4.2 und 4.4).
Stillzeit
Die Laktation kann durch KHK beeinflusst werden, da sie die Menge der Muttermilch reduzieren und deren Zusammensetzung verändern können. Bis die stillende Mutter ihr Kind vollkommen abgestillt hat, sollte eine Anwendung von KHK daher generell nicht empfohlen werden. Zwar können geringe Mengen der kontrazeptiv wirksamen Steroide und/oder deren Metaboliten in die Milch gelangen, Hinweise auf nachteilige Auswirkungen auf die Gesundheit des Kindes liegen jedoch nicht vor.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Novial hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Beschreibung ausgewählter Nebenwirkungen
Bei Anwenderinnen von KHK wurde ein erhöhtes Risiko für arterielle und venöse thrombotische und thromboembolische Ereignisse einschließlich Myokardinfarkt, Schlaganfall, transitorische ischämische Attacken, Venenthrombose und Lungenembolie beobachtet, die in Abschnitt 4.4 eingehender behandelt werden.
Es wurden weitere Nebenwirkungen bei Anwenderinnen von KHK berichtet. Darunter sind: Hypertonie; hormonabhängige Tumore (z. B. Lebertumore, Brustkrebs); Chloasma. Sie werden in Abschnitt 4.4 eingehender behandelt.
Wie bei allen KHK können Veränderungen des vaginalen Blutungsmusters auftreten, insbesondere während der ersten Monate der Anwendung. Dies kann Änderungen der Häufigkeit (ausbleibend, seltener, häufiger oder kontinuierlich), Intensität (erhöht oder vermindert) oder Dauer der Blutung beinhalten.
Nebenwirkungen, die möglicherweise mit der Anwendung von Novial oder anderen KHK in Zusammenhang stehen, sind in der nachfolgenden Tabelle aufgelistet1. Alle Nebenwirkungen sind nach Systemorganklasse und Häufigkeit aufgeführt: häufig (>1/100), gelegentlich (>1/1.000 bis <1/100) und selten (<1/1.000).
|
Systemorgansystemklasse |
Häufig |
Gelegentlich |
Selten |
|
Erkrankungen des Immunsystems |
Überempfindlichkeit | ||
|
Stoffwechsel- und Ernährungsstörungen |
Flüssigkeitsretention | ||
|
Psychiatrische Erkrankungen |
depressive Verstimmung, Stimmungs schwankungen |
verminderte Libido |
vermehrte Libido |
|
Erkrankungen des |
Kopfschmerzen |
Migräne |
|
Nervensystems | |||
|
Augenerkrankungen |
Beschwerden beim Tragen von Kontaktlinsen | ||
|
Gefäßerkrankungen |
Venöse Thromboembolien, Arterielle Thromboembolien | ||
|
Erkrankungen des Gastrointestinaltraktes |
Übelkeit, abdominale Schmerzen |
Erbrechen, Diarrhö | |
|
Erkrankungen der Haut und des Unterhaut-Zellgewebes |
Hautausschlag, Urtikaria |
Erythema nodosum, Erythema multiforme | |
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Brustschmerzen, Spannungsgefühl in den Brüsten |
Brustvergrößerung |
Fluor vaginalis, Brustdrüsensekretion |
|
Untersuchungen |
Gewichtszunahme |
Gewichtsabnahme |
1 In der Tabelle ist der passendste MedDRA Terminus zur Beschreibung einer bestimmten unerwünschten Arzneimittelwirkung aufgeführt. Synonyme oder ähnliche Erkrankungsbilder sind nicht aufgeführt, sollten jedoch ebenfalls in Betracht gezogen werden.
Wechselwirkungen
Wechselwirkungen zwischen anderen Arzneimitteln (Enzyminduktoren) und oralen Kontrazeptiva können zu Durchbruchblutungen und/oder Ausbleiben der kontrazeptiven Wirkung führen (siehe Abschnitt 4.5).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Es liegen keine Meldungen über schwerwiegende Folgen bei Überdosierung vor.
Symptome einer Überdosierung sind: Übelkeit, Erbrechen sowie geringfügige vaginale Blutungen bei jungen Mädchen. Ein Antidot ist nicht bekannt, die Behandlung hat symptomatisch zu erfolgen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Sexualhormone und Modulatoren des Genitalsystems, Gestagene und Estrogene, Sequenzialpräparate, ATC-Code: G03A B05
Die empfängnisverhütende Wirkung von KHK beruht auf verschiedenen Faktoren, als deren wichtigste die Ovulationshemmung und die Veränderung des Zervikalsekrets anzusehen sind. Neben der kontrazeptiven Wirkung haben KHK verschiedene günstige Eigenschaften, die unter Berücksichtigung der negativen Wirkungen (siehe Warnhinweise, Nebenwirkungen) die Wahl der Verhütungsmethode beeinflussen können. Die Zyklen werden regelmäßiger, die Menstruation oft weniger schmerzvoll und die Blutungen sind schwächer. Letzteres verringert die Häufigkeit von Eisenmangel. Zusätzlich zeigte sich, zumindest unter höher dosierten KHK (50 Mikrogramm Ethinylestradiol), ein verringertes Risiko von fibrozystischen Mastopathien, Ovarialzysten, Infektionen innerer Genitalorgane (pelvic inflammatory disease), ektopischen Schwangerschaften und Endometrium- bzw. Ovarialkarzinomen. Inwieweit dies auch für niedriger dosierte KHK zutrifft, bleibt nachzuweisen.
In klinischen Studien wurde gezeigt, dass Novial die androgenen Parameter 3-a-Androstendiolglucuronid, Androstendion, DHEA-S und freies Testosteron signifikant erniedrigt.
Kinder und Jugendliche
Es liegen keine Studien zur Wirksamkeit und Unbedenklichkeit bei Jugendlichen unter 18 Jahren vor.
5.2 Pharmakokinetische Eigenschaften
Desogestrel
Resorption
Desogestrel wird nach oraler Verabreichung rasch und vollständig resorbiert und in Etonogestrel umgewandelt. Die maximalen Blutspiegel an Etonogestrel erhöhen sich von 1,5 ng/ml am Tag 7 auf 5 ng/ml am Tag 21 des Zyklus und werden ca. 1,5 Stunden nach Verabreichung erreicht. Die Bioverfügbarkeit beträgt 62 bis 81 %.
Verteilung
Etonogestrel wird sowohl an Albumin als auch an sexualhormonbindendes Globulin (SHBG) gebunden. Nur 2 bis 4 % der Gesamtkonzentration im Serum sind freies Steroid, 40 bis 70 % sind spezifisch an SHBG gebunden. Die Ethinylestradiol-bedingte Zunahme der SHBG-Konzentration beeinflusst die relative Bindung an Serumproteine, was zu einem Anstieg der SHBG-Bindung und zu einer Abnahme der Albumin-Bindung führt. Das scheinbare Verteilungsvolumen von Desogestrel beträgt 1,5 l/kg.
Biotransformation
Etonogestrel wird komplett über die bekannten Wege des Steroidabbaus metabolisiert. Die metabolische Clearance aus dem Serum beträgt 2 ml/min/kg. Es gibt keine metabolischen Interaktionenen mit gleichzeitig verabreichtem Ethinylestradiol.
Elimination
Die Etonogestrel-Serumspiegel nehmen zweiphasig mit einer Halbwertszeit von 30 Stunden in der terminalen Dispositionsphase ab. Desogestrel und seine Metaboliten werden mit dem Harn und der Galle in einem Verhältnis von ca. 6 : 4 ausgeschieden.
Steady-state-Bedingungen
Die Pharmakokinetik von Etonogestrel wird durch die SHBG-Spiegel beeinflusst, die durch Ethinylestradiol um das Dreifache erhöht werden. Bei täglicher Einnahme nehmen die Serumspiegel um etwa das Zwei- bis Dreifache zu, wobei der Steady state in der zweiten Hälfte des Verabreichungszyklus erreicht wird.
Ethinylestradiol
Resorption
Ethinylestradiol wird nach oraler Verabreichung rasch und vollständig resorbiert. Maximale Blutspiegel mit ca. 80 pg/ml werden nach 1 bis 2 Stunden erreicht. Die absolute Bioverfügbarkeit beträgt infolge präsystemischer Konjugatbildung und des First-pass-Effekts ca. 60 %.
Verteilung
Ethinylestradiol ist zu einem Großteil, aber unspezifisch an Serumalbumin gebunden (ca. 98,5 %) und verursacht eine Zunahme der Serumkonzentration von SHBG. Das (scheinbare) Verteilungsvolumen beträgt ca. 5 l/kg.
Biotransformation
Ethinylestradiol wird präsystemisch sowohl in der Schleimhaut des Dünndarms als auch in der Leber konjugiert. Es wird primär durch aromatische Hydroxylierung verstoffwechselt und in eine Vielzahl von hydroxylierten und methylierten Metaboliten umgewandelt, die sowohl in freier Form als auch als Glucuronide und Sulfate vorliegen. Die metabolische Clearance beträgt ca. 5 ml/min/kg.
Elimination
Der Ethinylestradiol-Serumspiegel nimmt in zwei Dispositionsphasen mit einer Halbwertszeit von ca. 24 Stunden in der terminalen Dispositionsphase ab. Ethinylestradiol wird nicht in unveränderter Form ausgeschieden. Die Metaboliten werden mit dem Harn und der Galle im Verhältnis von 4 : 6 mit einer Halbwertszeit von ca. 24 h eliminiert.
Steady-state-BedingungenDer Steady state wird nach 3 bis 4 Tagen erreicht, wobei die Serumkonzentration um 30 bis 40 % höher als nach Verabreichung einer Einzeldosis ist.
5.3 Präklinische Daten zur Sicherheit
Präklinische Daten zeigen kein spezielles Risiko für den Menschen, wenn KHK wie empfohlen angewendet werden. Diese Aussage stützt sich auf konventionelle Studien zur chronischen Toxizität, zur Genotoxizität, zum kanzerogenen Potenzial und zur Reproduktionstoxizität. Jedoch muss berücksichtigt werden, dass Sexualsteroide das Wachstum gewisser hormonabhängiger Gewebe und Tumoren fördern können.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Gelbe Filmtabletten:
Tablettenkern: alpha-Tocopherol (Ph.Eur.), Lactose-Monohydrat, Kartoffelstärke, Povidon (K 27,0 -
32.4) , Hochdisperses Siliciumdioxid, Stearinsäure (Ph.Eur.); Filmüberzug: Hypromellose, Macrogol 400, Talkum, Titandioxid [E 171], Eisen(III)-hydroxid-oxid x H2O [E 172].
Rote Filmtabletten:
Tablettenkern: alpha-Tocopherol (Ph.Eur.), Lactose-Monohydrat, Kartoffelstärke, Povidon (K 27,0 -
32.4) , Hochdisperses Siliciumdioxid, Stearinsäure (Ph.Eur.); Filmüberzug: Hypromellose, Macrogol 400, Talkum, Titandioxid [E 171], Eisen(III)oxid
[E 172].
Weiße Filmtabletten:
Tablettenkern: alpha-Tocopherol (Ph.Eur.), Lactose-Monohydrat, Kartoffelstärke, Povidon (K 27,0 -
32.4) , Hochdisperses Siliciumdioxid, Stearinsäure (Ph.Eur.); Filmüberzug: Hypromellose, Macrogol 400, Talkum, Titandioxid [E 171].
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit 3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 30 °C lagern.
In der Originalverpackung aufbewahren.
6.5 Art und Inhalt des Behältnisses
PVC/Aluminium-Blisterpackung, verpackt in einem Aluminium-beschichteten Beutel. Packungsgrößen: 21, 3 x 21 und 6 x 21 Tabletten
Jede Blisterpackung enthält 21 Tabletten (7 gelbe, 7 rote und 7 weiße Tabletten).
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
Aspen Pharma Trading Limited, 3016 Lake Drive, Citywest Business Campus, Dublin 24, Irland
8. ZULASSUNGSNUMMER
46695.00.00
9. DATUM DER VERLÄNGERUNG DER ZULASSUNG
November 2006
10. STAND DER INFORMATION
Mai 2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Diese Inzidenzen wurden aus der Gesamtheit der epidemiologischen Studiendaten abgeleitet, wobei relative Risiken der verschiedenen Arzneimittel im Vergleich zu Levonorgestrel-haltigen KHK verwendet wurden.
Mittelwert der Spannweite 5-7 pro 10.000 Frauenjahre, auf der Grundlage eines relativen Risikos für Levonorgestrel-haltige KHK versus Nichtanwendung von ungefähr 2,3 bis 3,6