Novocart[R] 3D
Zusammenfassung der wesentlichen Merkmale des ATMP
1. Bezeichnung des Arzneimittels
a) NOVOCART® 3D
Trägergekoppeltes autologes Chondrozytentransplantatprodukt, humanen Ursprungs.
b) Stoffgruppe: Arzneimittel für neuartige Therapien (biotechnologisch bearbeitetes Gewebeprodukt), autolog.
2. Qualitative und quantitative Zusammensetzung nach Wirkstoffen und den sonstigen Bestandteilen
2.1 Qualitative Beschreibung
a) Wirkstoff:
Autologe, in-vitro expandierte, charakterisierte und vitale humane Chondrozyten (Knorpelzellen).
b) Sonstige Bestandteile:
Kollagen basierte biphasische Matrix bovinen Ursprungs.
Medium.
Zur vollständigen Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
2.2 Quantitative Beschreibung
11 cm2 Kollagenmatrix mit einer Gesamtzellzahl von 8,25 - 44 Mio. Chondrozyten.
Zellzahl: 0,75 Mio.- 4 Mio./cm2 Matrix.
Das Transplantatprodukt NOVOCART® 3D wird in ca.15,8 ml farblosem Transportmedium ausgeliefert.
3. Darreichungsform
Chondrozyten-besiedelte biphasische Matrix zur chirurgischen Anwendung. Das Implantat besteht aus einer undurchsichtigen Membran-Schwammstruktur, die zellbesiedelt eine weiße bis weißgelbliche Färbung aufweist. Die abdeckende Membran ist glatt, der dem Boden des Defekts zuzuwendende, zellbesiedelte Schwamm der Matrix porös.
4. Klinische Angaben
4.1 Anwendungsgebiete
Operativ biologische Rekonstruktion vollschichtiger Gelenkknorpelschäden des Kniegelenks mittels trägergekoppelter Transplantation autologer Chondrozyten (ACT) mit einer Mindestdefektgröße von 2,5 cm2 und einer maximalen Einzeldefektgröße von 10 cm2, die nicht überschritten werden darf. Es können maximal zwei Einzeldefekte parallel behandelt werden, diese müssen darüber hinaus voneinander unabhängig sein. Bei der Behandlung von zwei unabhängigen Einzeldefekten, muss deren Fläche in der Summe mindestens 5 cm2 betragen. Geeignete Defektindikationen stellen lokalisierte, klinisch symptomatische Gelenkknorpelschäden 3. und 4. Grades nach der ICRS-Klassifikation dar, die durch akute oder Wiederholungstraumata oder durch eine Osteochondrosis dissecans verursacht wurden und die nur inadäquat auf konservative Behandlungsmethoden ansprechen. Bei guter Patientencompliance können auch lokalisiert degenerative, jedoch nicht diffus-degenerative Knorpelschäden mit NOVOCART® 3D behandelt werden. Eine vollständig erhaltene Knorpelrandleiste ist nicht erforderlich, da die zellbesiedelte biphasische Matrix von
NOVOCART® 3D mit Hilfe spezieller resorbierbarer Minipins und unter Anwendung eines entsprechenden Instrumentariums transossär verankert werden kann.
Als orientierende obere Altersgrenze für die Behandlung mit NOVOCART® 3D ist das 50. Lebensjahr anzusehen.
Kinder und Jugendliche: Auf Grund des noch vorhandenen intrinsischen Regenerationspotenzials bei Kindern sollte NOVOCART® 3D bis zum Abschluss des Wachstums nicht als primäres Behandlungsverfahren angewendet werden. Als radiologisches Ausschlusskriterium dient der Nachweis offener Epiphysenfugen.
4.2 Empfohlene Dosierung, Art und Dauer der Anwendung
NOVOCART® 3D ist ausschließlich für die autologe Anwendung bestimmt und darf nur von einem Arzt mit produktspezifischem Fachwissen (Teilnahme an einer Schulung zur Gewebeentnahme und Transplantation von NOVOCART® 3D) durchgeführt werden. Ferner sind wichtige gesetzliche Vorgaben, die Durchführung der aseptischen Entnahme von Knorpelgewebe und die aseptische Implantation von NOVOCART® 3D in einem Handbuch mit Anweisungen für die klinische Anwendung beschrieben und müssen berücksichtigt werden.
Dosierung:
Die zellbesiedelte Matrix muss intraoperativ vom Chirurgen entsprechend der Form und Größe des Knorpelschadens zugeschnitten werden, um zu gewährleisten, dass der Defekt vollständig abgedeckt ist. Die dabei angewendete Dosis entspricht 0,75 - 4 Mio. Chondrozyten pro cm2 Matrix bzw. Defektfläche, wobei der zellbesiedelte Schwammanteil der Matrix auf die zuvor präparierte und von geschädigtem Knorpelgewebe befreite Knochenlammelle des Knorpelschadens implantiert wird.
Dosierungsanpassungen:
Das Trägermaterial wird entsprechend der Defektgröße passend zugeschnitten oder ausgestanzt. Das für die Herstellung von NOVOCART® 3D erforderliche autologe Knorpelgewebe zur Zellanzucht wird arthroskopisch mit Hilfe einer Knorpel-Knochen-Stanze gewonnen (spezielle Entnahmetrephine als steriles Einmalinstrument). Pro NOVOCART® 3D Einheit müssen zwei Stanzzylinder entnommen werden. Die Anzahl der zu entnehmenden Knorpel-Knochenstanzen ist in der nachfolgenden Tabelle dargestellt.
|
Einzeldefektgröße* |
Anzahl zu entnehmender Stanzen |
Anzahl N3D |
|
> 2,5 cm2 bis < 10 cm2 |
2 |
1 |
|
Summe zweier Einzeldefekte* |
Anzahl zu entnehmender Stanzen |
Anzahl N3D |
|
> 5 cm2 bis < 10 cm2 |
2 |
1 |
|
>10 cm2 bis < 20 cm2 |
4 |
2 |
*Bitte beachten Sie die im Kapitel 4.1 Anwendungsgebiete genannten Größenbeschränkungen für die mit N3D behandelbaren Defekte.
Art der Anwendung:
Zur chirurgischen Anwendung. Für die Behandlung mit NOVOCART® 3D sind zwei operative Eingriffe notwendig. Bei der ersten OP wird die Gewebeentnahme vorgenommen. Diese muss mit dem dazugehörigen Knorpelentnahme-Set durchgeführt werden.
In der zweiten OP findet die Retransplantation der autologen Knorpelzellen statt, die auf einer Trägermatrix fixiert sind. Zur Transplantation wird das mitgelieferte Instrumentenset (Ringstanzen und Küretten) empfohlen. Mit den Instrumenten wird das Defektdebridement bis auf die intakte subchondrale Knochenlamelle vorgenommen. Auftretende Blutungen der Knochenplatte sind durch Epinephrin oder durch punktuell und sparsam aufgetragenen Fibrinkleber zu stillen. Mit der zur Defektpräparation verwendeten Ringstanze wird anschließend die individuelle Transplantatgröße ausgestanzt. Die Implantatfixierung in der präparierten Defektkammer erfolgt mit Hilfe resorbierbarer Einzelknopfnähte oder Minipins. Im Falle der Behandlung eines osteochondralen Defekts, z.B. bei Osteochondrosis dissecans, ist vor der Anwendung von NOVOCART® 3D die subchondrale Knochenlammelle zu rekonstruieren.
Nähere Details zur OP-Vorbereitung und -durchführung sowie zur postoperativen Nachbehandlung sind im Anwenderhandbuch von NOVOCART® 3D beschrieben.
4.3 Gegenanzeigen
Überempfindlichkeit gegenüber Rindereiweiß oder einem anderen der in Abschnitt 6.1 genannten sonstigen Bestandteile. NOVOCART® 3D sollte nicht während der Schwangerschaft und Stillzeit angewendet werden.
Anatomisch-orthopädische Ausschlusskriterien:
• Osteoarthrose (radiologisches Ausschlusskriterium: Strukturveränderungen größer Grad 2 nach Kellgren und Lawrence)
• Gelenksteife
• Arthrofibrose
• Abweichung von der physiologischen Beinachse von mehr als 3° (Korrektur zeitnah zur ACT)
• Total/subtotal resezierter Meniskus (Teilresektion bis max. ein Drittel des Gesamtvolumens ist zulässig)
• Insuffiziente Bandführung (Korrektur zeitnah zur ACT)
• Patellamalalignement (Korrektur vor oder während der ACT)
• Implantierte Carbonstifte oder Schlittenprothesen
• Entzündliche Gelenkerkrankungen (z.B. rheumatoide Arthritis)
• Knorpelschäden < 2.5 cm2 Gesamtfläche (nach Defektpräparation) bei Verwendung von NOVOCART® 3D als primär rekonstruktives Behandlungsverfahren
• Knorpelschaden > 10 cm2 pro behandeltem Einzeldefekt
• Korrespondierende Knorpelschäden ("kissing leasons")
• Mehr als zwei voneinander unabhängige Knorpelschäden desselben Gelenks
• Primär knorpelrekonstruktives Verfahren bei Kindern und Jugendlichen mit offenen Wachstumsfugen
• Diffuse Chondromalazie
• Angeborene oder erworbene Deformationen der Patella Andere Ausschlusskriterien:
• Chronische Infektionskrankheiten (nicht grundsätzlich bei Hepatitis oder HIV)
• Unbehandelte Störungen der Blutgerinnung
• Tumorkrankheiten, bestehend oder innerhalb der letzten 5 Jahre
• Metabolische Arthropathien (z.B. Gicht/Pseudogicht)
• Autoimmunologische Erkrankungen
• Borreliose
• Schwere neurologische oder muskuläre Erkrankungen (ALS; MS)
• Adipositas (Body-Mass-Index > 35)
• Schwangerschaft und Stillzeit
• Suchterkrankungen
• Psychische Erkrankungen mit reduzierter Compliance
• Allergie gegen Rindereiweiß oder Überempfindlichkeit gegen einen der unter Abschnitt 6.1 genannten anderen Hilfsstoffe
• Knochenerkrankungen (z.B. Morbus Paget), Kollagenosen oder andere schwerwiegende Stoffwechselerkrankungen des Bindegewebes (z.B. Ehlers-Danlos-Syndrom)
• Periphere arterielle Verschlusskrankheit
• Fortgeschrittene Osteoporose oder Osteopenie
• Primärer Hyperparathyreoidismus oder Hyperthyreoidismus
• Erkrankungen mit skeletären Entwicklungsstörungen, wie z.B. Stickler-Syndrom, Spina bifida, Osteogenesis imperfecta oder Kaschin-Beck-Krankheit
• Rachitis
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Vorsichtsmaßnahmen des anwendenden Arztes:
NOVOCART® 3D ist ein autologes Zellimplantat und darf ausschließlich bei dem Patienten angewendet werden, für den es hergestellt wurde. Vor der Implantation ist daher vom behandelnden Arzt zu prüfen, ob die Angaben zur Identität des zu operierenden Patienten mit den entsprechenden Angaben zum Patienten/Spender auf den Versandunterlagen und dem Verpackungssystem von NOVOCART® 3D übereinstimmen. Dabei ist auch die Unversehrtheit des äußeren Transportgefäßes zu kontrollieren (intakte Versiegelung des Schraubdeckels durch das Etikett). Die Transportbox mit dem darin gelagerten Transplantat darf nicht in der Nähe des Gefahrenbereichs von Strahlenquellen, z.B. Bildverstärkern, gelagert werden. Falls Bildverstärker im OP eingesetzt werden, muss während deren Verwendung der Transportkoffer mit dem Transplantat aus dem Gefahrenbereich entfernt werden. Das Transplantat darf nicht gefroren sein und im Verlauf der Anwendung nicht austrocknen oder zu sehr gequetscht werden, da hierdurch die biologischen Funktionen der Chondrozyten und damit die Wirksamkeit von NOVOCART® 3D beeinträchtigt werden können.
Um unphysiologische Gelenkbelastungen zu vermeiden und um günstige Heilungsbedingungen zu schaffen, müssen bestehende Begleitpathologien, wie z.B. eine Achsfehlstellung oder auch ein Patellamalalignement, zeitnah korrigiert werden. Ferner sollte das Gelenk keine übermäßige Laxität aufweisen. Sowohl vordere als auch hintere Kreuzbänder des Kniegelenks sollten stabil sein oder es sollte eine auch funktionell wirksame Rekonstruktion durchgeführt werden, um Scherkräfte und Drehbelastungen auf das Gelenk zu reduzieren. Lokalisiert degenerative Knorpelschäden und Defekte der Patella weisen im Durchschnitt höhere Komplikationsraten auf. Hierüber muss ein Patient ggf. aufgeklärt werden.
Folgende Voraussetzungen für eine ACT mit NOVOCART® 3D sollten gegeben sein:
• intakte korrespondierende Gelenkfläche (Schädigung bis maximal Grad II nach ICRS-Klassifikation)
• intakter Meniskus (Teilresektion bis max. ein Drittel des Gesamtvolumens)
• maximal zwei unabhängige Defekte, die nicht korrespondieren (keine "kissing leasons")
• intakte Band- und Patellaführung, physiologische oder korrigierte Beinachse
• freie Gelenkbeweglichkeit
Perioperativ sollte ein antibiotischer Schutz zur Infektionsprophylaxe verabreicht werden (siehe hierzu auch Anwenderhandbuch zu NOVOCART® 3D). Für die Implantation ist eine Miniarthrotomie unter aseptischen Bedingungen erforderlich. Je nach Gelenk und Defektlokalisation sind die hierfür geeigneten operativen Zugänge zu verwenden. NOVOCART® 3D sollte erst kurz vor seiner Implantationsvorbereitung aus dem geschlossenen Transportgefäß entnommen werden. Dabei ist zu beachten, dass dieses von außen nicht steril ist.
Während der Herstellung und vor der Implantation von NOVOCART® 3D werden mehrere validierte Sterilitätskontrollen durchgeführt. Die abschließenden Ergebnisse des letzten Sterilitätstests liegen vor Versand noch nicht vor. Sollte zu irgendeinem Zeitpunkt ein positiver Befund festgestellt werden, wird der behandelnde Arzt kontaktiert, um entweder die Absage der Implantation oder einen Aktionsplan basierend auf den patientenspezifischen Umständen und der Risikobewertung zu besprechen.
Postoperative Nachbehandlung und Rehabilitation:
Es sollte eine angemessen überwachte und mehrstufige Rehabilitation durchgeführt werden, wobei deren Art und Weise in erster Linie vom betroffenen Gelenk und der anatomischen Lage des Defekts im Gelenk bestimmt ist. Biomechanisch meist höher belastete Gelenke wie das Kniegelenk sollten dabei für mehrere Wochen entlastet werden. Außerdem können verschiedene physiotherapeutische Maßnahmen sinnvoll bzw. erforderlich sein, die vom behandelnden Arzt je nach Gelenk und Defektsituation indiziert werden können. Auf belastende Sportarten sollte in der Regel für mindestens 12 Monate verzichtet werden. Aus Studien bzw. Nachuntersuchungen ist bekannt, dass die zu frühe Wiederaufnahme belastender Sportarten zu schlechteren klinischen Ergebnissen führen kann. Weitere Ausführungen zur postoperativen Nachbehandlung sind im Anwenderhandbuch von NOVOCART® 3D enthalten.
Vorsichtsmaßnahmen des Patienten zum Eigenschutz, dem Schutz der Umwelt/ Familie:
Bitte beachten Sie Gegenanzeigen und Kontraindikationen.
4.5 Wechselwirkungen mit anderen Arzneimitteln oder anderen Mitteln
Form- oder glutaraldehydhaltige Proteinkleber (z.B. mit Fibrin oder Albumin) dürfen nicht zusammen mit NOVOCART® 3D angewendet werden, da diese Substanzen zytotoxische Wirkung aufweisen können. Ähnliches gilt für die intraartikuläre Gabe von Analgetika, weshalb auch diese im Rahmen der Anwendung von NOVOCART® 3D nicht empfohlen wird.
4.6 Verwendung während der Schwangerschaft und Stillzeit
Es liegen keine hinreichenden Daten für die Anwendung von autologen Chondrozyten bei Schwangeren oder während der Stillzeit vor. Angesichts der Art und beabsichtigten klinischen Anwendung von NOVOCART® 3D werden konventionelle Studien zur Reproduktions- und Entwicklungstoxizität als nicht relevant angesehen. In Anbetracht der lokalen Applikation des Arzneimittels werden keine unerwünschten Wirkungen auf die Schwangerschaft oder auf ein zu stillendes Kind erwartet. Da NOVOCART® 3D jedoch mithilfe invasiver Operationstechniken implantiert wird, kann die Anwendung während der Schwangerschaft oder Stillzeit nicht empfohlen werden.
Wird eine Patientin nach der Entnahme von Gewebe, aber vor der Reimplantation von NOVOCART® 3D schwanger, können die entnommenen Zellen optional kryokonserviert werden. Die Retransplantation wird dann für einen Zeitpunkt nach der beendeten Schwangerschaft und Stillzeit angesetzt.
Wird eine Patientin nach einer Retransplantation schwanger, sollte die begleitende Schmerzmedikation geprüft und eventuell angepasst werden. Zu möglichen Auswirkungen von NOVOCART® 3D auf die Fertilität liegen keine Daten vor.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen
In der postoperativen Zeit und während der Rehabilitationsphase ist die Verkehrstüchtigkeit und das Bedienen von Maschinen eingeschränkt und durch den behandelnden Arzt zu beurteilen, da das operierte Gelenk über mehrere Wochen nicht voll belastbar ist.
4.8 Erwartete Nebenwirkungen/ unerwünschte Reaktionen
Mögliche unerwünschte Wirkungen können in Ereignisse unterteilt werden, die durch NOVOCART® 3D selbst oder überwiegend durch die mit NOVOCART® 3D verbundenen operativen Eingriffe (Produktimplantation und vorausgehende Knorpelentnahme) entstehen können. Auch andere neben dem Knorpelschaden bestehende Begleitverletzungen, wie z.B.
5
Band- oder Meniskusverletzungen des Kniegelenks, die Defektursache und -lokalisation oder mangelhafte Patientenauswahl oder -compliance, können zum Auftreten oder zur Beeinflussung von Komplikationen oder Beschwerden führen.
Wichtiger Hinweis! NOVOCART® 3D unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit des Arzneimittels. Angehörige von Gesundheitsberufen sind daher aufgefordert, jeden Verdachtsfall einer unerwünschten Nebenwirkung, der im Rahmen der Anwendung von NOVOCART® 3D auftritt, zu melden. Weitere Hinweise zur Meldung von unerwünschten Ereignissen und Nebenwirkungen sind im Anwenderhandbuch beschrieben und sind zu beachten. Grundsätzlich können die nachstehenden Komplikationen auftreten.
Unerwünschte Wirkungen im Zusammenhang mit NOVOCART® 3D:
Vollständiges oder partielles Therapieversagen z.B. durch Implantatvoll- oder Teilablösung, Abstoßung oder Absterben des Implantats, lokal überschießende Knorpelbildung (Transplantathypertrophie), ggf. mit Ausbildung einer Gelenkstufe, Bildung eines freien Gelenkkörpers mit Gelenkblockaden, unvollständige Defektauffüllung, Implantatverknöcherung oder Entstehung von qualitativ minderwertigem Ersatzgewebe (z.B. Faserknorpel) mit Knorpelerweichung (Chondromalazie) oder -degeneration (Chondrose), allergische oder andere Unverträglichkeitsreaktionen. Obwohl GMP-gerecht und mehrfach infektionsserologisch geprüftes allogenes Spenderserum zur Zellanzucht verwendet wird, verbleibt ein Restrisiko für die Übertragung von Infektionen menschlicher Herkunft.
Komplikationen die aufgrund eines operativen Gelenkeingriffs entstehen können: Oberflächliche Wund-, Gelenk- oder systemische Infektionen, Reizung oder Entzündung der Gelenkinnenhaut (Synovitis) oder von Bändern oder Sehnen (Tendinitis) des Gelenks, Pannus- (Verdickung der Gelenkinnenhaut) oder Plicaentstehung (Schwellung mit Faltenbildung der Gelenkinnenhaut) mit hierauf folgender Gelenkentzündung, Fieber, Gelenkerguss, Gelenkschwellung, Verletzung von Blutgefäßen mit Blutergussbildung (Hämatom) oder Gelenkeinblutung (Hämarthros), Einschränkung der Gelenkbeweglichkeit (Arthrofibrose) durch Vermehrung von Bindegewebe, Narbenbildung oder Weichteilverklebungen im Gelenk (Adhäsionen), Verletzung oder Schädigung von gesundem Knorpelgewebe, des Meniskus oder der Bänder (z.B. Kreuzband), Implantatfehlplatzierung, Beeinträchtigung der Beweglichkeit der Kniescheibe, überschießendes Wachstum (Hypertrophie) des Hoffaschen Fettkörpers im Knie, ggf. mit Spannungsgefühl, Schmerzentstehung und Bewegungseinschränkung, Narbenbildung der Haut, ggf. mit Narbenschmerz, Keloidbildung, Verletzung von Nerven mit Gefühlstörungen oder Lähmungserscheinungen, komplexes regionales Schmerzsyndrom mit dystrophen Erscheinungen der betroffenen Extremität, Muskelverletzungen, Muskelatrophie oder -schwäche, Unverträglichkeit gegen Nahtmaterial mit Entstehung von Hautblasen oder Wundheilungsstörungen, Thrombosen, Lungenembolie, anaphylaktischer Schock oder andere schwerwiegende oder einfache Ereignisse die mit einem operativen Eingriff oder einer hiermit verbundenen Anästhesie verbunden sein können.
Ggf. Revisions- und Folgeeingriffe, die sowohl durch unerwünschte Nebenwirkungen des Implantats oder durch Komplikationen der hiermit verbundenen operativen Eingriffe erforderlich werden.
Zusammenfassung des Sicherheitsprofils:
Basierend auf der Exposition bzw. Behandlung von Patienten mit 8.517 ausgelieferten NOVOCART® 3D-Implantaten wurden bisher folgende Häufigkeiten unerwünschter Ereignisse beobachtet. Die Nebenwirkungen sind nach Systemorganklasse und Häufigkeit aufgelistet. Häufigkeiten werden entsprechend der folgenden Definition angegeben: sehr häufig (> 1/10); häufig (> 1/100, < 1/10); gelegentlich (> 1/1.000, < 1/100); selten (> 1/10.000, < 1/1.000); sehr selten (< 1/10.000).
Tabellarische Auflistung der beobachteten Nebenwirkungen von NOVOCART® 3D:
|
Systemorganklasse |
Gelegentlich |
Selten |
|
Infektionen und parasitäre Erkrankungen |
Gelenkinfektion Oberflächliche Wundinfektion | |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Gelenkerguss Arthralgie Arthrofibrose Synovitis |
Adhäsionen Gelenkschwellung Bewegungseinschränkung des Gelenks Gelenkblockaden Lokale Hämatombildung Hämarthros Subchondrales Knochenödem Chondromalazie Freier Gelenkkörper |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Entzündung Pyrexie Hyperthermie Lokale Ödembildung | |
|
Untersuchungen |
C-reaktives Protein | |
|
Verletzung, Vergiftungen und durch Eingriffe bedingte Komplikationen |
Implantatablösung |
Klinisch symptomatische Implantathypertrophie Implantatteilablösung Thrombose |
Sonstige Hinweise:
Gelegentlich kann bei Auftreten einer Infektion oder bei z.B. nicht ausreichender Zellvitalität oder -qualität bei der Zellzüchtung eine Freigabe des hergestellten Zelltransplantats nicht erfolgen und somit eine Retransplantation nicht durchgeführt werden. Es kann gegebenenfalls eine erneute Entnahme von Gewebe notwendig werden, um ein neues Transplantatprodukt herstellen zu können.
4.9 Überdosierung
Nicht bekannt.
5. Pharmakologische Eigenschaften
Pharmakotherapeutische Gruppe:
Andere Mittel gegen Störungen des Muskel- und Skelettsystems
ATC-Code: M09AX02
5.1 Pharmakodynamische Eigenschaften
Zu NOVOCART® 3D wurden keine klinisch-pharmakologischen Studien durchgeführt. Die biphasische Matrix wurde speziell als Trägermaterial für humane Chondrozyten entwickelt. In präklinischen Untersuchungen konnte gezeigt werden, dass ihr zelltragender Schwammanteil die Redifferenzierung expandierter humaner Chondrozyten und dadurch die Entstehung von hyalinartigem Knorpelgewebe fördert. Verschiedene präklinische und klinische Befunde legen nahe, dass die mit dem biokompatiblen Trägermaterial implantierten Knorpelzellen den Defektbereich besiedeln und im postoperativen Heilungsverlauf neues Knorpelgewebe aufbauen.
Klinische Wirksamkeit
Zu NOVOCART® 3D wurden im Bereich des Kniegelenks von verschiedenen Arbeitsgruppen mehrere Studien durchgeführt und publiziert. Bei den Ein- und Zwei-Jahres-
Nachuntersuchungen wurde in unterschiedlichen klinischen Scores (z.B. IKDC-Score) eine statistisch signifikante Verbesserung in den behandelten Patientenpopulationen gefunden.
In einer nicht kontrollierten prospektiven Anwendungsbeobachtung wurden klinische Daten zur Wirksamkeit von NOVOCART® 3D in einem Zeitraum von bis zu 6 Jahren postoperativ erfasst. Das durchschnittliche Patientenalter betrug 35.9 Jahre (15 bis 66 Jahre), die durchschnittliche Defektgröße vor und nach Debridement 6.9 bzw. 7.5 cm2.
Insgesamt wurden 182 Patienten mit traumatisch, lokalisiert degenerativ oder durch Osteochondrosis dissecans bedingten Knorpelschäden in 7 teilnehmenden Zentren in Deutschland mit NOVOCART® 3D behandelt und nachuntersucht. Ein wesentliches Ergebnis dieser Untersuchungen war ein durch den Patienten subjektiv wahrgenommener Behandlungserfolg im Sinne von Schmerz- und Beschwerdereduktion. Die Ergebnisse deuten darauf hin, dass Patienten mit einem klinisch symptomatischen und vollschichtig umschriebenen Knorpelschaden des Kniegelenks unterschiedlicher Ursache und Lokalisation im bisher untersuchten Zeitraum von 6 Jahren von einer Behandlung mit NOVOCART® 3D profitieren können. Für andere Gelenke, wie z.B. dem Sprung-, Hüft-, Schulter- oder Ellenbogengelenk, liegen für die Anwendung von NOVOCART® 3D nur Einzelfallberichte vor.
5.2 Pharmakokinetische Eigenschaften
Es werden keine pharmakokinetischen Eigenschaften (Migration) von NOVOCART® 3D angenommen, da die Knorpelzellen im Schwammanteil des Arzneiträgers fixiert sind. Die zellundurchlässige und abdeckende Kollagenmembran des Arzneiträgers soll eine Migration der Zellen in den Außenraum des Defekts verhindern. Aus histologischen
Gewebeuntersuchungen beim Menschen, die nach Implantation von NOVOCART® 3D zu verschiedenen Zeitpunkten entnommen wurden, ist bekannt, dass das kollagene Trägermaterial im Laufe von mehreren Wochen resorbiert wird.
5.3 Nicht-klinische Studien
Das verwendete Trägermaterial ist gemäß den durchgeführten Biokompatibilitätsstudien (ISO 10993) als toxikologisch unbedenklich eingestuft und als Medizinprodukt CE-zertifiziert (Zertifikatnummer G7A 12 05 10066 333). Die durchgeführten präklinischen Studien haben eine gute Bioverträglichkeit belegt.
Neben der Verträglichkeit wurde auch die Wirksamkeit, d.h. die Fähigkeit zur Knorpelregeneration, der mit humanen charakterisierten Chondrozyten besiedelten biphasischen Matrix vor ihrer klinischen Einführung in-vitro und in Tierversuchen geprüft. Für die Untersuchungen in-vivo wurden unter GLP-Bedingungen (Good Laboratory Practice) drei voneinander unabhängige SCID-Mausversuchsreihen durchgeführt. Die Versuche beinhalteten dabei Experimente im ektopen Lager, in einem chondralen Defektmodel sowie Dosisfindungsstudien zur erforderlichen Mindestzellzahl pro cm2 Trägermaterial für eine reproduzierbare Knorpelbildung. Dabei wurde eine Knorpelregeneration im Bereich des zelltragenden Schwammanteils der biphasischen Matrix gefunden, jedoch keine unerwünschte Knorpelbildung durch die defektabdeckende und zellundurchlässige Membran hindurch. Die durchgeführten Studien zeigten keine unerwünschten lokalen oder systemischen Ereignisse, die auf die Implantation der zellbesiedelten Matrix zurückgeführt werden konnten.
Ferner wurde mittels validierter Verfahren geprüft, ob die Kultivierung humaner Chondrozyten, wie sie zur Herstellung von NOVOCART® 3D verwendet wird, zu unerwünschten Veränderungen ihrer Chromosomeneigenschaften führt. Der Vergleich des Karyotyps vor und nach der Zellvermehrung ergab keine Hinweise auf pathologische Veränderungen.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Kollagen-basierte biphasische Matrix (Kollagen bovinen Ursprungs), D-Glukose, D-Ca-Pantothenat, Folsäure, L-Inositol, Nikotinamid, Pyridoxin x HCl, Riboflavin, Thiamin x HCl, DL-alpha Liponsäure, Biotin, Linolsäure- Methylester, Vitamin B12 Hypoxanthin, Thymidin, Putrescin x 2HCl, L-Alanin, L-Arginin x HCl, L-Asparagin x H2O, L-Asparaginsäure, L-Cystein x HCl x H2O, L-Glutaminsäure, L-Histidin x HCl x H2O, L-Isoleucin, L-Lysin x HCl, L-Methionin, L-Phenylalanin, L-Prolin, L-Serin, L-Threonin, L-Tryptophan, L-Tyrosin x H2O x 2Na, L-Valin, L-Cystein x 2HCl, Glycin, L- Glutamin, HEPES, Na-Pyruvat, NaCl, KCl, MgSO4, NaH2PO4, NaHCO3, FeSO4 x 7H2O, Fe(NO3)3 x 7H2O, Na2HPO4, CuSO4 x 5H2O, ZnSO4 x
7H2O, MgCl2, CaCl2, Cholinchlorid, Humanserum, L-Ascorbinsäure, Na-Chondroitinsulfat, Humanalbumin, Caprylat, N-acetyl-DL-tryptophanat, BMP-2, Sucrose, NaOH, Polysorbat 80, Huminsulin, Metacresol, Glycerol, Aqua ad injectabilia.
6.2 Inkompatibilitäten
Unverträglichkeit gegenüber einem der Inhaltsstoffe.
6.3 Angaben zur Haltbarkeit
3 Tage bzw. 72 h nach Fertigstellung des Produkts.
Siehe auch Begleitschreiben und Hinweis „verwendbar bis" auf dem Etikett.
6.4 Besondere Lagerhinweise
Lagerbedingung: 2-8°C
NOVOCART® 3D darf nicht eingefroren werden, da die biologischen Funktionen von Zellen und Zellprodukten beim Einfrieren beeinträchtigt werden können.
Aufbewahrung von NOVOCART® 3D bis zum Operationsbeginn im dafür vorgesehenen Transportkoffer mit TIC® System (Versandbox mit 48h-Stunden Temperaturschutz für diagnostisches Probenmaterial und biotechnologisch bearbeitete Gewebeprodukte) oder Aufbewahrung im Kühlschrank in der Transportbox (TIC® Box). Detaillierte Angaben zur Handhabung des TIC® Systems finden Sie direkt auf der Kennzeichnung des Systems bzw. im Schulungsmaterial zu NOVOCART® 3D.
6.5 Art und Inhalt des Behältnisses
Das Primärbehältnis, in dem sich das Transplantatprodukt NOVOCART® 3D befindet, wird in einem Transportgefäß (unsteriler Schutzbehälter) geliefert. Das Primärbehältnis ist ein rundes Gefäß mit Schraubverschluss (Abb. 1). Die besiedelten Matrixeinheiten von NOVOCART® 3D werden mit einem Transportkoffer ausgeliefert.
Das sterile (unter Reinraumbedingungen aseptisch hergestellte) Transplantatprodukt befindet sich auf einer Polyethylenplatte (PE-Platte) in einem Transportmedium. Es wird durch einen Metallrahmen mit Bügel auf der PE-Platte festgehalten. Das unsterile Transportgefäß wird geöffnet und an den sterilen OP-Bereich angereicht. Mit einer sterilen Fasszange wird das Trägersystem am Metallbügel entnommen und auf den sterilen OP-Beistelltisch zur weiteren Vorbereitung (ausstanzen, zuschneiden) abgelegt.
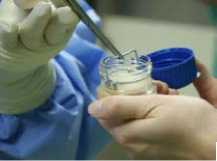
Abb. 1: Transportgefäß mit auf der PE-Platte einliegendem NOVOCART® 3D Implantat
6.6 Hinweise für die Handhabung und Entsorgung
Die Anwendung des ATMP muss in der Bundesrepublik Deutschland erfolgen.
Vor der Anwendung ist die Unversehrtheit des äußeren Gefäßes zu prüfen (intakte Versiegelung des Schraubdeckels durch das Etikett).
Das Transplantat darf nicht gefroren sein und im Verlauf der Anwendung nicht austrocknen oder zu sehr gequetscht werden, da hierdurch die biologischen Funktionen der Chondrozyten und damit die Wirksamkeit von NOVOCART® 3D beeinträchtigt werden können.
Transplantatreste oder mit dem Produkt in Kontakt getretene Abfallmaterialien müssen gemäß den lokalen Bestimmungen als chirurgischer Abfall entsorgt werden, um mögliche Gefahren für die Umwelt zu vermeiden.
7. Inhaber der Genehmigung nach §4b AMG
TETEC AG Aspenhaustrasse 18 72770 Reutlingen Tel.: +49 (0) 7121 51487-60 Fax: +49 (0) 7121 51487-61
8. Genehmigungsnummer
PEI.A.11511.01.1
9. Datum der Erteilung der Genehmigung
29.08.2014
10. Stand der Information
07/2014
11. Verkaufsabgrenzung
Verschreibungspflichtig
10