Novopulmon Meda Novolizer 400 Mikrogramm/Dosis Pulver Zur Inhalation
FI / ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS/SPC
Novopulmon Meda Novolizer 400 Mikrogramm/Dosis, Pulver zur Inhalation
1. BEZEICHNUNG DES ARZNEIMITTELS
Novopulmon Meda Novolizer, 400 Mikrogramm/Dosis, Pulver zur Inhalation
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: Budesonid
Eine abgegebene Dosis enthält 400 Mikrogramm Budesonid.
Sonstiger Bestandteil:
10,5 mg Lactose-Monohydrat / abgegebene Dosis
Die abgegebene Dosis ist die für den Patienten aus dem Mundstück abgegebene verfügbare Dosis.
3. DARREICHUNGSFORM
Pulver zur Inhalation Weißes Pulver
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur Behandlung des persistierenden Asthmas.
Hinweis: Budesonid ist nicht zur Behandlung von akuten Asthmaanfällen geeignet.
4.2 Dosierung, Art und Dauer der Anwendung
Zur Inhalation
Wechselt ein Patient von einem anderen Inhalationssystem zu Novopulmon Meda Novolizer, sollte die Dosis überprüft und gegebenenfalls individuell neu angepasst werden. Dabei sind der Wirkstoff, das Dosisregime und die Applikationsmethode zu berücksichtigen.
Steroid-naive Patienten sowie Patienten, die bereits vorher mit inhalativen Steroiden behandelt wurden:
Erwachsene (einschließlich ältere Patienten) und Kinder/Jugendliche über 12 Jahre:
Empfohlene Anfangsdosis: 200 - 400 Mikrogramm ein- oder zweimal täglich
Empfohlene Höchstdosis: 800 Mikrogramm zweimal täglich
Kinder von 5 - 12 Jahren:
Empfohlene Anfangsdosis: 200 Mikrogramm zweimal oder
200 - 400 Mikrogramm einmal täglich
Empfohlene Höchstdosis: 400 Mikrogramm zweimal täglich
Kinder unter 5 Jahren:
Die Anwendung von Novopulmon MEDA Novolizer bei Kindern unter 5 Jahren wird nicht empfohlen, da keine ausreichenden Daten zur Unbedenklichkeit und Wirksamkeit vorliegen.
Hinweis: Für die 200-Mikrogramm-Einzeldosen ist das Medikament in einer 200-Mikrogramm-Stärke erhältlich.
Es wird empfohlen, die Dosis den individuellen Ansprüchen der Patienten, der Schwere der Erkrankung und der klinischen Reaktion des Patienten anzupassen. Die Dosis ist solange anzupassen, bis die Erkrankung beherrscht wird und sollte dann auf die niedrigste Dosis titriert werden, mit der eine wirksame Asthmakontrolle gewährleistet werden kann.
Dosierungsgrenzen:
Erwachsene (einschließlich ältere Patienten) und Kinder/Jugendliche über 12 Jahre: 200 -1600 Mikrogramm täglich
Kinder von 5 - 12 Jahren: 200 - 800 Mikrogramm täglich
Zu Beginn der Behandlung, in Perioden mit schwerem Asthma sowie bei einer Verringerung bzw. dem Absetzen der Behandlung mit oralen Glukokortikosteroiden empfiehlt sich für Kinder und Erwachsene (einschließlich älterer Patienten) die Anwendung zweimal pro Tag.
Bei erwachsenen (einschließlich älteren) Patienten sowie bei Kindern/Jugendlichen über 12 Jahre mit leichtem bis mäßigem Asthma, die bereits zweimal täglich mit inhalativen Glukokortikosteroiden (entweder Budesonid oder Beclometasondipropionat) behandelt werden, kann das Medikament in Form einer einmal täglichen Anwendung von bis zu 800 Mikrogramm verabreicht werden.
Bei Kindern von 5 - 12 Jahren mit leichtem bis mäßigem Asthma, die bereits zweimal täglich mit inhalativen Glukokortikosteroiden (entweder Budesonid oder Beclometasondipropionat) behandelt werden, kann das Medikament in Form einer einmal täglichen Anwendung von bis zu 400 Mikrogramm verabreicht werden.
Wird ein Patient von einer zweimal täglichen Anwendung auf eine einmal tägliche Anwendung umgestellt, so sollte das in Höhe der gleichen täglichen Gesamtdosis unter Berücksichtigung des Medikaments und der Applikationsmethode erfolgen. Dann wird empfohlen, diese Dosis auf die niedrigste Dosis zu reduzieren, die für die Aufrechterhaltung einer wirksamen Kontrolle des Asthmas erforderlich ist. Eine Behandlung mit der einmal täglichen Anwendung kann nur dann in Erwägung gezogen werden, wenn die Asthmasymptome unter Kontrolle gebracht sind.
Bei einer einmal täglichen Anwendung sollte die Dosis am Abend genommen werden.
Im Falle einer Verschlechterung der Asthmakontrolle, die sich zum Beispiel durch anhaltende respiratorische Symptome und eine verstärkte Anwendung von inhalativen Bronchodilatatoren äußert, sollte man die Dosis der inhalativen Steroide steigern. Patienten, die das Arzneimittel nach Therapieplan einmal täglich anwenden, ist anzuraten, die inhalierte Dosis an Kortikosteroid zu verdoppeln, indem sie die Tagesdosis nun zweimal am Tag applizieren. Bei jeglicher Verschlechterung der Asthmakontrolle sollte der Patient so schnell wie möglich ärztlichen Rat einholen.
Zur Linderung von akuten Asthmasymptomen sollte jederzeit ein schnell wirkender inhalativer Beta2-Agonist zur Verfügung stehen.
Asthma
Bei der Erhaltungstherapie von Asthma können orale Glukokortikoide möglicherweise durch Novopulmon Meda Novolizer ersetzt werden bzw. deren Dosis signifikant reduziert werden.
Bei Beginn der Umstellung von oralen Steroiden auf Novopulmon Meda Novolizer sollte sich der Patient in einer relativ stabilen Phase befinden. Eine hohe Dosis Novopulmon Meda Novolizer wird dann in Kombination mit dem vorher eingenommenen Steroid über ungefähr 10 Tage gegeben. Danach sollte die orale Steroiddosis schrittweise (z.B. um 2,5 mg Prednisolon oder dessen Äquivalent jeden Monat) bis zur niedrigsten möglichen Dosis reduziert werden. In vielen Fällen ist es möglich, die orale Steroidgabe komplett durch Novopulmon Meda Novolizer zu ersetzen. Für weitere Informationen zum Absetzen von Kortikoiden siehe Abschnitt 4.4.
Art und Dauer der Behandlung:
Novopulmon Meda Novolizer ist für eine Langzeitbehandlung vorgesehen. Es sollte regelmäßig entsprechend dem empfohlenen Therapieplan angewendet werden, auch wenn der Patient keine Symptome aufweist.
Obwohl es bereits innerhalb von 24 Stunden zu einer Verbesserung der Asthmakontrolle kommen kann, kann ein zusätzlicher Behandlungszeitraum von 1 - 2 Wochen erforderlich sein, um einen maximalen Nutzen zu erreichen.
Um sicherzustellen, dass der Wirkstoff den beabsichtigten Wirkungsort optimal erreicht, ist es erforderlich, gleichmäßig und so kräftig, tief und schnell wie möglich (bis zur maximalen Inhalationstiefe) zu inhalieren. Ein deutlich hörbares Klickgeräusch sowie der Farbwechsel im Kontrollfenster von Grün auf Rot zeigen an, dass die Inhalation korrekt vorgenommen wurde. Falls das Klickgeräusch und der Farbwechsel im Kontrollfenster ausbleiben sollten, ist der Inhalationsvorgang zu wiederholen. Das Inhalationsgerät bleibt solange gesperrt, bis eine korrekte Inhalation erfolgt ist.
Um das Risiko für eine orale Candidiasis und Heiserkeit zu reduzieren wird empfohlen, die Inhalation vor den Mahlzeiten vorzunehmen und den Mund nach jeder Inhalation mit Wasser auszuspülen bzw. sich die Zähne zu putzen.
Anwendung und Handhabung des Novolizer-Inhalators
Deckel
Patrone Zahlenfenster Taste
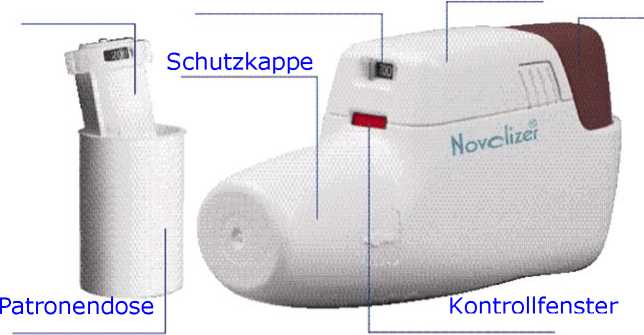
Patronenwechsel
1. Drücken Sie die geriffelten Flächen auf beiden Seiten des Deckels des Pulverinhalators leicht zusammen, schieben Sie den Deckel nach vorn und nehmen ihn nach oben ab.
2. Entfernen Sie die Schutzfolie von der Patronendose und nehmen Sie die neue Patrone heraus.
3. Stecken Sie die Patrone mit dem Zahlenfenster in Richtung des Mundstückes in den Novolizer-Inhalator hinein.
4. Zum Schluss setzen Sie den Deckel wieder von oben in die seitlichen Führungen und schieben ihn flach bis zum Einrasten in Richtung der Taste. Bitte belassen Sie die Patrone im Novolizer-Inhalator, bis diese aufgebraucht ist. Allerdings muss sie maximal 6 Monate nach dem Einsetzen gegen eine neue Patrone ausgetauscht werden.
Hinweis: Novopulmon Meda Novolizer-Patronen dürfen nur in Verbindung mit dem NovolizerPulverinhalator verwendet werden.
Anwendung
1. Der Novolizer-Inhalator ist bei der Anwendung immer waagerecht zu halten. Zunächst wird die Schutzkappe entfernt.
2. Die große farbige Taste wird ganz nach unten gedrückt. Ein lautes Doppelklicken ist zu hören und die Farbe im unteren Kontrollfenster wechselt von Rot auf Grün. Jetzt kann die farbige Taste wieder losgelassen werden. Die grüne Farbe im Kontrollfenster signalisiert, dass der Novolizer-Inhalator zur Inhalation bereit ist.
3. Der Patient sollte ausatmen, keinesfalls aber in den Pulverinhalator hinein.
4. Das Mundstück wird mit den Lippen umschlossen und die Pulverdosis kräftig mit einem langen Atemzug eingesaugt. Während dieses Atemzuges muss ein deutliches Klicken hörbar sein, das die korrekte Inhalation anzeigt. Der Patient sollte den Atem danach noch einige Sekunden anhalten und anschließend normal weiter atmen.
Hinweis: Sollte der Patient mehr als eine Inhalation benötigen, müssen die Schritte 2 - 4 wiederholt werden.
5. Die Schutzkappe wird wieder auf das Mundstück gesetzt - der Inhalationsvorgang ist jetzt abgeschlossen.
6. Im Zahlenfenster wird die Anzahl der verbleibenden Inhalationen angezeigt.
Hinweis: Die große farbige Taste darf nur unmittelbar vor der Inhalation gedrückt werden.
Für den Patienten ist eine unbeabsichtigte doppelte Inhalation mit dem Novolizer-Inhalator nicht möglich. Ein Klickgeräusch sowie ein Wechsel der Farbe im Kontrollfenster zeigen an, dass die Inhalation korrekt vorgenommen wurde. Wenn die Farbe des Kontrollfensters nicht wechselt, sollte die Inhalation wiederholt werden. Falls auch nach wiederholten Versuchen keine korrekte Inhalation erzielt werden konnte, sollte der Patient den Arzt aufsuchen.
Reinigung
Der Novolizer-Inhalator muss in regelmäßigen Abständen gereinigt werden, zumindest aber bei jedem Wechsel der Patrone. Hinweise für den Patienten zur Reinigung des NovolizerInhalators sind der Packungsbeilage zu entnehmen.
Hinweis: Um den korrekten Gebrauch des Novolizer-Inhalators zu gewährleisten, sollten Patienten über Anwendung und Gebrauch des Inhalators umfassend informiert werden.
Kinder dürfen dieses Produkt nur unter der Aufsicht von Erwachsenen anwenden.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff Budesonid oder gegen den sonstigen Bestandteil Lactose-Monohydrat (welcher geringe Mengen Milcheiweiß enthält).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Budesonid ist nicht angezeigt für die Behandlung von akuter Atemnot bzw. bei Status asthmaticus. Diese Zustände sollten auf übliche Weise behandelt werden.
Die Behandlung einer akuten Verschlimmerung des Asthmas bzw. der Asthmasymptome kann eine Erhöhung der Budesonid-Dosis erforderlich machen. Dem Patienten ist der Einsatz eines schnell wirkenden inhalativen Bronchodilatators als Notfallmedikation zur Linderung akuter Asthmasymptome anzuraten.
Bei Patienten mit aktiver bzw. latenter Lungentuberkulose sind eine genaue Beobachtung und besondere Sorgfalt erforderlich. Patienten mit aktiver Lungentuberkulose dürfen Budesonid nur dann anwenden, wenn sie gleichzeitig mit wirksamen Tuberkulostatika behandelt werden. Ebenso ist auch bei Patienten mit fungalen, viralen oder anderen Infektionen der Luftwege eine genaue Beobachtung sowie besondere Sorgfalt geboten. Auch sie dürfen Budesonid nur dann anwenden, wenn sie eine entsprechende Behandlung der Infektionen erhalten.
Patienten, denen eine korrekte Inhalation wiederholt misslingt, sollten ihren Arzt zu Rate ziehen.
Bei Patienten mit schwerer Leberfunktionsstörung kann die Behandlung mit Budesonid (ähnlich wie eine Behandlung mit anderen Glukokortikosteroiden) zu einer verringerten Eliminationsrate sowie zu einer Steigerung der systemischen Verfügbarkeit führen. Auf mögliche systemische Wirkungen sollte besonders geachtet werden. Aus diesem Grunde ist die Funktion der Hypothalamus-Hypophysen-Nebennieren (HPA)-Achse bei diesen Patienten in regelmäßigen Abständen zu überprüfen.
Eine Langzeitbehandlung mit hohen Dosen von inhalativen Kortikosteroiden kann, insbesondere wenn diese über der empfohlenen Dosis liegen, zu einer klinisch signifikanten adrenalen Suppression führen. Bei diesen Patienten können Anzeichen und Symptome einer Nebenniereninsuffizienz auftreten, wenn sie starkem Stress ausgesetzt sind. Für Belastungsperioden bzw. elektive Operationen ist ein zusätzlicher systemischer Kortikosteroidschutz in Erwägung zu ziehen.
Insbesondere dann, wenn hohe Dosen über einen längeren Zeitraum verschrieben werden, kann es bei jedem inhalativen Kortikosteroid zu systemischen Wirkungen kommen. Ein Auftreten dieser Wirkungen ist allerdings bei der Inhalationsbehandlung sehr viel weniger wahrscheinlich als bei oralen Kortikosteroiden. Zu solchen möglichen systemischen Wirkungen sind zu rechnen: Cushing-Syndrom, cushingoide Erscheinungen, adrenale Suppression, Wachstumsverzögerung bei Kindern und Jugendlichen, Abnahme der Knochenmineraldichte, Katarakt, Glaukom, und noch seltener eine Reihe von psychischen Veränderungen oder Verhaltensauffälligkeiten einschließlich psychomotorische Hyperaktivität, Schlafstörungen, Ängstlichkeit, Depression oder Aggression (besonders bei Kindern). Aus diesem Grunde ist es wichtig, dass die Dosierung an inhalativem Kortikosteroid auf die niedrigste Dosis eingestellt wird, bei der sich eine wirksame Asthmakontrolle aufrechterhalten lässt.
Die gleichzeitige Anwendung von Ketoconazol, HIV-Proteasehemmern oder anderen potenten CYP3A4-Hemmern ist zu vermeiden. Falls das nicht möglich ist, sollte ein möglichst langer Abstand zwischen den Behandlungen eingehalten werden (siehe auch Abschnitt 4.5).
Während der Behandlung mit inhalativen Kortikosteroiden kann eine orale Candidose auftreten. Diese Infektion kann die Behandlung mit einer entsprechenden antimykotischen Therapie notwendig machen und bei einigen Patienten den Abbruch der Behandlung erfordern (siehe auch Abschnitt 4.2).
Wie auch bei anderen Inhalationstherapien kann ein paradoxer Bronchospasmus auftreten, der sich durch eine Verstärkung des pfeifenden Atmens unmittelbar nach der Einnahme manifestiert. In diesem Falle sollte die Behandlung mit inhalativem Budesonid sofort abgebrochen, der Patient befundet und bei Bedarf eine alternative Therapie eingeleitet werden.
Es wird empfohlen, die Körpergröße von Kindern, die eine Langzeitbehandlung mit inhalativen Kortikosteroiden erhalten, regelmäßig zu überwachen. Sollte sich das Wachstum verlangsamen, muss die Therapie mit dem Ziel überprüft werden, die Dosis des inhalativen Kortikosteroidszu senken. Der Nutzen der Kortikosteroidtherapie und die möglichen Risiken einer Wachstumsverlangsamung müssen sorgfältig abgewägt werden. Weiterhin sollte man eine Überweisung des Patienten an einen Facharzt für Atemwegserkrankungen bei Kindern in Erwägung ziehen.
Vorsichtsmaßnahmen bei Patienten, die vorher noch nicht mit Kortikosteroiden behandelt worden sind:
Wird Budesonid regelmäßig entsprechend der gegebenen Hinweise angewendet, sollte bei Patienten, die vorher nie oder nur gelegentlich eine kurze Behandlung mit Kortikosteroiden erhalten haben, nach etwa ein bis zwei Wochen eine Verbesserung bei der Atmung spürbar sein. Allerdings können extreme Schleimansammlungen und Entzündungsprozesse die Bronchialwege in einem solchen Ausmaß verstopfen, dass das Budesonid seine lokalen Wirkungen nicht vollständig entfalten kann. In solchen Fällen sollte die inhalative Therapie mit Budesonid durch eine kurze Zwischenbehandlung mit systemischen Kortikosteroiden ergänzt werden. Nachdem man die Dosis der systemischen Kortikosteroide schrittweise reduziert hat, wird die Behandlung mit den inhalativen Dosen fortgesetzt.
Vorsichtsmaßnahmen für die Umstellung von Patienten von systemisch aktiven Kortikosteroiden auf eine Inhalationstherapie:
Patienten, die eine systemische Behandlung mit Kortikosteroiden erhalten, sollten dann auf Novopulmon Meda Novolizer umgestellt werden, wenn ihre Symptome unter Kontrolle sind.
Bei diesen Patienten, deren adrenokortikale Funktion normalerweise eingeschränkt ist, darf die systemische Behandlung mit Kortikosteroiden nicht plötzlich eingestellt werden. Zu Beginn der Umstellung sollte über den Zeitraum von 7 bis 10 Tagen eine hohe Dosis Novopulmon Meda Novolizer zusätzlich zu den systemischen Kortikosteroiden verabreicht werden. Dann kann man entsprechend der Reaktion des Patienten und abhängig von der ursprünglichen Dosis des systemischen Steroids die tägliche Dosis des systemischen Kortikosteroids schrittweise reduzieren (z.B. um 1 Milligramm Prednisolon bzw. das Äquivalent jede Woche oder um 2,5 Milligramm Prednisolon bzw. das Äquivalent jeden Monat). Das orale Steroid sollte auf eine möglichst geringe Stufe reduziert werden. Es kann auch möglich sein, dass man das orale Steroid vollständig durch inhalatives Budesonid ersetzt.
Innerhalb der ersten Monate nach Umstellung der Patienten von der systemischen Gabe von Kortikosteroiden auf eine Inhalationstherapie kann eine Wiederaufnahme der systemischen Gabe von Kortikosteroiden im Falle von Belastungsperioden bzw. in Notfällen (z.B. schwere Infektionen, Verletzungen, Operationen) erforderlich werden. Das betrifft ebenfalls Patienten, die eine Langzeitbehandlung mit hohen Dosierungen inhalativer Kortikosteroide erhalten haben. Auch bei ihnen kann eine eingeschränkte adrenokortikale Funktion vorliegen, so dass sie in Belastungsperioden einen systemischen Kortikosteroidschutz benötigen.
Die Erholung von einer eingeschränkten Nebennierenfunktion kann eine beachtliche Zeitspanne in Anspruch nehmen. Die Funktion der Hypothalamus-Hypophysen-Nebennieren-Achse sollte regelmäßig beobachtet werden.
Trotz der Aufrechterhaltung bzw. sogar einer Verbesserung der Atemfunktion kann sich der Patient während des Absetzens der systemischen Kortikosteroide in unspezifischer Weise unwohl fühlen. Man sollte den Patienten bestärken, die Behandlung mit inhalativem Budesonid und das Absetzen der oralen Steroide fortzusetzen, solange keine klinischen Anzeichen einer Nebenniereninsuffizienz erkennbar sind.
Nachdem der Patient auf eine Inhalationstherapie umgestellt worden ist, können Symptome manifest werden, die durch die vorherige systemische Behandlung mit Glukokortikosteroiden unterdrückt worden sind, z.B. allergische Rhinitis, allergisches Ekzem, Muskel- und Gelenkschmerzen. Diese Symptome sollten mit geeigneten Arzneimitteln zusätzlich behandelt werden.
Die Behandlung mit inhalativem Budesonid darf nicht plötzlich beendet werden.
Verschlimmerung klinischer Symptome aufgrund von akuten Atemwegsinfektionen:
Falls sich die klinischen Symptome durch akute Atemwegsinfektionen verschlimmern, ist eine Behandlung mit entsprechenden Antibiotika in Erwägung zu ziehen. Die Dosis an Budesonid kann bei Bedarf angepasst werden. In bestimmten Situationen kann auch eine systemische Behandlung mit Glukokortikosteroiden angezeigt sein.
Wird nach einer Behandlungsdauer von 14 Tagen keine Besserung der Symptome bzw. keine adäquate Asthmakontrolle erreicht, muss medizinischer Rat eingeholt werden, damit entweder die Dosis erneut angepasst wird oder die ordnungsgemäße Inhalationsmethode erneut erläutert wird.
Vorsichtsmaßnahmen für die Umstellung von Patienten von Novopulmon Novolizer 200 Mikrogramm auf Novopulmon Novolizer 400 Mikrogramm:
Patienten, die nicht in der Lage sind, eine Flussrate von über 60 l/Min. zu erreichen, sowie Kinder sind bei Umstellung von der Novopulmon Novolizer 200 Mikrogramm Stärke auf die Novopulmon Novolizer 400 Mikrogramm Stärke bei gleicher Dosis sorgfältig zu überwachen.
Lactose kann Milcheiweiß enthalten. Normalerweise verursacht der Lactosegehalt von Novopulmon Meda Novolizer bei Patienten mit Lactoseintoleranz keine Probleme.
Allerdings wurde bei Patienten mit schwerem Enzymmangel in sehr seltenen Fällen über eine Lactoseintoleranz nach der Inhalation von lactosehaltigem Pulver berichtet.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Budesonid wird primär über das CYP3A4-Enzymsystem verstoffwechselt. Deshalb können Hemmer dieses Enzyms (wie z.B. Ketoconazol, Itraconazol, HIV-Proteasehemmer) die systemische Exposition von Budesonid um ein Vielfaches erhöhen (siehe Abschnitt 4.4). Da keine Daten vorliegen, aus denen sich Dosierungsempfehlungen ableiten lassen, sollte diese Kombination vermieden werden. Falls das nicht möglich ist, sollte ein möglichst langer zeitlicher Abstand zwischen den Behandlungen eingehalten werden. Eine Verringerung der Budesonid-Dosis kann ebenfalls in Betracht gezogen werden.
Begrenzte Daten zu dieser Wechselwirkung für hoch dosiertes inhalatives Budesonid weisen darauf hin, dass es zu einem deutlichen Anstieg der Plasma-Konzentrationen (im Durchschnitt um das Vierfache) kommen kann, wenn Itraconazol (200 mg einmal täglich) gleichzeitig mit inhalativem Budesonid (Einzeldosis in Höhe von 1000 ^g) verabreicht wird.
Bei Frauen, die ebenfalls mit Östrogenen und kontrazeptiven Steroiden behandelt wurden, hat man erhöhte Plasmakonzentrationen und eine verstärkte Wirkung von Kortikoiden beobachtet. Allerdings wurde keine Wirkung gesehen, wenn Budesonid gleichzeitig mit niedrig dosierten kombinierten oralen Kontrazeptiva eingenommen wurde.
Da es zu einer Unterdrückung der Nebennierenrindenfunktion kommen kann, ist es möglich, dass ein ACTH-Stimulationstest zum Nachweis einer Hypophyseninsuffizienz zu falschen Ergebnissen führen kann (niedrige Werte).
4.6 Schwangerschaft und Stillzeit
Schwangerschaft
Die Ergebnisse aus einer großen prospektiven epidemiologischen Studie und aus weltweiten Erfahrungen nach Markteinführung weisen darauf hin, dass inhaliertes Budesonid während der Schwangerschaft keine nachteiligen Wirkungen für die Gesundheit des Fötus / des Neugeborenen hat.
Wie für andere Arzneimittel erfordert die Anwendung von Budesonid während der Schwangerschaft eine Abwägung des Nutzens für die Mutter und der Risiken für den Fötus.
Stillzeit
Budesonid wird in die Muttermilch sezerniert. Bei Anwendung therapeutischer Dosen von Budesonid sind jedoch keine Auswirkungen auf den Säugling zu erwarten. Novopulmon MEDA Novolizer kann während der Stillzeit angewendet werden.
Eine Erhaltungstherapie mit inhalativem Budesonid (200 oder 400 Mikrogramm zweimal täglich) bei stillenden Frauen mit Asthma resultiert in einer vernachlässigbaren systemischen Budesonid-Exposition der gestillten Säuglinge.
In einer pharmakokinetischen Studie betrug die geschätzte tägliche Dosis für den Säugling 0,3 % der täglichen maternalen Dosis bei beiden Dosierungen und die durchschnittliche Plasmakonzentration bei Säuglingen wurde, unter der Annahme einer vollständigen oralen Bioverfügbarkeit im Säugling, auf 1/600stel der im mütterlichen Plasma beobachteten Konzentration geschätzt. Alle in den Plasmaproben der Säuglinge gefundenen BudesonidKonzentrationen lagen unter der Bestimmungsgrenze.
Basierend auf Daten zu inhaliertem Budesonid und der Tatsache, dass Budesonid lineare pharmakokinetische Eigenschaften innerhalb der therapeutischen Dosierungsintervalle nach nasaler, inhalativer, oraler und rektaler Verabreichung von therapeutischen Budesonid-Dosen aufweist, kann man davon ausgehen, dass die Exposition des gestillten Kindes gering ist.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Budesonid hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
In der nachstehenden Tabelle sind Nebenwirkungen geordnet nach Organsystemen und Häufigkeit aufgeführt. Die Häufigkeit wird wie folgt definiert:
Sehr häufig (> 1/10); Häufig (> 1/100 bis < 1/10); Gelegentlich (> 1/1.000 bis < 1/100); Selten (> 1/10.000 bis < 1/1.000); Sehr selten (< 1/10.000); Nicht bekannt (Häufigkeit auf Grundlage der verfügbare Daten nicht abschätzbar).
Tabelle zu Arzneimittelnebenwirkungen nach Systemorganklassen (SOC) und Häufigkeit
|
SOC |
Häufigkeit |
Nebenwirkungen |
|
Infektionen und parasitaere |
häufig |
Oropharyngeale Candidiasis |
|
Erkrankungen | ||
|
Erkrankungen des Immunsystems |
selten |
Sofortige und verzögerte Überempfindlichkeitsreaktionen, einschließlich: Angioneurotisches Ödem Anaphylaktische Reaktion |
|
Endokrine Erkrankungen |
selten |
Anzeichen und Symptome |
systemischer Kortikosteroideffekte, einschließlich:
Adrenale Suppression und Wachstumsverzögerung *
|
Psychiatrische Erkrankungen |
selten nicht bekannt |
Ruhelosigkeit Nervosität Depression Verhaltensauffälligkeit (vorwiegend bei Kindern) Schlafstörungen Ängstlichkeit Psychomotorische Hyperaktivität Aggression |
|
Augenerkrankungen |
nicht bekannt |
Katarakt Glaukom |
|
Erkrankungen der Atemwege, |
häufig |
Heiserkeit |
|
des Brustraums und |
Husten | |
|
Mediastinums |
Rachenreizung | |
|
selten |
Bronchospasmus Dysphonie Heiserkeit** | |
|
Erkrankungen des Gastrointestinaltrakts |
häufig |
Reizung der Mundschleimhaut |
|
Erkrankungen der Haut und |
selten |
Urtikaria |
|
des Unterhautzellgewebes |
Ausschlag Dermatitis Pruritus Erythem Blutergüsse | |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
sehr selten |
Abnahme der Knochendichte |
* Siehe nachstehend unter "Kinder"
** selten bei Kindern
Häufig können leichte Reizungen der Schleimhaut, begleitet von Rachenreizung, Heiserkeit und Husten auftreten.
Es kann zu einer erhöhten Infektionsanfälligkeit kommen. Die Fähigkeit, mit Belastungen umzugehen, kann eingeschränkt sein.
Lactose-Monohydrat enthält geringe Mengen Milcheiweiß und kann deshalb allergische Reaktionen hervorrufen.
Bei Patienten mit einer kürzlich diagnostizierten chronisch obstruktiven Lungenerkrankung (COPD), die eine Therapie mit inhalativen Kortikosteroiden (ICS) beginnen, besteht ein erhöhtes Risiko für eine Lungenentzündung. Allerdings hat eine gewichtete Bewertung von acht zusammengefassten klinischen Prüfungen, in die 4643 mit Budesonid behandelte COPD-Patienten und 3643 nach dem Zufallsprinzip einbezogene Patienten, die eine Behandlung ohne ICS erhielten, kein erhöhtes Risiko für eine Lungenentzündung gezeigt. Die Ergebnisse der ersten sieben dieser acht Untersuchungen wurden in Form einer Metaanalyse veröffentlicht.
Kinder:
Aufgrund des Risikos einer Wachstumsverzögerung bei Kindern sollte die Körpergröße regelmäßig überwacht werden (siehe Abschnitt 4.4.).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn oder über http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Es wird nicht erwartet, dass eine akute Überdosierung mit Novopulmon MEDA Novolizer (selbst bei übermäßig hohen Dosierungen) zu klinischen Problemen führt.
Längerfristig gesehen kann eine Atrophie der Nebennierenrinde auftreten. Es kann zu Wirkungen kommen, die für Glukokortikosteroide üblich sind, z. B. zu einer erhöhten Anfälligkeit für Infektionen. Die Fähigkeit zur Stressanpassung kann eingeschränkt sein.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: ANDERE INHALATIVE MITTEL BEI OBSTRUKTIVEN ATEMWEGSERKRANKUNGEN
Glukokortikoide, ATC-Code: R03BA02
Bei Budesonid handelt es sich um ein synthetisches Glukokortikoid. Nach oraler Inhalation hat es eine lokale entzündungshemmende Wirkung auf die Bronchialschleimhaut.
Budesonid durchdringt Zellmembranen und bindet sich an ein cytoplasmatisches Rezeptorprotein. Dieser Komplex tritt in den Zellkern ein und löst dort die Biosynthese spezifischer Proteine, wie Makrokortin (Lipokortin), aus. Die hormonähnlichen Wirkungen treten nach einer gewissen Latenzzeit auf (30 - 60 Minuten) und führen zu einer Hemmung der Phospholipase A2. Es ist auch möglich, dass therapeutisch wirksame BudesonidDosierungen (wie andere entzündungshemmende Glukokortikosteroide) die Cytokin-induzierte COX-2-Expression unterdrücken.
Klinisch führt der entzündungshemmende Effekt zum Beispiel zu einer Besserung der Symptome, wie der Atemnot. Die Hyperreaktivität des Bronchialtrakts auf exogene Reize ist vermindert.
Klinische Sicherheit
Kinder und Jugendliche
Spaltlampenuntersuchungen wurden bei 157 Kindern (im Alter von 5 bis 16 Jahren) durchgeführt, die 3 bis 6 Jahre mit einer durchschnittlichen Tagesdosis von 504 ^g Budesonid zur Inhalation behandelt wurden. Die Ergebnisse wurden mit 111 gleichaltrigen asthmatischen Kindern verglichen. Budesonid zur Inhalation war nicht mit einem erhöhten Auftreten einer Cataracta subcapsularis posterior verbunden.
Einfluss auf die Plasmakortisolkonzentration
Studien, in denen gesunde Probanden mit Budesonid zur Inhalation behandelt wurden, haben eine dosisabhängige Wirkung auf die Plasma- und Urinkortisolwerte gezeigt.
ACTH-Tests beweisen, dass Budesonid zur Inhalation in den empfohlenen Dosierungen einen signifikant geringeren Einfluss auf die Nebennierenfunktion hat als Prednison 10 mg.
5.2 Pharmakokinetische Eigenschaften Absorption
Maximale Plasmaspiegel werden etwa 30 Minuten nach der Inhalation erreicht.
Die systemische Bioverfügbarkeit nach der Inhalation beträgt bis zu 37% und die Konzentration im humanen Plasma beläuft sich nach der Inhalation einer Einzeldosis von 1600 Mikrogramm auf 0,63 nmol/l.
Die Triggerschwelle des Novolizer-Inhalators, die für eine erfolgreiche Inhalation überschritten werden muss, liegt bei einem inspiratorischen Fluss durch den Inhalator bei 35 - 50 l/min. Bei der Umstellung von Budesonid Novolizer 200 Mikrogramm auf Budesonid Novolizer 400 Mikrogramm wurde eine Dosislinearität bei Flussraten von 60 l/Min und mehr gezeigt.
Die in-vitro gemessene respirable Dosis (Partikelgröße < 5 pm) im klinisch relevanten Bereich beläuft sich auf etwa 20 - 50 %. Bei gesunden Probanden gelangen etwa 20 - 30 % der verabreichten Budesonid-Dosis in die Lungen. Der Rest setzt sich in Mund, Nase und Rachen ab; ein großer Teil davon wird verschluckt.
Verteilung
Das Verteilungsvolumen von Budesonid beträgt ungefähr 3 l/kg. Die Plasmaproteinbindung beträgt im Mittel 85 - 90 %.
Biotransformation
Budesonid wird in sehr hohem Maße (ca. 90 %) bei der ersten Leberpassage zu Metaboliten mit niedrigerer Glukokortikosteroidaktivität metabolisiert. Die Glukokortikosteroidaktivität der Hauptmetaboliten 6-beta-Hydroxybudesonid und 16-alpha-Hydroxyprednisolon beträgt weniger als 1% der Budesonid-Aktivität. Budesonid wird hauptsächlich über CYP-3A4, eine Untergruppe des Cytochrom-P-450-Systems, metabolisiert.
Elimination
Die Metaboliten werden unverändert oder in konjugierter Form hauptsächlich über die Nieren ausgeschieden. Unverändertes Budesonid ist im Urin nicht nachgewiesen worden. Die systemische Clearance von Budesonid ist bei gesunden Erwachsenen hoch (ungefähr 1,2 l/min) und die terminale Plasmahalbwertszeit beträgt nach i.v.-Dosierung bei gesunden Erwachsenen durchschnittlich 2 - 3 Stunden.
Linearität
Bei klinisch relevanten Dosen ist die Pharmakokinetik von Budesonid dosisproportional.
Kinder und Jugendliche
Budesonid hat eine systemische Clearance von ungefähr 0,5 l/min bei asthmatischen Kindern im Alter von 4 bis 6 Jahren. Pro kg Körpergewicht haben Kinder eine Clearance, die ungefähr 50% größer ist als die bei Erwachsenen. Die terminale Halbwertszeit von Budesonid nach Inhalation beträgt bei asthmatischen Kindern ungefähr 2,3 Stunden. Diese entspricht ungefähr der von gesunden Erwachsenen.
5.3 Präklinische Daten zur Sicherheit
Basierend auf konventionellen Studien zur chronischen Toxizität, Genotoxizität und Kanzerogenität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen bei therapeutischen Dosen erkennen.
Glukokortikosteroide, einschließlich Budesonid, haben zu teratogenen Wirkungen bei Tieren, einschließlich Gaumenspalten und Skelettabnormitäten, geführt. Es wird als unwahrscheinlich angesehen, dass ähnliche Wirkungen bei einer Anwendung von therapeutischen Dosierungen beim Menschen auftreten könnten.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile Lactose-Monohydrat
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit
• Arzneimittel (Budesonid in der Patrone, in einem Behältnis verpackt)
Haltbarkeit der ungeöffneten Verpackung:
3 Jahre
Haltbarkeit nach dem Öffnen der Patronendose:
6 Monate
• Novolizer-Inhalator
Haltbarkeit vor dem ersten Gebrauch:
3 Jahre
Haltbarkeit nach Anbruch:
1 Jahr
Hinweis: Tests haben die Funktionsfähigkeit des Novolizer-Pulverinhalators für 2000 Dosierungen belegt. Daher können mit diesem Novolizer-Inhalator maximal 40 Patronen mit jeweils 50 Einzeldosen bzw. 20 Patronen mit jeweils 100 Einzeldosen innerhalb eines Jahres verwendet werden, bevor der Pulverinhalator ausgetauscht werden muss.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
In der Originalverpackung aufbewahren.
Während des Gebrauchs ist Novopulmon Meda Novolizer vor Feuchtigkeit geschützt aufzuwahren.
6.5 Art und Inhalt des Behältnisses
1 Patrone (Polystyrol / Polypropylen) mit 50 bzw. 100 Einzeldosen, entsprechend einer Füllmenge von 0,545 bzw. 1,09 g Pulver.
1 Novolizer-Inhalator (das Mundstück ist aus Polycarbonat, der Pulverinhalator aus Acrylnitrilbutadienstyrol-Copolymer und Polyoxymethylen), verpackt in einem mit Aluminiumfolie verschlossenen Behältnis aus Polypropylen.
Packungsgrößen:
Packungen:
1 Patrone mit 50 bzw. 100 Einzeldosen sowie 1 Novolizer-Pulverinhalator
2 Patronen mit 100 Einzeldosen sowie 1 Novolizer-Pulverinhalator Nachfüllpackungen:
1 Patrone mit 50 bzw. 100 Einzeldosen
2 Patronen mit 100 Einzeldosen Klinikpackungen:
(1 Patrone mit 50 Einzeldosen sowie 1 Novolizer-Pulverinhalator) x 10 (1 Patrone mit 100 Einzeldosen sowie 1 Novolizer-Pulverinhalator) x 10
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
MEDA Pharma GmbH & Co. KG Benzstraße 1 61352 Bad Homburg Telefon: (06172) 888-01 Telefax: (06172) 888-2740 medinfo@medapharma.de
8. ZULAS S UNGSNUMMER(N) 67865.00.00
9. DATUM DER ZULAS S UNG
Datum der Zulassung: 28. März 2008 Datum der Verlängerung: 11. Juni 2013
10. STAND DER INFORMATION April 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig