Octanine F 1000
Seite 1/13
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER OCTANINE F 500 I.E. / 1000 I.E.
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Blutgerinnungsfaktor IX vom Menschen
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige
Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich bitte an Ihren Arzt, Apotheker oder das medizinische Fachpersonal.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. - siehe Abschnitt 4
Was in dieser Packungsbeilage steht
1. Was ist OCTANINE F und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von OCTANINE F beachten?
3. Wie ist OCTANINE F anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist OCTANINE F aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist OCTANINE F und wofür wird es angewendet?
OCTANINE F gehört zur Arzneimittelgruppe der sog. Gerinnungsfaktoren. Es enthält den Blutgerinnungsfaktor IX vom Menschen. Das ist ein spezielles Eiweiß (Protein), das die Gerinnungsfähigkeit des Blutes erhöht.
OCTANINE F dient zur Behandlung und Vorbeugung von Blutungen bei Patienten mit Hämophilie B (Bluterkrankheit). Bei dieser Erkrankung können Blutungen länger andauern als erwartet. Die Ursache liegt in einem angeborenen Mangel an Gerinnungsfaktor IX im Blut.
OCTANINE F ist als Pulver mit Lösungsmittel zur Herstellung einer Injektionslösung erhältlich. Nach der Herstellung der Lösung wird diese in eine Vene (intravenös) injiziert.
2. Was sollten Sie vor der Anwendung von OCTANINE F beachten? OCTANINE F darf nicht angewendet werden,
• wenn Sie allergisch gegen den Blutgerinnungsfaktor IX vom Menschen oder gegen einen der in Abschnitt 6 genannten sonstigen Bestandteile dieses Arzneimittels sind.
• wenn Sie an einer Heparin-induzierten Thrombozytopenie Typ II leiden, d.h. die Anzahl Ihrer Blutplättchen nach Behandlung mit Heparin stark abnimmt. Blutplättchen sind Zellen im Blut, die zur Blutstillung beitragen. Heparin ist ein Arzneimittel, das eingesetzt wird, um die Bildung von Blutgerinnseln zu verhindern.
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit ihrem Arzt oder Apotheker bevor sie Octanine F anwenden.
• Wie bei allen intravenös zu verabreichenden Arzneimitteln, die Proteine enthalten, sind Überempfindlichkeitsreaktionen (allergische Reaktionen) möglich. OCTANINE F enthält neben Faktor IX und Heparin auch Spuren von anderen menschlichen Proteinen. Frühe Anzeichen allergischer Reaktionen sind:
- Quaddelbildung (Nesselsucht)
- Hautausschlag
- Engegefühl in der Brust
- keuchende Atmung
- niedriger Blutdruck
- akute allergische Allgemeinreaktion (Anaphylaxie, d.h. einzelne oder alle genannten Symptome entwickeln sich sehr rasch und treten mit großer Intensität auf).
Wenn Sie diese Symptome bemerken, brechen Sie die Injektion sofort ab und benachrichtigen Sie Ihren Arzt. Im Falle eines anaphylaktischen Schocks muss er so schnell wie möglich die empfohlene Behandlung einleiten.
• Ihr Arzt kann Ihnen eine Impfung gegen Hepatitis A und B empfehlen, wenn Sie regelmäßig oder wiederholt Faktor-IX-Konzentrate erhalten, die aus menschlichem Blutplasma gewonnen werden.
• Es ist bekannt, dass Personen mit Hämophilie B Hemmkörper (neutralisierende Antikörper) gegen Faktor IX entwickeln können. Diese Hemmkörper werden von den Immunzellen gebildet. Sie erhöhen das Risiko, einen anaphylaktischen Schock (schwere allergische Allgemeinreaktion) zu erleiden. Wenn bei Ihnen eine allergische Reaktion auftritt, müssen Sie deshalb darauf untersucht werden, ob bei Ihnen derartige Hemmkörper vorhanden sind. Bei Patienten mit neutralisierenden Antikörpern gegen Faktor IX ist das Risiko eines anaphylaktischen Schocks erhöht, wenn sie weiter mit Faktor IX behandelt werden. Die erste Faktor-IX-Injektion muss daher unter ärztlicher Aufsicht erfolgen, so dass im Falle einer allergischen Reaktion eine ausreichende ärztliche Versorgung gewährleistet ist.
• Faktor-IX-Proteinkonzentrate können zu einer Verstopfung Ihrer Blutgefäße durch Blutgerinnsel führen. Wegen dieses Risikos, das bei Produkten mit geringem
Reinheitsgrad höher ist, müssen Sie nach der Verabreichung von Faktor-IXKonzentraten auf Zeichen einer Gerinnselbildung überwacht werden, wenn bei Ihnen:
> Zeichen einer Fibrinolyse (Auflösung von Blutgerinnseln) vorhanden sind,
> eine Verbrauchskoagulopathie (ausgedehnte Blutgerinnung in den Blutgefäßen) vorliegt,
> eine Lebererkrankung diagnostiziert wurde,
> vor kurzem eine Operation durchgeführt wurde,
> ein erhöhtes Risiko für Gerinnselbildung oder für eine Verbrauchskoagulopathie besteht.
Wenn einer der genannten Umstände auf Sie zutrifft, wird Ihnen Ihr Arzt OCTANINE F nur verabreichen, wenn der Nutzen gegenüber den Risiken überwiegt.
• Nach mehrmaliger Behandlung mit Produkten, die den Gerinnungsfaktor IX vom Menschen enthalten, müssen die Patienten auf die Entwicklung von Hemmkörpern (neutralisierende Antikörper) überwacht werden. Die Bestimmung der Menge dieser Hemmkörper erfolgt in Bethesda-Einheiten (BE) mithilfe geeigneter biologischer Tests.
Virussicherheit bei Blutpräparaten
o Bei der Herstellung von Medikamenten aus menschlichem Blut oder Plasma werden bestimmte Maßnahmen getroffen, um die Übertragung von Infektionen auf die Patienten zu verhindern. Zu diesen Maßnahmen gehören die sorgfältige Auswahl der Blut- und Plasmaspender um sicherzustellen, dass solche, die möglicherweise infiziert sind, ausgeschlossen werden, sowie die Untersuchung jeder Einzelspende und der Plasmapools auf Anzeichen von Viren. Außerdem wenden die Hersteller dieser Konzentrate bei der Verarbeitung von Blut und Plasma Verfahren zur Inaktivierung oder Entfernung von Viren an. Trotz der getroffenen Maßnahmen kann bei der Anwendung von Arzneimitteln, die aus menschlichem Blut oder Blutplasma hergestellt sind, die Übertragung von Infektionen nicht völlig ausgeschlossen werden. Dies gilt auch für unbekannte oder neu auftretende Viren und sonstige Krankheitserreger.
o Die angewendeten Verfahren zur Inaktivierung oder Entfernung von Viren gelten als wirksam gegen Viren mit Lipidhülle, wie das Humane Immundefizienz-Virus (HIV), das Hepatitis-B-Virus und das Hepatitis-C-Virus, sowie gegen das nicht-umhüllte Hepatitis-A-Virus. Die verwendeten Verfahren sind möglicherweise bei nicht-umhüllten Viren, wie z. B. Parvovirus B19, nur begrenzt wirksam. Die Infektion mit Parvovirus B19 kann bei schwangeren Frauen (Infektion des Fetus) und bei Personen mit Immunschwächekrankheiten oder bestimmten Formen der Anämie (z. B. Sichelzellenanämie oder hämolytische Anämie) zu schweren Reaktionen führen.
Es wird dringend empfohlen, dass bei jeder Verabreichung von OCTANINE F der Name und die Chargennummer des Präparates aufgezeichnet werden, um die verwendeten Chargen zu dokumentieren.
Kinder
Wenn OCTANINE F einem Neugeborenen verabreicht wird, muss das Kind engmaschig auf Zeichen einer Verbrauchskoagulopathie überwacht werden
Anwendung von OCTANINE F zusammen mit anderen Arzneimitteln
Wechselwirkungen zwischen Produkten aus Blutgerinnungsfaktor IX vom Menschen und anderen Arzneimitteln sind bisher nicht bekannt.
Informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel anwenden bzw. vor kurzem angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt.
Schwangerschaft und Stillzeit
Zur Anwendung von Faktor IX während der Schwangerschaft und Stillzeit liegen keine Erfahrungen vor. Faktor IX darf daher bei schwangeren Frauen und stillenden Müttern nur angewendet werden, wenn dies eindeutig erforderlich ist.
Fragen Sie vor der Anwendung oder Einnahme von allen Arzneimitteln Ihren Arzt oder Apotheker um Rat.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Es wurden keine Auswirkungen von OCTANINE F auf die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beobachtet.
3. Wie ist OCTANINE F anzuwenden?
Wenden Sie OCTANINE F immer genau nach Absprache mit Ihrem Arzt an. Fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht sicher sind.
OCTANINE F wird nach der Herstellung der Injektionslösung mit dem mitgelieferten Lösungsmittel in eine Vene (intravenös) injiziert.
Verwenden Sie bitte ausschließlich das mitgelieferte Injektionszubehör. Die Anwendung anderer Injektions-/Infusionsbestecke kann mit zusätzlichen Risiken verbunden sein und kann zum Fehlschlagen der Therapie führen.
Die Behandlung darf nur unter Aufsicht eines in der Hämophiliebehandlung erfahrenen Arztes eingeleitet werden. Dosis und Dauer der Substitutionsbehandlung mit OCTANINE F sind abhängig vom Schweregrad Ihres Faktor-IX-Mangels, von Ort und Ausmaß der Blutung und von Ihrem klinischen Zustand.
Berechnung der Dosis:
Ihr Arzt wird Ihnen sagen, wie häufig Sie OCTANINE F anwenden und wieviel Sie jeweils injizieren müssen.
Die Dosis von Faktor IX wird in Internationalen Einheiten (I.E.) ausgedrückt. Die Aktivität von Faktor IX im Plasma gibt an, wieviel Faktor IX im Plasma vorhanden ist. Sie wird entweder in Prozent (bezogen auf das Blutplasma von gesunden Menschen) oder in Internationalen Einheiten (bezogen auf einen internationalen Standard für den Gehalt an Faktor IX im Blutplasma) angegeben.
Eine Internationale Einheit (I.E.) der Faktor-IX-Aktivität entspricht der Menge an Faktor IX in 1 ml Blutplasma eines gesunden Menschen. Die Berechnung der erforderlichen Faktor-IX-Dosis beruht auf der Beobachtung, dass 1 I.E. Faktor IX pro Kilogramm Körpergewicht die Faktor-IX-Aktivität im Blutplasma um ungefähr 1% der normalen Aktivität anhebt. Zur Berechnung der für Sie erforderlichen Dosis wird die Faktor-IXAktivität in Ihrem Blutplasma gemessen. Anhand des Ergebnisses wird ermittelt, wie groß der Anstieg der Aktivität sein muss.
Die erforderliche Dosis wird nach folgender Formel berechnet:
Erforderliche Einheiten = Körpergewicht (kg) x gewünschte Zunahme der Faktor-IX-Aktivität (%) (I.E./dl) x 0,8
Wie hoch Ihre Dosis sein muss und wie häufig Sie sie benötigen, hängt immer davon ab, wie Sie auf das Medikament ansprechen und wird von Ihrem Arzt entschieden. Faktor-IX-Konzentrate brauchen nur selten häufiger als einmal täglich verabreicht zu werden.
Da es Unterschiede im Ansprechen auf Faktor-IX-Konzentrate geben kann, muss Ihr Faktor-IX-Spiegel während der Behandlung gemessen werden, um danach die Dosis und Verabreichungshäufigkeit ermitteln zu können. Insbesondere bei Operationen wird Ihr Arzt Blutuntersuchungen (Faktor-IX-Aktivität im Blutplasma) durchführen, um die Substitutionstherapie engmaschig zu kontrollieren.
Vorbeugung von Blutungen
Wenn Sie an schwerer Hämophilie B leiden, sollten Sie 20 bis 40 I.E. Faktor IX pro Kilogramm Körpergewicht injizieren. Zur vorbeugenden Dauerbehandlung (Prophylaxe) sollten Sie diese Dosis zweimal wöchentlich injizieren. Ihre Dosierung muss Ihrem Ansprechen auf die Behandlung angepasst werden. In manchen Fällen, besonders bei jüngeren Patienten, können kürzere Abstände zwischen den Injektionen oder höhere Dosen erforderlich sein.
Anwendung bei Kindern
In einer klinischen Prüfung mit Kindern unter 6 Jahren lag die durchschnittliche Dosis pro Behandlungstag bei 40 I.E./kg Körpergewicht.
Wenn bei Ihnen die Blutung nicht gestillt werden kann
Wenn die erwartete Faktor-IX-Aktivität nach einer Injektion nicht erreicht wird, oder die Blutung nach Verabreichung der richtigen Dosis nicht zu stoppen ist, müssen Sie Ihren Arzt informieren. Er wird Ihr Blutplasma untersuchen um festzustellen, ob Sie Hemmkörper (Antikörper) gegen das Faktor-IX-Protein entwickelt haben. Diese Hemmkörper können die Aktivität von Faktor IX reduzieren. Sind Hemmkörper nachweisbar, kann es notwendig werden, auf eine andere Therapie umzustellen. Ihr Arzt wird dies mit Ihnen besprechen und gegebenenfalls eine darüber hinausgehende Behandlung empfehlen.
Wenn Sie eine größere Menge OCTANINE F angewendet haben, als Sie sollten
Symptome einer Überdosierung mit Blutgerinnungsfaktor IX vom Menschen wurden bislang nicht beobachtet. Jedoch sollte die empfohlene Dosierung nicht überschritten werden.
Die „Anleitung zur Heimselbstbehandlung“ finden Sie im Karton, der den Gerätesatz enthält.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
• Selten wurden bei Patienten, die mit Faktor-IX-haltigen Produkten behandelt wurden, Überempfindlichkeitsreaktionen oder allergische Reaktionen beobachtet. Folgende Symptome können auftreten:
o unwillkürliches Zusammenziehen der Blutgefäße (Spasmen) mit Schwellungen von Gesicht, Mund und Rachen
o Brennen und Stechen an der Injektionsstelle
o Schüttelfrost
o Hitzegefühl und Hautrötung
o Hautausschlag
o Kopfschmerzen
o Quaddelbildung (Nesselsucht)
o niedriger Blutdruck
o Müdigkeit
o Übelkeit
o Unruhe
o Herzrasen
o Engegefühl in der Brust
o Kribbeln auf der Haut o Erbrechen o keuchende Atmung
In manchen Fällen können allergische Reaktionen zu einer schweren Reaktion führen, die als Anaphylaxie bezeichnet wird und mit einem Schock einhergehen kann. Diese Reaktionen treten in den meisten Fällen im Zusammenhang mit der Entwicklung von Faktor-IX-Hemmkörpern auf. Wenn Sie an einem der oben genannten Symptome leiden, informieren Sie bitte Ihren Arzt.
• Wenn Sie an Hämophilie B leiden, können sich in seltenen Fällen bei Ihnen neutralisierende Antikörper (Hemmkörper) gegen Faktor IX entwickeln. Diese Antikörper können dazu führen, dass Ihr Medikament nicht mehr richtig wirkt. In diesem Fall wird Ihr Arzt dies mit Ihnen besprechen und Ihnen die weitere Behandlung empfehlen.
An einer klinischen Prüfung mit OCTANINE F nahmen 25 Kinder mit Hämophilie B teil, von denen sechs nicht vorbehandelt waren. Während der Studie wurden keine Hemmkörper beobachtet. Die Verträglichkeit wurde bei allen Injektionen mit „sehr gut" oder „gut" beurteilt.
• Bei manchen Hämophilie-B-Patienten mit Hemmkörpern gegen Faktor IX und allergischen Reaktionen in der Krankengeschichte, bei denen eine Hemmkörpertherapie mit hohen Faktor-IX-Dosen durchgeführt wurde, entwickelte sich ein nephrotisches Syndrom (eine schwere Nierenkrankheit).
• In seltenen Fällen kann Fieber auftreten.
• Bei Verabreichung von Faktor-IX-Konzentraten mit geringem Reinheitsgrad kann es in seltenen Fällen zu einer Gerinnselbildung in einem Blutgefäß kommen. Das kann folgende Komplikationen nach sich ziehen:
o Herzinfarkt
o ausgedehnte Blutgerinnung in den Gefäßen (Verbrauchskoagulopathie) o Blutgerinnsel in den Venen (Venenthrombose) o Blutgerinnsel in den Lungen (Lungenembolie).
Diese Nebenwirkungen sind bei Verwendung von Faktor-IX-Konzentraten mit geringem Reinheitsgrad häufiger; bei Konzentraten mit hohem Reinheitsgrad wie OCTANINE F treten sie nur sehr selten auf.
• Der Heparingehalt des Präparates kann in sehr seltenen Fällen eine plötzliche Abnahme der Zahl der Blutplättchen unter 100.000 pro Mikroliter oder weniger als 50% des Ausgangswertes verursachen. Dabei handelt es sich um eine allergische Reaktion, die als "Heparin-induzierte Thrombozytopenie Typ II” bezeichnet wird. Diese zahlenmäßige Abnahme der Blutplättchen kann bei Patienten, die vorher nicht überempfindlich auf Heparin waren, 6-14 Tage nach Behandlungsbeginn auftreten. Bei Patienten mit vorbestehender Überempfindlichkeit gegen Heparin kann sich diese Störung innerhalb von wenigen Stunden nach Behandlungsbeginn entwickeln. Diese schwere Form des Blutplättchen-Abfalls kann von folgenden Störungen begleitet sein bzw. sie verursachen: o Blutgerinnselbildung in Arterien und Venen
o Verstopfung eines Blutgefäßes durch ein Blutgerinnsel, das aus einer anderen Region angeschwemmt wird
o eine schwerwiegende Blutgerinnungsstörung, die als Verbrauchskoagulopathie bezeichnet wird
o Absterben der Hautzellen (Wundbrand) im Bereich der Injektionsstelle o punktförmige Hautblutungen o blaue Flecken in der Haut o Teerstuhl
Wenn Sie derartige allergische Reaktionen bemerken, beenden Sie sofort die Injektion von OCTANINE F und verwenden Sie in Zukunft keine heparinhaltigen Arzneimittel mehr. Wegen dieser seltenen Wirkung auf die Blutplättchen muss Ihr Arzt deren Zahl engmaschig überwachen, insbesondere zu Beginn der Behandlung.
Informationen zur Virussicherheit finden Sie in Abschnitt 2.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Sie können Nebenwirkungen auch direkt über das aufgeführte nationale Meldesystem anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
Deutschland
Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel
Paul-Ehrlich-Institut
Paul-Ehrlich-Str. 51-59
63225 Langen
Tel: +49 6103 77 0
Fax: +49 6103 77 1234
Website: www.pei.de
5. Wie ist OCTANINE F aufzubewahren?
Bewahren Sie dieses Arzneimittel unzugänglich für Kinder auf.
Nicht über 25°C lagern.
Nicht einfrieren.
Durchstechflaschen im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Sie dürfen dieses Arzneimittel nach dem auf dem Etikett und dem Umkarton nach „Verwendbar bis" angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats.
Die Stabilität der gebrauchsfertigen Lösung wurde über einen Zeitraum von 72 Stunden bei Raumtemperatur ( +25°C) nachgewiesen.
Vom mikrobiologischen Standpunkt aus muss das Produkt sofort verwendet werden. Wenn es nicht sofort verwendet wird, liegen die Aufbewahrungszeit und die Bedingungen vor Anwendung in der Verantwortung des Anwenders, wobei normalerweise 24 Stunden bei 2°C - 8°C nicht überschritten werden sollten, es sei denn, die Rekonstitution / Verdünnung fand unter kontrollierten und validierten aseptischen Bedingungen statt.
Die gebrauchsfertige Lösung ist nur zum einmaligen Gebrauch bestimmt. Verwenden Sie keine trübe oder unvollständig aufgelöste Lösung.
Das Arzneimittel darf nicht im Abwasser oder Haushaltsabfall entsorgt werden. Fragen Sie Ihren Apotheker wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr benötigen. Diese Maßnahme hilft die Umwelt zu schützen.
6. Inhalt der Packung und weitere Informationen Was OCTANINE F enthält
Der Wirkstoff ist der Blutgerinnungsfaktor IX vom Menschen.
Die sonstigen Bestandteile sind Heparin, Natriumchlorid, Natriumcitrat, Argininhydrochlorid und Lysinhydrochlorid.
Dieses Arzneimittel enthält bis zu 69 mg Natrium pro Flasche OCTANINE F 500 und bis zu 138 mg Natrium pro Flasche OCTANINE F 1o0o. Dies sollten Sie berücksichtigen, wenn Sie auf eine natriumarme Ernährung achten müssen.
Wie OCTANINE F aussieht und Inhalt der Packung
OCTANINE F ist in 2 Packungsgrößen erhältlich: OCTANINE F 500 bzw. OCTANINE F 1000, die nominell 500 I.E. bzw. 1000 I.E. Blutgerinnungsfaktor IX vom Menschen pro Flasche enthalten. Jede Packung enthält Pulver und Lösungsmittel zur Herstellung einer Injektionslösung.
Das Produkt enthält ca. 100 I.E./ml Gerinnungsfaktor IX vom Menschen, wenn das Konzentrat in 5 ml bzw. 10 ml Wasser für Injektionszwecke aufgelöst wird.
OCTANINE F wird aus menschlichem Plasma hergestellt.
Die Aktivität (I.E.) wird entsprechend dem Europäischen Arzneibuch bestimmt, indem mit einem internationalen Standard der Weltgesundheitsorganisation (WHO) verglichen wird. Die spezifische Aktivität von OCTANINE F beträgt ca. 100 I.E./mg Protein.
Inhalt der Packung:
OCTANINE F besteht aus zwei Teilverpackungen, die mit einem Folienstreifen zusammengehalten werden.
Eine Teilverpackung enthält:
- 1 Durchstechflasche mit Pulver zur Herstellung einer Injektionslösung
- Gebrauchsinformation
Die zweite Teilverpackung enthält:
- 1 Durchstechflasche mit Lösungsmittel (Wasser für Injektionszwecke): 5 ml für OCTANINE F 500 bzw. 10 ml für OCTANINE F 1000.
- Jede Packung enthält außerdem folgende Verbrauchsmaterialien: 1 Einmalspritze, 1 Transferset Mix2VialTM, 1 Injektionsnadel (Butterfly)
- 2 Alkoholtupfer
Pharmazeutischer Unternehmer und Hersteller
OCTAPHARMA GmbH Elisabeth-Selbert-Str. 11 40764 Langenfeld Tel.: 02173-917-0 Fax: 02173-917-111 E-Mail: info@octapharma.de www. octapharm a. de
Niederlassung Dessau
Otto-Reuter-Str. 3
06847 Dessau-Roßlau
Tel.: 0340-5508-0
Fax: 0800-2896-282
E-Mail: vertrieb@octapharma.de
Bei Fragen zu diesem Arzneimittel wenden Sie sich bitte an den lokalen Vertreter des pharmazeutischen Unternehmens.
Diese Packungsbeilage wurde zuletzt überarbeitet im 11/2014.
Herkunftsland des Blutplasmas: Deutschland, Estland, Finnland, Kroatien Luxemburg, Norwegen, Österreich, Portugal, Schweden, Schweiz, Slowenien, Spanien, Tschechische Republik, Ungarn,USA.
Es wird auf die Dokumentationspflicht gemäß Transfusionsgesetz hingewiesen.
Anleitung zur häuslichen Behandlung und Selbstverabreichung
• Bitte lesen Sie alle Anweisungen durch und befolgen Sie sie sorgfältig.
• Verwenden Sie OCTANINE F nicht mehr nach dem Verfalldatum, das auf dem Etikett und dem Umkarton angegeben ist.
• Bitte achten Sie bei allen Arbeitsschritten strikt auf Hygiene.
• Die gebrauchsfertige Injektionslösung in der Spritze ist klar oder leicht schillernd (opaleszent). Verwenden Sie keine Lösungen, die trübe aussehen oder Rückstände enthalten.
• Das gebrauchsfertige Präparat unmittelbar nach dem Auflösen verwenden, um mikrobielle Verunreinigungen zu verhindern.
• Verwenden Sie bitte ausschließlich das mitgelieferte Injektionszubehör. Die Anwendung anderer Injektions-/Infusionsbestecke kann mit Risiken verbunden sein oder die Wirksamkeit beeinträchtigen.
Anleitung zur Vorbereitung der Lösung:
1. Lösungsmittel und Konzentrat in den ungeöffneten Flaschen auf Zimmertemperatur bringen. Nicht direkt aus dem Kühlschrank verwenden.
2. Die Schutzkappen von der Konzentratflasche und Lösungsmittelflasche entfernen und die Gummistopfen beider Flaschen mit einem Alkoholtupfer desinfizieren.
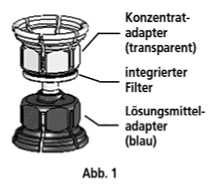
3. Die Lösungsmittelflasche auf eine feste, ebene Unterlage (z.B. Tisch) stellen. Das in Abb. 1 beschriebene Mix2Vial-Set mit dem blauen Adapter auf die Lösungsmittelflasche (LM) aufsetzen und bis zum Anschlag nach unten drücken (Abb. 2+3).
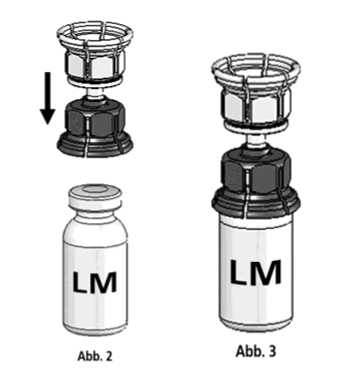
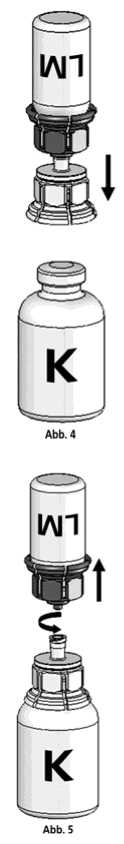
4. Die Konzentratflasche (K) auf eine feste, ebene Unterlage stellen. Die Lösungsmittelflasche (LM) mit dem Mix2Vial-Set umdrehen und senkrecht mit dem transparenten Ende auf die Konzentratflasche (K) aufsetzen und bis zum Anschlag nach unten drücken (Abb. 4). Das Vakuum in der Konzentratflasche saugt das Lösungsmittel an.
5. Die Konzentratflasche mit Mix2VialTM-Set und der verbundenen
Lösungsmittelflasche leicht schwenken (nicht schütteln) bis das Produkt vollständig gelöst ist. Das Konzentrat löst sich bei Zimmertemperatur spätestens nach 10 Minuten vollständig. Dabei ist eine leichte Schaumbildung möglich, die sich auflösen wird. Die Lösungsmittelflasche zusammen mit dem blauen Adapter von der Konzentratflasche abdrehen (Abb. 5) und die Lösungsmittelflasche mit dem blauen Adapter verwerfen.
Die gebrauchsfertige Konzentratlösung ist farblos. Nach Auflösen in dem beigefügten Wasser für Injektionszwecke wird Octanine intravenös verabreicht.
Anleitung zur Injektion:
Der Puls sollte vor und während der Injektion gemessen werden. Eine deutliche Erhöhung der Pulsfrequenz klingt normalerweise nach Verlangsamen oder Unterbrechen der Injektion schnell wieder ab.
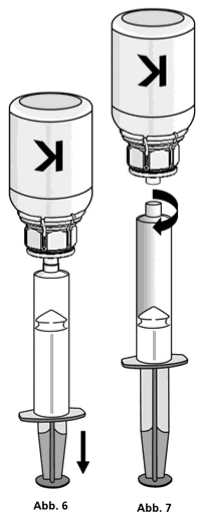
1. Die Spritze mit dem transparenten Adapter der Konzentratflasche verbinden. Die Flasche samt Einmalspritze umdrehen und das aufgelöste Präparat in die Spritze aufziehen (Abb. 6).
Die Injektionslösung in der Spritze sollte klar oder leicht schillernd sein. Nachdem das Produkt in die Spritze überführt wurde, den Spritzenzylinder fassen und die Spritze vom transparenten Adapter der Konzentratflasche entfernen (Abb. 7). Verwerfen Sie die Konzentratflasche mit dem Adapter.
2. Vorgesehene Injektionsstelle mit einem Alkoholtupfer desinfizieren.
3. Die beigepackte Flügelkanüle auf die Spritze aufsetzen.
4. Stechen Sie die Flügelkanüle in die gewählte Vene. Wenn Sie die Vene vor der Punktion gestaut haben, damit Sie sie besser sehen können, müssen Sie die Stauung öffnen, bevor Sie mit der Injektion beginnen. Es darf kein Blut in die Spritze gelangen, da dies zur Bildung von Blutgerinnseln führen könnte.
5. Injizieren Sie die Lösung langsam in die Vene, wobei die Injektionsgeschwindigkeit höchstens 2 - 3 ml pro Minute betragen sollte.
Wenn Sie mehr als eine Flasche des Konzentrates benötigen, kann die Flügelkanüle in der Vene belassen werden. Die Spritze kann ebenfalls für mehrere Konzentratflaschen benutzt werden. Zum Herstellen der gebrauchsfertigen Lösung immer ein neues Mix2VialTM-Set benutzen.
Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker.