Octanine F 500
Seite 1/14
Fachinformation
1 BEZEICHNUNG DES ARZNEIMITTELS OCTANINE F 500 bzw. 1000
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung.
2 QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
OCTANINE F 500 bzw. 1000, Pulver und Lösungsmittel zur Herstellung einer Injektionslösung, enthält nominell 500 I.E. bzw. 1000 I.E. Blutgerinnungsfaktor IX vom Menschen pro Durchstechflasche.
Das Konzentrat enthält ca. 100 I.E./ml Blutgerinnungsfaktor IX vom Menschen, wenn es in 5 ml bzw. 10 ml Wasser für Injektionszwecke (Ph. Eur.) aufgelöst worden ist.
OCTANINE F wird aus menschlichem Plasma hergestellt.
Die Aktivität (I.E.) wird mittels des einstufigen Koagulationstests entsprechend des Europäischen Arzneibuches im Vergleich zu einem internationalen Standard der Weltgesundheitsorganisation (WHO) bestimmt. Die spezifische Aktivität von OCTANINE F beträgt ca. 100 I.E./mg Protein.
Dieses Arzneimittel enthält bis zu 3 mmol (69 mg) Natrium pro Flasche OCTANINE F 500 und bis zu 6 mmol (138 mg) Natrium pro Flasche OCTANINE F 1000. Dies ist bei Patienten zu berücksichtigen, die auf eine natriumarme Ernährung achten müssen.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3 DARREICHUNGSFORM
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung.
Das Pulver ist eine leicht körnige, weiße oder schwach gelbliche Substanz.
4 KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Therapie und Prophylaxe von Blutungen bei Patienten mit Hämophilie B (angeborener Faktor-IX-Mangel).
4.2 Dosierung und Art der Anwendung
Die Behandlung sollte nur unter Aufsicht eines in der Hämophiliebehandlung erfahrenen Arztes begonnen werden.
Zuvor unbehandelte Patienten
Die Sicherheit und Wirksamkeit von OCTANINE F in zuvor unbehandelten Patienten ist nicht belegt.
Überwachung der Behandlung
Während der Behandlung ist die regelmäßige Bestimmung der Faktor- IX-Spiegel ratsam, um die Dosis und die Häufigkeit der Infusionen festzulegen. Jeder Patient reagiert möglicherweise anders auf Faktor IX und zeigt eine andere Halbwertszeit und Recovery. Bei Dosierung nach Körpergewicht kann bei über- oder untergewichtigen Patienten eine Anpassung erforderlich sein. Insbesondere bei größeren chirurgischen Eingriffen ist eine präzise Überwachung der Substitutionstherapie mit Hilfe der Gerinnungsanalyse (Faktor-IX-Aktivität) unverzichtbar.
Dosierung
Dosierung und Dauer der Substitutionsbehandlung sind abhängig von der Schwere des Faktor-IX-Mangels, von der Lokalisation und dem Ausmaß der Blutung sowie vom klinischen Zustand des Patienten.
Die Anzahl der an Faktor IX verabreichten Einheiten wird in Internationalen Einheiten (I.E.) ausgedrückt, für die der aktuelle WHO-Standard für Faktor-IX-Konzentrate gilt. Die Faktor-IX-Aktivität im Plasma wird entweder in Prozent (bezogen auf normales Humanplasma) oder in Internationalen Einheiten (bezogen auf einen internationalen Standard für Faktor IX im Plasma) angegeben.
Eine Internationale Einheit (I.E.) der Faktor-IX-Aktivität entspricht der Menge an Faktor IX in 1 ml normalem Humanplasma.
Bedarfsbehandlung
Die Berechnung der erforderlichen Dosis von Faktor IX beruht auf der Beobachtung, dass 1 Internationale Einheit (I.E.) Blutgerinnungsfaktor IX pro kg Körpergewicht die Faktor-IX-Aktivität im Plasma um ca. 1% der normalen Aktivität erhöht. Die erforderliche Dosis für OCTANINE F wird mit Hilfe der folgenden Formel ermittelt:
Erforderliche Einheiten = Körpergewicht (kg) x gewünschter Anstieg der Faktor-IX-Aktivität (%) (I.E./dl) x 0,8
Menge und Häufigkeit der Verabreichung sollten sich im Einzelfall immer an der klinischen Wirksamkeit orientieren.
Im Fall des Auftretens folgender hämorrhagischer Ereignisse sollte die Faktor-IXAktivität im Plasma im entsprechenden Zeitraum nicht unter das angegebene Niveau sinken (angegeben in % des Normalwertes). Die nachfolgende Tabelle kann als Richtschnur zur Festlegung der Dosis bei Blutungsepisoden und chirurgischen Eingriffen dienen:
|
Blutungsgrad / Art des chirurgischen Eingriffs |
Erforderlicher Faktor-IXSpiegel (%) |
Häufigkeit der Dosen (Stunden) / Dauer der Therapie (Tage) |
|
Blutung | ||
|
Beginnende Gelenkblutung, Muskelblutung oder Blutungen in der Mundhöhle |
20 - 40 |
Alle 24 h wiederholen. Mindestens 1 Tag, bis die durch Schmerzen angezeigte Blutung gestillt oder eine Heilung erreicht ist. |
|
Größere Gelenkblutungen, Muskelblutung oder Hämatom |
30 - 60 |
Die Infusion über 3 - 4 Tage oder länger alle 24 h wiederholen, bis zum Erreichen von Schmerzfreiheit und Aufhebung der akuten Bewegungseinschränkung. |
|
Lebensbedrohliche Blutungen |
60 - 100 |
Infusion alle 8 - 24 h wiederholen, bis die Gefahr gebannt ist. |
|
Operation | ||
|
Kleiner Eingriff einschließlich Zahnextraktionen |
30 - 60 |
Alle 24 h, mindestens 1 Tag, bis eine Heilung erzielt ist. |
|
Großer Eingriff |
80 - 100 (vor und nach der Operation) |
Infusion alle 8 - 24 h wiederholen, bis eine angemessene Wundheilung erzielt ist, dann die Therapie für mindestens 7 Tage weiterführen, um eine Faktor-IX-Aktivität von 30% bis 60% (I.E./dl) aufrechtzuerhalten. |
Prophylaxe
Zur Prophylaxe bei Patienten mit schwerer Hämophilie B sollten 20 - 40 I.E. Faktor IX pro kg Körpergewicht (KG) alle 3 bis 4 Tage verabreicht werden.
In manchen Fällen, besonders bei jüngeren Patienten, können kürzere Dosierungsintervalle oder höhere Dosen erforderlich sein.
Kontinuierliche Infusion
Es liegen keine ausreichenden Daten vor, um die Dauerinfusion von OCTANINE F bei chirurgischen Eingriffen zu empfehlen.
Kinder und Jugendliche
In einer klinischen Prüfung mit 25 Kindern unter 6 Jahren lag die mittlere tägliche Dosis sowohl zur Prophylaxe als auch zur Blutungsbehandlung zwischen 35 und 40 I.E./kg KG.
Art der Anwendung Intravenöse Anwendung.
Es wird empfohlen, nicht mehr als 2-3 ml pro Minute zu verabreichen. Hinweise zur Rekonstitution des Arzneimittels vor der Anwendung, siehe Abschnitt 6.
4.3 Gegenanzeigen
- Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
- Bekannter allergisch bedingter Abfall der Thrombozytenzahl während der Behandlung mit Heparin oder einem heparinhaltigen Arzneimittel (Heparininduzierte Thrombozytopenie [HIT] Typ II).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Überempfindlichkeit
Allergische Reaktionen können bei der Verabreichung von OCTANINE F auftreten. Das Konzentrat enthält neben Faktor IX und Heparin auch Spuren von anderen menschlichen Proteinen. Bei Auftreten von Überempfindlichkeitssymptomen sollte Patienten geraten werden, die Behandlung mit diesem Konzentrat sofort abzubrechen und ihren Arzt aufzusuchen. Patienten sollen über frühe Anzeichen einer allergischen Reaktion wie Quaddeln, generalisierte Urtikaria, Engegefühl in der Brust, Stridor, Hypotonie und Anaphylaxie informiert werden.
Im Falle eines Schocks sollten die medizinischen Standards zur Schocktherapie beachtet werden.
Inhibitoren
Nach wiederholter Behandlung mit Faktor-IX-Konzentrat sollten Patienten auf die Bildung von neutralisierenden Antikörpern (Inhibitoren) hin überwacht werden. Hierzu sollten geeignete biologische Tests verwendet werden (Darstellung in Bethesda-Einheiten (BE)).
In der Fachliteratur finden sich Berichte über eine Korrelation zwischen dem Auftreten von Faktor-IX-Inhibitoren und allergischen Reaktionen. Deshalb müssen alle Patienten, die allergische Reaktionen zeigen, auf das Vorliegen von Faktor-IXInhibitoren untersucht werden. Es ist zu beachten, dass bei Inhibitorpatienten im Fall einer erneuten Faktor-IX-Exposition ein erhöhtes Überempfindlichkeitsrisiko gegenüber Faktor IX besteht.
Aufgrund des Risikos allergischer Reaktionen gegenüber Faktor-IX-Konzentraten muss die Initialbehandlung mit Blutgerinnungsfaktor IX nach dem Ermessen des behandelnden Arztes unter medizinischer Aufsicht erfolgen, so dass beim Auftreten allergischer Reaktionen eine ausreichende medizinische Versorgung gewährleistet werden kann.
Thrombose
Wegen des potentiellen Risikos thrombotischer Komplikationen sollte eine klinische Überwachung auf Frühsymptome einer Koagulopathie mit Thrombosetendenz und einer Verbrauchskoagulopathie mittels entsprechender biologischer Tests eingeleitet werden, wenn dieses Präparat Patienten mit Lebererkrankungen oder Patienten nach Operationen, Neugeborenen oder Patienten mit einem Risiko für thrombotische Störungen oder Verbrauchskoagulopathie (disseminierte intravasale Gerinnung) verabreicht wird. In jedem dieser Fälle muss der Nutzen der Behandlung mit OCTANINE F gegen das Risiko für das Auftreten dieser Komplikationen abgewogen werden
Kardiovaskuläre Ereignisse
Bei Patienten mit kardiovaskulärem Risiko kann die Substitutionstherapie mit Faktor IX zu einer Erhöhung des Risikos für Herz -Kreislauferkrankungen führen.
Katheterbedingte Komplikationen
Wenn ein zentralvenöser Zugang erforderlich ist, muss das Risiko für entsprechende Komplikationen wie lokale Infektionen, Bakteriämien und Thrombosen an der Katheterstelle beachtet werden.
Übertragbare Erreger
• Zu den Standardmaßnahmen zur Verhinderung von Infektionen als Folge der Anwendung von Arzneimitteln, die aus humanem Blut oder Plasma hergestellt werden, zählen die Auswahl der Spender, die Testung der Einzelspenden und Plasmapools auf spezifische Infektionsmarker sowie wirkungsvolle Verfahren bei der Herstellung zur Inaktivierung/Entfernung von Viren. Dennoch kann bei der Anwendung von aus menschlichem Blut oder Plasma hergestellten Arzneimitteln die Möglichkeit der Übertragung von Krankheitserregern nicht völlig ausgeschlossen werden. Dies gilt auch für bisher unbekannte oder neu auftretende Viren und andere Erreger.
• Die angewendeten Inaktivierungs-/Eliminierungsverfahren gelten als wirksam gegen Viren mit Lipidhülle wie Humanes Immundefizienz Virus (HIV), Hepatitis B Virus (HBV) und Hepatitis C Virus (HCV), sowie gegen das nicht-umhüllte Hepatitis A Virus (HAV). Die verwendeten Verfahren sind möglicherweise nur begrenzt wirksam gegen nicht-umhüllte Viren wie z. B. Parvovirus B19. Die Infektion mit Parvovirus B19 kann bei schwangeren Frauen (Infektion des Fetus) und bei Personen mit Immunschwächekrankheiten oder einer gesteigerten Erythropoese (z. B. bei hämolytischer Anämie) zu schweren Reaktionen führen.
Bei Patienten, die regelmäßig oder wiederholt Faktor-IX Produkte aus humanem Plasma erhalten, sollte ein angemessener Impfschutz (Hepatitis A und B) in Betracht gezogen werden.
Es wird auf die Dokumentationspflicht gemäß Transfusionsgesetz hingewiesen.
Patienten auf einer kontrollierten Natriumdiät
Dieses Arzneimittel enthält bis zu 3 mmol (bzw. 69 mg) Natrium pro Flasche OCTANINE F 500 und bis zu 6 mmol (bzw. 138 mg) Natrium pro Flasche OCTANINE F 1000. Dies ist bei Patienten zu berücksichtigen, die auf eine natriumarme Ernährung achten müssen.
Kinder und Jugendliche
Die angeführten Warnhinweise und Vorsichtsmaßnahmen gelten sowohl für Erwachsene als auch Kinder und Jungendliche.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Wechselwirkungen von Konzentraten aus humanem Blutgerinnungsfaktor IX mit anderen Arzneimitteln sind nicht bekannt.
4.6 Fertilität, Schwangerschaft und Stillzeit
Mit Faktor IX wurden keine Reproduktionsstudien an Tieren durchgeführt. Aufgrund des seltenen Vorkommens von Hämophilie B bei Frauen gibt es keine Erfahrung hinsichtlich des Gebrauchs von Faktor IX während der Schwangerschaft und Stillzeit. Daher sollte Faktor IX bei schwangeren oder stillenden Frauen nur angewendet werden, wenn dies unbedingt erforderlich ist.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
OCTANINE F hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Zusammenfassung des Sicherheitsprofils
Überempfindlichkeits- oder allergische Reaktionen (wie z. B. Quincke-Ödem, Brennen und Stechen an der Injektionsstelle, Schüttelfrost, Hitzegefühl, generalisierte Urtikaria, Kopfschmerzen, Ausschlag, Hypotonie, Lethargie, Übelkeit, Unruhe, Tachykardie, Engegefühl in der Brust, Kribbeln, Erbrechen, Stridor) wurden selten bei Patienten nach Behandlung mit Faktor-IX-haltigen Präparaten beobachtet. In manchen Fällen entwickelte sich aus diesen Reaktionen, die in engem zeitlichen Zusammenhang mit der Bildung von Faktor-IX-Inhibitoren auftraten (siehe auch Abschnitt 4.4), eine schwere Anaphylaxie. Es liegen Berichte über das Auftreten eines nephrotischen Syndroms nach versuchter Induktion einer Immuntoleranz bei Hämophilie-B-Patienten mit Faktor-IX-Inhibitoren und bekannter allergischer Diathese vor.
In seltenen Fällen wurde Fieber beobachtet.
Patienten mit Hämophilie B können neutralisierende Antikörper (Inhibitoren) gegen Faktor IX entwickeln. Faktor-IX-Inhibitoren äußern sich in einer ungenügenden klinischen Wirksamkeit. In solchen Fällen wird empfohlen, sich an ein spezialisiertes Hämophiliezentrum zu wenden. Im Rahmen einer klinischen Prüfung mit 25 Kindern mit Hämophilie B traten keine Inhibitoren auf. Sechs der Kinder waren zu Studienbeginn nicht vorbehandelt und wurden im Median 38 Tage mit OCTANINE F behandelt (Bereich: 8-90 Behandlungstage). Bei allen Patienten lagen bei Studienbeginn die Ergebnisse der Inhibitor-Testung unterhalb der Nachweisgrenze von <0,4 BE. Es wurde keine Inhibitorenbildung während der Studie beobachtet.
Bei Verabreichung von Faktor-IX-Produkten mit geringem Reinheitsgrad besteht ein höheres potentielles Risiko für thromboembolische Episoden. Die Anwendung von Faktor-IX-Produkten mit niedrigem Reinheitsgrad war mit dem Auftreten von Myokardinfarkt, disseminierter intravasaler Gerinnung, Venenthrombose und Lungenembolie verbunden. Der Gebrauch hochreiner Faktor-IX-Konzentrate ist sehr selten mit solchen Nebenwirkungen verbunden.
Zur Sicherheit hinsichtlich übertragbarer Erreger siehe Abschnitt 4.4.
Tabellarische Auflistung von Nebenwirkungen
Die nachfolgende Tabelle entspricht der MedDRA-Systemorganklassifizierung (SOC und bevorzugter Begriff).
Die Häufigkeiten wurden gemäß folgender Konvention bestimmt: sehr häufig (>1/10); häufig (>1/100 bis <1/10); gelegentlich (>1/1.000 bis <1/100); selten (>1/10.000 bis <1/1.000); sehr selten (<1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Untersuchungen
MedDRA Standard System-Organ-Klasse
Erkrankungen des Immunsystems
Gefäßerkrankungen
Erkrankungen der Nieren und Harnwege
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
Nebenwirkungen | |
|
Selten |
Sehr selten |
|
Überempfindlichkeit |
anaphylaktischer Schock |
|
Thromboembolytische Ereignisse1 | |
|
nephrotisches Syndrom | |
|
Heparin-induzierte Thrombozytopenie Pyrexie | |
|
anti-Faktor-IX-Antikörper- positiv | |
Beschreibung einzelner Nebenwirkungen
Aufgrund des Heparingehaltes von OCTANINE F kann in sehr seltenen Fällen ein allergisch induzierter Abfall der Thrombozytenzahl auf Werte deutlich unter 100.000/gl oder auf weniger als 50% des Ausgangswertes beobachtet werden (heparininduzierte Thrombozytopenie Typ II). Bei Patienten ohne vorbestehende Überempfindlichkeit gegen Heparin kann der Thrombozytenabfall 6 - 14 Tage nach Behandlungsbeginn auftreten. Bei Patienten mit vorbestehender Überempfindlichkeit gegen Heparin kann der Thrombozytenabfall unter Umständen innerhalb von Stunden auftreten.
Diese schwere Form des Thrombozytenabfalls kann mit arteriellen und venösen Thrombosen, Thromboembolien, Verbrauchskoagulopathien, Hautnekrosen an der Injektionsstelle, Petechien, Purpura und Meläna verbunden sein. Wenn die genannten allergischen Reaktionen beobachtet werden, ist die Injektion von OCTANINE F sofort abzubrechen. Der Patient muss informiert werden, dass er in Zukunft keine heparinhaltigen Arzneimittel mehr erhalten darf. Wegen dieser sehr seltenen, von Heparin ausgelösten Auswirkung auf Thrombozyten, sollte der Thrombozytengehalt des Patienten besonders bei Behandlungsbeginn sorgfältig überwacht werden.
Kinder und Jugendliche
Häufigkeit, Art und Schwere der Nebenwirkungen bei Kindern sind vergleichbar mit denen von Erwachsenen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das aufgeführte nationale Meldesystem anzuzeigen:
Deutschland
Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel
Paul-Ehrlich-Institut
Paul-Ehrlich-Str. 51-59
63225 Langen
Tel: +49 6103 77 0
Fax: +49 6103 77 1234
Website: www.pei.de
4.9 Überdosierung
Es wurden keine Fälle von Überdosierung beobachtet.
5 PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antihämorrhagika: Blutgerinnungsfaktor IX. ATC-Code: B02BD04
Faktor IX ist ein einkettiges Glykoprotein mit einem Molekulargewicht von ca. 68.000 Dalton. Er ist ein Vitamin-K-abhängiger Blutgerinnungsfaktor und wird in der Leber gebildet. Faktor IX wird durch Faktor XIa im endogenen Gerinnungssystem und von Faktor VII/Gewebefaktorkomplex im exogenen Gerinnungssystem aktiviert. Aktivierter Faktor IX aktiviert seinerseits in Verbindung mit dem aktivierten Faktor VIII den Faktor X. Aktivierter Faktor X wandelt Prothrombin zu Thrombin, welches dann Fibrinogen zu Fibrin umwandelt, wodurch ein Gerinnsel gebildet wird.
Hämophilie B ist eine geschlechtsgebundene erbliche Blutgerinnungsstörung, die auf verringerte Spiegel von Gerinnungsfaktor IX zurückzuführen ist und zu massiven Blutungen in Gelenken, Muskeln oder Organen führen kann, die entweder spontan auftreten oder als Folge von Verletzungen bzw. chirurgischen Eingriffen. Durch die Substitutionstherapie wird der Faktor-IX-Spiegel im Plasma erhöht und somit ist eine vorübergehende Korrektur des Faktormangels und der Blutungsneigung möglich.
Kinder und Jugendliche
OCTANINE F wurde an 25 Kindern unter 6 Jahren klinisch geprüft. Zu Studienbeginn waren 6 der Kinder nicht vorbehandelt. Die Recovery der Studienteilnehmer nach der Verabreichung von >25 I.E. OCTANINE F/kg Körpergewicht wurde während der ersten 3 Behandlungsmonate sowie nach 12-24 Monaten untersucht. Die berechneten Werte für die Incremental Recovery (geometrisches Mittel ± Standardabweichung, Einstufen-Test, effektiver Wirkstoffgehalt) betragen 0,8±1,4 bzw. 0,9±1,3 %/I.E./kg für den ersten bzw. den zweiten Untersuchungszeitpunkt.
5.2 Pharmakokinetische Eigenschaften
Für OCTANINE F wurden in einer klinischen Prüfung mit 13 Hämophilie-B-Patienten über 12 Jahren (Durchschnittsalter: 28 Jahre, Bereich: 12-61 Jahre) folgende pharmakokinetische Daten ermittelt:
|
N = 13 |
Median |
Mittelwert |
SD* |
Minimum |
Maximum |
|
Incremental Recovery [I.E./dl]/[I.E./kg] |
1,2 |
1,3 |
0,5 |
0,8 |
2,4 |
|
AUC*norm (I.E. x dl-1 x h x I.E.-1 x kg) |
32,4 |
37,7 |
13,0 |
24,5 |
64,0 |
|
Halbwertszeit (h) |
27,8 |
29,1 |
5,2 |
22,0 |
36,8 |
|
MRT* (h) |
39,4 |
40,0 |
7,3 |
30,2 |
51,6 |
|
Clearance (ml x h-1 x kg) |
3,1 |
2,9 |
0,9 |
1,6 |
4,1 |
*AUC = Fläche unter der Kurve *MRT = Mittlere Verweildauer *SD = Standardabweichung
Die Inkrementale Recovery wurde in einer zweiten Studie erneut untersucht. Die Meta-Analyse sämtlicher Recovery-Bestimmungen (n = 19) ergab eine
durchschnittliche Recovery von ca. 1,1 [I.E./dl]/[I.E./kg].
5.3 Präklinische Daten zur Sicherheit
Blutgerinnungsfaktor IX vom Menschen (im Konzentrat) ist ein normaler Bestandteil des menschlichen Plasmas und verhält sich wie körpereigener Faktor IX.
Klinische Studien in Tieren sind eingeschränkt vorhanden und geben keine Hinweise auf zusätzliche Risiken neben den bereits in der Fachinformation beschriebenen.
6 PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Pulver: Heparin, Natriumchlorid, Natriumcitrat, Argininhydrochlorid, Lysinhydrochlorid Lösungsmittel: Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Es sollte ausschließlich der mitgelieferte Gerätesatz genutzt werden. Ansonsten kann der Therapieerfolg aufgrund der Adsorption des humanen Blutgerinnungsfaktors IX an die inneren Oberflächen einiger Injektions-/Infusionsgeräte beeinträchtigt werden.
6.3 Dauer der Haltbarkeit
2 Jahre.
Die chemische und physikalische Haltbarkeit der gebrauchsfertigen Lösung ist für 72 h bei 25°C nachgewiesen worden.
Vom mikrobiologischen Standpunkt aus muss das Produkt sofort verwendet werden. Wenn es nicht sofort verwendet wird, liegen die Aufbewahrungszeit und die Bedingungen vor Anwendung in der Verantwortung des Anwenders, wobei normalerweise 24 Stunden bei 2°C - 8°C nicht überschritten werden sollten, es sei denn, die Rekonstitution / Verdünnung fand unter kontrollierten und validierten aseptischen Bedingungen statt.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25°C lagern.
Nicht einfrieren.
Die Durchstechflaschen im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Aufbewahrungsbedingungen nach Rekonstitution des Arzneimittels, siehe Abschnitt
6.3.
6.5 Art und Inhalt des Behältnisses
OCTANINE F besteht aus zwei Teilverpackungen, die mit einem Folien-Streifen
zusammengehalten werden.
Die 1. Teilverpackung enthält:
- Pulver in einer 30-ml-Durchstechflasche (Typ-I-Glas) mit einem Chlorobutyl- oder Bromobutyl-Gummistopfen (latexfrei) und einer Aluminiumbördelkappe mit Flip-off-Verschluss
- Gebrauchsinformation
Die 2. Teilverpackung enthält:
- 5 ml bzw. 10 ml Lösungsmittel (Wasser für Injektionszwecke; Typ-I- oder Typ-II-Glas) mit einem Halobutyl-Gummistopfen (latexfrei) und einer Aluminiumbördelkappe mit Flip-off-Verschluss
- 1 Gerätesatz bestehend aus: 1 Einmalspritze, 1 Transferset Mix2VialTM, 1 Injektionsnadel (Butterfly)
- 2 Alkoholtupfer
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Bitte lesen Sie alle Anweisungen durch und befolgen Sie sie sorgfältig.
Bitte achten Sie bei allen Arbeitsschritten strikt auf Keimfreiheit.
Die gebrauchsfertige Injektionslösung in der Spritze ist klar oder leicht schillernd (opaleszent). Verwenden Sie keine Lösungen, die trübe aussehen oder Rückstände enthalten.
Das gebrauchsfertige Präparat unmittelbar nach dem Auflösen verwenden, um mikrobielle Verunreinigungen zu verhindern.
Verwenden Sie bitte ausschließlich das mitgelieferte Injektionszubehör. Die Anwendung anderer Injektions-/Infusionsbestecke kann mit Risiken verbunden sein oder die Wirksamkeit beeinträchtigen.
Anleitung für das Auflösen:
1. Das Produkt nicht direkt aus dem Kühlschrank verwenden, sondern erst Lösungsmittel und Pulver in den ungeöffneten Flaschen auf Zimmertemperatur bringen.
2. Die Schutzkappen (Schnappdeckel) von der Pulverflasche und Lösungsmittelflasche entfernen und die Gummistopfen beider Flaschen mit einem der mitgelieferten Alkoholtupfer desinfizieren.
3. Das Transferset [Mix2Vial®] ist in Abb. 1 dargestellt. Die Lösungsmittelflasche auf eine ebene Fläche stellen und festhalten. Das Mix2Vial-Set mit dem blauen Adapter auf die Lösungsmittelflasche (LM) aufsetzen und nach unten drücken, bis es einrastet (Abb. 2+3).
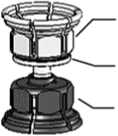
Pulveradapter
(transparent)
integrierter
Filter
Lösungsmittel
adapter
(blau)
Abb. 1

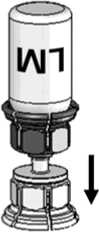
4. Die Pulverflasche (P) auf eine ebene Fläche stellen und festhalten. Die Lösungsmittelflasche (LM) mit dem Mix2Vial-Set umdrehen und senkrecht mit dem transparenten Ende auf die Pulverflasche (P) aufsetzen und nach unten drücken, bis es einrastet (Abb. 4). Das Lösungsmittel fließt automatisch in die Pulverflasche.

Abb. 4

5. Während beide Flaschen noch verbunden sind, die Pulverflasche leicht schwenken (nicht schütteln), bis das Pulver gelöst ist. Das Pulver löst sich bei Zimmertemperatur spätestens nach 10 Minuten vollständig. Dabei ist eine leichte Schaumbildung möglich. Dieser Schaum wird sich auflösen. Die
Lösungsmittelflasche zusammen mit dem blauen Mix2Vial-Adapter von der Pulverflasche abdrehen (Abb. 5).
Die Lösungsmittelflasche mit dem blauen Teil des Mix2Vial-Adapters verwerfen.
Injektion:
Als Vorsichtsmaßnahme sollte Ihr Puls vor und während der Injektion gemessen werden. Bei einer deutlichen Erhöhung der Pulsfrequenz die Injektion verlangsamen oder kurzfristig unterbrechen.
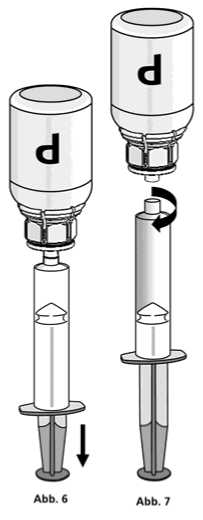
1. Die Spritze mit dem transparenten Mix2Vial-Adapter der Pulverflasche verbinden. Die Flasche samt Einmalspritze umdrehen und das aufgelöste Präparat in die Spritze aufziehen (Abb. 6).
Die Injektionslösung in der Spritze sollte klar oder leicht schillernd sein. Nachdem die Lösung in die Spritze überführt wurde, den Spritzenzylinder fassen und die Spritze vom transparenten Mix2Vial-Adapter der Pulverflasche entfernen (Abb. 7). Dabei die Spritze weiter nach unten halten. Verwerfen Sie die leere Pulverflasche mit dem Mix2Vial-Adapter.
2. Vorgesehene Injektionsstelle mit einem der mitgelieferten Alkoholtupfer desinfizieren.
3. Die beigepackte Flügelkanüle auf die Spritze aufsetzen.
4. Stechen Sie die Flügelkanüle in die gewählte Vene. Wenn Sie die Vene vor der Punktion gestaut haben, damit Sie sie besser sehen können, müssen Sie die Stauung öffnen, bevor Sie mit der Injektion beginnen. Es darf kein Blut in die Spritze gelangen, da dies zur Bildung von Blutgerinnseln führen könnte.
5. Injizieren Sie die Lösung langsam in die Vene, wobei die Injektionsgeschwindigkeit höchstens 2 - 3 ml pro Minute betragen sollte.
Wenn Sie mehr als eine Flasche OCTANINE F für eine Behandlung benötigen, können dieselbe Flügelkanüle und dieselbe Spritze wieder benutzt werden. Das Mix2Vial-Set ist nur zum einmaligen Gebrauch bestimmt.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7 INHABER DER ZULASSUNG
OCTAPHARMA GmbH Elisabeth-Selbert-Str. 11 40764 Langenfeld E-Mail: info@octapharma.de www.octapharma.de
8 ZULASSUNGSNUMMERN
OCTANINE F 500: 10501a/97-2 OCTANINE F 1000: 10501a/97-3
9 DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
Datum der Erstzulassung: 07.09.2000 Datum der Zulassungsverlängerung: 16.03.2015
10 STAND DER INFORMATION
10/2015
11. VERSCHREIBUNGSSTATUS / APOTHEKENPFLICHT
Verschreibungspflichtig
12. SONSTIGE HINWEISE
Herkunftsland des Blutplasmas: Deutschland, Belgien, Estland, Finnland, Kroatien, Luxemburg, Norwegen, Österreich, Portugal, Schweden, Schweiz, Slowenien, Tschechische Republik, Ungarn, USA.
MedDRA lowest level term (LLT)