Octaplex 1000
Seite 1/14
GEBRAUCHSINFORMATION UND FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS Octaplex 1000
Pulver und Lösungsmittel zur Herstellung einer i.v. Infusionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Octaplex 1000 enthält den humanen Prothrombinkomplex (PPSB) und wird als Pulver und Lösungsmittel zur Herstellung einer i.v. Infusionslösung angeboten. Octaplex 1000 enthält nominell:
|
Name des Bestandteils |
Octaplex 1000 Menge pro Durchstechflasche (I.E.) |
Octaplex 1000 Menge nach Rekonstitution mit 40 ml Wasser für Injektionszwecke (I.E./ml) |
|
Wirkstoffe | ||
|
Blutgerinnungsfaktor II |
560 - 1520 |
14 - 38 |
|
Blutgerinnungsfaktor VII |
360 - 960 |
9 - 24 |
|
Blutgerinnungsfaktor IX |
1000 |
25 |
|
Blutgerinnungsfaktor X |
720 - 1200 |
18 - 30 |
|
Weitere wirksame Bestandteile | ||
|
Protein C |
520 - 1240 |
13 - 31 |
|
Protein S |
480 - 1280 |
12 - 32 |
Der Gesamtproteingehalt pro Durchstechflasche beträgt 520 -1640 mg.
Die spezifische Aktivität des Produkts, bezogen auf die Faktor-IX-Aktivität, ist > 0,6 I.E./mg Protein.
Sonstige Bestandteile, die bekanntermaßen einen Effekt haben: Natrium (150 - 250 mg pro Flasche), Heparin (200 - 500 I.E. pro Flasche bzw. 0,2 - 0,5 I.E./I.E. Faktor IX). Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver und Lösungsmittel zur Herstellung einer intravenösen Infusionslösung. Das Pulver ist weiß bis leicht bläulich.
Das Lösungsmittel ist klar und farblos.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
- Behandlung von Blutungen und perioperative Prophylaxe von Blutungen bei einem erworbenen Mangel an Prothrombinkomplex-Faktoren, wenn eine schnelle Korrektur des Mangels erforderlich ist, wie zum Beispiel ein durch die Behandlung mit Vitamin-K-Antagonisten verursachter Mangelzustand, oder im Falle einer Überdosierung von Vitamin-K-Antagonisten.
- Behandlung von Blutungen und perioperative Prophylaxe bei einem angeborenen Mangel der Vitamin-K-abhängigen Gerinnungsfaktoren II und X, wenn Einzelfaktorkonzentrate nicht zur Verfügung stehen.
4.2 Dosierung und Art der Anwendung Dosierung
Nachstehend werden nur allgemeine Dosierungsrichtlinien gegeben. Die Behandlung sollte unter Aufsicht eines Spezialisten mit Erfahrung in der Behandlung von Gerinnungsstörungen begonnen werden. Dosierung und Dauer der Substitution hängen vom Schweregrad der Störung, dem Ort und Ausmaß der Blutung und von dem klinischen Zustand des Patienten ab.
Die Menge und die Häufigkeit der Verabreichung sollten individuell für den einzelnen Patienten kalkuliert werden. Die Dosierungsintervalle müssen an die unterschiedlichen Halbwertzeiten der verschiedenen Gerinnungsfaktoren des Prothrombinkomplexes angepasst sein (siehe Abschnitt 5.2). Grundlage der individuellen Dosierung ist die regelmäßige Bestimmung der Plasmakonzentration der entsprechenden Gerinnungsfaktoren, die Messung von Globalparametern der Prothrombinkomplex-Konzentration (z.B. Quickwert, INR) sowie die kontinuierliche Überwachung des klinischen Zustandes des Patienten.
Im Falle größerer chirurgischer Eingriffe ist die genaue Überwachung der Substitutionstherapie mittels Gerinnungstests unerlässlich (spezifische
Gerinnungsfaktortests und/oder allgemeine Tests zur Ermittlung des
Prothrombinkomplex-Spiegels).
Behandlung von Blutungen und perioperative Prophylaxe von Blutungen bei einem erworbenen Mangel an Prothrombinkomplex-Faktoren:
Die Dosierung hängt von der INR vor Behandlung und der gewünschten INR ab. In der folgenden Tabelle ist die ungefähre Dosis (ml gelöstes Produkt/kg Körpergewicht) angegeben, welche für die Normalisierung der INR (< 1,2 innerhalb einer Stunde) bei unterschiedlichen initialen INR benötigt wird:
|
Initiale INR |
2 - 2,5 |
2,5 - 3 |
3 - 3,5 |
> 3,5 |
|
Ungefähre Dosis* (ml Octaplex/kg Körpergewicht) |
0,9 -1,3 |
1,3 - 1,6 |
1,6 - 1,9 |
> 1,9 |
* Die Einzeldosis sollte 3.000 I.E. (120 ml Octaplex 1000) nicht überschreiten.
Alternativ kann auch der Quick-Wert zur Dosierung von Octaplex 1000 herangezogen werden. Es gilt die folgende Faustregel: 1 I.E. pro kg Körpergewicht hebt den Quick-Wert um ca. 1 % an.
Zur Dosisberechnung kann die folgende Richtformel benutzt werden:
Initialdosis (I.E.) = Körpergewicht (kg) x gewünschter Quick-Wert-Anstieg (%) x 1 (I.E./[kg x %])
Hohe initiale Dosen von 40 I.E./kg Körpergewicht (KG) sind angezeigt bei bedrohlichen bzw. ausgedehnten Blutungen (z.B. Hirnblutung, Zungenbiss, retroperitoneale Blutungen, Muskelblutungen, gastrointestinale und Mundhöhlenblutungen), Operationen mit großen Wundflächen und/oder hoher Blutungsgefahr (auch bei Tonsillektomie).
Dosen von mehr als 40 I.E./kg KG sollten in mehreren Teilmengen verabreicht werden.
Niedrige initiale Dosierungen von 20 I.E./kg KG sind angezeigt bei kleineren Haut-und Muskelblutungen, Nasenbluten (Epistaxis), Blut im Urin (Hämaturie) und Operationen mit kleinen Wundflächen [z.B. Zahnextraktion, Leistenbruchoperation (Herniotomie)].
|
Blutungsereignis |
Therapeutisch Quickwert |
notwendiger INR |
|
leichtere Blutungen bzw. kleinere Verletzungen oder Eingriffe |
30 - 50% |
ca. 1,6 - 2,4 |
|
schwere Verletzungen oder größere Operationen |
60 - 80 % |
ca. 1,15 - 1,4 |
Höhere Aktivitäten können in Einzelfällen erforderlich sein.
Die durch das Prothrombinkomplex-Konzentrat innerhalb kurzer Zeit erreichte Umkehr der durch den Vitamin-K-Antagonisten hervorgerufenen Verminderung der Blutgerinnung hält 6 - 8 Stunden an. Die gleichzeitige Verabreichung von Vitamin K mit dem Prothrombinkomplex-Konzentrat (s. 6.2 Inkompatibilitäten) sollte immer in Erwägung gezogen werden, da durch Vitamin K die Normalisierung der Synthese der Vitamin-K-abhängigen Gerinnungsfaktoren nach 4-6 h erreicht wird. Bei gleichzeitiger Gabe von Vitamin K ist eine wiederholte Behandlung mit Prothrombinkomplex-Konzentrat normalerweise nicht erforderlich.
Da diese Empfehlungen auf empirischen Daten beruhen und Wiederfindungsrate (Recovery) und Wirkungsdauer variieren können, ist eine kontinuierliche Überwachung des INR bzw. des Quick-Wertes erforderlich.
Blutungen und perioperative Prophylaxe bei einem angeborenen Mangel der Vitamin-K-abhängigen Gerinnungsfaktoren II und X, wenn Einzelfaktorkonzentrate nicht zur Verfügung stehen:
Die Berechnung der erforderlichen Dosierung für die Behandlung basiert auf der empirischen Erkenntnis, dass die Gabe von 1 I.E. Faktor II/kg Körpergewicht die
Faktor-II-Aktivität im Plasma um ca. 0,02 I.E./ml erhöht bzw. 1 I.E. Faktor X/kg Körpergewicht die Faktor-X-Aktivität im Plasma um ca. 0,017 I.E./ml erhöht.
Die Dosis eines verabreichten spezifischen Faktors wird in Internationalen Einheiten (I.E.) angegeben - bezogen auf den aktuellen WHO - Standard für diesen Faktor. Die Aktivität eines spezifischen Gerinnungsfaktors im Plasma wird entweder als Prozentsatz (relativ zu normalem Plasma) oder in Internationalen Einheiten (relativ zum Internationalen Standard für den spezifischen Faktor) angegeben.
Eine Internationale Einheit (I.E.) an Gerinnungsfaktorenaktivität entspricht der Menge, die in 1 ml normalem humanem Plasma zu finden ist.
Zum Beispiel wird die erforderliche Dosis für Faktor X auf Grundlage des empirischen Ergebnisses ermittelt, dass 1 Internationale Einheit (I.E.) Faktor X/kg Körpergewicht die Faktor-X-Aktivität im Plasma um 0,017 I.E./ml anhebt. Die erforderliche Dosis wird nach folgender Formel ermittelt:
Erforderliche Einheiten = Körpergewicht (kg) x gewünschter Faktor-X-Anstieg (I.E./ml) x 59 (ml/kg)
wobei 59 (ml/kg) der reziproke Wert der geschätzten Wiederfindungsrate ist.
Erforderliche Dosis für den Faktor II:
Erforderliche Einheiten = Körpergewicht (kg) x gewünschter Faktor-II-Anstieg (I.E./ml) x 50 (ml/kg)
Wenn die individuelle Wiederfindungsrate bekannt ist, sollte dieser Wert für die Berechnung verwendet werden.
Art der Anwendung
Hinweise zur Rekonstitution des Arzneimittels vor der Anwendung, siehe Abschnitt 6.6. Octaplex 1000 muss intravenös verabreicht werden. Die Infusion sollte unter aseptischen Bedingungen mit einer Geschwindigkeit von 1 ml pro Minute eingeleitet und mit 2-3 ml pro Minute weitergeführt werden.
4.3 Gegenanzeigen
- Überempfindlichkeit gegenüber den Wirkstoffen oder einem der in Abschnitt 6.1 genannten sonstigen Bestandteile.
- Aktuelle oder aus der Anamnese bekannte allergisch bedingte Thrombozytopenie (Typ II) auf Heparin.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Der Rat eines Spezialisten mit Erfahrung in der Behandlung von Gerinnungsstörungen sollte eingeholt werden.
Octaplex 1000 sollte bei Patienten mit einem erworbenen Mangel an Vitamin-K-abhängigen Gerinnungsfaktoren (z. B. verursacht durch die Behandlung mit Vitamin-K-Antagonisten) nur verwendet werden, wenn eine schnelle Korrektur des Prothrombinkomplex-Spiegels erforderlich ist, wie zum Beispiel bei starken Blutungen oder einer Notoperation. In anderen Fällen ist normalerweise die Verringerung der Dosis des Vitamin-K-Antagonisten und/oder die Verabreichung von Vitamin K ausreichend.
Patienten, die einen Vitamin-K-Antagonisten erhalten, können eine Hyperkoagulationsbereitschaft aufweisen, die sich durch die Infusion des Prothrombinkomplex-Konzentrats verstärken kann.
Bei einem angeborenen Mangel an einem der Vitamin-K-abhängigen Faktoren sollte ein Einzelfaktorpräparat eingesetzt werden, wenn dieses zur Verfügung steht.
Wenn allergische oder anaphylaktische Reaktionen auftreten, muss die Infusion sofort unterbrochen werden. Im Falle eines Schocks sind die medizinischen Standards für die Behandlung eines Schocks zu befolgen.
Zur Verhinderung von Infektionen, die durch die Verwendung von Arzneimitteln entstehen, die aus humanem Blut oder Plasma hergestellt werden, werden verschiedene Maßnahmen getroffen. Hierzu gehören die Auswahl der Spender, das Testen der einzelnen Spenden und Plasma-Pools auf spezifische Infektionsmarker, sowie effektive Herstellungsschritte für die Inaktivierung/Entfernung von Viren.
Trotz dieser Vorsichtsmaßnahmen kann bei der Verabreichung von Arzneimitteln, die aus humanem Blut oder Plasma hergestellt werden, die Möglichkeit der Übertragung von infektiösen Krankheitserregern nicht vollkommen ausgeschlossen werden. Dies trifft auch auf unbekannte oder neu auftretende Viren sowie andere Krankheitserreger zu.
Die getroffenen Maßnahmen werden als wirksam für umhüllte Viren wie HIV, HBV und HCV angesehen. Die getroffenen Maßnahmen können bei nicht umhüllten Viren, wie HAV und Parvovirus B19, von eingeschränkter Wirksamkeit sein. Eine Parvovirus-B19-Infektion kann für Schwangere (Infektion des Fetus) und für Patienten mit einem Immunmangel oder einer erhöhten Erythropoese (z. B. bei hämolytischer Anämie) schwerwiegend sein.
Es wird auf die Dokumentationspflicht gemäß Transfusionsgesetz hingewiesen.
Es wird empfohlen, Patienten gegen Hepatitis A und Hepatitis B zu impfen, wenn sie regelmäßig oder wiederholt aus humanem Plasma hergestellte ProthrombinkomplexKonzentrate erhalten.
Bei Patienten mit entweder angeborenem oder erworbenem Mangel besteht insbesondere bei wiederholter Gabe von Prothrombinkomplex-Konzentraten ein Risiko einer Thrombose oder einer disseminierten intravasalen Gerinnung.
Patienten, denen ein humaner Prothrombinkomplex verabreicht wird, sollten genau auf Symptome einer intravasalen Gerinnung oder Thrombose hin beobachtet werden. Aufgrund des Risikos thromboembolischer Komplikationen sollten bei der Verabreichung von humanen Prothrombinkomplex-Produkten Patienten mit der
Anamnese einer koronaren Herzerkrankung oder eines Herzinfarktes, mit einer Lebererkrankung, mit einem Risiko eines thromboembolischen Ereignisses oder einer disseminierten intravasalen Gerinnung, peri- oder postoperative Patienten und Neugeborene genau beobachtet werden. In jeder dieser Situationen sollte der potentielle Vorteil der Behandlung gegen das Risiko dieser Komplikationen abgewogen werden.
Es liegen keine Daten zum Gebrauch von Octaplex 1000 im Fall perinataler Blutungen aufgrund eines Vitamin-K-Mangels bei Neugeborenen vor.
Octaplex 1000 enthält 150 - 250 mg Natrium pro Flasche. Bei Patienten mit einer Natriumdiät ist dies zu berücksichtigen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige
Wechselwirkungen
Humane Prothrombinkomplex - Produkte neutralisieren den Effekt der Behandlung mit Vitamin-K-Antagonisten. Wechselwirkungen mit anderen Arzneimitteln sind nicht bekannt.
Beeinflussung von biologischen Tests:
Bei der Durchführung von Gerinnungstests, die empfindlich auf Heparin reagieren, ist der Heparingehalt des verabreichten Prothrombinkomplex-Produktes zu
berücksichtigen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Die Sicherheit von humanem Prothrombinkomplex zum Gebrauch in der Schwangerschaft und während der Stillzeit ist nicht untersucht worden. Tierversuche sind nicht geeignet, um die Sicherheit im Hinblick auf eine Schwangerschaft, die Entwicklung des Embryos/Fetus, die Entbindung oder die postnatale Entwicklung zu beurteilen. Daher sollten humane Prothrombinkomplexe bei schwangeren oder stillenden Frauen nur bei einer klaren Indikation verabreicht werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
4.8 Nebenwirkungen
Erkrankungen des Immunsystems:
• Eine Substitutionstherapie kann selten (>1/10.000, < 1/1.000) zur Bildung von zirkulierenden Antikörpern gegen einzelne Gerinnungsfaktoren führen. Wenn solche Inhibitoren auftreten, wird der infundierte Prothrombinkomplex teilweise oder vollständig inaktiviert. Dadurch wird die klinische Wirksamkeit von Prothrombinkomplex-Konzentraten eingeschränkt.
• Allergische oder anaphylaktische Reaktionen und ein Anstieg der Körpertemperatur sind in klinischen Studien, die mit Octaplex 1000 durchgeführt wurden, nicht beobachtet worden. Sie können jedoch in seltenen Fällen auftreten (>1/10.000, < 1/1.000).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
• Ein Anstieg der Körpertemperatur wurde bislang nicht beobachtet, kann jedoch in seltenen Fällen auftreten (>1/10.000, < 1/1.000).
Gefäßerkrankungen:
• Es besteht das Risiko von Thromboembolien nach der Verabreichung von humanem Prothrombinkomplex (siehe Abschnitt 4.4).
Erkrankungen des Nervensystems:
• Kopfschmerzen können in seltenen Fällen auftreten (>1/10.000, < 1/1.000). Untersuchungen:
• Ein vorübergehender Anstieg der Lebertransaminasen ist in seltenen Fällen beobachtet worden (>1/10.000, < 1/1.000).
Sonstige:
Selten werden Heparin-Antikörper-vermittelte schwere Thrombozytopenien (Typ II) mit Thrombozytenwerten deutlich unter 100.000 / pl oder einem schnellen Abfall auf weniger als 50 % des Ausgangswertes beobachtet. Bei Patienten ohne vorbestehende Überempfindlichkeit gegen Heparin beginnt der Thrombozytenabfall in der Regel 6-14 Tage nach Behandlungsbeginn. Bei Patienten mit Überempfindlichkeit gegenüber Heparin tritt dieser Abfall unter Umständen innerhalb von Stunden auf. Die schwere Form der Thrombozytopenie kann verbunden sein mit arteriellen und venösen Thrombosen/Thromboembolien, Verbrauchskoagulopathie, evtl. Hautnekrosen an der Injektionsstelle, Petechien, Purpura und Meläna. Dabei kann die blutgerinnungshemmende Wirkung des Heparins vermindert sein (Heparintoleranz).
Bei Patienten, bei denen die genannten allergischen Reaktionen auftreten, muss Octaplex 1000 sofort abgesetzt werden. Bei ihnen darf auch in Zukunft kein heparinhaltiges Arzneimittel mehr angewendet werden. Wegen der genannten gelegentlich auftretenden ungünstigen Wirkung des Heparins auf die Thrombozyten muss deren Zahl, insbesondere zu Beginn der Behandlung mit Octaplex 1000, engmaschig kontrolliert werden.
Angaben zur Sicherheit im Hinblick auf übertragbare Krankheitserreger: siehe Abschnitt 4.4.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-
Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das aufgeführte nationale Meldesystem anzuzeigen.
Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel
Paul-Ehrlich-Institut
Paul-Ehrlich-Str. 51-59
63225 Langen
Tel: +49 6103 77 0
Fax: +49 6103 77 1234
Website: www.pei.de
4.9 Überdosierung
Die Verwendung hoher Dosen humaner Prothrombinkomplex-Produkte ist mit Fällen eines Myokardinfarkts, einer disseminierten intravasalen Gerinnung, Venenthrombose und Lungenembolie in Verbindung gebracht worden. Im Falle einer Überdosis ist daher das Risiko für die Entstehung thromboembolischer Komplikationen oder einer disseminierten intravasalen Gerinnung erhöht.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antihämorrhagika, Blutgerinnungsfaktoren IX, II, VII und X in Kombination, ATC-Code: B02BD01.
Die Gerinnungsfaktoren II, VII, IX und X, die Vitamin-K-abhängig in der Leber synthetisiert werden, werden im Allgemeinen als Prothrombinkomplex bezeichnet. Zusätzlich zu den Gerinnungsfaktoren sind in Octaplex 1000 die Vitamin-K-abhängigen Gerinnungsinhibitoren Protein C und Protein S enthalten.
Faktor VII ist das Zymogen der aktiven Serinprotease Faktor VIIa. Der Komplex aus Gewebsthromboplastin und Faktor VIIa aktiviert die Gerinnungsfaktoren X und IX zu Xa und IXa. In der weiteren Aktivierung der Gerinnungskaskade wird Prothrombin (Faktor II) zu Thrombin gespalten. Durch Thrombin wird aus Fibrinogen Fibrin gebildet, das zu einem Gerinnsel vernetzt wird.
Der isolierte schwere Mangel an Faktor VII führt aufgrund einer gestörten primären Hämostase mit einer reduzierten Thrombin- und Fibrinbildung zu Blutungsneigungen. Der isolierte Mangel an Faktor IX ist eine der klassischen Hämophilien (Hämophilie B). Der isolierte Mangel an Faktor II oder Faktor X ist sehr selten, kann aber in schweren Fällen Blutungen wie bei klassischen Hämophilien verursachen.
Die weiteren Bestandteile, die Gerinnungsinhibitoren Protein C und Protein S, werden ebenfalls in der Leber synthetisiert. Die biologische Aktivität von Protein C wird durch den Cofaktor Protein S verstärkt.
Aktiviertes Protein C hemmt die Gerinnung durch Inaktivierung der Gerinnungsfaktoren Va und VIIIa. Protein S ist als Cofaktor von Protein C an der
Hemmung der Gerinnung beteiligt. Protein-C-Mangel kann mit einem Thromboserisiko einhergehen.
Die Behandlung mit Vitamin-K-Antagonisten kann zu einem Mangel an Vitamin-K-abhängigen Gerinnungsfaktoren führen (erworbener Mangel). Schwerwiegende Mangelerscheinungen führen zu starken Blutungen, die eher durch retroperitoneale oder zerebrale Blutungen als durch Muskel- und Gelenksblutungen gekennzeichnet sind. Eine schwere Leberinsuffizienz führt ebenfalls zu einer deutlichen Reduzierung der Vitamin-K-abhängigen Gerinnungsfaktoren und einer Blutungsneigung, die oft aufgrund einer gleichzeitig reduzierten intravasalen Gerinnung, einer Reduzierung der Gerinnungsinhibitoren, einer verminderten Fibrinolyse sowie einer erniedrigten Thrombozytenzahl komplex ist.
Die Verabreichung von humanem Prothrombinkomplex führt zu einem Anstieg der Vitamin-K-abhängigen Gerinnungsfaktoren im Plasma und kann die Gerinnungsstörung vorübergehend bei den Patienten korrigieren, die unter einem Mangel an einem oder mehreren dieser Faktoren leiden.
5.2 Pharmakokinetische Eigenschaften
Die Halbwertzeiten in Plasma lauten für:
|
Faktor II |
48 - 60 Stunden |
|
Faktor VII |
1,5 - 6 Stunden |
|
Faktor IX |
20 - 24 Stunden |
|
Faktor X |
24 - 48 Stunden |
|
Protein C |
1,5 - 6 Stunden |
|
Protein S |
24 - 48 Stunden |
Octaplex 1000 ist aufgrund der intravenösen Verabreichung sofort und vollständig verfügbar.
5.3 Präklinische Daten zur Sicherheit
Die Faktoren des humanen Prothrombinkomplexes (im Konzentrat) verhalten sich wie die körpereigenen Gerinnungsfaktoren II, VII, IX, X.
Toxizitätsuntersuchungen mit wiederholten Dosen an Tieren sind wegen der Antikörperbildung gegen heterologe Proteine nicht durchführbar.
Präklinische und klinische Untersuchungen ergaben keine Hinweise auf ein erhöhtes thrombogenes Potential von Octaplex 1000.
Bisherige klinische Erfahrungen geben keine Hinweise auf onkogene oder mutagene Wirkungen von Prothrombinkomplex-Präparaten.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Pulver:
Heparin: 0,2 - 0,5 I.E./I.E. Faktor IX Tri-Natriumcitrat-Dihydrat
Lösungsmittel:
Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Dieses Arzneimittel darf nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit 2 Jahre
Die chemische und physikalische Haltbarkeit der gebrauchsfertigen Lösung ist für bis zu 8 Stunden bei Raumtemperatur (bis max. + 25°C) belegt.
Vom mikrobiologischen Standpunkt aus muss das Produkt sofort verwendet werden, es sei denn, die Rekonstitution fand unter kontrollierten und validierten aseptischen Bedingungen statt. Wenn die Lösung nicht sofort verwendet wird, liegen die Aufbewahrungszeit und die Bedingungen vor Anwendung in der Verantwortung des Anwenders.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25°C lagern. Nicht einfrieren. In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Aufbewahrungsbedingungen nach Rekonstitution des Arzneimittels, siehe Abschnitt 6.3.
6.5 Art und Inhalt des Behältnisses
Eine Packung Octaplex 1000 enthält:
- 1 Durchstechflasche mit Pulver (Glas Typ I mit Halobutyl-Stopfen und Flip off -Bördelkappe)
- 1 Durchstechflasche mit 40 ml Wasser für Injektionszwecke (Glas Typ I mit Halobutyl-Stopfen und Flip-off-Bördelkappe)
- 1 Transferset Mix2Vial™.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Bitte lesen Sie alle Anweisungen durch und befolgen Sie sie sorgfältig!
Der Lösungsvorgang des Präparates und die Injektion müssen unter aseptischen Bedingungen erfolgen!
Das Produkt löst sich bei Raumtemperatur schnell in eine klare oder leicht opaleszente Lösung auf (eine leichte Blaufärbung ist möglich). Verwenden Sie keine
Lösungen, die trüb sind oder Ablagerungen aufweisen. Rekonstituiertes Produkt sollte vor der Anwendung visuell auf Partikel und Verfärbungen überprüft werden.
Nach Rekonstitution sollte die gebrauchsfertige Lösung umgehend verwendet werden.
Die gebrauchsfertige Lösung ist nur zum einmaligen Gebrauch bestimmt.
Es wird empfohlen, das in der Packung enthaltene Transferset zu verwenden.
Nicht verbrauchte Lösung verwerfen. Nicht verwendetes Arzneimittel und Abfallmaterialien sind entsprechend den nationalen Anforderungen zu entsorgen.
Hinweis für Allergiker: Die verwendeten Gummistopfen sind latexfrei.
Herstellung der Lösung:
1. Falls erforderlich, Lösungsmittel (Wasser für Injektionszwecke) und Pulver in den ungeöffneten Flaschen auf Raumtemperatur bringen. Diese Temperatur sollte während der Rekonstitution beibehalten werden. Wird zum Erwärmen des Lösungsmittels ein Wasserbad benutzt, muss sorgfältig darauf geachtet werden, dass das Wasser nicht mit dem Gummistopfen oder dem Verschluss der Flaschen in Berührung kommt. Die Temperatur des Wasserbades darf maximal 37°C betragen.
2. Schutzdeckel (Flip off) von der Pulverflasche (P) und der Lösungsmittelflasche (LM) entfernen und die Gummistopfen beider Flaschen mit einem Alkoholtupfer desinfizieren.
3. Die Schutzfolie von der äußeren Verpackung des Mix2Vial™ entfernen, aber das Mix2Vial™ nicht aus dem Blister entnehmen. Die Lösungsmittelflasche (LM) auf eine ebene Fläche stellen und festhalten. Das Mix2Vial™ mit dem Blister fassen und den Dorn des blauen Adapters senkrecht durch das Zentrum des Stopfens der Lösungsmittelflasche (LM) stechen, bis es einrastet (Abb. 1).
Die Verpackung vom Mix2Vial™ entfernen, indem man die Lösungsmittelflasche (LM) festhält und den Blister senkrecht nach oben abzieht. Dabei ist darauf zu achten, dass nicht das Mix2Vial™ entfernt wird (Abb. 2).
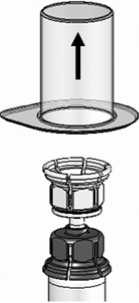
LM
t—1
LM
Fig.l
Abb.. 1
Abb.. 2
4. Die Pulverflasche (P) auf eine ebene Fläche stellen und festhalten. Die Lösungsmittelflasche (LM) mit dem Mix2Vial™ umdrehen und senkrecht mit dem transparenten Ende auf die Pulverflasche (P) aufsetzen und nach unten drücken, bis es einrastet (Abb. 3). Das Lösungsmittel fließt automatisch in die Pulverflasche.
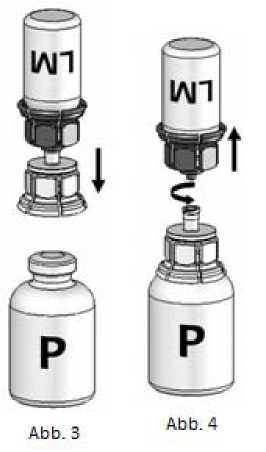
5. Während beide Flaschen noch verbunden sind, die Pulverflasche leicht schwenken (nicht schütteln) bis das Pulver gelöst ist. Octaplex löst sich bei Raumtemperatur schnell zu einer farblosen bis leicht blauen Lösung. Die Lösungsmittelflasche zusammen mit dem blauen Mix2Vial™-Adapter von der Pulverflasche abdrehen (Abb. 4).
Die Lösungsmittelflasche mit dem blauen Teil des Mix2Vial™-Adapters verwerfen.
Wenn sich das Pulver nicht vollständig auflöst oder sich Rückstände bilden, dürfen Sie das Präparat nicht verwenden.
Anweisungen für die Infusion:
Als Vorsichtsmaßnahme sollte die Pulsfrequenz des Patienten vor und während der Infusion kontrolliert werden. Wenn ein deutlicher Anstieg der Pulsfrequenz erfolgt, muss die Infusionsgeschwindigkeit verringert oder die Verabreichung unterbrochen werden.
1. Eine 40 ml Einmalspritze mit dem transparenten Mix2Vial™-Adapter der Pulverflasche verbinden. Die Flasche samt Einmalspritze umdrehen und das aufgelöste Präparat in die Spritze aufziehen.
Nachdem die Lösung in die Spritze überführt wurde, den Spritzenzylinder fassen und die Spritze vom transparenten Mix2Vial™-Adapter der Pulverflasche entfernen. Dabei die Spritze weiter nach unten halten. Verwerfen Sie die leere Pulverflasche mit dem Mix2Vial™-Adapter.
2. Vorgesehene Injektionsstelle mit einem Alkoholtupfer desinfizieren.
3. Das Präparat wird langsam (zu Beginn 1 ml/ Minute, nicht mehr als 2-3 ml pro Minute) intravenös appliziert.
Es ist darauf zu achten, dass kein Blut in die gefüllte Spritze gelangt, da die Gefahr besteht, dass es dort gerinnt und dadurch Fibringerinnsel injiziert werden. Das Mix2Vial™ist nur zum einmaligen Gebrauch bestimmt.
7. PHARMAZEUTISCHER UNTERNEHMER UND HERSTELLER
OCTAPHARMA GmbH Elisabeth-Selbert-Str. 11 40764 Langenfeld Tel.: 02173-917-0 Fax: 02173-917-111 E-Mail: info@octapharma.de www.octapharma.de
Niederlassung Dessau
Otto-Reuter-Str. 3
06847 Dessau-Roßlau
Tel.: 0340-5508-0
Fax: 0800-2896-282
E-Mail: vertrieb@octapharma.de
8. ZULASSUNGSNUMMER
PEI.H.02312.02.1
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung:
Datum der Verlängerung der Zulassung:
10. STAND DER INFORMATION
Juli 2015
11. VERSCHREIBUNGSSTATUS / APOTHEKENPFLICHT
Verschreibungspflichtig
12. HERKUNFTSLAND DES BLUTPLASMAS
Deutschland, Estland, Finnland, Luxemburg, Norwegen, Österreich, Schweden, Schweiz, Slowenien, Tschechische Republik, Ungarn, USA.
13. SONSTIGE HINWEISE
Kontrollen der Thrombozytenzahlen sollen
- vor Beginn der Heparingabe
- am 1. Tag nach Beginn der Heparingabe und
- anschließend während der ersten drei Wochen regelmäßig alle drei bis vier Tage erfolgen.
Darüber hinaus wird eine Kontrolle der Thrombozytenzahl am Ende der Heparingabe empfohlen.
14/14