Orfiril 600
Zusammenfassung der Merkmale des Arzneimittels (SPC)
FACHINFORMATION
▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen siehe Abschnitt 4.8.
1. BEZEICHNUNG DES ARZNEIMITTELS
Orfiril 150, 150 mg, magensaftresistentes Dragee Orfiril 300, 300 mg, magensaftresistentes Dragee Orfiril 600, 600 mg, magensaftresistentes Dragee
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 magensaftresistentes Dragee enthält 150/300/600 mg Natriumvalproat (entsprechend 130,14/260,28/520,56 mg Valproinsäure).
Sonstige Bestandteile mit bekannter Wirkung:
Orfiril 300/600: 41,4 mg/82,8 mg Natrium pro Dragee.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
magensaftresistentes Dragee Orfiril 150, Orfiril 300
Weißes bis schwach gelbliches, rundes, gewölbtes magensaftresistentes Dragee Orfiril 600
Weißes bis schwach gelbliches, längliches, gewölbtes magensaftresistentes Dragee
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur Behandlung von:
- Generalisierten Anfällen in Form von Absencen, myoklonischen Anfällen und tonischklonischen Anfällen
- fokalen und sekundär-generalisierten Anfällen
- zur Kombinationsbehandlung bei anderen Anfallsformen, z.B. fokalen Anfällen mit einfacher und komplexer Symptomatik sowie fokalen Anfällen mit sekundärer Generalisation, wenn diese Anfallsformen auf die übliche antiepileptische Behandlung nicht ansprechen.
Hinweis:
Bei Kleinkindern sind Valproinsäure-haltige Arzneimittel nur in Ausnahmefällen Mittel erster Wahl; Orfiril sollte nur unter besonderer Vorsicht nach strenger Nutzen-Risiko-Abwägung und möglichst als Monotherapie angewendet werden.
4.2 Dosierung und Art der Anwendung
Mädchen, weibliche Jugendliche, Frauen im gebärfähigen Alter und schwangere Frauen Die Behandlung mit Orfiril muss von einem in der Therapie von Epilepsie erfahrenen Spezialisten eingeleitet und überwacht werden. Diese sollte nur dann eingeleitet werden, wenn andere Behandlungen nicht wirksam sind oder nicht vertragen werden (siehe Abschnitte 4.4 und 4.6) und Nutzen und Risiken sollten in regelmäßigen Untersuchungen weiterhin sorgfältig gegeneinander abgewogen werden. Orfiril sollte vorzugsweise als Monotherapie und in der niedrigsten wirksamen Dosis verschrieben werden, wenn möglich als Retardformulierung, um hohe Spitzenkonzentrationen im Plasma zu vermeiden. Die tägliche Dosis sollte in mindestens zwei Einzeldosen aufgeteilt werden.
Dosierung
Die Dosierung ist individuell vom (Fach-)Arzt zu bestimmen und zu kontrollieren, wobei Anfallsfreiheit bei minimaler Dosierung, besonders in der Schwangerschaft, angestrebt werden sollte.
Es empfiehlt sich ein stufenweiser (einschleichender) Aufbau der Dosierung bis zur optimal wirksamen Dosis.
In der Monotherapie beträgt die Initialdosis in der Regel 5 - 10 mg Valproinsäure/kg Körpergewicht, die alle 4-7 Tage um etwa 5 mg Valproinsäure/kg Körpergewicht erhöht werden sollte.
Die volle Wirkung ist in einigen Fällen erst nach 4-6 Wochen zu beobachten. Die Tagesdosen sollen deshalb nicht zu früh über mittlere Werte hinaus gesteigert werden.
Zur stufenweisen Steigerung der Dosis und für eine präzise Einstellung der Erhaltungsdosis steht Orfiril in verschiedenen Wirkstärken zur Verfügung: als magensaftresistentes Dragee mit 150 bzw. 300 bzw. 600 mg sowie als Lösung zum Einnehmen mit 60 mg/ml.
Die mittlere Tagesdosis beträgt während der Langzeitbehandlung im Allgemeinen für:
- Erwachsene und ältere Patienten 20 mg Valproinsäure/kg Körpergewicht
- Jugendliche 25 mg Valproinsäure/kg Körpergewicht
- Kinder 30 mg Valproinsäure/kg Körpergewicht.
Entsprechend werden folgende orientierende Tagesdosen empfohlen:
|
Dosierungstabelle | ||
|
Lebensalter |
Körpergewicht |
Durchschnittl. Dosis |
|
(in kg) |
(in mg/Tag1) | |
|
Erwachsene |
ab ca. 60 |
1200-2100 |
|
Jugendliche ab 14 Jahre Kinder:1) |
ca. 40-60 |
600-1500 |
1 bezogen auf mg Natriumvalproat
|
3-6 Monate |
ca. 5,5-7,5 |
150 |
|
6-12 Monate |
ca. 7,5-10 |
150-300 |
|
1-3 Jahre |
ca. 10-15 |
300-450 |
|
3-6 Jahre |
ca. 15-25 |
450-600 |
|
7-14 Jahre |
ca. 25-40 |
600-1200 |
Wird Orfiril in Kombination oder als Substitutionstherapie zu einer früheren Medikation gegeben, muss die Dosis der bis dahin eingenommenen Antiepileptika, besonders die des Phenobarbitals, unverzüglich vermindert werden. Falls die vorausgegangene Medikation abgesetzt wird, hat dies ausschleichend zu erfolgen.
Da die enzyminduzierende Wirkung anderer Antiepileptika reversibel ist, ist etwa 4-6 Wochen nach der letzten Einnahme eines solchen Antiepileptikums der Serumspiegel der Valproinsäure zu kontrollieren und die Tagesdosis gegebenenfalls zu reduzieren.
Die Serumkonzentration (bestimmt vor der ersten Tagesdosis) sollte 100 pg Valproinsäure/ml nicht überschreiten.
Bei Patienten mit Niereninsuffizienz oder Hypoproteinämie muss der Anstieg an freier Valproinsäure im Serum in Betracht gezogen und die Dosis ggf. reduziert werden. Entscheidend für eine Dosisanpassung sollte jedoch das klinische Bild sein, da eine Bestimmung der
Valproinsäuregesamtkonzentration im Serum zu falschen Schlussfolgerungen führen kann(s. auch Pkt. 5.2. Pharmakokinetische Eigenschaften).
Die Tagesdosis kann auf 2-4 Einzelgaben verteilt werden.
Folgende Tagesdosen werden empfohlen: siehe Dosierungstabelle
Art der Anwendung
Die magensaftresistenten Dragees sollten möglichst 1 Stunde vor den Mahlzeiten (morgens nüchtern) unzerkaut mit reichlich Flüssigkeit (z.B. 1 Glas Wasser) eingenommen werden.
Die Dauer der Anwendung ist individuell verschieden und wird vom behandelnden Arzt festgelegt.
Die antiepileptische Therapie ist grundsätzlich eine Langzeittherapie.
Über die Einstellung, Behandlungsdauer und das Absetzen von Orfiril sollte im Einzelfall ein Facharzt (Neurologe, Neuropädiater) entscheiden. Im Allgemeinen ist eine Dosisreduktion und ein Absetzen der Medikation frühestens nach zwei- bis dreijähriger Anfallsfreiheit zu erwägen. Das Absetzen muss in schrittweiser Dosisreduktion über ein bis zwei Jahre erfolgen. Kinder können der 1
Dosis pro kg Körpergewicht entwachsen, anstelle altersgemäßer Dosisanpassung, wobei sich der EEG-Befund nicht verschlechtern sollte.
4.3 Gegenanzeigen
Orfiril Dragees dürfen nicht angewendet werden bei:
- Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
- Lebererkrankungen in der eigenen oder Familienanamnese sowie manifesten schwerwiegenden Leber- und Pankreasfunktionsstörungen
- Leberfunktionsstörungen mit tödlichem Ausgang während einer Valproinsäure-Therapie bei Geschwistern
- Porphyrie
- Blutgerinnungsstörungen.
Valproat darf nicht angewendet werden bei Patienten, die unter mitochondrialen Erkrankungen leiden, die durch Mutationen in dem das mitochondriale Enzym Polymerase Gamma (POLG) kodierenden Kerngen verursacht sind, wie beispielsweise das Alpers-Huttenlocher-Syndrom, sowie bei Kindern im Alter unter zwei Jahren, bei denen der Verdacht auf eine POLG-verwandte Erkrankung (siehe Abschnitt 4.4) besteht.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Orfiril darf nur unter besonderer Vorsicht angewendet werden (relative Gegenanzeige) bei:
- Kleinkindern, bei denen die gleichzeitige Behandlung mit mehreren Antiepileptika erforderlich ist
- mehrfach behinderten Kindern und Jugendlichen mit schweren Anfallsformen.
- Knochenmarkschädigung
- metabolischen Erkrankungen, insbesondere angeborener Enzymopathie
- Niereninsuffizienz und Hypoproteinämie
- systemischem Lupus erythematodes.
Leber- und Pankreasschädigung
Gelegentlich (> 1/1000 - < 1/100) sind schwere Schädigungen der Leber mit tödlichem Ausgang beobachtet worden. Am häufigsten betroffen waren Säuglinge und Kleinkinder unter 3 Jahren, die an schweren epileptischen Anfällen litten, besonders wenn zusätzlich eine Hirnschädigung, mentale Retardierung oder eine angeborene Stoffwechselerkrankung vorliegen. Bei dieser Patientengruppe sollte die Valproinsäure-Anwendung mit besonderer Vorsicht und als Monotherapie erfolgen. Die Erfahrung hat gezeigt, dass oberhalb dieser Altersgruppe (vor allem jenseits des 10. Lebensjahres) die Häufigkeit der Lebererkrankungen beträchtlich abnimmt.
In der Mehrzahl der Fälle wurden Leberschäden innerhalb der ersten 6 Monate der Therapie beobachtet, insbesondere zwischen der 2. und 12. Woche, und zumeist bei der gleichzeitigen Anwendung anderer Antiepileptika.
Schwere, lebensbedrohende Schädigungen von Leber oder Pankreas treten gelegentlich auf und kommen fast ausschließlich in den ersten 6 Behandlungsmonaten vor. Betroffen sind vorwiegend Kinder unter 15 Jahren, besonders mehrfachbehinderte Kleinkinder unter Kombinationstherapie.
Klinische Symptome
Meistens zeigen sich klinische Auffälligkeiten (Appetitverlust, Übelkeit, Erbrechen, Bauchschmerzen, Abneigung gegen gewohnte Speisen, Abneigung gegen Valproinsäure, Müdigkeit, Schlappheit,
Zunahme von Frequenz/Schwere der Anfälle, Hämatome/Epistaxis, Ödeme der Augenlider/unteren Extremitäten, Ikterus) schon vor der Veränderung von Laborwerten.
Besonders zu Behandlungsbeginn können die Leberenzyme auch unabhängig von einer Leberfunktionsstörung vorübergehend erhöht sein. Der klinischen Überwachung der Patienten kommt deshalb größere Bedeutung zu als den Laborbefunden.
Maßnahmen zur Früherkennung einer Leberschädigung:
Vor Behandlungsbeginn ausführliche klinische Untersuchungen (insbesondere hinsichtlich Stoffwechselstörungen, Hepatopathie, Pankreasaffektionen und Gerinnungsstörungen) und laborchemische Bestimmung von Blutbild mit Thrombozyten, Bilirubin, SGOT, SGPT, y-GT, alkalischer Phosphatase, Lipase, a-Amylase im Blut, Blutzucker, Gesamteiweiß, Quick, PTT, Fibrinogen, Faktor VIII und assoziierten Faktoren. Die Patienten sind engmaschig zu überwachen (besonders bei Fieber), die Eltern/Bezugspersonen sind auf Zeichen einer Leberschädigung (s.o.) hinzuweisen und in die Überwachung mit einzubeziehen.
Eltern und behandelnder Arzt sollten in den ersten 6 Behandlungsmonaten engen direkten oder telefonischen Kontakt halten:
Erster Telefonkontakt 2 Wochen nach Behandlungsbeginn, erste ärztliche und laborchemische Untersuchung nach 4 Wochen. Danach Arztkontakte jeweils in den Wochen 8, 12, 16, 22, 28, 40 und 52. Telefonkontakte in den Wochen 6, 10, 14, 19, 34.
Eltern sind anzuweisen, bei klinischen Auffälligkeiten und unabhängig von diesem Zeitplan sofort den behandelnden Arzt zu informieren.
Laborkontrollen bei den Arztbesuchen:
Bei unauffälligem Kind: Blutbild mit Thrombozyten, SGOT und SGPT, bei jeder zweiten ärztlichen Untersuchung außerdem Gerinnungsparameter. Nach 12-monatiger Therapie ohne Auffälligkeiten sind nur noch 2-3 ärztliche Kontrollen pro Jahr erforderlich.
Bei Jugendlichen (etwa ab dem 15. Lebensjahr) und Erwachsenen sind im ersten Halbjahr monatliche Kontrollen des klinischen Befundes und der Laborparameter sowie in jedem Fall vor Therapiebeginn anzuraten. Diese Kontrollen sollten Blutbild (inklusive Thrombozyten), Leberwerte und Pankreasfunktionstests umfassen.
Ein sofortiger Therapieabbruch ist zu erwägen bei:
nicht erklärbarer Störung des Allgemeinbefindens, klinischen Zeichen einer Leber- oder Pankreasaffektion oder Blutungsneigung, mehr als 2-3facher Erhöhung der Lebertransaminasen auch ohne klinische Zeichen (Enzyminduktion durch evtl. Begleitmedikation bedenken), leichter (eineinhalb- bis zweifacher) Erhöhung der Lebertransaminasen bei gleichzeitigem, akut fieberhaftem Infekt, ausgeprägter Störung des Gerinnungsstatus.
Niereninsuffizienz und Hypoproteinämie
Bei Patienten mit Niereninsuffizienz und Hypoproteinämie muss der Anstieg an freier Valproinsäure im Serum in Betracht gezogen werden und die Dosis ggf. reduziert werden.
Lupus erythematodes
Die Anwendung von Valproinsäure-haltigen Arzneimitteln führt nur selten zu Reaktionen des Immunsystems. Trotzdem sollte bei Patienten, die Anzeichen eines Lupus erythematodes zeigen, der Einsatz nur unter sorgfältiger Nutzen-Risiko-Abwägung erfolgen.
Hyperammonämie
Unter der Behandlung mit Valproinsäure-haltigen Präparaten kann es zu einem Anstieg des Ammoniakserumspiegels (Hyperammonämie) kommen. Deshalb ist beim Auftreten von Symptomen wie Apathie, Somnolenz, Erbrechen, Hypotension sowie bei der Zunahme der Anfallsfrequenz der
Serumspiegel von Ammoniak und Valproinsäure zu bestimmen; ggf. ist die Dosis des Präparates zu reduzieren. Bei Verdacht auf eine bereits bestehende enzymatische Störung des Harnstoffzyklusses sollte der Ammoniakserumspiegel bereits vor Beginn der Therapie mit Valproinsäure-haltigen Arzneimitteln bestimmt werden.
Verschlechterung des Anfallsleidens
Wie bei anderen Antiepileptika auch kann es unter der Behandlung mit Valproinsäure-haltigen Arzneimitteln zur Verschlechterung des Anfallsleidens kommen.
Gastrointestinale Symptome
Zu beachten ist, dass zu Beginn einer Valproinsäure-Behandlung selten auch eine harmlose, meist vorübergehende Übelkeit, manchmal auch mit Erbrechen und Appetitlosigkeit, auftreten kann, die sich von selbst oder nach Dosisverringerung zurückbildet.
Gerinnungsstatus
Vor einem operativen oder zahnärztlichen Eingriff ist der Gerinnungsstatus zu überprüfen. Bei gleichzeitiger Einnahme von Vitamin-K-Antagonisten wird eine engmaschige Kontrolle des QuickWertes empfohlen.
Patienten mit vorausgegangener Knochenmarkschädigung müssen streng überwacht werden. Gewichtszunahme
Patienten sollen auf eine mögliche Gewichtszunahme zu Beginn der Behandlung hingewiesen werden. Geeignete Maßnahmen zur Gewichtskontrolle sind zu ergreifen.
Absetzen der Therapie mit Valproinsäure
Das Absetzen von Valproinsäure oder die Umstellung auf ein anderes Antiepileptikum müssen schrittweise und mit besonderer Vorsicht erfolgen. Abrupte Änderungen der Dosierung können zu einer plötzlichen Verschlechterung der epileptischen Anfälle führen.
Bei der Beobachtung nicht-dosisabhängiger Nebenwirkungen ist das Absetzen des Arzneimittels angezeigt.
Beeinflussung von Labortests
Da Valproinsäure teilweise zu Ketonkörpern metabolisiert wird, sollte bei Diabetikern mit Verdacht auf Ketoazidose eine mögliche falsch-positive Reaktion eines Tests auf Ketonkörper-Ausscheidung berücksichtigt werden.
HIV -Replikation
In einzelnen Studien hat sich in vitro ein stimulierender Effekt von Natriumvalproat auf die Replikation von HI-Viren gezeigt. Dieser In-vitro-Effekt ist gering ausgeprägt und abhängig von den eingesetzten experimentellen Modellen und/oder individuellen Reaktionen gegenüber Natriumvalproat auf zellulärer Ebene. Klinische Konsequenzen dieser Beobachtungen sind nicht bekannt. Unabhängig davon sollten diese Ergebnisse bei HIV-positiven Patienten, die Natriumvalproat erhalten, in die Bewertung von Ergebnissen der routinemäßigen Bestimmung der Virusbelastung einbezogen werden.
Suizidgedanken und suizidales Verhalten
Über suizidale Gedanken und suizidales Verhalten wurde bei Patienten, die mit Antiepileptika in verschiedenen Indikationen behandelt wurden, berichtet. Eine Metaanalyse randomisierter, Placebokontrollierter Studien mit Antiepileptika zeigte auch ein leicht erhöhtes Risiko für das Auftreten von Suizidgedanken und suizidalem Verhalten. Der Mechanismus für die Auslösung dieser Nebenwirkung ist nicht bekannt und die verfügbaren Daten schließen die Möglichkeit eines erhöhten Risikos bei der Einnahme von Natriumvalproat nicht aus.
Deshalb sollten Patienten hinsichtlich Anzeichen von Suizidgedanken und suizidalen Verhaltensweisen überwacht und eine geeignete Behandlung in Erwägung gezogen werden. Patienten (und deren Betreuern) sollte geraten werden medizinische Hilfe einzuholen, wenn Anzeichen für Suizidgedanken oder suizidales Verhalten auftreten.
Carbapeneme
Die gleichzeitige Anwendung von Valproinsäure/Valproaten und Carbapenemen wird nicht empfohlen (siehe Abschnitt 4.5).
Mädchen/weibliche Jugendliche/Frauen im gebährfähigen Alter/Schwangerschaft:
Aufgrund seines hohen teratogenen Potentials und des Risikos für Entwicklungsstörungen bei Kindern, die im Mutterleib Valproat ausgesetzt sind, darf Orfiril nicht bei Mädchen, weiblichen Jugendlichen, Frauen im gebärfähigen Alter und schwangeren Frauen angewendet werden, es sei denn, dass alternative Behandlungen nicht wirksam sind oder nicht vertragen werden. Der Nutzen und die Risiken sollten bei Routineüberprüfungen der Behandlung, in der Pubertät sowie unverzüglich, wenn eine Frau im gebärfähigen Alter, die mit Orfiril behandelt wird, eine Schwangerschaft plant oder schwanger wird, sorgfältig gegeneinander abgewogen werden.
Frauen im gebärfähigen Alter müssen während der Behandlung wirksame Verhütungsmethoden anwenden und über die Risiken, die mit einer Anwendung von Orfiril während der Schwangerschaft verbunden sind, aufgeklärt werden (siehe Abschnitt 4.6).
Der verordnende Arzt muss dafür sorgen, dass die Patientin durch geeignete Materialien, wie z. B. die Patienteninformationsbroschüre, umfassend über die Risiken aufgeklärt wird, damit sie diese besser versteht.
Insbesondere muss der verordnende Arzt dafür sorgen, dass der Patientin folgende Punkte bewusst sind:
• die Art und das Ausmaß der Risiken bei einer Exposition während der Schwangerschaft, insbesondere die teratogenen Risiken und die Risiken für Entwicklungsstörungen.
• die Notwendigkeit der Anwendung einer zuverlässigen Verhütungsmethode,
• die Notwendigkeit einer regelmäßigen Überprüfung der Behandlung,
• die Notwendigkeit, unverzüglich ihren Arzt aufzusuchen, wenn sie darüber nachdenkt, schwanger zu werden, oder die Möglichkeit einer Schwangerschaft besteht.
Bei Frauen, die eine Schwangerschaft planen, sollten alle Möglichkeiten ausgeschöpft werden, um vor der Empfängnis auf eine geeignete Alternativbehandlung umzustellen, sofern dies möglich ist (siehe Abschnitt 4.6).
Die Behandlung mit Valproat sollte nur fortgesetzt werden, wenn ein Arzt mit Erfahrung in der Behandlung von Epilepsie den Nutzen und die Risiken der Behandlung mit Valproat für die Patientin erneut bewertet hat.
Patienten mit bekannter mitochondrialer Erkrankung bzw. mit Verdacht auf eine mitochondriale Erkrankung
Valproat kann die klinischen Anzeichen für zugrunde liegende mitochondriale Erkrankungen, die durch Mutationen der mitochondrialen DNA oder auch des kernkodierten POLG-Gens verursacht werden, auslösen oder verstärken. So wurde von Patienten mit angeborenen neurometabolischen Erkrankungen, die durch Mutationen im Gen für das mitochondriale Enzym Polymerase Gamma (POLG) verursacht werden, wie beispielsweise das Alpers-Huttenlocher-Syndrom, eine höhere Rate
an durch Valproat induzierten Fällen von akutem Leberversagen und leberbedingten Todesfällen gemeldet.
POLG-verwandte Erkrankungen sollten vermutet werden bei Patienten mit entsprechender familiärer Belastung oder Symptomen, die auf eine POLG-verwandte Erkrankung hinweisen, einschließlich nicht geklärter Enzephalopathie, refraktärer Epilepsie (fokal, myoklonisch), Status epilepticus bei Vorstellung, Entwicklungsverzögerung, psychomotorischer Regression, axonaler sensomotorischer Neuropathie, Myopathie, zerebellarer Ataxie, Ophthalmoplegie oder komplizierter Migräne mit okzipitaler Aura. Die Untersuchung auf POLG-Mutationen sollte in Einklang mit der derzeitigen klinischen Praxis für die diagnostische Bewertung solcher Erkrankungen erfolgen (siehe Abschnitt 4.3).
Natriumgehalt
Ein Dragee Orfiril 300 mg enthält 1,8 mmol (41,4 mg) Natrium.
Ein Dragee Orfiril 600 mg enthält 3,6 mmol (82,8 mg) Natrium.
Dies ist zu berücksichtigen bei Personen unter Natrium kontrollierter (natriumarmer/kochsalzarmer) Diät.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bei der Kombination von Orfiril mit anderen Antikonvulsiva ist zu beachten, dass wechselseitige Beeinflussungen der Wirkstoffkonzentrationen im Serum möglich sind.
a) Valproinsäure wird beeinflusst von:
Enzyminduzierende Antiepileptika wie Phenobarbital, Phenytoin, Primidon und Carbamazepin erhöhen die Valproinsäure-Ausscheidung und vermindern dadurch die Wirkung.
Felbamat erhöht dosisabhängig die Serumkonzentration von freier Valproinsäure linear um 18 %.
Mefloquin verstärkt den Abbau von Valproinsäure und besitzt außerdem potentiell krampfauslösende Wirkungen. Eine gleichzeitige Anwendung kann daher zu epileptischen Anfällen führen.
Ein Absinken der Serumkonzentrationen von Valproinsäure wurde beschrieben, wenn gleichzeitig Carbapeneme angewendet wurden, was zu einer 60-100%igen Senkung der Valproinsäurespiegel in etwa 2 Tagen führte. Aufgrund des raschen Eintritts und des Ausmaßes des Absinkens werden die Folgen einer Wechselwirkung zwischen Valproinsäure und Carbapenemen bei Patienten, die stabil auf Valproinsäure eingestellt sind, als nicht kontrollierbar angesehen und eine gleichzeitige Anwendung sollte daher vermieden werden (siehe Abschnitt 4.4).
Die Valproinsäurekonzentration im Serum kann durch die gleichzeitige Gabe von Cimetidin, Erythromycin und Fluoxetin erhöht werden. Es sind jedoch auch Fälle beschrieben, in denen die Valproinsäurekonzentration im Serum durch gleichzeitige Fluoxetineinnahme erniedrigt wurde.
Bei gleichzeitiger Einnahme von Valproinsäure-haltigen Arzneimitteln und Antikoagulantien oder Acetylsalicylsäure kann es zu erhöhter Blutungsneigung kommen. Außerdem vermindert Acetylsalicylsäure die Bindung von Valproinsäure an Plasmaproteine. Eine gleichzeitige Gabe von Valproinsäure-haltigen Arzneimitteln und Acetylsalicylsäure sollte bei Fieber und Schmerzen, besonders bei Säuglingen und Kleinkindern, unterbleiben. Deshalb werden bei gleichzeitiger Anwendung regelmäßige Kontrollen der Blutgerinnungswerte empfohlen.
Rifampicin kann den Valproinsäureserumspiegel erniedrigen, was zu einem fehlenden therapeutischen Effekt führt. Daher kann bei gleichzeitiger Gabe von Rifampicin eine Dosisanpassung von Valproinsäure notwendig sein.
b) Valproinsäure beeinflusst:
Von besonderer klinischer Bedeutung ist die Erhöhung der Phenobarbital-Konzentration durch Valproinsäure, was sich in einer starken Sedierung (besonders bei Kindern) äußern kann. Falls diese auftritt, muss die Phenobarbital- bzw. Primidondosis erniedrigt werden (Primidon wird z. T. zu Phenobarbital metabolisiert). Deshalb ist insbesondere innerhalb der ersten 15 Tage einer Kombinationstherapie eine sorgfältige Überwachung empfehlenswert.
Bei Therapie mit Phenytoin kann durch die zusätzliche Gabe von Orfiril oder einer Dosiserhöhung von Orfiril die Menge des freien Phenytoins ansteigen (Konzentration des nicht eiweißgebundenen, wirksamen Anteils), ohne dass der Serumspiegel des Gesamtphenytoins erhöht ist. Dadurch kann das Risiko für das Auftreten von Nebenwirkungen, insbesondere einer Hirnschädigung, erhöht werden (siehe auch “4.8. Nebenwirkungen”).
Der Serumspiegel von Phenytoin kann bei Kindern nach gleichzeitiger Verabreichung von Clonazepam und Valproinsäure erhöht werden.
In der Kombinationstherapie mit Valproinsäure und Carbamazepin wurden Symptome beschrieben, die möglicherweise auf die Potenzierung des toxischen Effektes von Carbamazepin durch Valproinsäure zurückzuführen sind. Der Serumspiegel des pharmakologisch aktiven Metaboliten Carbamazepin-10, 11-epoxid kann durch Valproinsäure bis in den toxischen Bereich erhöht werden, obwohl der Carbamazepin-Spiegel innerhalb des therapeutischen Bereichs bleibt. Klinisches Monitoring ist insbesondere zu Beginn der Kombinationstherapie angezeigt; die Dosis von Carbamazepin sollte bei Bedarf angepasst werden.
Valproat verdrängte bei gesunden Probanden Diazepam aus der Plasmaalbuminbindung und hemmte dessen Metabolismus. In Kombinationsbehandlung kann die Konzentration von ungebundenem Diazepam erhöht sowie die Plasmaclearance und das Verteilungsvolumen der freien DiazepamFraktion (um 25 %; 20 %) reduziert werden. Die Halbwertszeit bleibt jedoch unverändert.
Die gleichzeitige Behandlung mit Natriumvalproat und Lorazepam hatte bei Gesunden eine Erniedrigung der Plasmaclearance von Lorazepam um bis zu 40 % zur Folge.
Valproinsäure hemmt den Metabolismus von Lamotrigin, dessen Dosierung daher ggf. angepasst werden sollte. Es gibt Verdachtsmomente, dass bei einer Kombination von Lamotrigin und Valproinsäure-haltigen Arzneimitteln das Risiko von Hautreaktionen erhöht ist, da einzelne Fälle schwerer Hautreaktionen berichtet wurden, die innerhalb von 6 Wochen nach Beginn einer Kombinationstherapie auftraten und sich teilweise nach Absetzen der Medikation oder erst nach entsprechender Behandlung zurückbildeten.
Valproinsäure kann den Serumspiegel von Felbamat um ca. 50 % erhöhen.
Auch der Metabolismus und die Proteinbindung von anderen Wirkstoffen wie Codein werden beeinflusst.
Valproinsäure kann die zentraldämpfende Wirkung von Arzneimitteln (z. B Barbiturate, Neuroleptika, Benzodiazepine, Antidepressiva, MAO-Hemmer) verstärken. Bei entsprechenden Kombinationen sollten die Patienten sorgfältig beobachtet und die Dosierungen ggf. angepasst werden.
Da Valproinsäure teilweise zu Ketonkörpern metabolisiert wird, sollte bei Diabetikern mit Verdacht auf Ketoazidose eine mögliche falsch-positive Reaktion eines Tests auf Ketonkörper-Ausscheidung berücksichtigt werden.
Valproinsäure erhöht möglicherweise die Serumkonzentration von Zidovudin, was zu verstärkter Toxizität des Zidovudins führen kann.
Valproinsäure hemmt den Metabolismus von Nimodipin, sodass der Serumspiegel von Nimodipin unter Kombinationsbehandlung stark ansteigen kann.
Valproinsäure kann die Plasmakonzentration von Ethosuximid erhöhen, was mit einem erhöhten Risiko des Auftretens von Nebenwirkungen verbunden ist. Bei gleichzeitiger Gabe der beiden Arzneimittel wird die Kontrolle des Plasmaspiegels von Ethosuximid empfohlen.
c) Sonstige:
Die Wirkung von empfängnisverhütenden Hormonpräparaten ("Pille") wird durch Valproinsäure nicht vermindert, da Valproinsäure keine enzyminduzierende Wirkung besitzt.
Es wird darauf hingewiesen, dass potentiell hepatotoxische Arzneimittel, wie auch Alkohol, die Lebertoxizität von Valproinsäure verstärken können.
Die gleichzeitige Gabe enzyminduzierender Arzneimittel kann mit einem erhöhten Risiko für Lebertoxizität und Hyperammonämie verbunden sein.
Bei gleichzeitiger Gabe von Valproinsäure und Topiramat ist über Enzephalopathie und/oder einen Anstieg des Ammoniakserumspiegels (Hyperammonämie) berichtet worden. Patienten, die mit diesen beiden Arzneistoffen behandelt werden, sollten sorgfältig hinsichtlich Anzeichen für eine hyperammonämische Enzephalopathie überwacht werden.
Bei einer Kombinationstherapie mit Lithium sollte die Plasmakonzentration beider Arzneistoffe regelmäßig überwacht werden.
Bei gleichzeitiger Behandlung mit Valproinsäure-haltigen Arzneimitteln und Clonazepam trat bei Patienten mit Anfällen vom Absence-Typ in der Vorgeschichte ein Absence-Status auf.
Bei einer Patientin mit schizoaffektiver Störung trat bei gleichzeitiger Behandlung mit Valproinsäure, Sertralin (Antidepressivum) und Risperidon (Neuroleptikum) eine Katatonie auf.
4.6 Fertilität, Schwangerschaft und Stillzeit
Orfiril darf nicht bei Mädchen, weiblichen Jugendlichen, Frauen im gebärfähigen Alter und schwangeren Frauen angewendet werden, es sei denn, dass andere Behandlungen nicht wirksam sind oder nicht vertragen werden. Frauen im gebärfähigen Alter müssen während der Behandlung zuverlässige Verhütungsmethoden anwenden. Bei Frauen, die eine Schwangerschaft planen, sollten alle Möglichkeiten ausgeschöpft werden, um vor der Empfängnis auf eine geeignete Alternativbehandlung umzustellen, sofern dies möglich ist.
Risiko einer Exposition gegenüber Valproat während der Schwangerschaft
Valproat ist sowohl bei alleiniger Gabe als auch bei Gabe in Kombination mit anderen Arzneimitteln mit Anomalien des Neugeborenen assoziiert. Die verfügbaren Daten legen nahe, dass bei der Behandlung von Epilepsie die Anwendung von Valproat zusammen mit anderen Arzneimitteln zu einem höheren Risiko für angeborene Missbildungen führt, als eine Valproat-Monotherapie.
Angeborene Missbildungen
Daten aus einer Metaanalyse (einschließlich Registern und Kohortenstudien) haben gezeigt, dass es bei 10,73 % der Kinder von Frauen, die an Epilepsie leiden und während der Schwangerschaft eine Monotherapie mit Valproat erhalten haben, zu angeborenen Missbildungen gekommen ist (95 % KI: 8,16-13,29). Dies stellt ein höheres Risiko für schwerwiegende Missbildungen als in der Allgemeinbevölkerung dar, in der das Risiko bei ca. 2-3 % liegt. Das Risiko ist dosisabhängig, doch es lässt sich keine Schwellendosis, unterhalb derer kein Risiko besteht, festlegen.
Die verfügbaren Daten zeigen eine erhöhte Inzidenz von leichteren und schwerwiegenderen Missbildungen. Zu den häufigsten Arten von Missbildungen zählen Neuralrohrdefekte, faziale Dysmorphien, Lippen-Kiefer-Gaumenspalte, Kraniostenose, Schädigungen des Herzens, der Nieren, des Urogenitaltraktes, der Extremitäten (einschließlich bilateraler Aplasie des Radius) sowie zahlreiche Anomalien verschiedener Körpersysteme.
Entwicklungsstörungen
Die Daten zeigen, dass es bei Kindern, die im Mutterleib Valproat ausgesetzt waren, zu unerwünschten Wirkungen in Hinblick auf deren geistige und körperliche Entwicklung kommen kann. Das Risiko scheint dosisabhängig zu sein, doch anhand der verfügbaren Daten lässt sich keine Schwellendosis, unterhalb derer kein Risiko besteht, festlegen. Über den genauen Schwangerschaftsabschnitt, in dem ein Risiko für diese Wirkungen besteht, gibt es keine gesicherten Erkenntnisse, und die Möglichkeit, dass das Risiko während der gesamten Schwangerschaft besteht, kann nicht ausgeschlossen werden.
Studien mit Vorschulkindern, die im Mutterleib Valproat ausgesetzt waren, zeigen, dass es bei bis zu 30-40 % zu Verzögerungen in der frühkindlichen Entwicklung kommt. Sie fangen zum Beispiel später an zu sprechen und zu laufen, haben geringere geistige Fähigkeiten, eine geringe Sprachkompetenz (Sprechen und Verstehen) und leiden unter Gedächtnisproblemen.
Der Intelligenzquotient (IQ), der bei Kindern im Alter von 6 Jahren mit einer Exposition gegenüber Valproat im Mutterleib bestimmt wurde, war um durchschnittlich 7-10 Punkte niedriger als bei Kindern, die anderen Antiepileptika ausgesetzt waren. Obwohl die Bedeutung von Störfaktoren nicht ausgeschlossen werden kann, steht jedoch fest, dass das Risiko einer intellektuellen Beeinträchtigung bei Kindern, die Valproat ausgesetzt waren, unabhängig vom IQ der Mutter erhöht sein kann.
Über die langfristigen Auswirkungen liegen nur begrenzte Daten vor.
Die verfügbaren Daten zeigen, dass Kinder, die im Mutterleib Valproat ausgesetzt waren, im Vergleich zur allgemeinen Studienpopulation ein erhöhtes Risiko für Störungen des autistischen Formenkreises (ca. 3-fach erhöht) und frühkindlichen Autismus (ca. 5-fach erhöht) aufweisen. Begrenzte Daten legen nahe, dass bei Kindern, die Valproat im Mutterleib ausgesetzt waren, eine höhere Wahrscheinlichkeit vorliegt, dass bei ihnen die Symptome einer Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS) auftreten.
Mädchen, weibliche Jugendliche und Frauen im gebärfähigen Alter (siehe oben und in Abschnitt 4.4) Wenn eine Frau eine Schwangerschaft planen möchte
• Während der Schwangerschaft stellen bei der Mutter auftretende tonisch-klonische Anfälle und Status epilepticus verbunden mit Hypoxie, ein besonderes Risiko dar, welches zum Tod der Mutter und des ungeborenen Kindes führen kann.
• Bei Frauen, die eine Schwangerschaft planen oder schwanger sind, muss die Behandlung mit Valproat neu überprüft werden.
• Bei Frauen, die eine Schwangerschaft planen, sollten alle Möglichkeiten ausgeschöpft werden, um vor der Empfängnis auf eine geeignete Alternativbehandlung umzustellen, sofern dies möglich ist.
Die Behandlung mit Valproat sollte nicht abgesetzt werden, ohne dass ein Arzt mit Erfahrung in der Behandlung von Epilepsie den Nutzen und die Risiken der Behandlung mit Valproat für die Patientin erneut bewertet hat. Wenn nach einer sorgfältigen Nutzen-Risiko-Abwägung die Behandlung mit Valproat während der Schwangerschaft fortgesetzt wird, gelten folgende Empfehlungen:
• Anwendung der niedrigsten wirksamen Dosis und Aufteilung der täglichen Valproat-Dosis in mehrere kleine Dosen, die über den Tag verteilt einzunehmen sind. Möglicherweise ist die Anwendung einer Retardformulierung anderen Darreichungsformen vorzuziehen, um hohe Spitzenkonzentrationen im Plasma zu vermeiden.
• Eine Folsäure-Supplementierung vor der Schwangerschaft kann das Risiko für Neuralrohrdefekte, das bei allen Schwangerschaften besteht, möglicherweise senken. Jedoch lassen verfügbare Hinweise nicht darauf schließen, dass eine solche Supplementierung Geburtsfehler oder Missbildungen, die durch eine Exposition gegenüber Valproat bedingt sind, verhindert.
• Einleitung einer speziellen pränatalen Überwachung, um möglicherweise auftretende Neuralrohrdefekte oder andere Missbildungen zu erkennen.
Risiken für Neugeborene
• In sehr seltenen Fällen wurde bei Neugeborenen, deren Mütter während der Schwangerschaft Valproat eingenommen haben, über das Auftreten eines hämorrhagischen Syndroms berichtet. Dieses hämorrhagische Syndrom geht mit Thrombozytopenie, Hypofibrinogenämie und/oder einer Abnahme anderer Gerinnungsfaktoren einher. Es wurde darüber hinaus über Afibrinogenämie berichtet, die zum Tod führen kann. Dieses Syndrom muss jedoch von einer durch Phenobarbital und andere Enzyminduktoren hervorgerufene Abnahme der Vitamin-K-abhängigen Gerinnungsfaktoren unterschieden werden. Daher sollten bei Neugeborenen Thrombozytenzahl, Fibrinogenspiegel im Plasma und Gerinnungsfaktoren untersucht sowie Gerinnungstests durchgeführt werden.
• Bei Neugeborenen, deren Mütter während des dritten Trimenons ihrer Schwangerschaft Valproat eingenommen haben, wurde über Fälle von Hypoglykämie berichtet.
• Bei Neugeborenen, deren Mütter während der Schwangerschaft Valproat eingenommen haben, wurde über Fälle von Hypothyreose berichtet.
• Bei Neugeborenen, deren Mütter während des letzten Trimenons ihrer Schwangerschaft Valproat eingenommen haben, kann es zu Entzugserscheinungen (insbesondere zu Agitiertheit, Reizbarkeit, Übererregbarkeit, Nervosität, Hyperkinesie, Tonusstörungen, Tremor, Krämpfe und Störungen bei der Nahrungsaufnahme) kommen.
Stillzeit
Valproat tritt in die Muttermilch in einer Konzentration zwischen 1 % und 10 % des mütterlichen Serumspiegels über. Bei gestillten Neugeborenen/Kindern von behandelten Müttern wurden hämatologische Störungen nachgewiesen (siehe Abschnitt 4.8).
Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Orfiril verzichtet werden soll bzw. die Behandlung mit Orfiril zu unterbrechen ist. Dabei sind sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau zu berücksichtigen.
Fertilität
Bei Frauen, die Valproat anwenden, wurde über Amenorrhoe, polyzystische Ovarien und erhöhte Testosteronspiegel berichtet (siehe Abschnitt 4.8). Die Verabreichung von Valproat kann auch die Fruchtbarkeit bei Männern beeinträchtigen (siehe Abschnitt 4.8). Aus Fallberichten geht hervor, dass die Fertilitätsstörungen nach dem Absetzen der Behandlung reversibel sind.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Zu Beginn einer Therapie mit Orfiril, bei höherer Dosierung oder in Kombination mit am Zentralnervensystem wirkenden Arzneimitteln können zentralnervöse Wirkungen wie z. B. Schläfrigkeit, Verwirrtheit das Reaktionsvermögen so weit verändern, dass - unabhängig von der Auswirkung des behandelten Grundleidens - die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen oder zur Durchführung von Tätigkeiten, die mit Sturz- oder Unfallgefahr einhergehen, beeinträchtigt wird. Dies gilt in verstärktem Maße bei gleichzeitigem Alkoholgenuss.
4.8 Nebenwirkungen
Sehr häufig (>1/10)
Häufig (>1/100, < 1/10)
Gelegentlich (> 1/1000, < 1/100)
Selten (> 1/10000, < 1/1000)
Sehr selten (< 1/10000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Erkrankungen des Blutes und des Lymphsystems
Häufig: Thrombozytopenie und Leukopenie, die sich oft unter Beibehalten der Medikation, aber immer nach Absetzen von Valproinsäure vollständig zurückbilden.
Gelegentlich: Blutungen*1
Sehr selten: Beeinträchtigung der Knochenmarksfunktion, die zu Lymphopenie, Neutropenie, Panzytopenie, Anämie oder Aplasie der Roten Zelllinie führen kann.
Nicht bekannt: Agranulozytose, erniedrigte Konzentration von Fibrinogen bzw. Faktor VIII, Hemmung der sekundären Phase der Plättchenaggregation und verlängerte Blutungszeit
Erkrankungen des Immunsystems
Selten: Veränderungen in den immunologischen Abwehrmechanismen (Blutgefäßentzündung, Lupus erythematodes)
Nicht bekannt: allergische Reaktionen, Angioödem Endokrine Erkrankungen
Nicht bekannt: Syndrom der inadäquaten ADH-Sekretion (SIADH)
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: isoliert und mäßig ausgeprägte Hyperammonämie ohne Veränderung der Leberfunktionsparameter, die keinen Therapieabbruch erfordert.
Häufig: Gewichtszunahme*2 (Risikofaktor für polyzystisch-ovarielles Syndrom, daher sorgfältige
Überwachung nötig, siehe Abschnitt 4.4) oder Gewichtsabnahme*2, erhöhter Appetit*2 oder auch
Appetitlosigkeit*2
Selten: Hyperinsulinämie
Sehr selten: Hyponatriämie
Psychiatrische Erkrankungen Gelegentlich: Verwirrtheit*1, Reizbarkeit*1 Nicht bekannt: Halluzinationen
Erkrankungen des Nervensystems
Häufig: Benommenheit*2, Schläfrigkeit*2, Tremor*2 oder Parästhesien*2 Gelegentlich: Enzephalopathie*3, Stupor*4 und Lethargie bis hin zum transienten Koma, Kopfschmerzen*1, Spastizität*1, Ataxie*1, Hyperaktivität*1
Nicht bekannt: Verschlechterung des Anfallsleidens, Sedierung, reversible extrapyramidale Störungen (z. B. Parkinsonismus), Demenz vergesellschaftet mit zerebraler Atrophie (nach Absetzen der Medikation reversibel)
Erkrankungen des Ohres und des Labyrinths
Nicht bekannt: Tinnitus, Hörverlust (reversibel oder irreversibel, Kausalzusammenhang nicht gesichert)
Erkrankungen der Atemwege, des Brustraums und des Mediastinums Nicht bekannt: eosinophiler Pleuraerguss
Erkrankungen des Gastrointestinaltrakts Häufig'. Diarrhoe*1
Gelegentlich', bei Einnahme der magensaftresistenten Dragees Übelkeit und Magenschmerzen (besonders zu Beginn der Behandlung, meist vorübergehend), Hypersalivationen*1 Selten: Schädigung der Bauchspeicheldrüse (teilweise mit tödlichem Ausgang)
Leber- und Gallenerkrankungen Häufig' Erhöhung der Leberenzyme
Gelegentlich: schwerwiegende (bis tödlich verlaufende) Leberfunktionsstörungen (dosisunabhängig, Risiko bei Kindern deutlich erhöht, insbesondere bei Kombinationstherapie, siehe auch Abschnitt 4.4)
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: vorübergehender Haarausfall (beim Nachwachsen lockigeres Haar), Veränderungen in der Haarpigmentierung (z. B. Ergrauen)
Selten: Reaktionen der Haut (Exanthem, Erythema multiforme)
Nicht bekannt: schwere Hautreaktionen (Stevens-Johnson-Syndrom und toxische epidermale Nekrolyse bzw. Lyell-Syndrom), Syndrom der Medikamentenreaktion mit Eosinophilie und systemischen Symptomen (DRESS), siehe auch „Erkrankungen des Immunsystems“, Hirsutismus (z. B. aufgrund des polyzystischen Ovarialsyndroms)
Skelettmuskulatur-. Bindegewebs- und Knochenerkrankungen
Es gibt Fallberichte über die Abnahme der Knochendichte unter dem Bild der Osteoporose bis hin zu pathologischen Frakturen bei Patienten, die Natriumvalproat über eine lange Zeit angewendet haben. Der Mechanismus, über den Natriumvalproat den Knochen-Metabolismus beeinflusst, ist nicht bekannt.
Erkrankungen der Niere und der Harnwege
Selten: nach Absetzen reversibles Fanconi-Syndrom (metabolische Acidose, Phosphaturie, Aminoacidurie, Glucosurie)
Nicht bekannt: Enuresis bei Kindern, interstitielle Nephritis, Verschlechterung der Nierenfunktion, Nierenversagen
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Selten: Amenorrhoe, Dysmenorrhoe, Polyzystisches Ovarialsyndrom, Unfruchtbarkeit bei Männern Nicht bekannt: gestörte Spermatogenese (mit reduzierter Spermienanzahl und/oder -motilität)
Kongenitale, familiaere und genetische Erkrankungen
Angeborene Missbildungen und Entwicklungsstörungen (siehe Abschnitte 4.4 und 4.6)
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Gelegentlich: periphere Ödeme*1 Selten: Hypothermie
Untersuchungen
Selten: erhöhte Testosteronspiegel, erniedrigte Spiegel des insulinartigen WachstumsfaktorBindungsproteins
Nicht bekannt: veränderte Schilddrüsenfunktionsparameter (klinische Relevanz unklar)
*1 Besonders zu Beginn der Behandlung *2 Dosisabhängige Nebenwirkungen
*3 Gelegentlich wurde kurz nach Anwendung von Valproinsäure-haltigen Arzneimitteln eine Enzephalopathie beobachtet, deren Pathogenese nicht geklärt ist, und die nach Absetzen des
Arzneimittels reversibel ist. Dabei wurden in einigen Fällen ein erhöhter Ammoniakspiegel sowie bei Kombinationstherapie mit Phenobarbital ein Anstieg des Phenobarbitalspiegels beschrieben.
Selten wurde, vor allem bei höherer Dosierung oder in Kombinationstherapie mit anderen Antiepileptika, auch über chronische Enzephalopathien mit neurologischer Symptomatik sowie Störungen höherer kortikaler Funktionen berichtet, deren Pathogenese ebenfalls nicht ausreichend geklärt wurde.
*4 Gelegentlich wurden Fälle von Stupor und Lethargie bis hin zum transienten Koma beobachtet, die zum Teil mit einer erhöhten Anfallsfrequenz verbunden waren und deren Symptomatik sich bei Reduktion der Dosis oder Absetzen des Arzneimittels zurückbildete. Die Mehrzahl dieser Fälle trat bei einer Kombinationstherapie (insbesondere mit Phenobarbital) oder nach einer raschen Dosiserhöhung auf.
Bei einer Langzeittherapie mit Orfiril zusammen mit anderen Antiepileptika, insbesondere Phenytoin, kann es zu Zeichen einer Hirnschädigung (Enzephalopathie) kommen: vermehrte Krampfanfälle, Antriebslosigkeit, Stupor, Muskelschwäche (muskuläre Hypotonie), Bewegungsstörungen (Choreatiforme Dyskinesien) und schwere Allgemeinveränderungen im EEG.
Besondere Aufmerksamkeit muss im Laufe der Behandlung auf folgende Anzeichen einer Leberschädigung gerichtet werden:
Verringerung antiepileptischer Wirkung, die durch erneutes Auftreten oder Zunahme epileptischer Anfälle gekennzeichnet ist; länger andauernde Symptome wie körperliches Schwächegefühl, Teilnahmslosigkeit, Appetitlosigkeit, Übelkeit und wiederholtes Erbrechen oder unklare Oberbauchbeschwerden, vermehrte Gewebewassereinlagerung im ganzen Körper oder in Teilen davon, Bewusstseinsstörungen mit Verwirrtheit, Unruhe oder Bewegungsstörungen.
Selten wurde auch eine Schädigung der Bauchspeicheldrüse mit ähnlichen Beschwerden beobachtet. Hinsichtlich dieser Anzeichen sollten Säuglinge und Kleinkinder ärztlich engmaschig überwacht werden.
Sind die oben erwähnten Beschwerden anhaltend oder schwerwiegend, so sind neben einer gründlichen Untersuchung auch entsprechende Laboruntersuchungen vorzunehmen (s. Sonstige Hinweise 4.4).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Bei jeder Beurteilung einer Intoxikation sollte an die Möglichkeit einer Mehrfach-Intoxikation z. B. durch Einnahme mehrerer Arzneimittel, beispielsweise in suizidaler Absicht, gedacht werden.
Valproinsäure besitzt bei therapeutischen Serumspiegeln (Bereich 50 - 100 pg/ml) eine relativ geringe Toxizität. Sehr selten sind akute Intoxikationen mit Valproinsäure bei Serumspiegeln über 100 pg/ml bei Erwachsenen als auch bei Kindern vorgekommen.
Einzelfälle akuter und chronischer Überdosierung mit tödlichem Ausgang sind aus der Literatur bekannt.
Symptome einer Überdosierung:
Das Vergiftungsbild ist gekennzeichnet durch Verwirrtheitszustände, Sedation bis hin zum Koma, Muskelschwäche und Hypo- bzw. Areflexie.
In Einzelfällen wurden Hypotension, Miosis, kardiovaskuläre wie respiratorische Störungen, zerebrales Ödem, metabolische Azidose, Hypernatriämie beobachtet.
Hohe Serumspiegel riefen bei Erwachsenen wie bei Kindern abnorme neurologische Störungen wie z. B. erhöhte Anfallsneigung und Verhaltensänderungen hervor.
Maßnahmen bei Überdosierung:
Ein spezifisches Antidot ist nicht bekannt.
Die Therapie muss sich deshalb auf allgemeine Maßnahmen zur Entfernung des Wirkstoffes aus dem Organismus und Stützung der Vitalfunktionen beschränken.
Wenn möglich ist initial, innerhalb von 30 Minuten nach Einnahme, Erbrechen auszulösen bzw. eine Magenspülung und die Gabe von Aktivkohle vorzunehmen. Hierbei ist intensivmedizinische Überwachung erforderlich.
Hämodialyse und forcierte Diurese können wirksam sein. Die Peritonealdialyse ist wenig wirksam.
Über die Wirksamkeit der hämatogenen Kohleperfusion sowie der kompletten Plasmasubstitution und -transfusion liegen keine ausreichenden Erfahrungen vor. Aus diesem Grund wird, besonders bei Kindern, eine intensive internistische Therapie ohne spezielle Detoxikationsverfahren, aber mit Kontrolle der Serumkonzentration empfohlen.
Die intravenöse Gabe von Naloxon zur Aufhellung der Bewusstseinstrübung ist als wirksam beschrieben worden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antiepileptika, Fettsäurederivate ATC-Code: N03A G01
Valproinsäure ist ein Antiepileptikum, das keine strukturelle Ähnlichkeit mit anderen antikonvulsiven Wirkstoffen zeigt. Als Wirkmechanismen von Valproinsäure wird eine Erhöhung der GABA-mediierten Inhibition durch einen präsynaptischen Effekt auf den GABA-Metabolismus und/oder eine direkte postsynaptische Wirkung auf die Ionenkanälchen oder neuronalen Membranen angenommen.
Es gibt Hinweise darauf, dass Natriumvalproat unempfindlich gegenüber Multidrug-Transportern ist. Multidrug-Transporter-Proteine entfernen Arzneistoffe aus dem Gehirn und können so die Antiepileptika-Konzentration am Wirkort erniedrigen. Die Überexpression von Multidrug-Transportern kann zu einer Pharmakoresistenz und somit zur Entwicklung eines therapieresistenten Status epilepticus oder einer therapierefraktären Epilepsie führen. Präklinische Studien und In-vitro-Untersuchungen zeigten, dass Valproat nicht von Multidrug-Transportern aus dem Gehirn ausgeschleust wird (bzw. kein Substrat für MDT ist). Die Entwicklung einer Multidrug-Transporter-basierten Pharmakoresistenz für Valproat wird somit als unwahrscheinlich erachtet.
Valproinsäure ist in Wasser sehr schwer löslich (1:800), das Natriumsalz ist in Wasser sehr leicht löslich (1:0,4).
5.2 Pharmakokinetische Eigenschaften
Resorption
Nach oraler Gabe werden die Valproinsäure und ihr Natriumsalz im Gastrointestinaltrakt schnell und nahezu vollständig resorbiert.
Serumspiegel. Plasmaproteinbindung. Verteilung
Der Zeitpunkt der maximalen Serumkonzentration hängt von der galenischen Darreichungsform ab: bei Lösungen wird sie innerhalb von 0.5 - 2 Stunden. bei Tabletten innerhalb 1 - 4 Stunden erreicht. Bei magensaftresistenten Zubereitungen ergibt sich die maximale Serumkonzentration nach 2 - 8 Stunden mit einer Verzögerung von 1 - 4 Stunden. Hierbei wurden nach einer Dosis von 600 mg maximale Serumkonzentrationen zwischen 46 - 88 pg/ml gemessen.
Es besteht keine lineare Beziehung zwischen Dosis und Serumkonzentration.
Der mittlere therapeutische Bereich der Serumkonzentration wird mit 50 - 100 pg/ml angegeben. Oberhalb von 100 pg/ml ist vermehrt mit Nebenwirkungen bis hin zur Intoxikation zu rechnen. Der Steady-State-Serumspiegel wird in der Regel innerhalb von 3 - 4 Tagen erreicht.
In der Zerebrospinalflüssigkeit liegt die Valproinsäure-Konzentration bei 10 % der jeweiligen Serumkonzentration.
Das Verteilungsvolumen ist altersabhängig und beträgt in der Regel 0.13 - 0.23 l/kg, bei Jüngeren 0.13 - 0.19 l/kg.
Valproinsäure wird zu 90 - 95 % an Plasmaproteine gebunden. vornehmlich an Albumin. Bei höherer Dosierung nimmt die Eiweißbindung ab. Die Plasmaproteinbindung ist bei älteren Patienten sowie bei Patienten mit Nieren- oder Leberfunktionsstörungen niedriger. In einer Studie wurden erhöhte Werte freien Wirkstoffes (8.5 bis über 20 %) bei Patienten mit signifikant verminderter Nierenfunktion beobachtet.
Die Valproinsäuregesamtkonzentration. bestehend aus freiem und proteingebundenem Anteil. kann bei Vorliegen einer Hypoproteinämie jedoch im wesentlichen unverändert sein. sie kann aber auch aufgrund der vermehrten Metabolisierung des freien Anteils vermindert sein.
Metabolismus. Ausscheidung
Die Biotransformation erfolgt über Glukuronidierung sowie ß-. ra- und ra ^Oxidation. Etwa 20 % der applizierten Dosis treten nach renaler Exkretion als Ester-Glukuronid im Harn auf. Es existieren mehr als 20 Metabolite. wobei die der ©-Oxidation als hepatotoxisch angesehen werden. Weniger als 5 % der applizierten Dosis Valproinsäure erscheinen unverändert im Urin. Hauptmetabolit ist die 3-Keto-Valproinsäure. die zu 3 -60 % im Harn auftritt. Dieser Metabolit ist bei der Maus antikonvulsiv wirksam. beim Menschen ist die Wirkung noch nicht geklärt.
Plasmaclearance. Plasmahalbwertszeit
Die Plasmaclearance betrug in einer Studie 12.7 ml/min bei Patienten mit Epilepsie. bei Gesunden liegt sie bei 5 - 10 ml/min. bei Einnahme enzyminduzierender Antiepileptika erhöht sie sich.
Die Plasmahalbwertszeit liegt bei Monotherapie durchschnittlich bei 12 - 16 Stunden und bleibt auch bei Langzeittherapie konstant.
Bei Kombination mit anderen Arzneimitteln (z. B. Primidon. Phenytoin. Phenobarbital und Carbamazepin) sinkt die Halbwertszeit. in Abhängigkeit von der Enzyminduktion. auf Werte zwischen 4 und 9 Stunden. Neugeborene und Kinder bis zu 18 Monaten zeigen Plasmahalbwertszeiten zwischen 10 und 67 Stunden. Die längsten Halbwertszeiten wurden unmittelbar nach der Geburt beobachtet. oberhalb von 2 Monaten nähern sich die Werte denen von Erwachsenen.
Bei Leberkranken ist die Halbwertszeit verlängert. Im Falle von Überdosierung wurden Halbwertszeiten bis zu 30 Stunden beobachtet.
In der Schwangerschaft nimmt bei Zunahme des Verteilungsvolumens im dritten Trimenon die hepatische und renale Clearance zu, mit einem möglichen Abfall der Serumkonzentration bei gleich hoher Dosierung.
Ferner ist zu beachten, dass sich im Verlauf der Schwangerschaft die Plasmaproteinbindung verändert und der freie (therapeutisch wirkende) Anteil der Valproinsäure zunehmen kann.
Übergang in die Muttermilch
Valproinsäure ist plazentagängig und geht in die Muttermilch über. Im Steady-state beträgt die Konzentration in der Muttermilch bis ca. 10 % der Serumkonzentration.
Bioverfügbarkeit/Bioäquivalenz
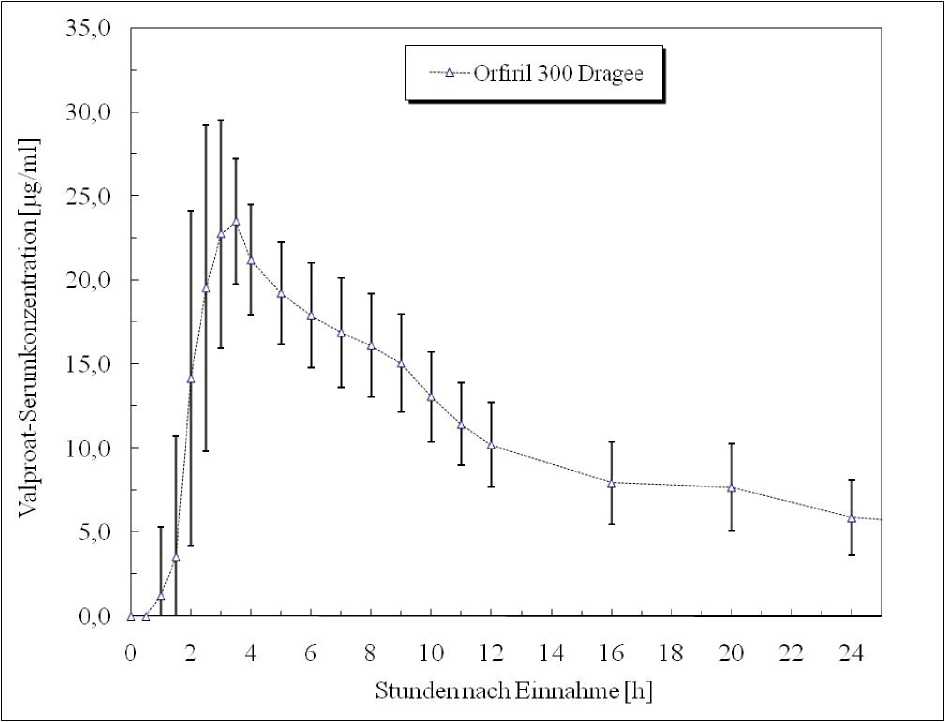
Eine im Jahr 1990 durchgeführte Bioverfügbarkeitsuntersuchung an 14 Probanden (männlich, im Alter von 20-33 Jahren) nach Einmalgabe von Orfiril 300 Dragees ergab folgende Werte:
Orfiril 300
maximale Plasmakonzentration
(Cmax): 25,6 ± 3,9 Mg/ml
Zeitpunkt der maximalen Plasmakonzentration 2,9 ± 0,5 h
(tmax):
Fläche unter der
Konzentrations-Zeit- 455,2 ± 128,9 ^g/mlxh
Kurve
(AUC):
Angabe der Werte als Mittelwert und Streubreite
Mittlere Serumspiegelverläufe in einem Konzentrations-Zeit-Diagramm:
5.3 Präklinische Daten zur Sicherheit
In Untersuchungen zur chronischen Toxizität wurden nach hohen oralen Dosen (250 mg/kg bei Ratten; 90 mg/kg bei Hunden) Atrophie der Hoden, Degeneration des Ductus deferens und eine insuffiziente Spermatogenese sowie Lungen- und Prostataveränderungen festgestellt.
Mutagenitätstests an Bakterien sowie an Ratten und Mäusen ergaben keine Hinweise auf ein mutagenes Potential.
Langzeituntersuchungen wurden an Ratten und Mäusen durchgeführt. Bei sehr hohen Dosierungen wurden vermehrt subkutane Fibrosarkome bei männlichen Ratten beobachtet. Valproinsäure erwies sich in Tierstudien als teratogen.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Calciumbehenat, Mikrokristalline Cellulose, Gelatine, Macrogol 6000, Methacrylsäure-Ethylacrylat-Copolymer (1:1) (Ph.Eur.), Natriumdodecylsulfat, Polysorbat 80, Siliciumdioxid (methyliert), Talkum, Triacetin, Titandioxid (E 171).
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit 5 Jahre.
Diese Arzneimittel sollen nach Ablauf des Verfalldatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Dose fest verschlossen halten, um den Inhalt vor Feuchtigkeit zu schützen.
6.5 Art und Inhalt des Behältnisses Orfiril 150
Glasbehältnis mit einem Stopfen aus Polyethylen Polyethylen-Behältnis mit Schraubdeckel aus Polypropylen 50 magensaftresistente Dragees 100 magensaftresistente Dragees 200 magensaftresistente Dragees Klinikpackung 1000 (10x100)
Orfiril 300
Glasbehältnis mit einem Stopfen aus Polyethylen Polypropylen-Behältnis mit Stopfen aus Polyethylen Polyethylen-Behältnis mit Schraubdeckel aus Polypropylen 50 magensaftresistente Dragees 100 magensaftresistente Dragees 200 magensaftresistente Dragees Klinikpackung 500 (10x50)
Orfiril 600
Polypropylen-Behältnis mit Stopfen aus Polyethylen Polyethylen-Behältnis mit Schraubdeckel aus Polypropylen 50 magensaftresistente Dragees 100 magensaftresistente Dragees 200 magensaftresistente Dragees Klinikpackung 500 (10x50)
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
DESITIN ARZNEIMITTEL GMBH Weg beim Jäger 214 22335 Hamburg Telefon: (040) 5 91 01-525 Telefax: (040) 5 91 01-377
8. ZULASSUNGSNUMMER(N)
Orfiril 150 1691.02.00 Orfiril 300 1691.01.00 Orfiril 600 1691.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung:
Orfiril 150 19.03.1982 Orfiril 300 19.03.1982 Orfiril 600 20.05.1981
Datum der letzten Verlängerung der Zulassung: Orfiril 150 20.11.2003 Orfiril 300 20.11.2003 Orfiril 600 20.11.2003
10. STAND DER INFORMATION
{MM.JJJJ}
11. VERKAUFSABGRENZUNG Verschreibungspflichtig
21
Hinweise:
Für Kinder bis zu 3 Jahren sollten vorzugsweise die zur Verfügung stehenden Darreichungsformen mit niedrigerem Wirkstoffgehalt (z.B. Lösung bzw. "Saft") verwendet werden.
Für Kinder bis zu 6 Jahren eignen sich besonders die zur Verfügung stehenden Darreichungsformen mit niedrigerem Wirkstoffgehalt (z.B. Orfiril Saft oder Dragees zu 150 mg).