Pemetrexed Zentiva 100 Mg Pulver Für Ein Konzentrat Zur Herstellung Einer Infusionslösung
Pemetrexed Zentiva®
FACHINFORMATION
1. BEZEICHNUNG DER ARZNEIMITTEL
Pemetrexed Zentiva 100 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung Pemetrexed Zentiva 500 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung Pemetrexed Zentiva 1000 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Jede Durchstechflasche enthält 100 mg, 500 mg oder 1000 mg Pemetrexed (als Pemetrexed-Dinatrium 2,5 H2O).
Nach Auflösung (siehe Abschnitt 6.6) enthält jede Durchstechflasche 25 mg/ml Pemetrexed. Sonstige Bestandteile mit bekannter Wirkung:
Jede 100-mg-Durchstechflasche enthält ca. 11 mg Natrium (< 1 mmol).
Jede 500-mg-Durchstechflasche enthält ca. 54 mg Natrium (2,35 mmol).
Jede 1000-mg-Durchstechflasche enthält ca. 108 mg Natrium (4,70 mmol).
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver für ein Konzentrat zur Herstellung einer Infusionslösung. Weißes bis leicht gelbliches Pulver.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Malignes Pleuramesotheliom
Pemetrexed Zentiva in Kombination mit Cisplatin ist angezeigt zur Behandlung von chemonaiven Patienten mit inoperablem malignem Pleuramesotheliom.
Nicht kleinzelliges Lungenkarzinom
Pemetrexed Zentiva ist in Kombination mit Cisplatin angezeigt zur First-Line-Therapie von Patienten mit lokal fortgeschrittenem oder metastasiertem nicht kleinzelligen Lungenkarzinom außer bei überwiegender plattenepithelialer Histologie (siehe Abschnitt 5.1).
Pemetrexed Zentiva in Monotherapie ist angezeigt für die Erhaltungstherapie bei lokal fortgeschrittenem oder metastasiertem nicht kleinzelligen Lungenkarzinom außer bei überwiegender plattenepithelialer Histologie bei Patienten, deren Erkrankung nach einer platinbasierten Chemotherapie nicht unmittelbar fortgeschritten ist (siehe Abschnitt 5.1).
Pemetrexed Zentiva in Monotherapie ist angezeigt zur Behandlung in Zweitlinientherapie von Patienten mit lokal fortgeschrittenem oder metastasiertem nicht kleinzelligen Lungenkarzinom außer bei überwiegender plattenepithelialer Histologie (siehe Abschnitt 5.1).
4.2 Dosierung und Art der Anwendung
Dosierung
Pemetrexed Zentiva darf nur unter der Aufsicht von Ärzten mit Erfahrung in der Anwendung von antineoplastischen Arzneimitteln angewendet werden.
Pemetrexed Zentiva in Kombination mit Cisplatin
Die empfohlene Dosis von Pemetrexed Zentiva beträgt 500 mg/m2 Körperoberfläche (KOF), verabreicht als intravenöse Infusion über einen Zeitraum von 10 Minuten am ersten Tag jedes 21-tägigen Behandlungszyklus. Die empfohlene Dosis von Cisplatin beträgt 75 mg/m2 KOF als Infusion über einen Zeitraum von 2 Stunden etwa 30 Minuten nach Abschluss der Pemetrexed-Infusion am ersten Tag jedes 21-tägigen Behandlungszyklus. Die Patienten müssen vor und/oder nach der Cisplatin-Gabe eine angemessene antiemetische Behandlung sowie ausreichend Flüssigkeit erhalten (siehe Cisplatin-Fachinformation für spezielle Dosierungshinweise).
Pemetrexed Zentiva in Monotherapie
Bei Patienten mit nicht kleinzelligem Lungenkarzinom nach vorangegangener Chemotherapie beträgt die empfohlene Dosis von Pemetrexed Zentiva 500 mg/m2 KOF, verabreicht als intravenöse Infusion über einen Zeitraum von 10 Minuten am ersten Tag jedes 21-tägigen Behandlungszyklus.
Prämedikation
Zur Reduktion der Häufigkeit und Schwere von Hautreaktionen muss am Tag vor und am Tag der Pemetrexed-Gabe sowie am Tag nach der Behandlung ein Kortikosteroid gegeben werden. Das Kortikosteroid muss einer zweimal täglichen oralen Gabe von 4 mg Dexamethason entsprechen (siehe Abschnitt 4.4).
Patienten, die mit Pemetrexed behandelt werden, müssen zur Reduktion der Toxizität zusätzlich Vitamine erhalten (siehe Abschnitt 4.4). Patienten müssen täglich orale Gaben von Folsäure oder Multivitamine mit Folsäure (350 bis 1000 Mikrogramm) erhalten. Während der sieben Tage vor der ersten Dosis Pemetrexed müssen mindestens 5 Dosen Folsäure eingenommen werden und die Einnahme muss während der gesamten Therapiedauer sowie für weitere 21 Tage nach der letzten Pemetrexed-Dosis fortgesetzt werden. Patienten müssen ebenfalls eine intramuskuläre Injektion Vitamin B12 (1000 Mikrogramm) in der Woche vor der ersten Pemetrexed-Dosis erhalten sowie nach jedem dritten Behandlungszyklus. Die weiteren Vitamin-Bi2-Injektionen können am selben Tag wie Pemetrexed gegeben werden.
Überwachung
Bei Patienten, die Pemetrexed erhalten, sollte vor jeder Gabe ein vollständiges Blutbild erstellt werden, einschließlich einer Differenzierung der Leukozyten und einer Thrombozytenzählung. Vor jeder Chemotherapie müssen Blutuntersuchungen zur Überprüfung der Nieren- und Leberfunktion erfolgen. Vor dem Beginn jedes Zyklus müssen die Patienten mindestens die folgenden Werte aufweisen: absolute Neutrophilenzahl > 1.500 Zellen/mm3, Thrombozytenzahl > 100.000 Zellen/mm3. Die Kreatinin-Clearance muss > 45 ml/min betragen.
Das Gesamtbilirubin sollte < 1,5-Fache des oberen Grenzwertes betragen. Die alkalische Phosphatase (AP), Aspartat-Aminotransferase (AST oder SGOT) und Alanin-Aminotransferase (ALT oder SGPT) sollte < 3-Fache des oberen Grenzwertes betragen. Für die alkalische Phosphatase, AST und ALT sind bei Vorliegen von Lebermetastasen Werte < 5-Fache des oberen Grenzwertes akzeptabel.
Dosisanpassungen
Am Beginn eines neuen Behandlungszyklus muss eine Dosisüberprüfung stattfinden unter Berücksichtigung des Nadirs des Blutbildes oder der maximalen nicht hämatologischen Toxizität der vorhergehenden Therapiezyklen. Möglicherweise muss die Behandlung verschoben werden, um genügend Zeit zur Erholung zu gestatten. Nach der Erholung müssen die Patienten entsprechend den Hinweisen in den Tabellen 1, 2 und 3 weiterbehandelt werden, die für Pemetrexed Zentiva als Monotherapie oder in Kombination mit Cisplatin anzuwenden sind.
|
Tabelle 1 - Dosisanpassung für Pemetrexed (als Monotherapie oder in Kombination) und Cisplatin - Hämatologische Toxizität | |
|
Nadir absolute Neutrophilenzahl < 500/mm3 und Nadir Thrombozyten > 50.000/mm3 |
75 % der vorigen Dosis (sowohl Pemetrexed als auch Cisplatin) |
|
Nadir Thrombozyten < 50.000/mm3 unabhängig vom Nadir der absoluten Neutrophilenzahl |
75 % der vorigen Dosis (sowohl Pemetrexed als auch Cisplatin) |
|
Nadir Thrombozyten < 50.000/mm3 mit Blutunga unabhängig vom Nadir der absoluten Neutrophilenzahl |
50 % der vorigen Dosis (sowohl Pemetrexed als auch Cisplatin) |
aDiese Kriterien entsprechen der Definition der National Cancer Institute Common Toxicity Criteria (CTC v2.0; NCI 1998) > CTC Grad-2-Blutung.
Sollten Patienten nicht hämatologische Toxizität > Grad 3 entwickeln (ausgenommen Neurotoxizität), muss die Therapie mit Pemetrexed unterbrochen werden, bis der Patient den Wert vor der Behandlung oder darunter erreicht hat. Die Behandlung sollte dann entsprechend den Richtlinien in Tabelle 2 fortgesetzt werden.
|
Tabelle 2 - Dosisanpassung für Pemetrexed (als Monotherapie oder in Kombination) und Cisplatin - Nicht hämatologische Toxizität3’ b | ||
|
Pemetrexed-Dosis (mg/m2) |
Cisplatin-Dosis (mg/m2) | |
|
Jede Toxizität Grad 3 oder 4 außer Mukositis |
75 % der vorigen Dosis |
75 % der vorigen Dosis |
|
Jede Diarrhö, die eine Hospitalisierung erfordert (unabhängig vom Grad) oder Diarrhö Grad 3 oder 4 |
75 % der vorigen Dosis |
75 % der vorigen Dosis |
|
Grad 3 oder 4 Mukositis |
50 % der vorigen Dosis |
100 % der vorigen Dosis |
aNational Cancer Institute Common Toxicity Criteria (CTC v2.0; NCI 1998). bAusgenommen Neurotoxizität.
Falls eine Neurotoxizität auftritt, muss die Dosis von Pemetrexed und Cisplatin gemäß Tabelle 3 angepasst werden. Die Behandlung ist beim Auftreten von Neurotoxizität Grad 3 oder 4 abzubrechen.
|
Tabelle 3 - Dosisanpassung für Pemetrexed (als Monotherapie oder in Kombination) und Cisplatin - Neurotoxizität | ||
|
CTC3 Grad |
Pemetrexed-Dosis (mg/m2) |
Cisplatin-Dosis (mg/m2) |
|
0-1 |
100 % der vorigen Dosis |
100 % der vorigen Dosis |
|
2 |
100 % der vorigen Dosis |
50 % der vorigen Dosis |
aNational Cancer Institute Common Toxicity Criteria (CTC v2.0; NCI 1998).
Die Behandlung mit Pemetrexed muss abgebrochen werden, wenn bei Patienten nach 2 Dosisreduktionen eine hämatologische Toxizität oder nicht hämatologische Toxizität Grad 3 oder 4 auftritt oder sofort beim Auftreten von Grad 3 oder 4 Neurotoxizität.
Besondere Patientengruppen
Ältere Patienten
Klinische Studien ergaben keinen Hinweis, dass bei Patienten im Alter von 65 Jahren oder darüber im Vergleich zu Patienten im Alter unter 65 Jahren ein erhöhtes Nebenwirkungsrisiko besteht. Es sind keine Dosisreduktionen erforderlich, welche über die für alle Patienten empfohlenen hinausgehen.
Kinder und Jugendliche
Es gibt keinen relevanten Einsatz von Pemetrexed Zentiva in der Behandlung von Kindern und
Jugendlichen mit malignem Pleuramesotheliom und nicht kleinzelligem Lungenkarzinom.
Patienten mit Nierenfunktionseinschränkung
(Standardformel nach Cockcroft und Gault oder glomeruläre Filtrationsrate gemessen mit der Tc99m-DTPA-Serumclearance-Methode): Pemetrexed wird hauptsächlich unverändert durch renale Exkretion eliminiert. In klinischen Studien waren bei Patienten mit einer Kreatinin-Clearance von > 45 ml/min keine Dosisanpassungen notwendig, die über die für alle Patienten empfohlenen Dosisanpassungen hinausgehen. Die Datenlage bei Patienten mit einer Kreatinin-Clearance von unter 45 ml/min war nicht ausreichend; daher wird die Anwendung nicht empfohlen (siehe Abschnitt 4.4).
Patienten mit Leberfunktionseinschränkung:
Es wurde kein Zusammenhang zwischen AST (SGOT), ALT (SGPT) oder Gesamtbilirubin und der Pharmakokinetik von Pemetrexed beobachtet. Allerdings wurden Patienten mit einer Leberfunktionseinschränkung von > dem 1,5-Fachen des oberen Bilirubin-Grenzwertes und/oder Aminotransferase-Werten von > dem 3,0-Fachen des oberen Grenzwertes (bei Abwesenheit von Lebermetastasen) oder > 5,0-Fachen des oberen Grenzwertes (bei Vorhandensein von Lebermetastasen) nicht speziell in den Studien untersucht.
Art der Anwendung
Vorsichtsmaßnahmen bei der Handhabung/vor der Anwendung von Pemetrexed Zentiva siehe Abschnitt 6.6.
Pemetrexed Zentiva ist als intravenöse Infusion über 10 min an Tag 1 des 21-tägigen Zyklus zu geben. Hinweise zur Rekonstitution und Verdünnung des Arzneimittels vor der Anwendung siehe Abschnitt 6.6.
4.3 Gegenanzeigen
- Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen
Bestandteile.
- Stillen (siehe Abschnitt 4.6).
- Gleichzeitige Gelbfieberimpfung (siehe Abschnitt 4.5).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Pemetrexed kann die Knochenmarkfunktion unterdrücken; dies manifestiert sich als Neutropenie, Thrombozytopenie und Anämie (oder Panzytopenie) (siehe Abschnitt 4.8). Die Knochenmarksuppression ist üblicherweise die dosislimitierende Toxizität. Patienten müssen im Hinblick auf die Knochenmarksuppression überwacht werden und Pemetrexed darf nicht an Patienten verabreicht werden, bevor deren absolute Neutrophilenzahl wieder einen Wert von > 1.500 Zellen/mm3 und die Thrombozytenzahl wieder einen Wert von > 100.000 Zellen/mm3 erreicht hat. Eine Dosisreduktion für weitere Zyklen basiert auf dem Nadir der absoluten Neutrophilenzahl, Thrombozytenzahl und maximaler nicht hämatologischer Toxizität, wie sie in den vorangegangenen Behandlungszyklen beobachtet wurden (siehe Abschnitt 4.2).
Eine geringere Toxizität und eine Reduktion der Grad-3/4-hämatologischen und -nicht-hämatologischen Toxizität wie Neutropenie, febrile Neutropenie und Infektion mit Grad-3/4-Neutropenie wurden beobachtet, wenn eine Vorbehandlung mit Folsäure und Vitamin BJ2 stattgefunden hatte. Daher müssen alle mit Pemetrexed behandelten Patienten angewiesen werden, Folsäure und Vitamin B12 als prophylaktische Maßnahme zur Reduktion behandlungsbedingter Toxizität anzuwenden (siehe Abschnitt 4.2).
Bei Patienten, die nicht mit Kortikosterioden vorbehandelt wurden, wurden Hautreaktionen berichtet. Eine Vorbehandlung mit Dexamethason (oder Äquivalent) kann die Häufigkeit und Schwere von Hautreaktionen verringern (siehe Abschnitt 4.2).
Patienten mit einer Kreatinin-Clearance von unter 45 ml/min wurden nicht in ausreichender Anzahl untersucht. Bei Patienten mit einer Kreatinin-Clearance von < 45 ml/min wird die Anwendung nicht empfohlen (siehe Abschnitt 4.2).
Patienten mit leichter bis mittlerer Niereninsuffizienz (Kreatinin-Clearance 45 bis 79 ml/min) müssen die gleichzeitige Einnahme nicht steroidaler Antiphlogistika (NSAID) wie Ibuprofen und Acetylsalicylsäure (> 1,3 g täglich) für mindestens 2 Tage vor der Therapie, am Tag der Therapie und mindestens 2 Tage nach der Therapie mit Pemetrexed vermeiden (siehe Abschnitt 4.5).
Bei Patienten mit leichter bis mittelschwerer Niereninsuffizienz, für die eine Therapie mit Pemetrexed vorgesehen ist, sollte die Einnahme von NSAID mit langer Halbwertszeit für mindestens 5 Tage vor der Therapie, am Tag der Therapie und mindestens 2 Tage nach der Therapie mit Pemetrexed unterbrochen werden (siehe Abschnitt 4.5).
Über schwerwiegende renale Ereignisse, einschließlich akuten Nierenversagens, wurde bei Pemetrexed-Monotherapie oder in Kombination mit anderen Chemotherapeutika berichtet. Viele Patienten, bei denen diese Ereignisse auftraten, hatten entsprechende Risikofaktoren für das Auftreten von renalen Ereignissen, einschließlich Dehydratation, vorbestehenden Bluthochdrucks oder Diabetes.
Die Wirkung von Flüssigkeit im transzellulären Raum, wie z. B. Pleuraerguss oder Ascites, auf Pemetrexed ist nicht vollständig bekannt. Eine Phase-2-Studie mit Pemetrexed mit 31 Patienten mit soliden Tumoren und gleichbleibender Flüssigkeitsansammlung im transzellulären Raum zeigte keinen Unterschied der Pemetrexed-Dosis, der normalisierten Plasmakonzentration oder der Clearance verglichen mit Patienten ohne Flüssigkeitsansammlung im transzellulären Raum. Daher soll bei Flüssigkeitsansammlung im transzellulären Raum eine Drainage des Ergusses vor der Pemetrexed-Behandlung in Betracht gezogen werden, diese ist aber nicht unbedingt notwendig.
Aufgrund der gastrointestinalen Toxizität von Pemetrexed in Kombination mit Cisplatin wurden schwere Dehydratationen beobachtet. Daher müssen Patienten eine ausreichende antiemetische Behandlung und angemessene Flüssigkeitszufuhr vor und/oder nach der Behandlung erhalten.
Schwerwiegende kardiovaskuläre Ereignisse, einschließlich Myokardinfarkt, und zerebrovaskuläre Ereignisse wurden in klinischen Studien mit Pemetrexed gelegentlich berichtet, wenn dieser Wirkstoff üblicherweise in Kombination mit einem anderen zytotoxischen Wirkstoff verabreicht wurde. Die meisten Patienten, bei denen diese Ereignisse beobachtet wurden, hatten vorbestehende kardiovaskuläre Risikofaktoren (siehe Abschnitt 4.8).
Ein immunsupprimierter Status ist bei Krebspatienten häufig. Aus diesem Grund wird die gleichzeitige Anwendung attenuierter Lebendimpfstoffe nicht empfohlen (siehe Abschnitte 4.3 und 4.5).
Pemetrexed kann das Erbgut schädigen. Geschlechtsreife Männer müssen angewiesen werden, während der Behandlung und bis zu 6 Monate danach kein Kind zu zeugen. Es werden wirksame kontrazeptive Maßnahmen oder Enthaltsamkeit empfohlen. Da die Möglichkeit einer irreversiblen Schädigung der Fortpflanzungsfähigkeit durch Pemetrexed besteht, sollten Männer vor dem Behandlungsbeginn darauf hingewiesen werden, Beratung hinsichtlich der Spermakonservierung einzuholen.
Frauen im gebärfähigen Alter müssen während der Behandlung mit Pemetrexed wirksame Methoden der Kontrazeption anwenden (siehe Abschnitt 4.6).
Es wurden Fälle von Strahlenpneumonitis bei Patienten berichtet, die vor, während oder nach ihrer Pemetrexed-Therapie bestrahlt wurden. Diesen Patienten sollte besondere Aufmerksamkeit gelten und die Verabreichung von radiosensibilisierenden Substanzen sollte mit Vorsicht erfolgen.
Bei Patienten, die Wochen oder Jahre zuvor eine Strahlentherapie erhalten hatten, wurden Fälle von sog. „Radiation Recall" berichtet.
Pemetrexed Zentiva 100 mg enthält ca. 11 mg (< 1 mmol) Natrium pro Durchstechflasche, d. h., es ist nahezu „natriumfrei“.
Pemetrexed Zentiva 500 mg enthält ca. 54 mg (2,35 mmol) Natrium pro Durchstechflasche. Dies ist zu berücksichtigen bei Personen unter Natriumkontrollierter (natriumarmer/ kochsalzarmer) Diät. Pemetrexed Zentiva 1000 mg enthält ca. 108 mg (4,70 mmol) Natrium pro Durchstechflasche. Dies ist zu berücksichtigen bei Personen unter Natrium kontrollierter (natriumarmer/ kochsalzarmer) Diät.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Pemetrexed wird hauptsächlich unverändert renal durch glomeruläre Filtration und in geringerem Ausmaß durch tubuläre Sekretion ausgeschieden. Eine gleichzeitige Anwendung nephrotoxischer Arzneimittel (z. B. Aminoglykoside, Schleifendiuretika, platinhaltige Arzneimittel, Cyclosporin) könnte zu einer verzögerten Ausscheidung von Pemetrexed führen. Diese Kombination sollte mit Vorsicht angewendet werden. Sofern notwendig, sollte die Kreatinin-Clearance eng überwacht werden.
Die gleichzeitige Anwendung von Substanzen, die ebenfalls tubulär sezerniert werden (z. B. Probenecid, Penicillin), kann möglicherweise zu einer verzögerten Ausscheidung von Pemetrexed führen. Wenn diese Arzneimittel mit Pemetrexed kombiniert werden, sollte dies mit Vorsicht geschehen. Falls notwendig, muss die Kreatinin-Clearance eng überwacht werden.
Bei Patienten mit normaler Nierenfunktion (Kreatinin-Clearance > 80 ml/min) können hohe Dosen nicht steroidaler Antiphlogistika (NSAID, wie Ibuprofen > 1.600 mg/Tag) und Acetylsalicylsäure in hoher Dosis (> 1,3 g täglich) zu einer verringerten Pemetrexed-Ausscheidung mit der Folge eines vermehrten Auftretens von Nebenwirkungen führen. Daher ist Vorsicht geboten, wenn bei Patienten mit normaler Nierenfunktion (Kreatinin-Clearance > 80 ml/min) hohe Dosen von NSAID oder Acetylsalicylsäure in hoher Dosis angewendet werden.
Bei Patienten mit leichter bis mittlerer Niereninsuffizienz (Kreatinin-Clearance 45 bis 79 ml/min) muss die gleichzeitige Anwendung von Pemetrexed und NSAID (z. B. Ibuprofen) oder Acetylsalicylsäure in hoher Dosis für mindestens 2 Tage vor der Therapie, am Tag der Therapie und mindestens 2 Tage nach der Therapie mit Pemetrexed vermieden werden (siehe Abschnitt 4.4).
Da keine Daten hinsichtlich des Interaktionspotenzials mit NSAID mit langer Halbwertszeit wie Piroxicam oder Rofecoxib vorliegen, sollte die gleichzeitige Anwendung mit Pemetrexed bei Patienten mit leichter bis mittelschwerer Niereninsuffizienz für mindestens 5 Tage vor der Therapie, am Tag der Therapie und mindestens 2 Tage nach der Therapie mit Pemetrexed unterbrochen werden (siehe Abschnitt 4.4). Bei gleichzeitiger Anwendung von NSAID ist es notwendig, die Patienten genau zu überwachen, ob Toxizitäten auftreten, insbesondere Knochenmarkdepression und gastrointestinale Toxizität.
Pemetrexed wird nur gering hepatisch metabolisiert. Ergebnisse aus In-vitro-Studien mit humanen Lebermikrosomen deuten darauf hin, dass keine klinisch signifikante Inhibition der metabolischen Clearance von Arzneimitteln zu erwarten ist, die von den Cytochromen CYP3A, CYP2D6, CYP2C9 und CYP1A2 metabolisiert werden.
Wechselwirkungen, die alle Zytostatika betreffen
Aufgrund eines erhöhten Thromboserisikos bei Krebspatienten werden häufig Antikoagulanzien angewendet. Die große intraindividuelle Variabilität des Gerinnungsstatus während der Krankheit und die Möglichkeit von Wechselwirkungen zwischen oralen Antikoagulanzien und antineoplastischer Chemotherapie erfordern eine erhöhte Überwachungsfrequenz der INR (International Normalised Ratio), wenn die Entscheidung getroffen wurde, den Patienten mit oralen Antikoagulanzien zu behandeln.
Gleichzeitige Anwendung kontraindiziert: Gelbfieberimpfstoff: Gefahr einer tödlichen generalisierten
Impferkrankung (siehe Abschnitt 4.3).
Gleichzeitige Anwendung nicht empfohlen: attenuierte Lebendimpfstoffe (ausgenommen Gelbfieber, diese ist kontraindiziert): Gefahr einer systemischen, möglicherweise tödlichen, Erkrankung. Das Risiko ist bei Patienten mit einer bereits bestehenden Immunsuppression aufgrund der zugrundeliegenden Krankheit erhöht. Verwenden Sie einen inaktivierten Impfstoff, sofern verfügbar (Poliomyelitis) (siehe Abschnitt 4.4).
4.6 Fertilität, Schwangerschaft und Stillzeit
Verhütung bei Männern und Frauen
Frauen im gebärfähigen Alter müssen während der Behandlung mit Pemetrexed eine zuverlässige Verhütungsmethode anwenden. Pemetrexed kann das Erbgut schädigen. Geschlechtsreife Männer müssen angewiesen werden, während der Behandlung und bis zu 6 Monate danach kein Kind zu zeugen. Es werden wirksame kontrazeptive Maßnahmen oder Enthaltsamkeit empfohlen.
Schwangerschaft
Es liegen keine Daten für die Verwendung von Pemetrexed bei Schwangeren vor, aber wie bei anderen Antimetaboliten werden bei einer Anwendung in der Schwangerschaft schwere Geburtsdefekte erwartet. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). Pemetrexed darf nicht während der Schwangerschaft angewendet werden, außer wenn unbedingt erforderlich und nach sorgfältiger Abwägung des Nutzens für die Mutter und des Risikos für den Fötus (siehe Abschnitt 4.4).
Stillzeit
Es ist nicht bekannt, ob Pemetrexed in die Muttermilch übergeht und unerwünschte Wirkungen beim gestillten Säugling können nicht ausgeschlossen werden. Daher darf eine Mutter während der Behandlung mit Pemetrexed nicht stillen (siehe Abschnitt 4.3).
Fertilität
Da die Möglichkeit einer irreversiblen Schädigung der Fortpflanzungsfähigkeit durch Pemetrexed besteht, sollten Männer vor dem Behandlungsbeginn darauf hingewiesen werden, Beratung hinsichtlich der Spermakonservierung einzuholen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt. Allerdings wurde berichtet, dass Pemetrexed Müdigkeit verursachen kann. Daher müssen Patienten vor der aktiven Teilnahme am Verkehr oder dem Bedienen von Maschinen gewarnt werden, wenn diese Wirkung auftritt.
4.8 Nebenwirkungen
Zusammenfassung des Nebenwirkungsprofils
Die am häufigsten berichteten unerwünschten Ereignisse, die im Zusammenhang mit Pemetrexed standen, entweder in der Mono- oder in der Kombinationstherapie angewendet, sind Knochenmarksuppressionbedingte Anämie, Neutropenie, Leukopenie, Thrombozytopenie und gastrointestinale Toxizitäten, die als Anorexie, Übelkeit, Erbrechen, Diarrhö, Obstipation, Pharyngitis, Mukositis und Stomatitis in Erscheinung treten. Andere Nebenwirkungen sind Nierentoxizitäten, erhöhte Aminotransferasen, Alopezie, Müdigkeit, Dehydratation, Rash (Hautrötung), Infektion/Sepsis und Neuropathie. Selten aufgetretene Ereignisse sind das Stevens-Johnson-Syndrom und die toxische epidermale Nekrolyse.
Tabellarisch aufgeführte unerwünschte Reaktionen
Die folgende Tabelle zeigt die Häufigkeit und Schwere unerwünschter Wirkungen, die in > 5 % von 168 Patienten mit Mesotheliom berichtet wurden und die randomisiert Cisplatin und Pemetrexed erhielten sowie 163 Patienten mit Mesotheliom, die randomisiert Cisplatin als Monotherapie erhielten.
Diese chemonaiven Patienten erhielten in beiden Behandlungsarmen zusätzliche tägliche Gaben von Folsäure und Vitamin B12.
Nebenwirkungen
Häufigkeitsangaben: sehr häufig (> 1/10), häufig (> 1/100, < 1/10), gelegentlich (> 1/1.000, < 1/100), selten (> 1/10.000, < 1/1.000), sehr selten (< 1/10.000) und nicht bekannt (auf Grundlage der verfügbaren Daten von Spontanberichten nicht abschätzbar).
Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
|
Systemorgan klasse |
Häufigkeit |
Ereignis* |
Pemetrexed/Cisplatin |
Cisplatin | ||
|
(N = 168) |
(N = 163) | |||||
|
Toxizität alle Grade (%) |
Grad 3-4 Toxizität (%) |
Toxizität alle Grade (%) |
Grad 3-4 Toxizität (%) | |||
|
Erkrankungen des Blutes und des Lymphsystems |
Sehr häufig |
Neutrophile/ Granulozyten erniedrigt |
56,0 |
23,2 |
13,5 |
3,1 |
|
Leukozyten erniedrigt |
53,0 |
14,9 |
16,6 |
0,6 | ||
|
Hämoglobin erniedrigt |
26,2 |
4,2 |
10,4 |
0,0 | ||
|
Thrombozyten erniedrigt |
23,2 |
5,4 |
8,6 |
0,0 | ||
|
Stoffwechsel-und Ernährungsstörungen |
Häufig |
Dehydratation |
6,5 |
4,2 |
0,6 |
0,6 |
|
Erkrankungen des Nervensystems |
Sehr häufig |
Sensorische Neuropathie |
10,1 |
0,0 |
9,8 |
0,6 |
|
Häufig |
Geschmacks störung |
7,7 |
0,0*** |
6,1 |
0,0*** | |
|
Augen erkrankungen |
Häufig |
Konjunktivitis |
5,4 |
0,0 |
0,6 |
0,0 |
|
Erkrankungen des Gastrointestinaltrakts |
Sehr häufig |
Diarrhö |
16,7 |
3,6 |
8,0 |
0,0 |
|
Erbrechen |
56,5 |
10,7 |
49,7 |
4,3 | ||
|
Stomatitis/ Pharyngitis |
23,2 |
3,0 |
6,1 |
0,0 | ||
|
Übelkeit |
82,1 |
11,9 |
76,7 |
5,5 | ||
|
Appetitverlust |
20,2 |
1,2 |
14,1 |
0,6 | ||
|
Obstipation |
11,9 |
0,6 |
7,4 |
0,6 | ||
|
Häufig |
Dyspepsie |
5,4 |
0,6 |
0,6 |
0,0 | |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Sehr häufig |
Hautrötung |
16,1 |
0,6 |
4,9 |
0,0 |
|
Haarausfall |
11,3 |
0,0*** |
5,5 |
0,0*** | ||
|
Erkrankungen der Nieren und Harnwege |
Sehr häufig |
Kreatinin erhöht |
10,7 |
0,6 |
9,8 |
1,2 |
|
Kreatinin- Clearance ** erniedrigt |
16,1 |
0,6 |
17,8 |
1,8 | ||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Sehr häufig |
Müdigkeit |
47,6 |
10,1 |
42,3 |
9,2 |
*Bezug auf National Cancer Institute CTC Version 2 für jeden Toxizitätsgrad ausgenommen das Ereignis „Kreatinin-Clearance erniedrigt“. welches abgeleitet wurde vom Begriff „Nieren/Genitaltrakt andere“.
Bezogen auf National Cancer Institute CTC (v2.0; NCI 1998) sollen Geschmacksstörung und Haarausfall nur als Grad 1 oder 2 berichtet werden.
Für diese Tabelle wurde eine Schwelle von 5 % festgelegt bezüglich der Aufnahme aller Ereignisse, bei denen der berichtende Arzt einen Zusammenhang mit Pemetrexed und Cisplatin für möglich hielt.
Klinisch relevante CTC-Toxizitäten, die bei > 1 % und < 5 % der Patienten berichtet wurden, die randomisiert Cisplatin und Pemetrexed erhielten, umfassten: Nierenversagen, Infektion, Fieber, febrile Neutropenie, erhöhte AST (SGOT), ALT (SGPT) und Gamma-GT, Nesselsucht und Brustschmerzen.
Klinisch relevante CTC-Toxizitäten, die bei < 1 % der Patienten berichtet wurden, die randomisiert Cisplatin und Pemetrexed erhielten, umfassten Arrhythmie und motorische Neuropathie.
Die folgende Tabelle zeigt die Häufigkeit und Schwere unerwünschter Wirkungen, die bei > 5 % von 265 Patienten berichtet wurden, die randomisiert Pemetrexed als Monotherapie mit Gaben von Folsäure und Vitamin B12 erhielten, sowie 276 Patienten, die randomisiert Docetaxel als Monotherapie erhielten. Alle Patienten litten an lokal fortgeschrittenem oder metastasiertem nicht kleinzelligen Lungenkarzinom und waren chemotherapeutisch vorbehandelt.
|
Systemorgan klasse |
Häufigkeit |
Ereignis* |
Pemetrexed |
Docetaxel | ||
|
N = 265 |
N = 276 | |||||
|
Toxizität alle Grade (%) |
Grad 3-4 Toxizität (%) |
Toxizität alle Grade (%) |
Grad 3-4 Toxizität (%) | |||
|
Erkrankungen des Blutes und des Lymphsystems |
Sehr häufig |
Neutrophile/ Granulozyten erniedrigt |
10,9 |
5,3 |
45,3 |
40,2 |
|
Leukozyten erniedrigt |
12,1 |
4,2 |
34,1 |
27,2 | ||
|
Hämoglobin erniedrigt |
19,2 |
4,2 |
22,1 |
4,3 | ||
|
Häufig |
Thrombozyten erniedrigt |
8,3 |
1,9 |
1,1 |
0,4 | |
|
Erkrankungen des Gastrointestinaltrakts |
Sehr häufig |
Diarrhö |
12,8 |
0,4 |
24,3 |
2,5 |
|
Erbrechen |
16,2 |
1,5 |
12,0 |
1,1 | ||
|
Stomatitis/ Pharyngitis |
14,7 |
1,1 |
17,4 |
1,1 | ||
|
Übelkeit |
30,9 |
2,6 |
16,7 |
1,8 | ||
|
Appetitverlust |
21,9 |
1,9 |
23,9 |
2,5 | ||
|
Häufig |
Obstipation |
5,7 |
0,0 |
4,0 |
0,0 | |
|
Leber- und Gallenerkrankungen |
Häufig |
ALT-(SGPT-) Erhöhung |
7,9 |
1,9 |
1,4 |
0,0 |
|
AST-(SGOT-) Erhöhung |
6,8 |
1,1 |
0,7 |
0,0 | ||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Sehr häufig |
Hautrötung/ Abschuppung |
14,0 |
0,0 |
6,2 |
0,0 |
|
Häufig |
Juckreiz |
6,8 |
0,4 |
18 |
0,0 | |
|
Haarausfall |
6,4 |
0,4** |
37,7 | |||
|
Allgemeine Erkrankungen und |
Sehr häufig |
Müdigkeit |
34,0 |
5,3 |
35,9 |
5,4 |
Beschwerden am V erabreichungsort
|
Häufig |
Fieber | ||||
|
8,3 |
0,0 |
7,6 |
0,0 |
Bezug auf National Cancer Institute CTC Version 2 für jeden Toxizitätsgrad.
Bezogen auf National Cancer Institute CTC (v2.0; NCI 1998) soll Haarausfall nur als Grad 1 oder 2 berichtet werden.
Für diese Tabelle wurde eine Schwelle von 5 % festgelegt bezüglich der Aufnahme aller Ereignisse, bei denen der berichtende Arzt einen Zusammenhang mit Pemetrexed für möglich hielt.
Klinisch relevante CTC-Toxizitäten, die bei > 1 % und < 5 % der Patienten berichtet wurden, die randomisiert Pemetrexed erhielten, umfassten: Infektion ohne Neutropenie, febrile Neutropenie, allergische Reaktionen/Überempfindlichkeitsreaktionen, erhöhte Kreatininwerte, motorische Neuropathie, sensorische Neuropathie, multiformes Erythem und Bauchschmerzen.
Klinisch relevante CTC-Toxizitäten, die bei < 1 % der Patienten berichtet wurden, die randomisiert Pemetrexed erhielten, umfassten supraventrikuläre Arrhythmien.
Die klinisch relevante Labortoxizität Grad 3 und 4 war bei den zusammengefassten Ergebnissen von drei einzelnen Pemetrexed-Monotherapiestudien (n = 164) der Phase 2 ähnlich der in der oben beschriebenen Phase 3 Pemetrexed-Monotherapiestudie, ausgenommen Neutropenie (12,8 % verglichen mit 5,3 %) und einer Erhöhung der Alanin-Aminotransferase (15,2 % verglichen mit
1,9 %). Diese Unterschiede sind wahrscheinlich auf Unterschiede in der Patientenpopulation zurückzuführen, da die Phase-2-Studien sowohl chemonaive als auch deutlich vorbehandelte Brustkrebspatienten mit bestehenden Lebermetastasen und/oder abnormen Ausgangswerten der Leberfunktionstests einschlossen.
Die folgende Tabelle zeigt die Häufigkeit und Schwere unerwünschter Wirkungen, die möglicherweise im Zusammenhang mit der Studienmedikation stehen könnten; sie wurden bei > 5 % von 839 Patienten mit NSCLC berichtet, die randomisiert Cisplatin und Pemetrexed erhielten, und 830 Patienten mit NSCLC, die randomisiert Cisplatin und Gemcitabin erhielten. Alle Patienten erhielten die Studienmedikation als First-Line-Therapie des lokal fortgeschrittenen oder metastasierten nicht kleinzelligen Lungenkarzinoms (NSCLC). Alle Patienten (in beiden Behandlungsgruppen) erhielten zusätzliche tägliche Gaben von Folsäure und Vitamin B12.
|
Systemorgan klasse |
Häufigkeit |
Ereignis** |
Pemetrexed/ Cisplatin |
Gemcitabin/ Cisplatin | ||
|
(N = 839) |
(N = 830) | |||||
|
Toxizität alle Grade (%) |
Grad 3-4 Toxizität (%) |
Toxizität alle Grade (%) |
Grad 3-4 Toxizität (%) | |||
|
Erkrankungen des Blutes und des Lymphsystems |
Sehr häufig |
Hämoglobin erniedrigt |
33,0* |
5,6* |
45,7* |
9,9* |
|
Neutrophile/ Granulozyten erniedrigt |
29,0* |
15,1* |
38,4* |
26,7* | ||
|
Leukozyten erniedrigt |
17,8 |
4,8* |
20,6 |
7,6* | ||
|
Thrombozyten erniedrigt |
10,1* |
4,1* |
26,6* |
12,7* | ||
|
Erkrankungen des Nervensystems |
Häufig |
Sensorische Neuropathie |
8,5* |
0,0* |
12,4* |
0,6* |
|
Geschmacks störungen |
8,1 |
0,0*** |
8,9 |
0,0*** | ||
|
Erkrankungen des Gastrointestinaltrakts |
Sehr häufig |
Übelkeit |
56,1 |
7,2* |
53,4 |
3,9* |
|
Erbrechen |
39,7 |
6,1 |
35,5 |
6,1 | ||
|
Appetitverlust |
26,6 |
2,4* |
24,2 |
0,7* | ||
|
Obstipation |
21,0 |
0,8 |
19,5 |
0,4 | ||
|
Stomatitis/ Pharyngitis |
13,5 |
0,8 |
12,4 |
0,1 | ||
|
Diarrhö ohne Kolostomie |
12,4 |
1,3 |
12,8 |
1,6 | ||
|
Häufig |
Dyspepsie/ Sodbrennen |
5,2 |
0,1 |
5,9 |
0,0 | |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Sehr häufig |
Haarausfall |
11,9* |
^** |
21,4* |
0,5*** |
|
Häufig |
Hautrötung/ Abschuppung |
6,6 |
0,1 |
8,0 |
0,5 | |
|
Erkrankungen der Nieren und Harnwege |
Sehr häufig |
Kreatinin erhöht |
10,1* |
0,8 |
6,9* |
0,5 |
|
Allgemeine Erkrankungen und Beschwerden am V erabreichungsort —*-:-1 |
Sehr häufig |
Müdigkeit |
42,7 |
6,7 |
44,9 |
4,9 |
**
***
Verwendung des ,Fisher Exact test‘.
Bezug auf National Cancer Institute CTC (v2.0; NCI 1998) für jeden Toxizitätsgrad.
Bezogen auf National Cancer Institute CTC (v2.0; NCI 1998) sollen Geschmacksstörung und Haarausfall nur als Grad 1 oder 2 berichtet werden.
Für diese Tabelle wurde für die Aufnahme aller Ereignisse, bei denen der berichtende Arzt einen Zusammenhang mit Pemetrexed und Cisplatin für möglich hielt, eine Schwelle von 5 % festgelegt.
Klinisch relevante Toxizitäten, die bei > 1 % und < 5 % der Patienten berichtet wurden, die randomisiert Cisplatin und Pemetrexed erhielten, umfassten: AST-Anstieg, ALT-Anstieg, Infektionen, febrile Neutropenie, Nierenversagen, Pyrexie, Dehydration, Konjunktivitis und erniedrigte Kreatinin-Clearance.
Klinisch relevante Toxizitäten, die bei < 1 % der Patienten berichtet wurden, die randomisiert Cisplatin und Pemetrexed erhielten, umfassten: GGT erhöht, Brustschmerz, Arrhythmien und motorische Neuropathie.
Klinisch relevante Toxizitäten der beiden Geschlechter waren ähnlich im Vergleich zur Gesamtpopulation aller Patienten, die Cisplatin und Pemetrexed erhielten.
Die folgende Tabelle zeigt die Häufigkeit und Schwere unerwünschter Wirkungen, die möglicherweise im Zusammenhang mit der Studienmedikation stehen könnten. In der Studie zur Erhaltungstherapie mit Pemetrexed (JMEN; N = 663) und in der Studie einer fortgesetzten Pemetrexed-Behandlung als Erhaltungstherapie (PARAMOUNT; N = 539) wurden diese bei > 5 % von 800 Patienten, die randomisiert eine Monotherapie mit Pemetrexed erhielten, und 402 Patienten, die randomisiert Placebo erhielten, berichtet. Alle Patienten hatten ein diagnostiziertes NSCLC im Stadium IIIB oder IV und hatten zuvor eine platinbasierte Chemotherapie erhalten. Die Patienten beider Behandlungsgruppen erhielten zusätzlich tägliche Gaben von Folsäure und Vitamin B12.
|
Systemorgan klasse |
Häufigkeit* |
Ereignis |
Pemetrexed*** |
Placebo*** | ||
|
(N = 800) |
(N = 402) | |||||
|
Toxizität alle Grade (%) |
Grad 3-4 Toxizität (%) |
Toxizität alle Grade (%) |
Grad 3-4 Toxizität (%) | |||
|
Erkrankungen des Blutes und des Lymphsystems |
Sehr häufig |
Hämoglobin erniedrigt |
18,0 |
4,5 |
5,2 |
0,5 |
|
Häufig |
Leukozyten erniedrigt |
5,8 |
1,9 |
0,7 |
0,2 | |
|
Neutrophile erniedrigt |
8,4 |
4,4 |
0,2 |
0,0 | ||
|
Erkrankungen des Nervensystems |
Häufig |
Sensorische Neuropathie |
7,4 |
0,6 |
5,0 |
0,2 |
|
Erkrankungen des Gastrointestinaltrakts |
Sehr häufig |
Übelkeit |
17,3 |
0,8 |
4,0 |
0,2 |
|
Appetitverlust |
12,8 |
1,1 |
3,2 |
0,0 | ||
|
Häufig |
Erbrechen |
8,4 |
0,3 |
1,5 |
0,0 | |
|
Mukositis/ Stomatitis |
6,8 |
0,8 |
1,7 |
0,0 | ||
|
Leber- und Gallenerkrankungen |
Häufig |
ALT-(SGPT-) Erhöhung |
6,5 |
0,1 |
2,2 |
0,0 |
|
AST-(SGOT-) Erhöhung |
5,9 |
0,0 |
1,7 |
0,0 | ||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Häufig |
Hautrötung/ Abschuppung |
8,1 |
0,1 |
3,7 |
0,0 |
|
Allgemeine Erkrankungen und Beschwerden am V erabreichungsort |
Sehr häufig |
Müdigkeit |
24,1 |
5,3 |
10,9 |
0,7 |
|
Häufig |
Schmerzen |
7,6 |
0,9 |
4,5 |
0,0 | |
|
Ödeme |
5,6 |
0,0 |
1,5 |
0,0 | ||
|
Erkrankungen der Nieren |
Häufig |
Erkrankungen **** der Nieren |
7,6 |
0,9 |
1,7 |
0,0 |
Abkürzungen: ALT = Alanin-Aminotransferase; AST = Aspartat-Aminotransferase;
CTCAE = Common Terminology Criteria for Adverse Event; NCI = National Cancer Institute;
SGOT = Serum-Glutamat-Oxalacetat-Aminotransferase;
SGPT = Serum-Glutamat-Pyruvat-Aminotransferase.
Definition der Häufigkeitsangaben: sehr häufig - > 10 %; häufig - > 5 % und < 10 %. Für alle Ereignisse, bei denen eine mögliche Beziehung zur Einnahme von Pemetrexed und Cisplatin vermutet wurde, wurde eine Grenze von 5 % zur Aufnahme in diese Tabelle verwendet.
Für den jeweiligen Schweregrad der Toxizität wird auf die CTCAE-Kriterien (Version 3.0; NCI 2003) des NCI verwiesen. Die aufgeführten Berichtsraten beziehen sich auf CTCAE-Version 3.0.
Die zusammengesetzte Nebenwirkungstabelle kombiniert die Ergebnisse aus den Studien JMEN zur Erhaltungstherapie mit Pemetrexed (N = 663) und PARAMOUNT zur Fortführung einer
Pemetrexed-Behandlung als Erhaltungstherapie (N = 539).
Kombinierter Terminus beinhaltet Serum/Blut-Kreatinin-Erhöhung, verminderte glomeruläre Filtrationsrate, Nierenversagen und renal/urogenital - andere.
Zu den klinisch relevanten CTC-Toxizitäten jeglichen Grades, die von > 1 % und < 5 % der Patienten berichtet wurden, die randomisiert Pemetrexed erhielten, gehören: febrile Neutropenie, Infektion, verminderte Thrombozytenzahl, Diarrhö, Verstopfung, Alopezie, Pruritus/Juckreiz, Fieber (ohne Neutropenie), Erkrankungen der Augenoberfläche (einschließlich Konjunktivitis), verstärkter Tränenfluss, Schwindel und motorische Neuropathie.
Zu den klinisch relevanten CTC-Toxizitäten, die von < 1 % der Patienten berichtet wurden, die randomisiert Pemetrexed erhielten, gehören: allergische Reaktionen/Hypersensitivität, Erythema multiforme, supraventrikuläre Arrhythmie und Lungenembolie.
Die Verträglichkeit wurde anhand der Patienten, die randomisiert Pemetrexed erhielten (N = 800), bewertet. Die Inzidenz der Nebenwirkungen wurde bei Patienten, die < 6 Zyklen Pemetrexed in der Erhaltungstherapie (N = 519) erhielten, bewertet und verglichen mit der bei Patienten, die > 6 Zyklen Pemetrexed (N = 281) erhielten. Es wurde eine Anstieg der Nebenwirkungen (alle Grade) mit längerer Exposition beobachtet. Eine signifikante Zunahme der Inzidenz von möglicherweise durch die Studienmedikation bedingte Neutropenie des Grades 3/4 wurde bei längerer Exposition mit Pemetrexed (< 6 Zyklen: 3,3 %, > 6 Zyklen: 6,4 %: p = 0,046) beobachtet. Bei längerer Exposition wurde bezüglich anderer einzelner Nebenwirkungen des Grades 3/4/5 kein statistisch signifikanter Unterschied beobachtet.
Schwerwiegende kardiovaskuläre und zerebrovaskuläre Ereignisse, einschließlich Myokardinfarkt, Angina Pectoris, zerebrovaskulärer Insult und transitorische ischämische Attacken, wurden in klinischen Studien mit Pemetrexed, das üblicherweise in Kombination mit einem anderen zytotoxischen Wirkstoff verabreicht wird, gelegentlich berichtet. Die meisten Patienten, bei denen diese Ereignisse beobachtet wurden, hatten vorbestehende kardiovaskuläre Risikofaktoren.
In klinischen Studien mit Pemetrexed wurden selten Fälle von Hepatitis, möglicherweise schwerwiegend, berichtet.
Gelegentlich wurde in klinischen Studien mit Pemetrexed über Panzytopenie berichtet.
Aus klinischen Studien wurden bei Patienten mit Pemetrexed-Behandlung gelegentlich Fälle von Colitis (einschließlich intestinaler und rektaler Blutungen, manchmal tödlich verlaufender, intestinaler Perforation, intestinaler Nekrose und Typhlitis) berichtet.
Aus klinischen Studien wurden bei Patienten mit Pemetrexed-Behandlung gelegentlich Fälle von manchmal tödlich verlaufender interstitieller Pneumonitis mit respiratorischer Insuffizienz berichtet.
Gelegentlich wurden Fälle von Ödemen bei mit Pemetrexed behandelten Patienten berichtet.
Aus klinischen Studien mit Pemetrexed wurde gelegentlich Ösophagitis/Strahlen-Ösophagitis berichtet.
Sepsis, manchmal tödlich, wurde häufig während klinischer Studien mit Pemetrexed berichtet.
Nach Markteinführung wurden bei mit Pemetrexed behandelten Patienten die folgenden Nebenwirkungen berichtet:
Es wurde gelegentlich über Fälle von akutem Nierenversagen bei Pemetrexed-Monotherapie oder in Kombination mit anderen Chemotherapeutika berichtet (siehe Abschnitt 4.4).
Es wurden gelegentlich Fälle von Strahlenpneumonitis bei Patienten berichtet, die vor, während oder nach ihrer Pemetrexed-Therapie bestrahlt wurden (siehe Abschnitt 4.4).
Bei Patienten, die vorher eine Strahlentherapie erhalten hatten, wurden selten Fälle von „Radiation Recall" berichtet (siehe Abschnitt 4.4).
Es wurde gelegentlich über Fälle von peripheren Ischämien, die manchmal zu Nekrosen an den Extremitäten führen, berichtet.
Seltene Fälle von bullösen Erkrankungen einschließlich Stevens-Johnson-Syndrom und toxischer epidermaler Nekrolyse wurden berichtet, die in einigen Fällen tödlich verliefen.
Selten wurde hämolytische Anämie bei Patienten, die mit Pemetrexed behandelt wurden, berichtet.
Seltene Fälle eines anaphylaktischen Schocks wurden berichtet.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkunganzuzeigen dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Berichtete Symptome einer Überdosierung waren Neutropenie, Anämie, Thrombozytopenie, Mukositis, sensorische Polyneuropathie und Hautrötung. Eine erwartete Komplikation einer Überdosierung ist eine Knochenmarkdepression, die sich als Neutropenie, Thrombozytopenie und Anämie manifestiert. Außerdem können Infektionen mit oder ohne Fieber, Durchfall und/oder Mukositis auftreten. Im Fall einer vermuteten Überdosierung müssen die Patienten mittels geeigneter Blutuntersuchungen überwacht werden und, soweit notwendig, eine unterstützende Therapie erhalten. Die Gabe von Calciumfolinat/Folinsäure zur Behandlung der Pemetrexed-Überdosierung sollte erwogen werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Folsäure-Analoga, ATC-Code: L01BA04.
Pemetrexed Zentiva (Pemetrexed) ist ein antineoplastisches Antifolat, das seine Wirkung ausübt, indem es wichtige folsäureabhängige metabolische Prozesse unterbricht, die für die Zellreplikation notwendig sind.
In-vitro-Studien zeigten, dass Pemetrexed als Antifolat mit mehreren Angriffspunkten wirkt, indem es die Thymidylatsynthase (TS), Dihydrofolatreduktase (DHFR) und
Glycinamidribonucleotidformyltransferase (GARFT) blockiert, die folatabhängige Schlüsselenzyme der De-novo-Biosynthese von Thymidin- und Purinnucleotiden sind. Pemetrexed wird sowohl von dem reduzierten Folat-Carrier als auch membranständigen folatbindenden Proteintransportsystemen in die Zellen transportiert. Sobald es sich in der Zelle befindet, wird Pemetrexed schnell und wirksam durch das Enzym Folylpolyglutamatsynthase in Polyglutamatformen überführt. Die Polyglutamatformen werden in den Zellen zurückgehalten und sind noch stärkere Inhibitoren der TS und GARFT. Die Polyglutamatreaktion ist ein zeit- und konzentrationsabhängiger Prozess, der in Tumorzellen stattfindet und, in geringerem Maße, in normalen Zellen. Metaboliten der Polyglutamatreaktion haben eine verlängerte intrazelluläre Halbwertszeit, was zu einer verlängerten Wirkdauer in malignen Zellen führt.
Die Europäische Arzneimittel-Agentur verzichtet auf die Verpflichtung zur Vorlage von Ergebnissen klinischer Prüfungen mit Pemetrexed bei allen Untergruppen der pädiatrischen Bevölkerung in allen zugelassenen Indikationen (siehe Abschnitt 4.2).
Klinische Wirksamkeit
Mesotheliom
EMPHACIS, eine multizentrische, randomisierte, einfachblinde Phase-3-Studie von Pemetrexed plus Cisplatin gegen Cisplatin bei chemonaiven Patienten mit malignem Pleuramesotheliom zeigte, dass mit Pemetrexed und Cisplatin behandelte Patienten einen klinisch bedeutsamen Vorteil eines um median 2,8 Monate verlängerten Überlebens gegenüber solchen Patienten hatten, die nur mit Cisplatin behandelt wurden.
Während der Studie wurde eine niedrig dosierte Folsäure- und Vitamin-B12-Gabe in die Therapie eingeführt, um die Toxizität zu verringern. Die primäre Analyse dieser Studie wurde in der Population aller Patienten vorgenommen, die in dem Behandlungsarm die Prüfmedikation erhielten (randomisiert und behandelt). Eine Subgruppenanalyse wurde für diejenigen Patienten vorgenommen, die Vitamingaben während der gesamten Behandlungsdauer erhielten (vollständige Vitamingabe). Die Ergebnisse dieser Analysen zur Wirksamkeit sind in der folgenden Tabelle zusammengefasst.
Wirksamkeit von Pemetrexed plus Cisplatin gegenüber Cisplatin beim malignen Pleuramesotheliom
|
Randomisierte und behandelte Patienten |
Patienten mit vollständiger Vitamingabe | |||
|
Wirksamkeitsparameter |
Pemetrexed/ |
Cisplatin |
Pemetrexed/ |
Cisplatin |
|
Cisplatin |
Cisplatin | |||
|
(N = 226) |
(N = 222) |
(N = 168) |
(N = 163) | |
|
Medianes Überleben (Monate) |
12,1 |
9,3 |
13,3 |
10,0 |
|
(95 % CI) |
(10,0-14,4) |
(7,8-10,7) |
(11,4-14,9) |
(8,4-11,9) |
|
Log Rank p-Wert |
0,020 |
0,051 | ||
|
Mediane Zeit bis zur |
5,7 |
3,9 |
6,1 |
3,9 |
|
Tumorprogression (Monate) | ||||
|
(95 % CI) |
(4,9-6,5) |
(2,8-4,4) |
(5,3-7,0) |
(2,8-4,5) |
|
Log Rank p-Wert |
0,001 |
0,008 | ||
|
Zeit bis zum Therapieversagen |
4,5 |
2,7 |
4,7 |
2,7 |
|
(Monate) | ||||
|
(95 % CI) |
(3,9-4,9) |
(2,1-2,9) |
(4,3-5,6) |
(2,2-3,1) |
|
Log Rank p-Wert |
0,001 |
0,001 | ||
|
Gesamtansprechrate** |
41,3 % |
16,7 % |
45,5 % |
19,6 % |
|
(95 % CI) |
(34,8-48,1) |
(12,0-22,2) |
(37,8-53,4) |
(13,8-26,6) |
|
Exakter p-Wert nach Fisher |
< 0,001 |
< 0,001 | ||
Abkürzung: CI = Konfidenzintervall.
p-Wert bezieht sich auf den Vergleich der beiden Arme.
In dem Pemetrexed/Cisplatin-Arm, randomisiert und behandelt (N = 225) und mit vollständiger Vitamingabe (N = 167).
Eine statistisch signifikante Verbesserung der klinisch relevanten Symptome (Schmerzen und Dyspnoe) im Zusammenhang mit dem malignen Pleuramesotheliom wurde bei Anwendung der Lungenkrebssymptomskala im Pemetrexed/Cisplatin-Arm (212 Patienten) gegenüber dem alleinigen Cisplatin-Arm (218 Patienten) gezeigt. Außerdem wurden statistisch signifikante Unterschiede in Lungenfunktionstests beobachtet. Die Unterschiede zwischen den beiden Behandlungsarmen ergaben sich durch eine Verbesserung der Lungenfunktionsparameter im Pemetrexed/Cisplatin-Arm und einer Verschlechterung der Lungenfunktion im Laufe der Zeit im Kontrollarm.
Für die Behandlung von Patienten, die an einem malignen Pleuramesotheliom leiden, mit Pemetrexed in der Monotherapie liegen nur begrenzt Daten vor. Pemetrexed wurde in Dosen von 500 mg/m2 als Monotherapie bei 64 chemonaiven Patienten mit malignem Pleuramesotheliom untersucht. Die Gesamtresponderrate betrug 14,1 %.
NSCLC, Second-Line-Therapie
Eine multizentrische, randomisierte, offene Phase-3-Studie mit Pemetrexed gegen Docetaxel bei Patienten mit lokal fortgeschrittenem oder metastasiertem NSCLC nach vorheriger Chemotherapie belegte eine mediane Überlebenszeit von 8,3 Monaten bei mit Pemetrexed behandelten Patienten (Intent-to-treat-Population n = 283) und von 7,9 Monaten bei mit Docetaxel behandelten Patienten (ITT, n = 288). In der vorangegangenen Chemotherapie war Pemetrexed nicht enthalten. Eine Analyse des Einflusses der Histologie auf den Behandlungseffekt auf das Gesamtüberleben fiel zugunsten von Pemetrexed bei Patienten mit NSCLC mit einem überwiegend nicht plattenepithelialen histologischen Typ (n = 399, 9,3 versus 8,0 Monate, angepasste HR = 0,78; 95 % CI = 0,61-1,00, p = 0,047) aus, bei Patienten mit Plattenepithelkarzinomhistologie zugunsten von Docetaxel (n = 172, 6,2 versus 7,4 Monate, angepasste HR = 1,56; 95 % CI = 1,08-2,26, p = 0,018). Es wurden keine klinisch relevanten Unterschiede des Sicherheitsprofils von Pemetrexed in den verschiedenen histologischen Untergruppen beobachtet.
Begrenzte Daten einer separat randomisierten, kontrollierten Phase-3-Studie zeigen, dass Wirksamkeitsdaten (Überleben und progressionsfreies Überleben) für Pemetrexed zwischen Patienten mit (n = 41) und ohne (n = 540) Vorbehandlung durch Docetaxel ähnlich sind.
|
Wirksamkeit von Pemetrexed gegen Docetaxel in |
NSCLC - ITT Population | |
|
Pemetrexed |
Docetaxel | |
|
Überlebenszeit (Monate) • Median (m) • 95 % CI für medianes Überleben • HR • 95 % CI für HR • p-Wert für Nichtunterlegenheit (HR) |
(n = 283) (n = 288) 8,3 7,9 (7,0-9,4) (6,3-9,2) 0,99 (0,82-1,20) 0,226 | |
|
Progressionsfreies Überleben (Monate) • Median • HR (95 % CI) |
(n = 283) (n = 288) 2,9 2,9 0,97 (0,82-1,16) | |
|
Zeit bis zum Therapieversagen (Monate) • Median • HR (95 % CI) |
(n = 283) (n = 288) 2,3 2,1 0,84 (0,71-0,997) | |
|
Ansprechen (n: qualifiziert für Ansprechen) • Ansprechrate (%) (95 % CI) • Stabiler Krankheitszustand (%) |
(n = 264) 9,1 (5,9-13,2) 45,8 |
(n = 274) 8,8 (5,7-12,8) 46,4 |
|
Abkürzungen: CI = Konfidenzintervall; HR = Hazarc |
-Ratio; ITT = Intent to treat; | |
n = Größe der Gesamtpopulation.
NSCLC, First-Line-Therapie
Eine multizentrische, randomisierte, offene Phase-3-Studie von Pemetrexed in Kombination mit Cisplatin gegenüber Gemcitabin in Kombination mit Cisplatin an chemonaiven Patienten mit lokal fortgeschrittenem oder metastasierendem (Grad IIIb oder IV) nicht kleinzelligem Lungenkarzinom zeigte, dass Pemetrexed in Kombination mit Cisplatin (Intent-to-treat-[ITT-]Gruppe, n = 862) den primären Endpunkt erreichte und ähnliche klinische Wirksamkeit zeigte wie Gemcitabin in Kombination mit Cisplatin (ITT, n = 863) bezogen auf Überleben (angepasste HR = 0,94; 95 % CI = 0,84-1,05). Alle in dieser Studie eingeschlossenen Patienten hatten einen ECOG-Performance-Status von 0 oder 1.
Die primäre Wirksamkeitsanalyse basierte auf der ITT-Population. Sensitivitätsanalysen von wichtigen Wirksamkeitsendpunkten wurden auch gegenüber der Gruppe untersucht, die die
Einschlusskriterien des Protokolls erfüllten (PQ = protocol qualified). Die Wirksamkeitsanalysen der PQ-Population sind konsistent mit den Analysen der ITT-Population und unterstützen die Nichtunterlegenheit der Pemetrexed-Cisplatin-Kombination gegenüber der Gemcitabin-Cisplatin-Kombination.
Progressionsfreies Überleben (PFS = progression free survival) und die Gesamtansprechrate waren zwischen den Behandlungsarmen ähnlich: Mittleres PFS war 4,8 Monate für die Kombination Pemetrexed + Cisplatin gegenüber 5,1 Monaten für die Kombination Gemcitabin + Cisplatin (angepasste HR = 1,04; 95 % CI = 0,94-1,15), die Gesamtansprechrate betrug 30,6 % (95 % CI = 27,3-33,9) für die Kombination Pemetrexed + Cisplatin gegenüber 28,2 % (95 % CI = 25,0-31,4) für die Kombination Gemcitabin + Cisplatin. Die PFS-Daten wurden teilweise durch eine unabhängige Bewertung (400 von 1.725 Patienten wurden nach dem Zufall für die Bewertung ausgewählt) bestätigt.
Die Analyse des Einflusses der NSCLC-Histologie auf das Überleben zeigte klinisch relevante Unterschiede entsprechend der Histologie, siehe untenstehende Tabelle.
Wirksamkeit von Pemetrexed + Cisplatin vs. Gemcitabin + Cisplatin in der First-Line-Therapie des nicht kleinzelligen Lungenkarzinoms (NSCLC) - ITT-Population und histologische Untergruppen ___
|
ITT-Population und histologische Untergruppen |
Mediane Überlebenszeit in Monaten (95 % CI) |
Angepasste Hazard-Ratio (HR) (95 % CI) |
Überlegenheit p-Wert | |||
|
Pemetrexed + Cisplatin |
Gemcitabin + Cisplatin | |||||
|
ITT-Population (N = 1.725) |
10,3 (9,8-11,2) |
N = 862 |
10,3 (9,6—10,9) |
N = 863 |
0,94a (0,84-1,05) |
0,259 |
|
Adenokarzinom (N = 847) |
12,6 (10,7-13,6) |
N = 436 |
10,9 (10,2-11,9) |
N = 411 |
0,84 (0,71-0,99) |
0,033 |
|
Großzelliges Karzinom (N = 153) |
10,4 (8,6-14,1) |
N = 76 |
6,7 (5,5-9,0) |
N = 77 |
0,67 (0,48-0,96) |
0,027 |
|
Andere (N = 252) |
8,6 (6,8-10,2) |
N = 106 |
9,2 (8,1-10,6) |
N = 146 |
1,08 (0,81-1,45) |
0,586 |
|
Plattenepithelkarzin om (N = 473) |
9,4 (8,4-10,2) |
N = 244 |
10,8 (9,5-12,1) |
N = 229 |
1,23 (1,00-1,51) |
0,050 |
Abkürzungen: CI = Konfidenzintervall; ITT = intent to treat; N = Größe der Gesamtpopulation.
a Statistisch signifikant für Nichtunterlegenheit, mit einem Gesamtkonfidenzintervall für HR (= Hazard-Ratio) deutlich unter der Nichtunterlegenheitsgrenze von 1,17645 (p < 0,001).
Kaplan-Meier-Kurven der Überlebenszeit nach Histologie
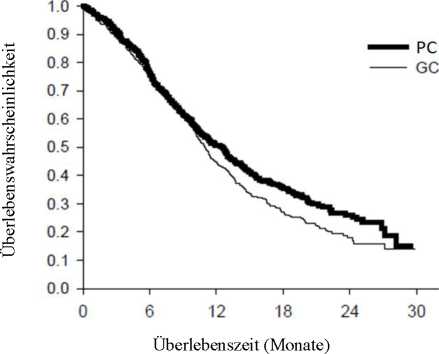
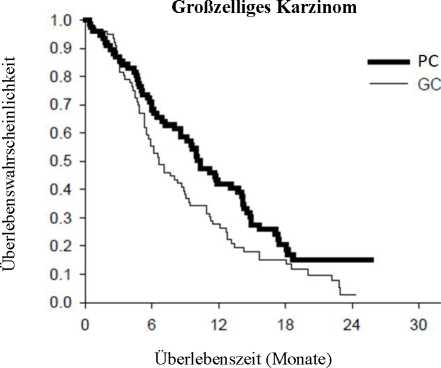
Es wurden keine klinisch relevanten Unterschiede des Sicherheitsprofils von Pemetrexed in Kombination mit Cisplatin in den verschiedenen histologischen Untergruppen beobachtet. Patienten, die mit Pemetrexed und Cisplatin behandelt wurden, benötigten weniger Transfusionen (16,4 % versus
28,9 %, p < 0,001), Erythrozytentransfusionen (16,1 % versus 27,3 %, p < 0,001) und Thrombozytentransfusionen (1,8 % versus 4,5 %, p = 0,002). Außerdem benötigten die Patienten seltener die Gabe von Erythropoetin/Darbopoetin (10,4 % versus 18,1 %, p < 0,001), G-CSF/GM-CSF (3,1 % versus 6,1 %, p = 0,004) und Eisenpräparaten (4,3 % versus 7,0 %, p = 0,021).
NSCLC, Erhaltungstherapie JMEN
Eine multizentrische, randomisierte, doppelblinde, placebokontrollierte Phase-3-Studie (JMEN) verglich die Wirksamkeit und Verträglichkeit einer Erhaltungstherapie mit Pemetrexed plus bestmöglicher supportiver Therapie (BSC = Best supportive care) (n = 441) mit der von Placebo plus BSC (n = 222) bei Patienten mit lokal fortgeschrittenem (Stadium IIIB) oder metastasiertem (Stadium IV) nicht kleinzelligen Lungenkarzinom (NSCLC), bei denen nach 4 Zyklen einer First-Line-Doublet-Therapie mit Cisplatin oder Carboplatin in Kombination mit Gemcitabin, Paclitaxel oder Docetaxel keine Progression aufgetreten war. Eine First-Line-Doublet-Therapie mit Pemetrexed war nicht eingeschlossen. Alle in dieser Studie eingeschlossenen Patienten hatten einen ECOG-Performance-Status von 0 oder 1. Die Patienten erhielten die Erhaltungstherapie bis zum Fortschreiten der Erkrankung. Wirksamkeit und Verträglichkeit wurden ab dem Zeitpunkt der Randomisierung bewertet, die im Anschluss an die First-Line-Therapie (Induktionstherapie) erfolgte. Im Median erhielten die Patienten 5 Zyklen in der Erhaltungstherapie mit Pemetrexed und 3,5 Zyklen mit Placebo. Insgesamt erhielten 213 Patienten (48,3 %) > 6 Zyklen und insgesamt 103 Patienten (23,4 %) > 10 Zyklen der Behandlung mit Pemetrexed.
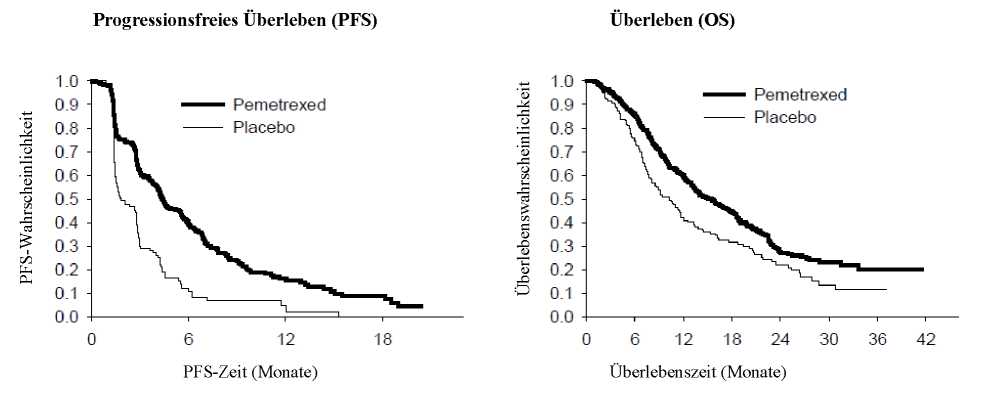
Die Studie erreichte ihren primären Endpunkt und zeigte eine statistisch signifikante Verbesserung des progressionsfreien Überlebens (PFS = Progression free survival) in der mit Pemetrexed behandelten Gruppe im Vergleich zum Placebo-Arm (n = 581, unabhängige Auswertung der Population, median
4,0 Monate vs. 2,0 Monate) (Hazard-Ratio = 0,60; 95 % CI: 0,49-0,73, p < 0,00001). Die unabhängige Beurteilung der CT-Scans der Patienten bestätigte die Ergebnisse der Bewertung des progressionsfreien Überlebens durch den Prüfer. Das mediane Überleben (OS - Overall Survival) lag bei der Gesamtpopulation (n = 663) im Pemetrexed-Arm bei 13,4 Monaten und im Placebo-Arm bei 10,6 Monaten (Hazard-Ratio = 0,79; 95 % CI: 0,65-0,95, p = 0,01192).
In Übereinstimmung mit anderen Studien zu Pemetrexed wurden in der JMEN in Abhängigkeit von der Histologie des NSCLC unterschiedliche Therapieergebnisse beobachtet. Bei Patienten mit NSCLC außer überwiegender plattenepithelialer Histologie (n = 430, unabhängige Auswertung der Population) betrug das mediane progressionsfreie Überleben PFS im Pemetrexed-Arm 4,4 Monate und 1,8 Monate im Placebo-Arm (Hazard-Ratio = 0,47; 95 % CI: 0,37-0,60, p = 0,00001). Das mediane Überleben
(OS) bei Patienten mit NSCLC außer überwiegender plattenepithelialer Histologie (n = 481) betrug im Pemetrexed-Arm 15,5 Monate und im Placebo-Arm 10,3 Monate (Hazard-Ratio = 0,70; 95 % CI: 0,56-0,88, p = 0,002). Bei Berücksichtigung der Induktionsphase betrug das mediane Überleben bei Patienten mit NSCLC außer überwiegender plattenepithelialer Histologie 18,6 Monate unter Pemetrexed und 13,6 Monate unter Placebo (Hazard-Ratio = 0,71; 95 % CI: 0,56-0,88, p = 0,002).
Bei Patienten mit plattenepithelialer Histologie deutete sich hinsichtlich des PFS und des OS kein Vorteil von Pemetrexed gegenüber Placebo an.
Es wurden keine klinisch relevanten Unterschiede in Hinblick auf das Verträglichkeitsprofil von Pemetrexed in den Histologie-Subgruppen beobachtet.
JMEN: Kaplan-Meier-Plots des progressionsfreien Überlebens (PFS) und des Überlebens (OS) unter Pemetrexed versus Placebo bei Patienten mit NSCLC außer überwiegender plattenepithelialer Histologie
PARAMOUNT
Eine multizentrische, randomisierte, doppelblinde, placebokontrollierte Phase-3-Studie (PARAMOUNT) verglich die Wirksamkeit und Verträglichkeit einer Erhaltungstherapie mit Pemetrexed plus bestmöglicher supportiver Therapie (BSC = Best supportive care) (n = 359) mit der von Placebo plus BSC (n= 180) bei Patienten mit lokal fortgeschrittenem (Stadium IIIB) oder metastasiertem (Stadium IV) nicht kleinzelligen Lungenkarzinom (NSCLC), mit Ausnahme von überwiegender plattenepithelialer Histologie, bei denen nach 4 Zyklen einer First-Line-Doublet-Therapie (Induktionstherapie) mit Pemetrexed in Kombination mit Cisplatin keine Progression aufgetreten war. Von den 939 Patienten, die als Induktionstherapie Pemetrexed in Kombination mit Cisplatin erhielten, wurden 539 Patienten auf eine Erhaltungstherapie mit Pemetrexed oder Placebo randomisiert. Von diesen randomisierten Patienten hatten 44,9 % ein komplettes/partielles Ansprechen und 51,9 % eine stabile Erkrankung nach der Induktionstherapie Pemetrexed plus Cisplatin gezeigt.
Für eine Randomisierung auf eine Erhaltungstherapie mussten die Patienten einen ECOG-Performance-Status von 0 oder 1 aufweisen. Die durchschnittliche (median) Zeit vom Start der Induktionstherapie Pemetrexed plus Cisplatin und dem Start der Erhaltungstherapie betrug 2,96 Monate in beiden Behandlungsarmen im Pemetrexed- wie auch Placebo-Arm. Die randomisierten Patienten erhielten die Erhaltungstherapie bis zum Fortschreiten der Erkrankung. Wirksamkeit und Verträglichkeit wurden ab dem Zeitpunkt der Randomisierung bewertet, die im Anschluss an die First-Line-Therapie (Induktionstherapie) erfolgte. Im Median erhielten die Patienten 4 Zyklen in der Erhaltungstherapie mit Pemetrexed und 4 Zyklen mit Placebo. Insgesamt erhielten 169 Patienten (47,1 %) > 6 Zyklen Pemetrexed-Erhaltungstherapie, entsprechend insgesamt mindestens 10 kompletten Zyklen Pemetrexed.
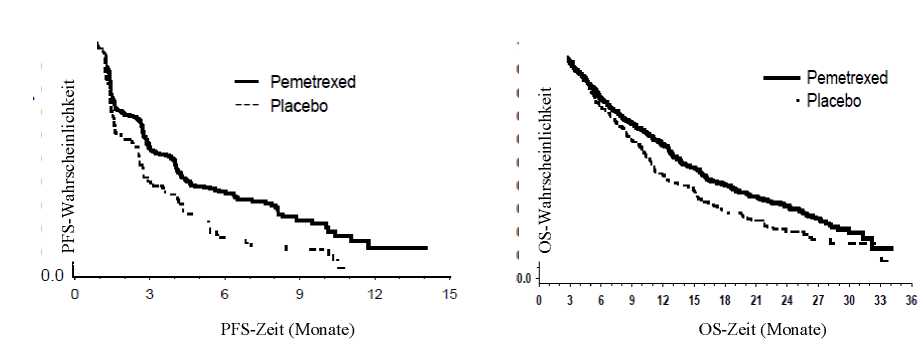
Die Studie erreichte ihren primären Endpunkt und zeigte eine statistisch signifikante Verbesserung des
progressionsfreien Überlebens (PFS) im Pemetrexed-Arm gegenüber dem Placebo-Arm (n = 472, unabhängige Auswertung der Population, median 3,9 Monate vs. 2,6 Monate, entsprechend) (Hazard-Ratio = 0,64; 95 % CI: 0,51-0,81, p = 0,0002). Die unabhängige Beurteilung der Scans der Patienten bestätigte die Ergebnisse des progressionsfreien Überlebens der Prüferbewertung. Für die randomisierten Patienten betrug die mediane Prüferermittelte PFS, ermittelt vom Beginn der Pemetrexed-plus-Cisplatin-First-Line-Induktionstherapie, 6,9 Monate im Pemetrexed-Arm und 5,6 Monate im Placebo-Arm (Hazard-Ratio = 0,59; 95 % CI = 0,47-0,74).
Nach einer Induktionstherapie mit Pemetrexed/Cisplatin (4 Zyklen) war die Behandlung mit Pemetrexed gegenüber Placebo für das Gesamtüberleben (OS) statistisch überlegen (Median
13.9 Monate versus 11,0 Monate, Hazard-Ratio = 0,78; 95 % CI = 0,64-0,96, p = 0,0195). Zum Zeitpunkt dieser finalen Analyse zum Überleben waren 28,7 % der Patienten im Pemetrexed-Arm am Leben bzw. „lost to follow up“ im Vergleich zu 21,7 % im Placebo-Arm. Die relative Effektivität einer Pemetrexed-Behandlung war zwischen den Untergruppen (einschließlich Krankheitsstadium, Ansprechen auf die Induktionstherapie, ECOG-PS, Raucherstatus, Geschlecht, Histologie und Alter) konsistent und ähnlich der in nicht adjustierten OS- und PFS-Analysen beobachteten. Die 1- und 2-Jahres-Überlebensraten für Pemetrexed-Patienten betrugen 58 % bzw. 32 % im Vergleich zu 45 % bzw. 21 % für Placebo-Patienten. Gerechnet ab Beginn der Pemetrexed/Cisplatin-Erstlinien-Induktionstherapie betrug das mediane Überleben (OS) von Patienten im Pemetrexed-Arm
16.9 Monate und im Placebo-Arm 14,0 Monate (Hazard-Ratio = 0,78; 95 % CI = 0,64-0,96). Der Prozentsatz von Patienten, die eine Behandlung nach Beendigung der Studientherapie erhielten, betrug 64,3 % für Pemetrexed und 71,7 % für Placebo.
PARAMOUNT: Kaplan-Meier-Plots des progressionsfreien Überlebens (PFS) und des Überlebens (OS) bei fortgeführter Pemetrexed-Behandlung als Erhaltungstherapie versus Placebo bei Patienten mit NSCLC außer überwiegender plattenepithelialer Histologie (berechnet nach Randomisierung)
Progressionsfreies Überleben (PFS)
Überleben (OS)
Die Pemetrexed-Erhaltungstherapie zeigte in beiden Studien JMEN und PARAMOUNT ein ähnliches Verträglichkeitsprofil.
5.2 Pharmakokinetische Eigenschaften
Die pharmakokinetischen Eigenschaften von Pemetrexed nach Gabe als Monotherapeutikum wurden bei 426 Krebspatienten mit verschiedenen soliden Tumoren in Dosen von 0,2 bis 838 mg/m2 in Infusionen über einen Zeitraum von 10 Minuten untersucht. Das Verteilungsvolumen im Steady State beträgt 9 l/m2. Nach Ergebnissen aus In-vitro-Studien wird Pemetrexed zu etwa 81 % an Plasmaproteine gebunden. Die Bindung wurde durch unterschiedliche Grade einer Niereninsuffizienz nicht nennenswert beeinflusst. Pemetrexed wird in eingeschränktem Maße hepatisch metabolisiert. Pemetrexed wird hauptsächlich unverändert im Urin ausgeschieden und 70 % bis 90 % der verabreichten Dosis werden innerhalb von 24 Stunden nach der Anwendung unverändert im Urin wiedergefunden. In-vitro-Studien zeigen, dass Pemetrexed aktiv über OAT3 (Organo-Anion-Transporter) sezerniert wird. Pemetrexed hat eine Gesamtclearance von 91,8 ml/min und die Halbwertszeit im Plasma beträgt 3,5 Stunden bei Patienten mit normaler Nierenfunktion (Kreatinin-Clearance 90 ml/min). Die interindividuelle Variabilität der Clearance ist mit 19,3 % gering. Die Gesamtexposition mit Pemetrexed (AUC) und die maximale Plasmakonzentration erhöhen sich proportional mit der Dosis. Die Pharmakokinetik von Pemetrexed bleibt über mehrere Behandlungszyklen unverändert.
Die Pharmakokinetik von Pemetrexed wird von gleichzeitig verabreichtem Cisplatin nicht beeinflusst. Die orale Gabe von Folsäure und die intramuskuläre Gabe von Vitamin B12 verändern nicht die Pharmakokinetik von Pemetrexed.
5.3 Präklinische Daten zur Sicherheit
Die Anwendung von Pemetrexed in trächtigen Mäusen führte zu einem verringerten Geburtsgewicht, unvollständiger Ossifikation einiger Skelettstrukturen und Gaumenspalte.
Die Anwendung von Pemetrexed führte bei männlichen Mäusen zur Reproduktionstoxizität mit etwas verringerter Fertilität und testikulärer Atrophie. In einer Studie mit Beagle-Hunden, die für 9 Monate intravenöse Bolus-Injektionen erhalten hatten, wurden testikuläre Veränderungen beobachtet (Degeneration/Nekrose des seminiferen Epithelgewebes). Dies lässt den Schluss zu, dass Pemetrexed die männliche Fertilität beeinträchtigen kann. Die weibliche Fertilität wurde nicht untersucht.
Pemetrexed wirkte sowohl im In-vitro-Chromosomenaberrationstest in Ovarialzellen des chinesischen Hamsters als auch im Ames-Test nicht mutagen. Pemetrexed wirkte im In-vivo-Micronucleus-Test in der Maus klastogen.
Es wurden keine Studien zur Bewertung des kanzerogenen Potenzials von Pemetrexed durchgeführt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Mannitol (Ph. Eur.)
Salzsäure (zur pH-Einstellung)
Natriumhydroxid (zur pH-Einstellung)
6.2 Inkompatibilitäten
Pemetrexed ist mit calciumhaltigen Lösungen inkompatibel, einschließlich Ringer-Lactat-Lösung und Ringer-Lösung. Da keine weiteren Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel, außer mit den unter Abschnitt 6.6 aufgeführten, nicht mit anderen Arzneimitteln werden.
6.3 Dauer der Haltbarkeit
Ungeöffnete Durchstechflasche 3 Jahre.
Stabilität der zubereiteten Lösung und der Lösung im Infusionsbeutel
Nach der Zubereitung (Rekonstitution) gemäß Anweisung enthält die Pemetrexed-Lösung zur Infusion kein antibakterielles Konservierungsmittel. Für die zubereitete Lösung wurde die chemische und physikalische Stabilität bei Kühlschranktemperatur (2 °C bis 8 °C) für einen Zeitraum von 24 Stunden nachgewiesen. Aus mikrobiologischer Sicht ist das Produkt unverzüglich anzuwenden. Sofern nicht unverzüglich angewendet, liegen die Aufbewahrungszeiten und die Bedingungen nach der Zubereitung in der Verantwortung des Anwenders und sollten 24 Stunden bei 2 °C bis 8 °C nicht
überschreiten.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Ungeöffnete Durchstechflasche
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich. Aufbewahrungsbedingungen nach Rekonstitution des Arzneimittels siehe Abschnitt 6.3.
6.5 Art und Inhalt des Behältnisses
10-ml-Durchstechflasche (Glasart I) mit Gummistopfen (Bromobutyl- oder Chlorobutyl-Elastomer, beschichtet z. B. mit Teflon) und Aluminium-Schnappdeckel mit elfenbeinfarbenem Klappdeckel; sie enthält 100 mg Pemetrexed.
25-ml-Durchstechflasche (Glasart I) mit Gummistopfen (Bromobutyl- oder Chlorobutyl-Elastomer, beschichtet z. B. mit Teflon) und Aluminium-Schnappdeckel mit blauem Klappdeckel; sie enthält 500 mg Pemetrexed.
50-ml-Durchstechflasche (Glasart I) mit Gummistopfen (Bromobutyl- oder Chlorobutyl-Elastomer, beschichtet z. B. mit Teflon) und Aluminium-Schnappdeckel mit grünem Klappdeckel, sie enthält 1000 mg Pemetrexed.
Packungsgröße: 1 Durchstechflasche.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
1. Verwenden Sie die erforderliche aseptische Technik bei der Zubereitung und weiteren Verdünnung von Pemetrexed für die Anwendung als Lösung zur intravenösen Infusion.
2. Berechnen Sie die Dosis und die Anzahl der notwendigen Durchstechflaschen von Pemetrexed Zentiva. Jede Durchstechflasche enthält einen Überschuss an Pemetrexed, um die Entnahme der angegebenen Menge zu ermöglichen.
3. Pemetrexed Zentiva 100 mg:
Lösen Sie den Inhalt der 100-mg-Durchstechflasche mit 4,2 ml 0,9%iger NatriumchloridInjektionslösung (9 mg/ml) ohne Konservierungsmittel auf, daraus resultiert eine Lösung mit einer Konzentration von ungefähr 25 mg/ml Pemetrexed. Schwenken Sie das Fläschchen vorsichtig, bis das Pulver vollständig gelöst ist. Die entstandene Lösung ist klar und die Färbung reicht von farblos bis gelb oder grüngelb, ohne dass die Produktqualität beeinträchtigt ist. Der pH der zubereiteten Lösung liegt zwischen 6,6 und 7,8. Ein weiterer Verdünnungsschritt ist notwendig.
In Abhängigkeit von der Körperoberfläche, aber auch nur bis zu einer Dosis von 1.700 mg liegt die Osmolalität der rekonstituierten und weiter verdünnten Lösung zwischen 280 und 500 Milliosmol/kg.
Pemetrexed Zentiva 500 mg:
Lösen Sie den Inhalt der 500-mg-Durchstechflasche mit 20 ml 0,9%iger NatriumchloridInjektionslösung (9 mg/ml) ohne Konservierungsmittel auf, daraus resultiert eine Lösung mit einer Konzentration von ungefähr 25 mg/ml Pemetrexed. Schwenken Sie das Fläschchen vorsichtig, bis das Pulver vollständig gelöst ist. Die entstandene Lösung ist klar und die Färbung reicht von farblos bis gelb oder grüngelb, ohne dass die Produktqualität beeinträchtigt ist. Der pH der zubereiteten Lösung liegt zwischen 6,6 und 7,8. Ein weiterer Verdünnungsschritt ist notwendig.
In Abhängigkeit von der Körperoberfläche, aber auch nur bis zu einer Dosis von 1.700 mg liegt die Osmolalität der rekonstituierten und weiter verdünnten Lösung zwischen 280 und 500 Milliosmol/kg.
Pemetrexed Zentiva 1000 mg:
Lösen Sie den Inhalt der 1000-mg-Durchstechflasche mit 40 ml 0,9%iger NatriumchloridInjektionslösung (9 mg/ml) ohne Konservierungsmittel auf, daraus resultiert eine Lösung mit einer Konzentration von ungefähr 25 mg/ml Pemetrexed. Schwenken Sie das Fläschchen vorsichtig, bis das Pulver vollständig gelöst ist. Die entstandene Lösung ist klar und die Färbung reicht von farblos bis gelb oder grüngelb, ohne dass die Produktqualität beeinträchtigt ist. Der pH der zubereiteten Lösung liegt zwischen 6,6 und 7,8. Ein weiterer Verdünnungsschritt ist notwendig.
In Abhängigkeit von der Körperoberfläche, aber auch nur bis zu einer Dosis von 1.700 mg liegt die Osmolalität der rekonstituierten und weiter verdünnten Lösung zwischen 280 und 500 Milliosmol/kg.
4. Verdünnen Sie das benötigte Volumen an rekonstituierter Pemetrexed-Lösung mit 0,9%iger Natriumchlorid-Injektionslösung (9 mg/ml) ohne Konservierungsmittel auf 100 ml Gesamtvolumen. Diese Lösung ist anschließend mittels intravenöser Infusion über einen Zeitraum von 10 Minuten zu verabreichen.
5. Pemetrexed-Infusionslösungen, die wie oben angegeben zubereitet wurden, sind kompatibel mit Polyvinylchlorid- und Polyolefin-beschichteten Infusionssets und -beuteln.
6. Parenteral zu applizierende Arzneimittel müssen vor der Anwendung auf Partikel und Verfärbung kontrolliert werden. Nicht anwenden, wenn Partikel sichtbar sind.
7. Pemetrexed-Lösungen sind zur Einmalanwendung bestimmt. Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen für Zytostatika zu beseitigen.
Zubereitung und Vorsichtsmaßnahmen bei der Anwendung: Wie bei anderen potenziell toxischen Onkolytika sollten die Handhabung und Zubereitung von Pemetrexed-Infusionslösungen mit Vorsicht geschehen. Die Verwendung von Handschuhen wird empfohlen. Sollte eine Pemetrexed-Lösung in Kontakt mit der Haut kommen, waschen Sie die Haut sofort und gründlich mit Wasser und Seife. Wenn Pemetrexed in Kontakt mit der Schleimhaut kommt, gründlich mit Wasser spülen. Pemetrexed wirkt nicht blasenbildend. Es gibt kein spezielles Antidot für Extravasate von Pemetrexed. Bis heute gibt es nur wenige Berichte über Extravasate von Pemetrexed, welche von den Prüfern nicht als schwerwiegend eingestuft wurden. Extravasate von Pemetrexed sollten mit den üblichen lokalen Standardmethoden für Extravasate anderer nicht blasenbildender Arzneimittel behandelt werden.
7. INHABER DER ZULASSUNG
Zentiva Pharma GmbH 65927 Frankfurt am Main Telefon: (01 80) 2 02 00 101
Telefax: (01 80) 2 02 00 111
Mitvertrieb:
Winthrop Arzneimittel GmbH 65927 Frankfurt am Main
Sanofi-Aventis Deutschland GmbH 65926 Frankfurt am Main
8. ZULASSUNGSNUMMERN
Pemetrexed Zentiva 100 mg: 93631.00.00 Pemetrexed Zentiva 500 mg: 93632.00.00 Pemetrexed Zentiva 1000 mg: 93633.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 09.03.2016
10. STAND DER INFORMATION
März 2016
11. VERKAUFSABGRENZUNG V erschreibungspflichtig.
24
0,06 €/Anruf (dt. Festnetz); max. 0,42 €/min (Mobilfunk).