Pen Mega - 1 A Pharma
Wortlaut der für die Fachinformation vorgesehen Angaben
F achinformation
1. BEZEICHNUNG DER ARZNEIMITTEL
Pen Mega - 1 A Pharma®
Pen 1,5 Mega - 1 A Pharma®
Wirkstoff: Phenoxymethylpenicillin-Kalium
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Pen Mega - 1 A Pharma
1 Filmtablette enthält 1 Million (1 Mega) Einheiten, entsprechend 653,6 mg Phenoxymethylpenicillin-Kalium bzw. 590 mg Phenoxymethylpenicillin.
Pen 1,5 Mega - 1 A Pharma
1 Filmtablette enthält 1,5 Millionen (1,5 Mega) Einheiten, entsprechend 980,4 mg Phenoxymethylpenicillin-Kalium bzw. 885 mg Phenoxymethylpenicillin.
Sonstige Bestandteile mit bekannter Wirkung:
Pfefferminzöl (enthält Levomethol) (siehe Abschnitt 4.3) und Kalium (siehe Abschnitt 4.4) Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Filmtabletten
Pen Mega - 1 A Pharma:
Weiß, oblong, bikonvex, mit beidseitiger Bruchkerbe.
Die Filmtablette kann in gleiche Dosen geteilt werden.
Pen 1,5 Mega - 1 A Pharma:
Weiß, oval, bikonvex, mit beidseitiger Bruchkerbe.
Die Filmtablette kann in gleiche Dosen geteilt werden.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur Behandlung von leichten bis mittelschweren Infektionen, die durch Phenoxymethylpenicillinsensible Erreger verursachr und einer oralen Penicillin-Therapie zugänglich sind (siehe Abschnitt 5.1), wie z. B.:
• Infektionen des Hals-, Nasen-, Ohrenbereiches (Pharyngitis, Tonsillitis, Sinusitis, Otitis media),
• Infektionen der tiefen Atemwege (Bronchitis, Bronchopneumonie, Pneumonie),
• Infektionen im Zahn-, Mund- und Kieferbereich,
• Endokarditisprophylaxe bei Eingriffen im Zahn-, Mund- und Kieferbereich oder am oberen Respirationstrakt,
• Infektionen der Haut (Pyodermie, Furunkulose, Phlegmone),
• Lymphadenitis, Lymphangitis,
• Infektionen verursacht durch Beta-hämolysierende Streptokokken der Gruppe A, z. B. Scharlach, Erysipel, Rezidivprophylaxe bei rheumatischem Fieber.
Gegebenenfalls ist eine Kombination mit einem weiteren geeigneten Antibiotikum möglich.
Die offiziellen Richtlinien für den angemessenen Gebrauch von antimikrobiellen Wirkstoffen sind bei der Anwendung von Pen Mega/1,5 Mega - 1 A Pharma zu berücksichtigen.
4.2 Dosierung und Art der Anwendung
Die antibakterielle Aktivität des Phenoxymethylpenicillin wird sowohl auf der Basis von Einheiten als auch auf Masse-(Gewichts-) Basis festgelegt. Dabei gilt folgende Beziehung:
• 1 mg Phenoxymethylpenicillin (freie Säure) entspricht 1695 Einheiten und 1 mg Phenoxymethylpenicillin-Kalium entspricht 1530 Einheiten.
• 1 000 000 Einheiten (1 Mega) entsprechen ungefähr 590 mg Phenoxymethylpenicillin bzw.
654 mg Phenoxymethylpenicillin-Kalium.
• 1500 000 Einheiten (1,5 Mega) entsprechen ungefähr 885 mg Phenoxymethylpenicillin bzw. 980 mg Phenoxymethylpenicillin-Kalium.
Dosierungsempfehlungen
Die Tagesdosis wird in 3 bis 4 Einzeldosen - gleichmäßig über den Tag verteilt - möglichst im Abstand von 6 bis 8 Stunden verabreicht.
Bei Infektionen des Hals-, Nasen-, Ohrenbereichs kann die Tagesdosis in zwei Einzeldosen im Abstand von 12 Stunden gegeben werden.
Zur Beachtung: Alle Milligramm-Angaben in den folgenden Ausführungen beziehen sich auf Phenoxymethylpenicillin (freie Säure).
Erwachsene und Jugendliche über 12 Jahre
Je nach Schwere und Lokalisation der Infektion 3- bis 4-mal täglich jeweils 295-885 mg Phenoxymethylpenicillin (0,5—1,5 Millionen Einheiten), entsprechend 3-mal täglich 1 Filmtablette Pen Mega/1,5 Mega - 1 A Pharma.
Kinder unter 12 Jahren
Kinder erhalten eine auf das jeweilige Körpergewicht und Lebensalter abgestimmte Tagesdosis.
• Kinder von 8-12 Jahren (über 30 kg Körpergewicht)
Tagesdosis: 708—1.416 mg (1,2—2,4 Millionen Einheiten), aufgeteilt in 3 bis 4 Einzeldosen, entsprechend 3- bis 4-mal täglich !4 Filmtablette Pen Mega — 1A Pharma oder 3-mal täglich !4 Filmtablette Pen 1,5 Mega — 1A Pharma.
• Kinder unter 8 Jahren
Pen Mega/1,5 Mega - 1 A Pharma sind für Kinder unter 8 Jahren auf Grund der Darreichungsform und des Wirkstoffgehaltes nicht geeignet. Für diese Altersgruppe steht
eine niedriger dosierbare, flüssige Darreichungsform (Pen 0,4 Mega TS - 1A Pharma) zur Verfügung.
Bei schweren Fällen bzw. bei minderempfindlichen Erregern oder ungünstig gelegenem Infektionsort kann die Tagesdosis auf das Doppelte und mehr gesteigert werden.
Dosierung bei eingeschränkter Nierenfunktion
Bis zu einer Kreatinin-Clearance von 30 - 15 ml/min ist es bei einem Dosierungsintervall von 8 Stunden im Allgemeinen nicht erforderlich, die Dosis von Phenoxymethylpenicillin zu verringern. Bei Anurie wird eine Verlängerung des Dosierungsintervalls auf 12 Stunden empfohlen.
Art der Anwendung
Pen Mega/1,5 Mega - 1 A Pharma sollte jeweils etwa 1 Stunde vor den Mahlzeiten eingenommen werden, um eine möglichst hohe Resorptionsquote zu erreichen.
Die Filmtabletten sind unzerkaut (schlechter Geschmack des Wirkstoffes) mit reichlich Flüssigkeit (z. B. 1 Glas Wasser) einzunehmen.
Um Kindern die regelmäßige Einnahme zu erleichtern, können sie Pen Mega/1,5 Mega - 1 A Pharma auch während der Mahlzeiten einnehmen.
Die Filmtabletten sind teilbar.
Dauer der Anwendung
Pen Mega/1,5 Mega - 1 A Pharma soll in der Regel 7- (bis 10) Tage lang eingenommen werden, mindestens bis 2 bis 3 Tage nach Abklingen der Krankheitserscheinungen.
Die Behandlungsdauer ist vom Ansprechen der Erreger bzw. dem klinischen Erscheinungsbild abhängig. Sollte nach 3 bis 4 Tagen ein Therapieeffekt nicht erkennbar sein, so ist eine erneute Sensibilitätsbestimmung durchzuführen und gegebenenfalls das Antibiotikum zu wechseln.
Bei der Behandlung von Infektionen mit Beta-hämolysierenden Streptokokken sollte die Therapiedauer mindestens 10 Tage betragen, um Spätkomplikationen (rheumatisches Fieber, Glomerulonephritis) vorzubeugen.
Die Behandlungsdauer der akuten Otitis media sollte auf 5 Tage begrenzt werden. Bei Patienten mit einem Risiko für Komplikationen kann eine Behandlungsdauer von 5 bis 10 Tagen empfehlenswert sein.
4.3 Gegenanzeigen
• Überempfindlichkeit gegen den Wirkstoff, gegen andere Penicilline, gegen Pfefferminzöl (enthält Levomenthol) oder gegen weitere der in Abschnitt 6.1 genannten sonstigen Bestandteile.
• Schwere akute Überempfindlichkeitsreaktionen (z. B. Anaphylaxie) auf ein anderes Beta-Laktam-Antibiotikum in der Anamnese.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Vor Beginn einer Behandlung mit Pen Mega/1,5 Mega - 1 A Pharma sollte die Vorgeschichte des Patienten im Hinblick auf vorangegangene Überempfindlichkeitsreaktionen auf Penicilline, Beta-Lactam-Antibiotika und andere Allergene sorgfältig abgeklärt werden.
Schwere und gelegentlich tödliche Überempfindlichkeitsreaktionen (anaphylaktoide Reaktionen) wurden bei mit Penicillinen (einschließlich dem oralen Phenoxymethylpenicillin) behandelten Patienten beobachtet. Kreuzallergien können in Verbindung mit Cephalosporinen und anderen Beta-Lactam-Antibiotika auftreten. Personen mit einer Überempfindlichkeitsreaktionen auf Penicilline oder Cephalosporine in der Vorgeschichte und Patienten mit allergischer Reaktionsbereitschaft (z. B. Heuschnupfen, Asthma bronchiale) tragen ein erhöhtes Risiko für solche Reaktionen, weshalb PenHEXAL in solchen Fällen mit besonderer Vorsicht angewandt werden muss. Beim Auftreten allergischer Reaktionen sollte das Arzneimittel abgesetzt und eine angemessene Behandlung mit den üblichen Wirkstoffen (z. B. Adrenalin bzw. andere blutdrucksteigernde Amine, Antihistamine oder Kortikosteroide) erfolgen.
Bei deutlich eingeschränkter Nierenfunktion ist bei der Verabreichung Vorsicht geboten, da es zu Wirkungen auf des zentrale Nervensystems kommen kann (siehe auch Abschnitt 4.8).
Bei Patienten mit schweren Magen-Darm-Störungen mit Erbrechen und Durchfällen sollte von der Behandlung mit Phenoxymethylpenicillin abgesehen werden, da eine ausreichende Resorption nicht gewährleistet ist (Hier empfiehlt sich eine parenterale Therapiemit einem geeigneten Antibiotikum).
Langfristige und wiederholte Anwendung von Pen Mega/1,5 Mega - 1 A Pharma kann zu Superinfektion mit resistenten Keimen oder mit Sprosspilzen führen (siehe Abschnitt 4.8). Daher sollten die Patienten in regelmäßigen Abständen hinsichtlich einer Sekundärinfektion kontrolliert und gegebenenfalls geeignete Maßnahmen ergriffen werden. Bei Patienten mit rheumatoidem Fieber in der Anamnese, die eine kontinuierliche Prophylaxe erhalten, sollte die Anwendung eines anderen prophylaktischen Wirkstoffs in Betracht gezogen werden.
Schwere und anhaltende Durchfälle während oder nach der Therapie mit Phenoxymethylpenicillin können ein Hinweis auf eine pseudomembranöse Enterokolitis sein. Hier ist eine Beendigung der Therapie mit Pen Mega/1,5 Mega - 1 A Pharma in Abhängigkeit von der Indikation zu erwägen und gegebenenfalls sofort eine angemessene Behandlung einzuleiten (z. B. Einnahme von speziellen Antibiotika/Chemotherapeutika, deren Wirksamkeit klinisch erwiesen ist). Arzneimittel, die die Peristaltik hemmen, sind kontraindiziert.
Pen Mega - 1 A Pharma
Eine Filmtablette enthält 1,64 mmol (64mg) Kalium . Dies ist zu berücksichtigen bei Patienten mit eingeschränkter Nierenfunktion sowie Personen unter Kalium kontrollierter Diät.
Pen 1,5 Mega - 1 A Pharma
Eine Filmtablette enthält 2,46 mmol (96 mg) Kalium . Dies ist zu berücksichtigen bei Patienten mit eingeschränkter Nierenfunktion sowie Personen unter Kalium kontrollierter Diät.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Antikoagulantien:
Penicilline können eine antikoagulative Therapie beeinflussen.
Probenecid:
Verringerte Ausscheidung von Phenoxymethylpenicillin aufgrund der Konkurrenz um die tubuläre Sekretion.
Sulfinpyrazon:
Verringerte Ausscheidung von Penicillinen durch Sulfinpyrazon.
Erythromycin, Tetracycline, Chloramphenicol:
Bei kombinierter Anwendung ist ein antagonistischer Effekt möglich. Die gleichzeitige Anwendung bakteriostatisch wirkendender Chemotherapeutika/Antibiotika wird nicht empfohlen.
Neomycin:
Es wurde berichtet, dass Neomycin die Resorption von Phenoxymethylpenicillin verringert.
Orale Kontrazeptiva:
Penicilline können die Wirksamkeit von oralen Empfängnisverhütungsmitteln beeinflussen. Methothrexat:
Die gleichzeitige Behandlung mit Methotrexat kann dessen Serumspiegel erhöhen und dessen toxische Wirkung verstärken. Eine Überwachung des Methotrexat-Serumspiegels ist daher erforderlich.
Oraler Typhusimpfstoff:
Penicilline können orale Typhusimpfstoffe inaktivieren.
Einfluss auf Laboruntersuchungen
Unter einer Therapie mit Pen Mega/1,5 Mega - 1 A Pharma können nicht-enzymatische Methoden zur Harnzuckerbestimmung ein falsch positives Resultat ergeben. Ebenso kann der Urobilinogen-Nachweis gestört werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Beobachtungen am Menschen haben bisher keinen Hinweis auf Schädigung des im Mutterleib befindlichen Kindes ergeben. Experimentelle Studien haben keine fruchtschädigende Wirkung erkennen lassen.
Da bisher keinerlei schädigende Wirkungen von Phenoxymethylpenicillin bekannt geworden sind, ist eine Anwendung von Pen Mega/1,5 Mega - 1 A Pharma während der gesamten Schwangerschaft bei entsprechender Indikation möglich.
Stillzeit
Phenoxymethylpenicillin wird in die Muttermilch ausgeschieden. Die maximalen Milchspiegel betragen etwa 50 % der maximalen Serumspiegel. Beim gestillten Säugling ist die Möglichkeit einer Sensibilisierung bzw. einer Beeinflussung der physiologischen Darmflora mit Auftreten von Durchfall oder Sprosspilzbesiedlung zu beachten.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
Allerdings können die möglichen Nebenwirkungen zu einer entsprechenden Beeinträchtigung führen.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig: Häufig: Gelegentlich: Selten:
Sehr selten: Nicht bekannt:
(> 1/10)
(> 1/100 bis < 1/10)
(> 1/1.000 bis < 1/100)
(> 1/10.000 bis <1/1.000)
(< 1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Infektionen und parasitäre Erkrankungen
Häufigkeit nicht bekannt: Superinfektion mit resistenten Keimen oder Sprosspilzen (siehe auch Abschnitt 4.4)
Erkrankungen des Blutes und des Lymphsystems
Sehr selten: Blutbildveränderungen in Form von Neutropenie Leukopenie,
Agranulozytose, Thrombozytopenie, Panzytopenie, hämolytische Anämie, Eosinophilie Koagulationsstörungen. Diese Erscheinungen sind reversibel.
Erkrankungen des Immunsystems
Häufig: allergische Reaktionen, meist in Form von Hautreaktionen (z. B.
Exantheme, Juckreiz, Urtikaria). Eine urtikarielle Sofortreaktion deutet meist auf eine echte Penicillin-Allergie hin und zwingt zum Therapieabbruch.
Sehr selten: schwerwiegende allergische Reaktionen als Folge einer Sensibilisierung
gegen die 6-Amino-Penicillansäure-Gruppe, z. B. in Form von Arzneimittelfieber, Gelenkschmerzen, angioneurotischem Ödem, Larynxödem, Bronchospasmen, Herzjagen, Luftnot, Serumkrankheit, allergischer Vaskulitis, schweren bullösen Hautreaktionen wie z.B. Stevens-Johnson-Syndrom, Lyell-Syndrom sowie Blutdruckabfall bis hin zu bedrohlichem Schock
Überempfindlichkeitsreaktionen aller Schweregrade - bis zum anaphylaktischen Schock - sind auch nach oraler Gabe von Penicillinen beobachtet worden. Schwere anaphylaktoide Reaktionen, die nach oraler Gabe von Penicillinen wesentlich seltener auftreten als nach intravenöser oder intramuskulärer Gabe, erfordern unter Umständen entsprechende Notfallmaßnahmen (siehe auch Abschnitt 4.4).
Erkrankungen des Nervensystems
Sehr selten: aseptische Meningitis
Häufigkeit nicht bekannt: Wirkungen auf des zentrale Nervensystems, einschließlich
Krampfanfälle (insbesondere bei hohen Dosen oder schwerer Nierenfunktionsstörung)
Erkrankungen des Gastrointestinaltrakts
Gastrointestinale Störungen, wie Übelkeit, Erbrechen, Appetitlosigkeit, Magendrücken, Bauchschmerzen, Flatulenz, weiche Stühle und Durchfälle(auch blutig). Diese Störungen sind meist leichter Natur und klingen häufig während, sonst nach Absetzen der Therapie ab.
Häufig:
Sehr selten: pseudomembranöse Enterokolitis, meist verursacht durch Clostridium
difficile (siehe auch Abschnitt 4.4).
Häufigkeit nicht bekannt: vorübergehend trockener Mund und Geschmacksveränderungen Leber- und Gallenerkrankungen
Sehr selten: Hepatitis und cholestatische Gelbsucht
Erkrankungen der Haut und des Unterhautzellgewebes
(siehe auch Erkrankungen des Immunsystems)
Häufig: Hautausschläge (Exantheme) und Schleimhautentzündungen,
besonders im Bereich des Mundes (Glossitis, Stomatitis)
Erkrankungen der Nieren und Harnwege
Sehr selten: interstitielle Nephritis
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Selten: Ausbildung einer schwarzen Haarzunge
Sehr selten: vorübergehende Zahnverfärbungen
Häufigkeit nicht bekannt: Parästhesien bei langer Anwendung
Bei der Behandlung von Spirochäteninfektionen kann es zu einer Herxheimer-Reaktion kommen, die durch Auftreten bzw. Verschlechterung von Allgemeinsymptomen wie z. B. Fieber, Schüttelfrost, Kopf- und Gelenkschmerzen gekennzeichnet ist.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit.
Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Die Toxizität von Phenoxymethylpenicillin ist äußerst gering, die therapeutische Breite ist außerordentlich groß.
Wie bei anderen Penicillinen ist die einmalige orale Aufnahme des Mehrfachen der therapeutischen Dosen von Phenoxymethylpenicillin nicht akut toxisch.
Bei oraler Verabreichung ist es praktisch unmöglich, Konzentrationen zu erreichen, die zur Auslösung neurotoxischer Symptome führen.
Symptome einer Überdosierung können sein: Brechreiz, Erbrechen, Bauchschmerzen, Diarrhöe und selten motorische Krämpfe. Wenn andere Symptome vorkommen, ist an die Möglichkeit einer allergischen Reaktion zu denken. Hyperkaliämie kann sich besonders bei Patienten mit einer Niereninsiffizienz unter Überdosierung ergeben.
Therapie einer Überdosierung: Spezielle Maßnahmen bei Überdosierung, außer dem Absetzen des Medikamentes, sind nicht erforderlich.
Eine Elimination von Phenoxymethylpenicillin kann mittels Hämodialyse erzielt werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe
Phenoxymethylpenicillin (Penicillin V) ist ein biosynthetisches, säurestabiles, nicht Betalaktamase-festes Betalaktam-Antibiotikum.
ATC-Code
J01CE02
Wirkungsweise
Der Wirkungsmechanismus von Phenoxymethylpenicillin beruht auf einer Hemmung der bakteriellen Zellwandsynthese (in der Wachstumsphase) durch Blockade der Penicillin-bindenden Proteine (PBPs) wie z. B. der Transpeptidasen. Hieraus resultiert eine bakterizide Wirkung.
Beziehung zwischen Pharmakokinetik und Pharmakodynamik
Die Wirksamkeit hängt im Wesentlichen von der Zeitdauer ab, während der der Wirkstoffspiegel oberhalb der MHK des Erregers liegt.
Resistenzmechanismen
Eine Resistenz gegenüber Phenoxymethylpenicillin kann auf folgenden Mechanismen beruhen:
- Inaktivierung durch Betalaktamasen: Phenoxymethylpenicillin ist nicht Betalaktamase-fest und wirkt daher nicht gegen Betalaktamase-bildende Bakterien (z. B. Staphylokokken oder Gonokokken).
- Reduzierte Affinität von PBPs gegenüber Phenoxymethylpenicillin: Die erworbene Resistenz bei Pneumokokken und einigen anderen Streptokokken gegenüber Phenoxymethylpenicillin beruht auf Modifikationen vorhandener PBPs als Folge einer Mutation. Für die Resistenz bei Methicillin (Oxacillin)-resistenten Staphylokokken hingegen ist die Bildung eines zusätzlichen PBPs mit verminderter Affinität gegenüber Phenoxymethylpenicillin verantwortlich.
- Unzureichende Penetration von Phenoxymethylpenicillin durch die äußere Zellwand kann bei Gram-negativen Bakterien dazu führen, dass die PBPs nicht ausreichend gehemmt werden.
- Durch Effluxpumpen kann Phenoxymethylpenicillin aktiv aus der Zelle transportiert werden.
Eine partielle oder vollständige Kreuzresistenz von Phenoxymethylpenicillin besteht mit anderen Penicillinen und Cephalosporinen.
Grenzwerte
Die Testung auf Empfindlichkeit gegenüber Phenoxymethylpenicillin erfolgt mit Hilfe von Benzylpenicillin unter Benutzung der üblichen Verdünnungsreihe. Folgende minimale Hemmkonzentrationen für sensible und resistente Keime wurden festgelegt:
|
Erreger |
Sensibel |
Resistent |
|
Staphylococcus spp. |
< 0,12 mg/l |
> 0,12 mg/l |
|
Streptococcus spp. (Gruppen A, B, C, G) |
< 0,25 mg/l |
> 0,25 mg/l |
|
Streptococcus pneumoniae |
< 0,06 mg/l |
> 2 mg/l |
|
Streptokokken der „Viridans“-Gruppe |
< 0,25 mg/l |
> 2 mg/l |
|
Neisseria gonorrhoeae |
< 0,06 mg/l |
> 1 mg/l |
|
Neisseria meningitidis |
< 0,06 mg/l |
> 0,25 mg/l |
|
Gram-negative Anaerobier |
< 0,25 mg/l |
> 0,5 mg/l |
|
Gram-positive Anaerobier |
< 0,25 mg/l |
> 0,5 mg/l |
|
Nicht speziesspezifische Grenzwerte* |
< 0,25 mg/l |
> 2 mg/l |
* Basieren hauptsächlich auf der Serumpharmakokinetik
Prävalenz der erworbenen Resistenz in Deutschland
Die Prävalenz der erworbenen Resistenz einzelner Spezies kann örtlich und im Verlauf der Zeit variieren. Deshalb sind - insbesondere für die adäquate Behandlung schwerer Infektionen - lokale Informationen über die Resistenzsituation erforderlich. Falls auf Grund der lokalen Resistenzsituation die Wirksamkeit von Phenoxymethylpenicillin in Frage gestellt ist, sollte eine Therapieberatung durch Experten angestrebt werden. Insbesondere bei schwerwiegenden Infektionen oder bei Therapieversagen ist eine mikrobiologische Diagnose mit dem Nachweis des Erregers und dessen Empfindlichkeit gegenüber Phenoxymethylpenicillin anzustreben.
Prävalenz der erworbenen Resistenz in Deutschland auf der Basis von Daten der letzten 5 Jahre aus nationalen Resistenzüberwachungsprojekten und -studien (Stand: Dezember 2012):
Aerobe Gram-positive Mikroorganismen
Actinomyces israelii
O
Corynebacterium diphtheriae °
Erysipelothrix rhusiopathiae °
Gardnerella vaginalis °
Streptococcus agalactiae
Streptococcus pneumoniae
Streptococcus pyogenes
Streptococcus dysgalactiae subsp. equisimilis ' (Streptokokken der Gruppen C & G)_
Streptokokken der „Viridans“-Gruppe °
A
Aerobe Gram-negative Mikroorganismen
Borrelia burgdorferi
Eikenella corrodens
o
Haemophilus influenzae
Anaerobe Mikroorganismen
Clostridium perfringens
o
Clostridium tetani
o
Fusobacterium spp.
o
Peptoniphilus spp.
o
Mycoplasma spp.
Veillonella parvula °
Andere Mikroorganismen
Treponema pallidum
O
Spezies, bei denen erworbene Resistenzen ein Problem bei der Anwendung darstellen können
Aerobe Gram-positive Mikroorganismen
Enterococcus ^ faecalis
Staphylococcus aureus
Staphylococcus epidermidis
Staphylococcus haemolyticus
Staphylococcus hominis
Aerobe Gram-negative Mikroorganismen
Neisseria gonorrhoeae
Von Natur aus resistente Spezies
Aerobe Gram-positive Mikroorganismen
Enterococcus faecium
Nocardia asteroides
Aerobe Gram-negative Mikroorganismen
Alle Enterobacteriaceae-Spezies
Moraxella catarrhalis
Pseudomonas aeruginosa
Anaerobe Mikroorganismen
Bacteroides spp.
Andere Mikroorganismen
Chlamydia spp.
Chlamydophila spp.
Legionella pneumophila
° Bei Veröffentlichung der Tabelle lagen keine aktuellen Daten vor. In der Primärliteratur, Standardwerken und Therapieempfehlungen wird von einer Empfindlichkeit ausgegangen.
$ Die natürliche Empfindlichkeit der meisten Isolate liegt im intermediären Bereich.
+ In mindestens einer Region liegt die Resistenzrate bei über 50%.
A Sammelbezeichnung für eine heterogene Gruppe von Streptokokken-Spezies. Resistenzrate kann in Abhängigkeit von der vorliegenden Streptokokken-Spezies variieren.
5.2 Pharmakokinetische Eigenschaften
Soweit nicht ausdrücklich erwähnt, beziehen sich die folgenden Angaben ausschließlich auf Phenoxymethylpenicillin-Kalium.
Resorption
Phenoxymethylpenicillin wird aufgrund seiner Säurestabilität nach weitgehend verlustfreier Magenpassage in den oberen Dünndarmabschnitten resorbiert. Die Resorptionsquote beträgt etwa 60 %. Das Ausmaß der Resorption hängt auch von der galenischen Form ab. Feste Darreichungsformen sind unproblematischer als Granulate zur Zubereitung einer Lösung/Suspension. Gleichzeitige Nahrungsaufnahme führt zu einer Verminderung der Resorption. Maximale Serumkonzentrationen werden nach ca. 30 - 60 Minuten erreicht. Nach oraler Gabe von 0,4 g, 1 g, 2 g und 3 g Penicillin-V wurden mittlere Spitzenkonzentrationen von 6,1; 15; 26,3 und 35,5 mg/l gemessen. Im Dosisbereich von 0,12 bis 3 g besteht eine annähernd lineare Beziehung zwischen der Höhe der Dosis und der Fläche unter der Konzentrations-Zeit-Kurve (AUC).
Nach Gabe von Phenoxymethylpenicillin-Calcium in Form von Tabletten waren die mittleren Serumkonzentrationen niedriger als nach Gabe einer gleich hohen Dosis des Kalium-Salzes.
Die Bioverfügbarkeit des Phenoxymethylpenicillins ist am geringsten nach Verabreichung des Benzathin-Salzes. Die Resorption scheint verzögert zu sein, wie bei einer retardierten Formulierung und die Serumspitzenkonzentrationen sind 3- bis 4-mal niedriger als beim Kalium-Salz. Der limitierende Faktor bei der Resorption des Benzathin-Salzes ist wahrscheinlich die geringe Lösungsgeschwindigkeit und nicht die Resorptionskapazität der Dünndarmmukosa.
Verteilung
Phenoxymethylpenicillin ist gut gewebegängig, und in verschiedenen Organen und Körperflüssigkeiten werden therapeutisch wirksame Konzentrationen erreicht. Die Liquorgängigkeit von Phenoxymethylpenicillin ist auch bei entzündeten Meningen gering. Die Serumproteinbindung von Phenoxymethylpenicillin liegt bei 75 ± 14 % und ist damit höher als die des Benzylpenicillins mit 48 %. Das scheinbare Verteilungsvolumen beträgt 15,3 ± 1,17 l.
Plazentagängigkeit/Übergang in die Muttermilch
29 Schwangere erhielten Phenoxymethylpenicillin unter der Geburt. Die fetalen Blutspiegel betrugen 44 % der Konzentrationen im mütterlichen Blut. Im Fruchtwasser wurden 58 % der mütterlichen Serumkonzentrationen erreicht. Nach einmaliger Einnahme von Phenoxymethylpenicillin lag der Quotient aus Milchkonzentrationen und korrespondierenden Serumkonzentrationen zwischen 0,05 und 1,02 mit einem Mittelwert von 0,15. Etwa 0,2 % der Dosis, die eine stillende Mutter einnimmt, gelangen durch das Stillen in den kindlichen Organismus.
Metabolisierung
Etwa 34 ± 20 % einer Dosis werden in Form von inaktiven Umwandlungsprodukten (z. B. Penicilloinsäure) im Urin aufgefunden.
Elimination
Die Exkretion von unverändertem Phenoxymethylpenicillin und seinen Umwandlungsprodukten erfolgt fast ausschließlich über die Nieren. Phenoxymethylpenicillin wird durch glomeruläre Filtration und tubuläre Sekretion ausgeschieden. Innerhalb von 12 Stunden werden 29 bis 43 % der verabreichten Dosis in unveränderter mikrobiologisch aktiver Form im Urin wiedergefunden. Innerhalb von 24 Stunden wird praktisch die gesamte resorbierte Menge in Form der Muttersubstanz und der Umwandlungsprodukte mit dem Urin ausgeschieden.
Bei Nierengesunden liegt die Serum-Halbwertzeit bei 30 bis 45 Minuten. Die Halbwertzeit ist dosisabhängig. Bei Untersuchungen der Halbwertzeit fand sich nach Gabe einer 0,4 g-Dosis eine Halbwertzeit von 0,5 Stunden und nach einer 3 g-Dosis eine Halbwertzeit von 1,1 Stunden. Bei Neugeborenen und Patienten mit eingeschränkter Nierenfunktion ist die Ausscheidung verzögert. Für die totale Clearance von Phenoxymethylpenicillin wurde nach i.v.-Gabe ein Wert von ca. 800 ml/min ermittelt und in einer anderen Untersuchung ein niedrigerer Wert von 476 ± 236 ml/min.
5.3 Präklinische Daten zur Sicherheit
Bisherige Genotoxizitätsuntersuchungen von Phenoxymethylpenicillin ergaben keine Hinweise auf klinisch relevante Effekte.
Langzeituntersuchungen an Ratten und Mäusen ergaben keine Anhaltspunkte für ein tumorerzeugendes Potenzial von Phenoxymethylpenicillin.
Untersuchungen an verschiedenen Tierspezies haben keine Hinweise auf teratogene Wirkung von Phenoxymethylpenicillin ergeben.
PHARMAZEUTISCHE ANGABEN
6.
6.1 Liste der sonstigen Bestandteile
Tablettenkern:
• Macrogol 6000
• Magnesiumstearat (Ph.Eur.)
• Maltodextrin
• Povidon K25
• Talkum
Filmüberzug:
• Hypromellose
• Pfefferminzöl (enthält Levomenthol)
• Saccharin-Natrium
• Talkum
• Titandioxid (E 171)
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit
2 Jahre
Die Arzneimittel sollen nach Ablauf des auf der Packung angegebenen Verfalldatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung und sonstige Hinweise zur Handhabung
Nicht über 25 °C lagern.
In der Originalverpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen.
6.5 Art und Inhalt des Behältnisses
PVC/PVDC/Aluminium Blister mit je 10 Filmtabletten Packungen mit 10, 14, 20 und 30 Filmtabletten.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
1 A Pharma GmbH Keltenring 1 + 3 82041 Oberhaching Telefon 089/6138825 - 0 Telefax 089/6138825 - 65 E-Mail: medwiss@1apharma.com
8. ZULASSUNGSNUMMERN
Pen Mega - 1 A Pharma®: 41151.00.00
Pen 1,5 Mega - 1 A Pharma®: 41151.01.00
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassungen: 21.01.1998
Datum der letzten Verlängerung der Zulassungen: 14.02.2003
10. STAND DER INFORMATION
September 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Bioverfügbarkeit
Pen 1,5 Mega - 1 A Pharma
Eine im Jahr 1999 durchgeführte Bioverfügbarkeitsuntersuchung an 22 Probanden (10 weibliche, 12 männliche Probanden) ergab im Vergleich zum Referenzpräparat:
Testpräparat Referenzpräparat
cmax [Eg/ml] 10,04 ± 3,71 9,84 ± 3,87
maximale Plasmakonzentration
tmax [h] 0,69 ± 0,20 0,77 ± 0,43
Zeitpunkt der maximalen Plasmakonzentration
AUC(0-t) [Eg*h/ml] 14,18 ± 4,42 14,99 ± 4,35
Fläche unter der KonzentrationsZeit-Kurve
Angabe der Werte als arithmetrische Mittelwerte und Streubreite
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem KonzentrationsZeit-Diagramm:
E
O)
o
n
o
*
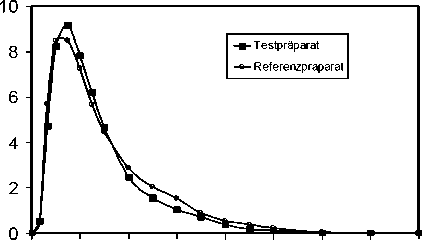
01 2345678
Zeit [h]
Aufgrund analoger Rezepturen und gegebener Dosislinearität ist diese Bioverfügbarkeitsstudie auch auf das Präparat Pen Mega - 1 A Pharma anwendbar.