Petnidan Saft
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Petnidan 250 mg/Weichkapseln
Petnidan Saft, 50 mg/ml Lösung zum Einnehmen
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Petnidan
1 Weichkapsel enthält 250 mg Ethosuximid.
Petnidan Saft
1 ml Lösung zum Einnehmen enthält 50 mg Ethosuximid. 1 Messlöffel (5 ml) enthält 250 mg Ethosuximid.
Sonstige Bestandteile mit bekannter Wirkung: Methyl(4-hydroxybenzoat)-Natriumsalz Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Petnidan
Ovale elfenbeinfarbene, opake Weichkapsel Petnidan Saft
Leicht gelbliche bis bräunliche Lösung mit Karamellgeschmack
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
- pyknoleptische Absencen sowie komplexe und atypische Absencen Hinweis:
Zur Vermeidung der bei komplexen und atypischen Absencen häufig hinzukommenden großen Anfälle kann Ethosuximid mit entsprechend wirksamen Antikonvulsiva (z.B. Primidon, Phenobarbital) kombiniert werden. Nur bei pyknoleptischen Absence-Epilepsien des Schulalters kann auf eine zusätzliche Grand-mal-Prophylaxe verzichtet werden.
- Myoklonisch-astatisches Petit mal und myoklonische Anfälle des Jugendlichen (Impulsiv-petit-mal), wenn andere Arzneimittel nicht wirksam waren und/oder nicht vertragen wurden.
4.2 Dosierung und Art der Anwendung
Dosierung
Kinder im Alter von 0 bis 6 Jahren sowie Personen, die keine Kapseln schlucken können, sollten Ethosuximid als Lösung zum Einnehmen erhalten. Mit dem Messlöffel sind sowohl 250 mg (5 ml) als auch 125 mg (2,5 ml) Lösung zum Einnehmen dosierbar. Ältere Kinder und Erwachsene nehmen Ethosuximid normalerweise in Kapselform ein.
Erwachsene, Ältere und Kinder über 6 Jahren: Mit einer niedrigen Dosis von 500 mg täglich beginnen und die Dosis alle fünf bis sieben Tage, je nach Verträglichkeit, in Schritten zu maximal 250 mg
erhöhen, bis mit einer Dosis von 1000-1500 mg täglich eine Kontrolle der Anfälle erreicht wird. Gelegentlich kann eine Dosis von 2000 mg, verteilt auf mehrere Gaben, erforderlich sein.
Kinder und Jugendliche
Kinder unter 2 Jahren: Mit einer täglichen Dosis von 125 mg (2,5 ml) Lösung zum Einnehmen beginnen und die Dosis im Abstand von wenigen Tagen langsam in kleinen Schritten erhöhen, bis eine Kontrolle der Anfälle erreicht wird.
Kinder von 2 bis 6 Jahren: Mit einer täglichen Dosis von 250 mg (5 ml) Lösung zum Einnehmen beginnen und die Dosis im Abstand von wenigen Tagen langsam in kleinen Schritten erhöhen, bis eine Kontrolle der Anfälle erreicht wird.
Bei den meisten Kindern liegt die optimale Dosis bei 20 mg/kg/Tag. Die Höchstdosis beträgt 1000 mg. Die therapeutischen Plasmaspiegel von Ethosuximid liegen normalerweise bei 40 bis 100 pg/ml, die Dosierung sollte sich jedoch nach dem klinischen Ansprechen richten. Die Halbwertszeit von Ethosuximid im Plasma beläuft sich auf mehr als 24 Stunden, sodass die Tagesdosis bei guter Verträglichkeit einmal täglich als Einzeldosis eingenommen werden kann. Jedoch sollte die Tagesdosis, insbesondere wenn sie hoch ausfällt, auf 2 oder 3 Einzelgaben verteilt werden.
Die derzeit vorliegenden Daten aus klinischen Studien zur Anwendung von Ethosuximid bei Kindern und Jugendlichen sind in Abschnitt 5.1 beschrieben.
Hämodialyse-Patienten
Ethosuximid ist dialysierbar. Hämodialyse-Patienten benötigen daher eine ergänzende Dosis oder ein geändertes Einnahmeschema. Während einer vierstündigen Dialyseperiode werden 39 bis 52 % der verabreichten Dosis entfernt.
Art der Anwendung
Die Einnahme sollte während oder nach den Mahlzeiten erfolgen. Die Weichkapseln können mit etwas Flüssigkeit eingenommen werden. Der Petnidan Saft kann auch während der Mahlzeiten eingenommen werden (z.B. Einrühren in den Milchbrei).
Die antiepileptische Therapie ist grundsätzlich eine Langzeittherapie. Über die Einstellung, Behandlungsdauer und das Absetzen von Petnidan sollte im Einzelfall der Facharzt (Neurologe, Neuropädiater) entscheiden.
Im Allgemeinen ist eine Dosisreduktion und ein Absetzen der Medikation frühestens nach 2-3jähriger Anfallsfreiheit zu erwägen.
Das Absetzen muss in schrittweiser Dosisreduktion über ein bis zwei Jahre erfolgen. Kinder können der Dosis pro kg Körpergewicht entwachsen anstelle altersgemäßer Dosisanpassung, wobei sich der EEG-Befund nicht verschlechtern sollte.
4.3 Gegenanzeigen
Petnidan/Petnidan Saft darf nicht gegeben werden bei - Überempfindlichkeit gegen den Wirkstoff, andere Succinimide,
Methyl(4-hydroxybenzoat)-Natriumsalz (im Petnidan Saft enthalten) oder einen der in Abschnitt
6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Wie bei allen Antiepileptika üblich, werden Kontrollen des Blutbildes und der Laborwerte empfohlen, insbesondere, wenn klinische Auffälligkeiten auftreten (siehe Abschnitt 4.8).
Beim Auftreten von Dyskinesien (siehe Abschnitt 4.8) ist das Absetzen von Ethosuximid erforderlich; gegebenenfalls ist darüber hinaus die intravenöse Gabe von Diphenhydramin angezeigt.
Auf die klinischen Symptome einer Knochenmarkschädigung (Fieber, Angina, Hämorrhagie) ist besonders zu achten. Zur Erfassung möglicher knochenmarkschädigender Wirkungen werden
2
regelmäßige (zunächst monatliche, nach 12 Monaten halbjährliche) Blutbildkontrollen empfohlen. Bei einer Leukozytenzahl kleiner als 3500/mm3 oder einem Anteil der Granulozyten kleiner als 25% erscheint eine Dosisreduktion oder ein Absetzen der Therapie angezeigt. Die Leberenzyme sind ebenfalls regelmäßig zu überwachen.
Besonders bei Patienten mit psychiatrischer Erkrankung in der Anamnese können entsprechende psychische Nebenwirkungen (siehe Abschnitt 4.8, paranoid-halluzinatorische Symptome, Angstzustände, Agitiertheit) auftreten, so dass Ethosuximid bei dieser Patientengruppe mit besonderer Vorsicht einzusetzen ist.
Suizidgedanken und suizidales Verhalten
Über suizidale Gedanken und suizidales Verhalten wurde bei Patienten, die mit Antiepileptika in verschiedenen Indikationen behandelt wurden, berichtet. Eine Metaanalyse randomisierter, placebo-kontrollierter Studien mit Antiepileptika zeigte auch ein leicht erhöhtes Risiko für das Auftreten von Suizidgedanken und suizidalem Verhalten. Der Mechanismus für die Auslösung dieser Nebenwirkung ist nicht bekannt und die verfügbaren Daten schließen die Möglichkeit eines erhöhten Risikos bei der Einnahme von Ethosuximid nicht aus.
Deshalb sollten Patienten hinsichtlich Anzeichen von Suizidgedanken und suizidalen Verhaltensweisen überwacht und eine geeignete Behandlung in Erwägung gezogen werden. Patienten (und deren Betreuern) sollte geraten werden medizinische Hilfe einzuholen, wenn Anzeichen für Suizidgedanken oder suizidales Verhalten auftreten.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Folgende Wechselwirkungen zwischen Ethosuximid und anderen Mitteln sind besonders zu beachten: Einfluss anderer Arzneimittel auf Ethosuximid
Bei gleichzeitiger Gabe von Carbamazepin erhöht sich die Plasmaclearance von Ethosuximid. Valproinsäure kann die Plasmakonzentration von Ethosuximid bei der Mehrzahl der Patienten erhöhen.
Einfluss von Ethosuximid auf andere Arzneimittel
Ethosuximid verändert in der Regel die Plasmakonzentrationen anderer Antiepileptika wie Primidon, Phenobarbital und Phenytoin nicht, weil Ethosuximid kein Enzyminduktor ist. Es wurde jedoch vereinzelt von einem Anstieg der Phenytoin-Konzentration bei gleichzeitiger Verabreichung von Ethosuximid berichtet.
Die gleichzeitige Anwendung von zentral wirksamen Medikamenten, Alkohol oder krampfprovozierenden Substanzen und Ethosuximid ist zu vermeiden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Frauen im gebärfähigen Alter sollten durch den Facharzt vor Beginn der Behandlung mit Ethosuximid über die Notwendigkeit von Planung und Überwachung einer Schwangerschaft beraten werden. Die Patientinnen sollten aufgefordert werden, eine während der Behandlung eingetretene Schwangerschaft sofort mitzuteilen.
Schwangerschaft
Die Behandlung mit Ethosuximid sollte während der Schwangerschaft nicht ohne ärztliche Zustimmung unterbrochen werden, weil ein plötzlicher Therapieabbruch bzw. eine unkontrollierte Verminderung der Dosis zu epileptischen Anfällen der Schwangeren führen kann, die ihr und/oder dem Ungeborenen Schaden zufügen können.
Ethosuximid passiert die Plazenta. Eine spezifische Embryopathie bei Kindern von Müttern unter Ethosuximid-Monotherapie ist nicht bekannt. Das Missbildungsrisiko unter Antiepileptikatherapie ist im Vergleich mit der zu erwartenden Häufigkeit in der Allgemeinbevölkerung von ungefähr 3 % um den Faktor 2 bis 3 erhöht. Die am häufigsten berichteten Fehlbildungen sind Lippenspalten, kardiovaskuläre
3
Fehlbildungen und Neuralrohrdefekte. Kombinationstherapien erhöhen dieses Risiko, so dass während der Schwangerschaft zu einer Monotherapie geraten wird.
Die Patientinnen sollen über das erhöhte Risiko von Fehlbildungen informiert und auf die Möglichkeit des pränatalen Screenings hingewiesen werden. Insbesondere zwischen dem 20. und 40. Schwangerschaftstag muss die niedrigste anfallskontrollierende Dosis gegeben werden. Die Ethosuximid-Serumkonzentration der Schwangeren muss regelmäßig überprüft werden.
Bei Planung einer Schwangerschaft sowie während der Schwangerschaft werden eine Kontrolle des Folsäurespiegels und gegebenenfalls Folsäuresubstitution empfohlen. Um einem Mangel an Vitamin K1 beim Neugeborenen und dadurch ausgelösten Blutungen vorzubeugen, wird eine Supplementierung im letzten Schwangerschaftsmonat empfohlen.
Stillzeit
In der Muttermilch werden Konzentrationen von bis zu 94% der maternalen Serumkonzentration erreicht. Während der Behandlung mit Ethosuximid darf nicht gestillt werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Während der Einstellungsphase, bei höherer Dosierung und in Kombination mit am Zentralnervensystem angreifenden Pharmaka kann das Reaktionsvermögen soweit verändert sein, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt wird. Dies kann auch bei bestimmungsgemäßem Gebrauch von Ethosuximid eintreten. Dieses gilt in verstärktem Maße im Zusammenwirken mit Alkohol.
Daher sollten das Führen von Fahrzeugen, die Bedienung von Maschinen oder sonstige gefahrvolle Tätigkeiten zumindest während der Einstellungsphase der Behandlung unterlassen werden. Die Entscheidung in jedem Einzelfall trifft der behandelnde Arzt unter Berücksichtigung der individuellen Reaktion und der jeweiligen Dosierung.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (>1/100 bis < 1/10)
Gelegentlich (>1/1.000 bis < 1/100)
Selten (>1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Im therapeutischen Dosisbereich sind Nebenwirkungen häufig und werden in etwa bei 1/6 der Patienten beobachtet. In der Mehrzahl handelt es sich um Übelkeit, Erbrechen, Singultus und Leibschmerzen.
Erkrankungen des Blutes und des Lymphsystems
Selten: Leukopenie*, Thrombozytopenie*, Agranulozytose*, Eosinophilie*
Nicht bekannt: In Einzelfällen wurden aplastische Anämien* und Panzytopenien* beobachtet.
Stoffwechsel- und Ernährungsstörungen Gelegentlich: Gewichtsverlust, Appetitstörungen
Psychiatrische Erkrankungen
Gelegentlich: Zurückgezogenheit, Ängstlichkeit, Schlafstörungen
Selten: innnerhalb von Tagen und Wochen sich entwickelnde paranoid-halluzinatorische
Erscheinungen
Erkrankungen des Nervensystems
Gelegentlich: schwere Kopschmerzen, Ataxie, Lethargie
4
Nicht bekannt: In wenigen Einzelfällen ist über Dyskinesien bei Behandlungsbeginn innerhalb der ersten 12 Stunden berichtet worden, die nach Absetzen von Ethosuximid wieder verschwanden bzw. sich durch Gabe von Diphenhydramin rasch auflösten.
Erkrankungen der Atemwege, des Brustraums und Mediastinums Häufig bis
sehr haufig: Singultus
Erkrankungen des Gastrointestinaltrakts Häufig bis
sehr häufig: Übelkeit, Erbrechen, Leibschmerzen
Gelegentlich: Diarrhoe, Verstopfung
Erkrankungen der Haus und des Unterhautzellgewebes
Selten: Lupus erythematodes unterschiedlicher Ausprägung*
Nicht bekannt: Es können allergische Hauterscheinungen*, wie Exantheme, aber auch in schwererer generalisierter Form als Stevens-Johnson-Syndrom*, auftreten.
* dosisunabhängiger Effekt (siehe auchAbschnitt 4.4)
Besondere Vorsichtshinweise für den Gebrauch
Die Wahrscheinlichkeit des Auftretens dosisabhängiger Nebenwirkungen lässt sich durch eine vorsichtige Dosierung (einschleichen bei Therapiebeginn, langsame Dosissteigerung) und die Einnahme während oder nach den Mahlzeiten reduzieren.
Beim Auftreten der nicht dosisabhängigen, reversiblen Nebenwirkungen ist das Absetzen von Ethosuximid angezeigt. Bei erneuter Verabreichung ist mit ihrem Wiederauftreten zu rechnen.
Bei Dauertherapie kann es zu einer Beeinträchtigung der Leistungsfähigkeit kommen, z.B. zu einem Abfall der schulischen Leistungen bei Kindern und Jugendlichen.
Information zu sonstigen Bestandteilen
Methyl(4-hydroxybenzoat) Natriumsalz (im Petnidan® Saft enthalten) kann Überempfindlichkeitsreaktionen, auch Spätreaktionen, hervorrufen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Bei jeder Beurteilung einer Intoxikation muss auch an die Möglichkeit einer Mehrfachintoxikation, z.B. durch Einnahme mehrerer Arzneimittel, beispielsweise in suizidaler Absicht, gedacht werden.
Die Symptome einer Überdosierung treten verstärkt unter dem Einfluss von Alkohol und anderen zentral dämpfenden Mitteln auf.
Symptome der Intoxikation
Ethosuximid besitzt eine geringe Toxizität. Bei Überdosierung treten in verstärktem Maße die unter Nebenwirkungen aufgeführten Symptome, wie Müdigkeit, Lethargie, Verstimmungs- und Erregungszustände, mitunter auch Reizbarkeit, auf.
Bei Verdacht auf eine Intoxikation empfiehlt sich in jedem Fall eine Bestimmung der Plasmakonzentration der Antiepileptika.
Therapie der Intoxikation
Bei schwerer Überdosierung ist eine initiale Magenspülung und die Gabe von Aktivkohle neben
5
intensivmedizinischer Überwachung des Kreislaufs und der Atmung erforderlich. Ein spezifisches Antidot ist nicht bekannt. Hämodialyse kann sinnvoll sein.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antiepileptika, ATC-Code: N03AD01
Ethosuximid ist ein Antiepileptikum aus der Gruppe der Succinimide. Der Wirkmechanismus ist weitgehend ungeklärt; es wurde unter anderem eine hemmende Wirkung auf den Abbau der GABA gefunden.
Kinder und Jugendliche
In einer doppelblinden, randomisierten, 20-wöchigen Studie mit 453 Kindern im Alter von 2,5 bis 13 Jahren mit frisch diagnostizierter Absence-Epilepsie im Kindesalter wurden die Wirksamkeit, Verträglichkeit und neuropsychologischen Wirkungen von Ethosuximid, Valproinsäure und Lamotrigin als Monotherapie bei Absence-Epilepsie im Kindesalter beurteilt. Dabei zeigte sich unter Behandlung mit entweder Ethosuximid oder Valproinsäure ein höherer Anteil von Kindern ohne Therapieversagen (53% bzw. 58%) als unter Behandlung mit Lamotrigin (29%; Odds Ratio für Ethosuximid vs. Lamotrigin, 2,66; 95%-Konfidenzintervall [KI], 1,65 bis 4,28; Odds Ratio für Valproinsäure vs. Lamotrigin, 3,34; 95%-KI, 2,06 bis 5,42; P<0,001 für beide Vergleiche). Sowohl in den präspezifizierten als auch in den Post-hoc-Analysen führte Ethosuximid zu weniger Wirkungen auf die Aufmerksamkeit als Valproinsäure (in Woche 16 und Woche 20 war der Prozentanteil von Probanden mit einem Confidence Index Score von >0,60 im Conners' Continuous Performance Test in der Valproinsäure-Gruppe höher als in der Ethosuximid-Gruppe [49% vs. 33%; Odds Ratio, 1,95; 95%-KI, 1,12 bis 3,41; P=0,03] und der Lamotrigin-Gruppe [49% vs. 24%; Odds Ratio, 3,04; 95%-KI, 1,69 bis 5,49; P<0,001]).
5.2 Pharmakokinetische Eigenschaften
Resorption
Ethosuximid wird nach oraler Gabe praktisch vollständig resorbiert. So wurden nach Einnahme von 1 g Ethosuximid an 3 Probanden nach 1-4 Stunden Cmax-Werte von 18-24 pg/ml gemessen.
Bei Erwachsenen wird bei Dauermedikation mit ca. 15 mg/kg Körpergewicht eine Plasmakonzentration von etwa 50 pg/ml erzielt. 1 mg/kg pro Tag oraler Dosis lässt eine Plasmakonzentration von 2-3 pg/ml erwarten.
8-10 Tage nach Therapiebeginn ist mit dem Eintreten des steady-state zu rechnen. Trotz starker interindividueller Variation der Plasmakonzentrationen bei gleicher oraler Dosis, zeigt sich eine dosislineare Abhängigkeit der Plasmakonzentration.
Die therapeutische Plasmakonzentration des Ethosuximid wird mit 40-100 pg/ml angegeben. Plasmakonzentrationen über 150 pg/ml können zu toxischen Wirkungen führen.
Kinder und Jugendliche
In einer Studie wurden nach einmaliger Gabe von 500 mg Ethosuximid an Kinder (7-8,5 Jahre, 12,9-24,4 kg Körpergewicht) nach 3-7 Stunden Cmax-Werte von 28,0-50,9 pg/ml ermittelt.
Bei Dauermedikation mit 20 mg/kg Körpergewicht wird bei Kindern eine Plasmakonzentration von etwa 50 pg/ml erzielt. 1 mg/kg pro Tag oraler Dosis lässt im Kindesalter eine Plasmakonzentration von 1-2 pg/ml, erwarten. Jüngere Kinder benötigen daher etwas höhere Dosen als ältere.
Verteilung
Ethosuximid wird nicht an Plasmaeiweiße gebunden.
Ethosuximid wird im Liquor und im Speichel in derselben Konzentration wie im Plasma gefunden.
Für das scheinbare Verteilungsvolumen werden Werte um 0,7 l/kg Körpergewicht angegeben. Ethosuximid ist plazentagängig.
Biotransformation.
Ethosuximid wird in hohem Maße in der Leber oxidativ metabolisiert. Es werden mehrere Metabolite gebildet. vorwiegend die beiden Diastereomere des 2-(1-Hydroxyethyl)-2-methylsuccinimid und des 2-Ethyl-2-methyl-3-hydroxysuccinimids. Die Metabolite sind wahrscheinlich inaktiv.
Elimination
Nur 10-20 % von Ethosuximid werden unverändert im Urin ausgeschieden. Die vorwiegend gebildeten Metabolite von Ethosuximid. die beiden Diastereomere des 2-(1-Hydroxyethyl)-2-methylsuccinimid und des 2-Ethyl-2-methyl-3-hydroxysuccinimids, werden zum Teil konjugiert als Glucuronide renal ausgeschieden.
Nach einer einmaligen oralen Gabe von 13.1 -18.0 mg Ethosuximid/kg Körpergewicht an 12 männliche Probanden (20-23 Jahre. 57.2-114.8 kg Körpergewicht) wurde eine Plasmahalbwertszeit von 38.3-66.6 Stunden ermittelt. Bei einmaliger Dosis von 500 mg Ethosuximid (Kapseln) an 5 Kinder wurden Plasmahalbwertszeiten von 25.7-35.9 Stunden. bei Gabe als Lösung von 24.8-41.7 Stunden gemessen.
Übergang in die Muttermilch
Ethosuximid tritt in die Muttermilch über. wobei das Verhältnis der Ethosuximidkonzentration in der Muttermilch zu der im Plasma mit 0.94±0.06 angegeben wird.
Bioverfügbarkeit
Die im Jahr 1991 durchgeführte Bioverfügbarkeitsuntersuchung mit PetnidanKapseln und PetnidanSaft (500 mg Ethosuximid) an 14 männlichen Probanden (Alter: 23 bis 35 Jahre. Körpergewicht: 64 bis 80 kg) ergab die folgenden Daten: siehe Abbildung.
Die Kurven zeigen die mittleren Ethosuximid-Plasmakonzentrationen nach einmaliger Applikation von 500 mg (2 Kapseln Petnidan bzw. 2 Messlöffel Petnidan Saft) an 14 gesunde Probanden.
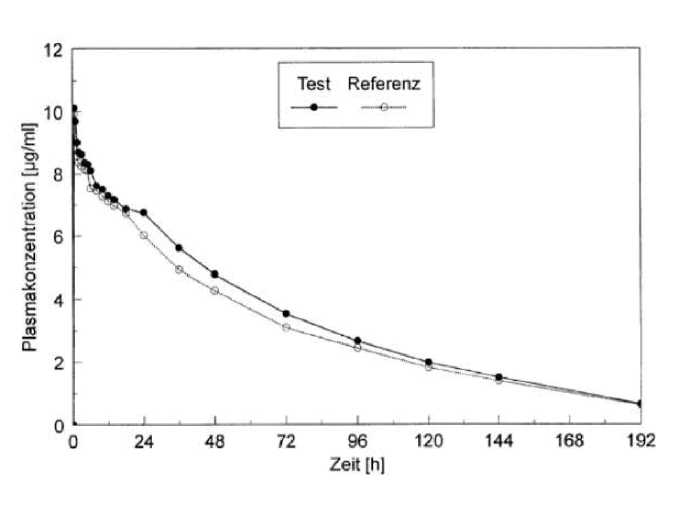
Tabelle 1: Pharmakokinetische Parameter von Petnidan nach oraler Dosis von 500 mg n = 14 männliche gesunde Probanden
|
Parameter |
Petnidan |
Petnidan Saft |
|
Cmax (mg/l) |
10,8 ± 2,0 |
10,1 ± 1,7 |
|
AUC0-to [mg/l.h] |
708,1 ± 126,3 |
655,7 ± 151,4 |
|
t 1/2 [h] |
55,2 ±11,2 |
57,6 ± 12,0 |
|
tmax[h] |
1,6 ± 3,6 |
1,1 ± 1,3 |
Angaben als Mittelwert ± Standardabweichung
Petnidan Kapseln und Petnidan Saft sind hinsichtlich Ausmaß und Geschwindigkeit der Resorption bioäquivalent.
5.3 Präklinische Daten zur Sicherheit
Untersuchungen zur akuten und chronischen Toxizität an verschiedenen Tierspezies haben keine Informationen ergeben, welche nicht schon in anderen Punkten der Fachinformation/SPC erwähnt werden.
Ethosuximid wurde in vitro (Ames-Test, Chromosomenaberrationstest) sowohl mit als auch ohne metabolische Aktivierung auf Mutagenität untersucht. In keinem der Untersuchungssysteme fanden sich Hinweise auf ein mutagenes Potential.
Langzeituntersuchungen am Tier auf ein tumorerzeugendes Potential liegen nicht vor.
Ethosuximid passiert die Plazenta. Studien zur Embryotoxizität an Ratten und Mäusen zeigten ein erhöhtes Auftreten von Missbildungen und Verhaltensveränderungen.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Petnidan
Eisenoxidhydrat (E172), Gelatine, Glycerol, D-Mannitol - D-Glucitol - Sorbitan - höhere Polyole -Gemisch, Macrogol 300, Mittelkettige Triglyceride, Titandioxid (E171) ,gereinigtes Wasser
Petnidan Saft
Karamell-Aroma, Citronensäure (E 330), Hypromellose, Macrogol 300, Methyl(4-hydroxybenzoat) Natriumsalz (E 219), Saccharin-Natrium, gereinigtes Wasser
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Petnidan Weichkapseln 3 Jahre
Petnidan Saft 5 Jahre
Der Petnidan Saft ist nach Anbruch der Flasche 3 Monate haltbar.
Die Arzneimittel dürfen nach Ablauf des Verfalldatums nicht mehr angewendet werden (s. Faltschachtel).
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Petnidan
Nicht über 30° lagern und Behältnis fest verschlossen halten.
Petnidan Saft
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses Petnidan
Kunststoffbehälter aus Polyethylen mit kindergesichertem Polypropylen-Verschluss.
50 Weichkapseln 100 Weichkapseln 200 Weichkapseln Klinikpackung 500 (5x100)
Petnidan Saft
Braunglasflasche mit 250 ml Lösung zum Einnehmen in einer Faltschachtel, die einen Messlöffel enthält.
Klinikpackung mit 750 ml (3 x 250 ml)
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Desitin Arzneimittel GmbH Weg beim Jäger 214 22335 Hamburg Telefon: 040/5 91 01-525 Telefax: 040/5 91 01-377
8. ZULASSUNGSNUMMER(N)
Petnidan
6002418.00. 00
Petnidan Saft
6002418.00. 01
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
Petnidan
Datum der Erteilung der Zulassung 11. März 2003
Petnidan Saft
Datum der Erteilung der Zulassung 19. Mai 2003
10. STAND DER INFORMATION
{MM.JJJJ}
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
10