Pleon Ra
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Pleon® RA
500 mg, magensaftresistente Filmtabletten Wirkstoff: Sulfasalazin
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 magensaftresistente Filmtablette enthält 500 mg Sulfasalazin.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Magensaftresistente Filmtablette.
Weiße bis schwach rosafarbene Filmtablette mit ovaler, gewölbter Form (Länge ca. 15,7 mm, Breite ca. 8,5 mm, Höhe ca. 7,4 mm).
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Behandlung der aktiven rheumatoiden Arthritis (chronische Polyarthritis) des Erwachsenen.
Behandlung der aktiven juvenilen idiopathischen Oligoarthritis (Enthesitis-assoziierte Arthritis) ab dem 6. Lebensjahr, die unzureichend auf nichtsteroidale Antiphlogistika (nonsteroidal antiinflammatory drugs, NSAID) und/oder lokale Glukokortikoidinjektionen angesprochen hat.
Behandlung der aktiven juvenilen idiopathischen Polyarthritis und polyarthritischen Spondylarthritis ab dem 6. Lebensjahr (Enthesitis-assoziierte Arthritis), die unzureichend auf nichtsteroidale Antiphlogistika (nonsteroidal antiinflammatory drugs, NSAID) angesprochen hat.
4.2 Dosierung und Art der Anwendung
Aktive rheumatoide Arthritis
Falls vom Arzt nicht anders verordnet, sollte Pleon RA täglich eingenommen werden, initial in kleinen Dosen, und stufenweise auf die optimale Dosis erhöht werden.
|
Woche |
1 |
2 |
3 |
4* |
|
Morgens |
1 Filmtablette (500 mg Sulfasalazin) |
1 Filmtablette (500 mg Sulfasalazin) |
2 Filmtabletten (1000 mg Sulfasalazin) | |
|
Abends |
1 Filmtablette (500 mg Sulfasalazin) |
1 Filmtablette (500 mg Sulfasalazin) |
2 Filmtabletten (1000 mg Sulfasalazin) |
2 Filmtabletten (1000 mg Sulfasalazin) |
* Und jede darauf folgende Woche.
Bei Patienten, die nach 3 Monaten nicht zufriedenstellend auf die Therapie mit 2 x 2 Filmtabletten täglich ansprechen, kann die Dosis auf 3 x 2 Filmtabletten erhöht werden. Eine maximale Tagesdosis von 4000 mg Sulfasalazin sollte nicht überschritten werden.
Aktive juvenile idiopathische Arthritis (Kinder ab 6 Jahren)
Die Tagesdosis sollte 50 mg/kg Körpergewicht betragen, aufgeteilt in 2 Einzeldosen. Die Tagesmaximaldosis beträgt 2 g Sulfasalazin. Zeigt sich nach 3 Monaten keine befriedigende Wirkung, kann die Tagesdosis auf 75 mg/kg Körpergewicht gesteigert werden, maximal 3 g Sulfasalazin pro Tag.
Um mögliche gastrointestinale Unverträglichkeiten zu reduzieren, ist eine einschleichende Therapie (beginnend mit einem Viertel oder einem Drittel der Erhaltungsdosis) empfehlenswert, bei der nach 4 Wochen durch wöchentliche Dosissteigerungen die Erhaltungsdosis erreicht wird.
Art und Dauer der Anwendung
Die Filmtabletten sollten mindestens 1 Stunde vor einer Mahlzeit mit reichlich Flüssigkeit eingenommen und ganz geschluckt werden.
Erfahrungsgemäß setzt die klinische Wirksamkeit innerhalb von 1-3 Monaten ein. Eine zusätzliche Therapie mit schmerzstillenden oder entzündungshemmenden Arzneimitteln kann notwendig sein.
Im Allgemeinen wird Sulfasalazin zur Langzeittherapie eingesetzt. Bei zufriedenstellender Wirksamkeit und Verträglichkeit kann es über Jahre eingenommen werden.
Besondere Patientengruppen
Ältere Patienten:
Es ist keine spezielle Dosisanpassung erforderlich. Wegen des möglichen Nebenwirkungsprofils sollten ältere Menschen besonders sorgfältig überwacht werden.
Patienten mit eingeschränkter Nierenfunktion:
Bei Patienten mit leichter bis mäßiger Einschränkung der Nierenfunktion ist keine Dosisreduktion erforderlich, Pleon RA sollte jedoch bei dieser Patientengruppe mit besonderer Vorsicht angewendet werden. (Patienten mit schwerer Niereninsuffizienz siehe Abschnitt 4.3.)
Patienten mit eingeschränkter Leberfunktion (siehe Abschnitt 5.2):
Bei Patienten mit leichter bis mäßiger Einschränkung der Leberfunktion ist keine Dosisreduktion erforderlich, Pleon RA sollte jedoch bei dieser Patientengruppe mit besonderer Vorsicht angewendet werden. (Patienten mit schwerer Leberfunktionsstörung siehe Abschnitt 4.3.)
Kinder und Jugendliche (jünger als 6 Jahre):
Pleon RA darf Kindern unter 6 Jahren nicht gegeben werden. Zur Anwendung bei Kindern und Jugendlichen siehe auch Abschnitt 4.3.
4.3 Gegenanzeigen
Pleon RA darf nicht angewendet werden bei
- Überempfindlichkeit gegen Sulfasalazin, seine Metaboliten oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile,
- Überempfindlichkeit gegenüber Sulfonamiden oder Salicylaten,
- Erkrankungen der blutbildenden Organe,
- akuter intermittierender Porphyrie,
- schwerer Leberinsuffizienz,
- schwerer Niereninsuffizienz,
- Patienten mit Gukose-6-Phosphat-Dehydrogenase-Mangel (Gefahr des Auftretens einer hämolytischen Anämie),
- vorbestehenden Blutbildveränderungen wie Leuko- oder Thrombozytopenie,
- Ileus,
- Stevens-Johnson-Syndrom oder toxisch epidermale Nekrolyse (auch in der Anamnese).
Die gleichzeitige Therapie mit Methenamin ist kontraindiziert.
Pleon RA ist nicht zur Behandlung systemischer Verlaufsformen der juvenilen idiopathischen Arthritis (JIA) geeignet.
Pleon RA darf Kindern unter 6 Jahren nicht gegeben werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Sulfasalazin sollte ausschließlich unter medizinischer Kontrolle verabreicht werden.
Pleon RA sollte mit Vorsicht bei Patienten verabreicht werden, die zu Überempfindlichkeitsreaktionen (allergische Disposition) oder Asthma bronchiale neigen.
Pleon RA sollte mit Vorsicht angewendet werden bei Patienten mit leichter Leber- oder Niereninsuffizienz sowie bei bekannter Überempfindlichkeit gegenüber Sulfonylharnstoffen.
Fälle von lebensbedrohlichen Hautreaktionen (Stevens-Johnson-Syndrom (SJS) und toxisch epidermaler Nekrolyse (TEN)) wurden in Zusammenhang mit der Anwendung von Sulfasalazin berichtet. Die Patienten sollten über die Anzeichen und Symptome dieser schweren Nebenwirkungen informiert und engmaschig bezüglich des Auftretens von Hautreaktionen überwacht werden.
Das Risiko für das Auftreten von SJS und TEN ist in den ersten Behandlungswochen am höchsten. Wenn Anzeichen oder Symptome für ein SJS oder eine TEN aufreten (z. B. progredienter Hautausschlag, oft mit Blasenbildung oder begleitenden Schleimhautläsionen), muss die Therapie mit Sulfasalazin beendet werden.
Der Verlauf von SJS und TEN wird maßgeblich von der frühzeitigen Diagnosestellung und dem sofortigen Absetzen aller verdächtigen Arzneimittel bestimmt, d. h. frühzeitiges Absetzen verbessert die Prognose.
Nach Auftreten eines SJS oder einer TEN in Zusammenhang mit der Anwendung von Sulfasalazin darf der Patient nie wieder mit Sulfasalazin behandelt werden.
Wegen der Möglichkeit einer Agranulozytose sollten Patienten angewiesen werden, auf bestimmte spezielle Anzeichen wie Fieber, Pharyngitis, Stomatitis, Furunkulose sowie verlängerte oder ungewöhnliche Blutungen zu achten bzw. davon zu berichten.
Bei Patienten, die Acetazolamid erhielten, wurde über ein akutes bilaterales Engwinkelglaukom und/oder Myopie berichtet. Es wird vermutet, dass dafür ein Ödem der Aderhaut bzw. des Ziliarkörpers verantwortlich ist, bedingt durch eine allergische oder idiosynkratische Reaktion auf die Sulfa-Komponente, die auch für andere Sulfonamide beschrieben wird. In diesen Fällen ist die Behandlung mit Pleon RA abzubrechen. Der Patient sollte angewiesen werden, Rat bei dem behandelnden Arzt einzuholen.
Bei Langsamacetylierern kann der Sulfapyridinspiegel toxische Konzentrationen erreichen. Daher wird die Bestimmung des Acetylierer-Phänotyps vor Beginn einer Behandlung mit Sulfasalazin empfohlen, insbesondere beim Auftreten von Nebenwirkungen. Wenn mehrere parallel gegebene Substanzen acetyliert werden müssen und wenn eine rheumatoide Arthritis mit einem Sjögren-Syndrom und/oder anderen Overlap-Syndromen kombiniert ist, ist diese Bestimmung ebenso sinnvoll wie vor der Therapie von Risikopatienten (Alter, Körpergewicht, Begleiterkrankungen).
Bei allen Patienten (auch bei benommenen Patienten) ist für ausreichende Flüssigkeitszufuhr zu sorgen.
Da die Folsäureresorption durch Sulfasalazin beeinflusst werden kann, kann es unter Umständen zu Folsäuremangelanämien kommen. Diese können durch Gabe von Folsäure behandelt werden. Der Folsäurestatus sollte insbesondere bei Patienten, die zusätzliche Risikofaktoren für die Entwicklung eines Folsäuremangels aufweisen, kontrolliert werden. Über eine begleitende Folsäuresupplementierung ist im Einzelfall zu entscheiden.
Frauen im gebärfähigen Alter
Sulfasalazin kann zu einem Folsäuremangel führen bzw. einen Folsäuremangel verstärken. Eine Folsäureunterversorgung während der Schwangerschaft wird mit dem Auftreten von Neuralrohrdefekten (Anenzephalie, Spina bifida) in Verbindung gebracht. Es gibt Hinweise, dass bei Einnahme von Sulfasalazin im Dreimonatszeitraum vor Beginn der Schwangerschaft ein erhöhtes Risiko für das Auftreten von Neuralrohrdefekten bei Kindern besteht. Frauen im gebärfähigen Alter ohne sicheren Konzeptionsschutz sollten daher bei Therapie mit Sulfasalazin eine FolsäureSupplementierung erhalten (siehe Abschnitte 4.5, 4.6 und 4.8).
Männliche Fertilität Siehe Abschnitt 4.6.
Kontrollen
Vor und während der Behandlung mit Sulfasalazin sollten der Urinstatus, das Blutbild einschließlich der Thrombozyten und des Differenzialblutbilds sowie die Leberfunktion (AP, SGPT) und die Nierenfunktion (Kreatinin) regelmäßig überwacht werden. In den ersten 3 Monaten der Therapie wird eine vierzehntägige Kontrolle, vom 4. bis 6. Monat eine monatliche und anschließend eine vierteljährliche Kontrolle empfohlen. Ebenso sollten beim Auftreten von Nebenwirkungen Kontrollen erfolgen.
Die Immunglobuline können unter der Therapie mit Sulfasalazin abfallen, und es kann zu einem Anstieg antinukleärer Antikörper (ANA) kommen. Diese Veränderungen können krankheitsbedingt sein. Ihre Bedeutung für die Therapie ist unklar. Vorsorglich wird die Kontrolle der Immunglobuline und ANA zu Beginn der Behandlung und in regelmäßigen Abständen empfohlen.
Kinder und Jugendliche
Die Therapie mit Pleon RA sollte bei Kindern nur von Fachärzten eingeleitet und überwacht werden, die über ausreichende Erfahrung in der Diagnose und Behandlung der betreffenden rheumatischen Erkrankung verfügen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bei Einnahme von Sulfasalazin mit anderen Arzneimitteln kann es zu Wechselwirkungen durch den Wirkstoff selbst oder auf Grund seiner Hauptmetaboliten kommen. Die klinisch relevantesten pharmakokinetischen Wechselwirkungen entstehen bei gleichzeitiger Einnahme von Antibiotika, Eisen und Kalzium, Folsäure und Arzneimitteln mit starker Proteinbindung.
Folsäure
Während der Therapie mit Sulfasalazin kann es zu verminderten Folsäurespiegeln kommen, vermutlich auf Grund einer Hemmung der Resorption. Dies kann zu einem Folsäuremangel führen bzw. einen bereits durch die Grundkrankheit oder Schwangerschaft verursachten Folsäuremangel verstärken.
Eisen
Sulfasalazin und Eisen bilden Chelate. Dies führt zu einer Resorptionshemmung von Sulfasalazin, nicht aber von Sulfapyridin.
Kalzium
Bei gleichzeitiger Kalziumglukonat-Therapie wurde beschrieben, dass Sulfasalazin verzögert resorbiert wurde.
Digoxin
In Einzelfällen wurde berichtet, dass bei Einnahme von Sulfasalazin die Aufnahme von Digoxin gehemmt wurde.
Antibiotika
Bei gleichzeitiger Einnahme von Antibiotika (erwiesen für Ampicillin, Neomycin, Rifampicin, Ethambutol) kann die Wirkung von Sulfasalazin verringert werden. Grund hierfür ist die Hemmung des teilweise bakteriellen Abbaus auf Grund der Schädigung der Darmflora.
Anionenaustauscher-Harze
Anionenaustauscher-Harze wie Colestipol oder Colestyramin binden sowohl Sulfasalazin als auch seine Metaboliten im Darm.
Antikoagulanzien
Der Abbau von oralen Antikoagulanzien wie Phenprocoumon oder Dicumarol über die Leber kann beeinträchtigt werden. Bei gleichzeitiger Einnahme sind besondere Vorsicht und eine regelmäßige Überwachung des Gerinnungsstatus notwendig.
Arzneimittel mit hoher Proteinbindung
Die gleichzeitige Einnahme mit Methotrexat, Phenylbutazon, Sulfinpyrazon oder anderen Arzneistoffen mit hoher Proteinbindung kann die Wirkung dieser Arzneimittel verstärken.
Arzneimittel mit blutschädigender Wirkung (Knochenmarkdepression)
Leukopenie, Anämie und/oder Thrombozytopenie können unter einer Therapie mit Pleon RA häufiger und intensiver auftreten. Bei gleichzeitiger Einnahme von Sulfasalazin mit anderen hämatotoxischen Arzneistoffen (z. B. Etanercept) muss eine engmaschige Kontrolle erfolgen.
Bei Patienten, die gleichzeitig mit Sulfasalazin und Thiopurinen (z. B. Azathioprin, Mercaptopurin) behandelt werden, besteht ein mit den Thiopurinen verbundenes erhöhtes Risiko für
Knochenmarkdepression/Leukopenie. Das Blutbild sollte überwacht und eine Dosisanpassung der Thiopurine in Betracht gezogen werden.
Ciclosporin
Die kombinierte Anwendung kann zu verringerten Ciclosporinspiegeln führen. Ursache hierfür ist vermutlich die Induktion von Cytochrom P450. Eine Kontrolle und Anpassung der Dosierung kann notwendig sein.
Typhus-Lebendimpfstoff
Eine verringerte Immunreaktion nach Gabe von Typhus-Lebendimpfstoff ist möglich. Daher wird zwischen der Einnahme von Sulfasalazin und der Anwendung eines Typhus-Lebendimpfstoffs ein Abstand von mindestens 24 Stunden empfohlen.
Hepatotoxische Arzneimittel
Bei gleichzeitiger Einnahme von Sulfasalazin und anderen hepatotoxischen Arzneistoffen muss die Leberfunktion sorgfältig überwacht werden.
Sulfonylharnstoffe
Bei gleichzeitiger Gabe mit Sulfonylharnstoffen kann deren blutzuckersenkender Effekt verstärkt werden.
Methenamin
Sulfasalazin darf wegen der möglichen Ausbildung einer Kristallurie nicht zusammen mit Methenamin enthaltenden Präparaten angewendet werden (siehe Abschnitt 4.3).
4.6 Fe rtilität, Schwange rs chaft und Stillze it
Männliche Fertilität
Die Anwendung von Sulfasalazin kann bei Männern zur Oligospermie mit reversibel beeinträchtigter Fertilität führen. Im Durchschnitt normalisiert sich die Spermienproduktion innerhalb von 2-3 Monaten nach Absetzen der Therapie. In keinem Fall kam es auf Grund der reversibel beeinträchtigten Fertilität zu Fehlbildungen. Die Verringerung der Zahl der Samenzellen beeinflusst nicht die sexuelle Potenz.
Schwangerschaft
Daten über eine begrenzte Anzahl von exponierten Schwangeren lassen nicht auf unerwünschte Wirkungen von Sulfasalazin auf die Schwangerschaft oder die Gesundheit des Fetus/Neugeborenen schließen. Zum heutigen Zeitpunkt liegen keine weiteren relevanten epidemiologischen Daten vor. Tierexperimentelle Studien limitierten Umfanges weisen nicht auf schädigende Wirkungen bezüglich Schwangerschaft oder embryo-fetaler Entwicklung hin (siehe Abschnitt 5.3).
Sulfasalazin und seine Metaboliten passieren die Plazenta. Die Sulfasalazin-Plasmaspiegel des Fetus und des Neugeborenen entsprechen ungefähr der mütterlichen Plasmakonzentration. Pleon RA sollte schwangeren Frauen mit Vorsicht verschrieben werden, besonders dann, wenn sie zum Langsamacetylierer-Phänotyp gehören (siehe Abschnitt 4.4).
Die Therapie mit Sulfasalazin kann zu Folsäuremangel führen oder einen Folsäuremangel, der durch die zu Grunde liegende Krankheit oder Schwangerschaft bedingt ist, verstärken (siehe Abschnitte 4.4, 4.5 und 4.8). Da Folsäuremangel zum Zeitpunkt der Konzeption oder im ersten Trimenon der Schwangerschaft mit einem erhöhten Risiko für Neuralrohrdefekte (z. B. Spina bifida) in Verbindung gebracht wird, wird eine ergänzende Gabe von Folsäure während einer Sulfasalazin-Therapie bei Frauen im gebärfähigen Alter sowie im ersten Trimenon der Schwangerschaft empfohlen.
Stillzeit
Sulfasalazin und seine Metaboliten werden in die Muttermilch sezemiert. Die Konzentration von Sulfapyridin in der Muttermilch beträgt etwa 40 % des mütterlichen Blutgehalts. Obwohl dies gewöhnlich nicht mit der Gefahr eines Kernikterus oder anderen Nebenwirkungen für den Säugling verbunden sein dürfte, können Probleme bei Mutter-Kind-Paaren mit herabgesetzter metabolischer Aktivität (Langsamacetylierer, Frühgeborene, Neugeborene mit neonatalem Ikterus, Glukose-6-phosphat-Dehydrogenase-Mangel) entstehen. Pleon RA sollte stillenden Müttern daher nur mit Vorsicht verschrieben werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Die Reaktionsfähigkeit einiger Patienten kann eingeschränkt sein. Patienten, die während einer Therapie mit Sulfasalazin unter Beschwerden wie Schwindelgefühl oder zentralnervösen Störungen leiden, sollten kein Fahrzeug führen, potenziell gefährliche Maschinen bedienen oder andere Tätigkeiten ausführen, die auf Grund eingeschränkter Reaktionsfähigkeit gefährlich werden können.
Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Im Einzelfall kann es schwierig sein, Nebenwirkungen zu diagnostizieren, da einige der unerwünschten Reaktionen der Sulfasalazin-Therapie auch Symptome der Erkrankung sein können. Der Patient sollte darauf hingewiesen werden, das Auftreten vorsichtshalber immer dem behandelnden Arzt mitzuteilen, da nur er diese Zeichen richtig beurteilen kann.
Viele Nebenwirkungen sind dosisabhängig und können durch die Verringerung der Dosis gemildert oder vermieden werden. Um mögliche gastrointestinale Unverträglichkeiten zu reduzieren, ist eine einschleichende Therapie empfehlenswert (siehe Abschnitt 4.2).
Bei Langsamacetylierern kann der Wirkstoffspiegel erhöht sein. Beim Auftreten von Nebenwirkungen wird daher die Bestimmung des Acetylierer-Phänotyps empfohlen.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zu Grunde gelegt:
Sehr häufig Häufig Gelegentlich Selten Sehr selten Nicht bekannt
(> 1/10)
(> 1/100 bis < 1/10)
(> 1/1.000 bis < 1/100)
(> 1/10.000 bis < 1/1.000)
(< 1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Die folgenden Nebenwirkungen können auftreten:
Infektionen und parasitäre Erkrankungen Selten: pseudomembranöse Colitis.
Erkrankungen des Blutes und Lymphsystems
Häufig: Folsäuremangel-Anämie (häufig Megaloblastose und Makrozytose), Leukopenie.
Gelegentlich: Panzytopenie, hämolytische Anämie, Methämoglobinämie, Thrombozytopenie. Selten: Agranulozytose, aplastische Anämie, Myelosuppression, Plasmozytose, Eosinophilie.
Sehr selten: myelodysplastisches Syndrom.
Die möglicherweise lebensbedrohliche Agranulozytose äußert sich in schwerem allgemeinem Krankheitsgefühl, verbunden mit Fieber, Schüttelfrost, Herzrasen, Halsschmerzen und Schluckbeschwerden sowie schmerzhaften Entzündungen der Schleimhäute im Mund-, Nasen- und Rachenraum sowie im Anal- und Genitalbereich.
In diesen Fällen ist Pleon RA sofort abzusetzen.
Nach Abklingen der Beschwerden sollte Pleon RA nicht erneut eingenommen werden. Erkrankungen des Immunsystems
Gelegentlich: Induktion von Auto-Antikörpern, Hypogammaglobulinämie, Lupus-erythematodesSyndrom.
Selten: DRESS-Syndrom (Hautreaktion mit Eosinophilie und systemischen Symptomen,
teilweise Reaktionen ähnlich einer Mononucleosis infectiosa oder Serumkrankheit), Anaphylaxie.
Psychiatrische Erkrankungen Gelegentlich: Depression.
Sehr selten: Psychose.
Erkrankungen des Nervensystems Sehr häufig: Kopfschmerzen.
Häufig:
Gelegentlich:
Selten:
Sehr selten: Häufigkeit nicht bekannt:
Schwindel, Störungen des Geschmackssinnes.
Parästhesien, Störungen des Geruchssinnes. metallischer Geschmack.
zentrale und periphere Neuropathie, Querschnittsmyelitis, aseptische Meningitis.
Enzephalopathie.
Augenerkrankungen
Gelegentlich: allergische Konjunktivitis.
Selten:
Sehr selten: Häufigkeit nicht bekannt:
gelbe Verfärbung der Augen. Gelbfärbung von Kontaktlinsen.
akutes bilaterales Engwinkelglaukom und/oder Myopie.
Erkrankungen des Ohrs und des Labyrinths Gelegentlich: Tinnitus.
Herzerkrankungen
Gelegentlich: Palpitationen, Tachykardie.
Sehr selten: Pericarditis, Myocarditis.
Gefäß erkrankungen Gelegentlich: erhöhter Blutdruck.
Sehr selten: Raynaud-Syndrom.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig:
Gelegentlich:
Selten:
Sehr selten: Häufigkeit nicht bekannt:
Husten.
Bronchialasthma, Dyspnoe.
fibrosierende Alveolitis, eosinophile Pneumonie.
Bronchiolitis obliterans.
interstitielle Lungenerkrankung, eosinophile Infiltration.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Übelkeit, Bauchschmerzen, Appetitlosigkeit, Dyspepsie, Magenbeschwerden.
Häufig: Erbrechen, Diarrhö, abdominale Schmerzen.
Gelegentlich: Blähungen.
Selten: Pankreatitis, Stomatitis.
Sehr selten: Exazerbation remittierender Colitis ulcerosa.
Leber und Gallenerkrankungen
Häufig:
Selten:
Sehr selten: Häufigkeit nicht bekannt:
erhöhte Leberenzymwerte.
Hepatitis.
fulminante Hepatitis (möglicherweise mit letalem Ausgang). Leberversagen.
Erkrankungen der Haut und des Unterhautzellgewebes Häufig: Pruritus, Exantheme.
Gelegentlich: Urtikaria, Quincke-Ödem, Photosensibilität, Enanthem, Alopezie.
Selten: Zyanose der Haut, gelborange Verfärbung der Haut, exfoliative Dermatitis.
Sehr selten: Stevens-Johnson-Syndrom (SJS) und toxisch epidermale Nekrolyse (TEN) (siehe
Abschnitt 4.4).
Häufigkeit
nicht bekannt: akut generalisierendes pustulöses Exanthem, Erythem, Lichen ruber planus.
Skelettmuskulatur-. Bindegewebs- und Knochenerkrankungen Häufig: Arthralgie.
Gelegentlich: Muskelschwäche.
Selten: Myalgie.
Häufigkeit
nicht bekannt: Sjögren-Syndrom.
Erkrankungen der Nieren und Harnwege Häufig: Proteinurie.
Selten: Hämaturie, Kristallausscheidungen im Urin, gelborange Verfärbung des Urins.
Sehr selten: akute interstitielle Nephritis, nephrotisches Syndrom.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Sehr häufig: bei Männern: Oligospermie, vorübergehend eingeschränkte Zeugungsfähigkeit.
Kongenitale, familiäre und genetische Erkrankungen Selten: akute Porphyrieschübe.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Sehr häufig: Müdigkeit.
Häufig: Fieber, Schläfrigkeit, Benommenheit, Konzentrationsstörungen, Schlaflosigkeit.
Gelegentlich: Gesichtsödeme, allgemeines Schwächegefühl.
Häufigkeit
nicht bekannt: Gelbfärbung von Körperflüssigkeiten.
Untersuchungen
Selten: Anstieg antinukleärer Antikörper (ANA).
Die Nebenwirkungen können allgemein in 2 Gruppen aufgeteilt werden:
Die erste Gruppe ist dosisabhängig, abhängig vom Acetylierer-Phänotyp und größtenteils vorhersehbar. Diese Gruppe umfasst Nebenwirkungen wie Übelkeit und Erbrechen, Kopfschmerzen, hämolytische Anämie und Methämoglobinämie.
Im Falle von dosisabhängigen Nebenwirkungen kann die Behandlung mit Pleon RA nach 1 Woche Unterbrechung weitergeführt werden, beginnend mit kleinen Dosen, welche langsam unter klinischer Aufsicht erhöht werden.
Die zweite Gruppe besteht aus Überempfindlichkeitsreaktionen, welche nicht vorhersehbar sind und meistens zu Beginn der Behandlung auftreten. Diese Gruppe umfasst Nebenwirkungen wie Hautausschlag, aplastische Anämie, Störungen der Leber- und Lungenfunktion sowie Autoimmunhämolyse.
In Fällen von Überempfindlichkeitsreaktionen sollte die Anwendung von Pleon RA sofort beendet werden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
a) Intoxikationserscheinungen
Es gibt Hinweise, dass Inzidenz und Schweregrad von Intoxikationen auf Grund einer Überdosierung direkt auf die Sulfapyridinkonzentration im Serum zurückzuführen sind. Symptome einer Überdosierung können sein: Übelkeit, Erbrechen, Magenbeschwerden und Bauchschmerzen. Bei weiter fortgeschrittenen Fällen können Symptome des zentralen Nervensystems wie Benommenheit, Krämpfe etc. auftreten. Die Sulfapyridinkonzentrationen im Serum können zur Verlaufskontrolle nach einer Überdosierung genutzt werden.
b) Behandlung bei Intoxikation
Im Falle einer Überdosierung wird bis zu 2,5 Stunden nach der Einnahme der Tabletten zu einer Magenspülung geraten. Mittel, die den Verdauungsvorgang beschleunigen, können eventuell die Resorption von Sulfasalazin verringern, wenn die Tabletteneinnahme länger als 2,5 Stunden zurückliegt. Sulfasalazin und seine Metaboliten sind dialysierbar. In Fällen von schwerer Vergiftung sollte die Anwendung von Pleon RA sofort beendet werden.
Einer Methämoglobinämie kann durch Verabreichung von Toluidinblau, 2-4 mg/kg Körpergewicht i. v., oder Methylenblau, 1-2 mg/kg Körpergewicht i. v., entgegengewirkt werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Spezifische Antirheumatika,
ATC-Code: M01 CX02.
Sulfasalazin (Salazosulfapyridin, 5[4-(2-Pyridylsu]famoyl)phenylazo]salicylsäure, SASP) ist eine Azoverbindung des Sulfonamids Sulfapyridin mit 5-Aminosalicylsäure (5-ASA). Obwohl die pharmakokinetischen Eigenschaften der Substanz weitgehend aufgeklärt sind und ihre klinische Wirksamkeit bei der Behandlung der rheumatoiden Arthritis belegt ist, bestehen dennoch Unklarheiten über den eigentlichen Wirkmechanismus.
Sulfasalazin ist bei der Behandlung der rheumatoiden Arthritis in die Klasse der Basistherapeutika einzuordnen. Ein wesentlicher Faktor der Wirkung von Sulfasalazin scheint der Einfluss auf die Leukotrien-Synthese, den Arachidonsäurestoffwechsel und die Lipoxygenierung am Ort des entzündlichen Geschehens zu sein. Der Beitrag der antimikrobiellen Wirkung zur Wirksamkeit ist ungeklärt. Diskutiert wird auch ein immunmodulierender Effekt.
5.2 Pharmakokinetische Eigenschaften
Resorption
Nach oraler Einnahme wird Sulfasalazin zu etwa 20 % im Dünndarm resorbiert.
Verteilung
Die höchste Serumkonzentration ist nach 3-6 Stunden erreicht. Die durchschnittliche Halbwertszeit nach einer Einzeldosis beträgt 5,7 Stunden, nach wiederholter Einnahme 7,6 Stunden. Die Eiweißbindung beträgt mehr als 95 %.
Metabolismus und Elimination
Ein kleinerer Teil der resorbierten Substanz wird mit dem Urin ausgeschieden, der Rest gelangt über die Galle zurück in den Dünndarm (enterohepatischer Kreislauf). Innerhalb von 2 Tagen nach Einnahme fällt der Serumspiegel auf eine sehr niedrige Konzentration. Der größte Teil der verabreichten Sulfasalazin-Dosis erreicht den Dickdarm und wird durch Darmbakterien in seine Metaboliten Sulfapyridin und 5-Aminosalicylsäure gespalten. Sulfapyridin wird resorbiert, teilweise acetyliert, hydroxyliert und glucuronidiert. Sulfapyridin wird dann zum größten Teil mit dem Urin ausgeschieden. Nicht acetyliertes Sulfapyridin ist an Serumalbumin gebunden und erreicht seine maximale Plasmakonzentration nach 12 Stunden. Nach 3 Tagen ist im Serum kein Sulfapyridin mehr nachzuweisen. Nach Einnahme einer einzelnen Dosis von 2 g Sulfasalazin sind etwa 80 % (70-90 %) der Dosis als ganzes Molekül und Sulfapyridin-Metaboliten im Urin nachweisbar. Entsprechend der genetischen Veranlagung entwickeln Langsamacetylierer eine höhere Serumkonzentration an freiem Sulfapyridin und zeigen aus diesem Grund eher Nebenwirkungen.
Der resorbierte Teil der 5-Aminosalicylsäure wird schnell mit dem Urin ausgeschieden, primär als Acetyl-5-Aminosalicylsäure. Ein größerer Teil wird über die Fäzes ausgeschieden.
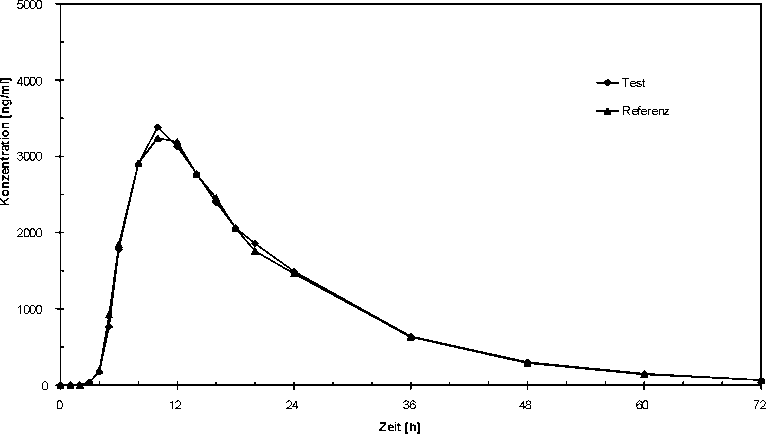
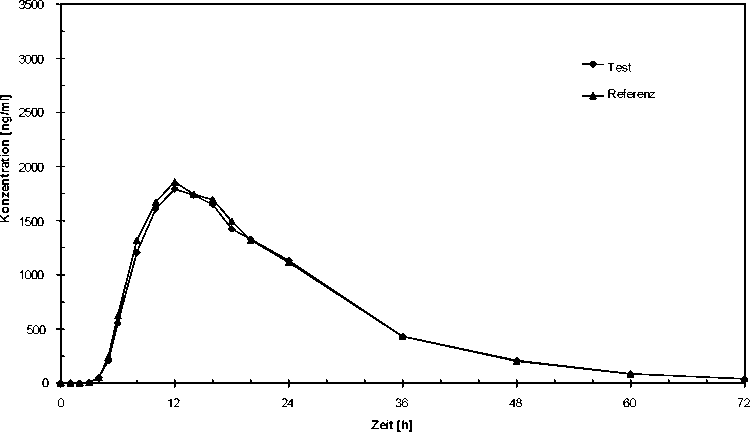
Bioverfügbarkeit
In einer Untersuchung an 24 gesunden Probanden aus dem Jahre 2002 wurde die Bioverfügbarkeit anhand der Menge der resorbierten Metaboliten Sulfapyridin und Acetylsulfapyridin nach oraler Gabe im Vergleich zu einem Referenzpräparat untersucht. Die Studie erbrachte die in der nachfolgenden Tabelle aufgeführten Ergebnisse. Die statistische Auswertung der pharmakokinetischen ÄquivalenzZielgrößen Cmax und AUC belegen die Bioäquivalenz mit dem Referenzpräparat.
|
Pleon RA |
Rel |
erenzpräparat | ||||
|
Metabolit |
AUC1 |
Cmax2 |
t 3 *max |
AUC1 |
Cmax2 |
t 3 lmax |
|
[pg/ml x h] |
[pg/ml] |
[h] |
[pg/ml x h] |
[pg/ml] |
[h] | |
|
Sulfapyridin |
59.49 + |
3.56 + |
10.3 + |
57.95 + |
3.48 |
9.8 |
|
30.59 |
1.2 |
2.1 |
32.89 |
1.21 |
2.1 | |
|
N-Acetyl- |
37.3 + |
1.69 + |
14.7 + |
36.8 + |
1.68 + |
14.3 + |
|
sulfapyridin |
17.36 |
1.16 |
4.0 |
19.55 |
1.18 |
3.4 |
'Fläche unter der Konzentrations-Zeit-Kurve. 2Maximale Plasmakonzentration.
3Zeitpunkt der maximalen Plasmakonzentration.
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität
Die akute Toxizität von Sulfasalazin ist niedrig. Die LD50-Werte sind für Mäuse und Ratten höher als 8-12 g/kg Körpergewicht.
Chronische Toxizität
Bei 6-monatigen Studien mit Hunden (250 mg und 500 mg/kg Körpergewicht) zeigte sich eine leichte Vergrößerung der Schilddrüse. Geringe Auswirkungen auf das Hodenepithel wurden nur nach Verabreichung der hohen Dosis von 500 mg/kg Körpergewicht festgestellt. Vergleichbare Ergebnisse wurden bei 6-monatigen Studien mit Ratten erhalten.
Reproduktionstoxizität
Studien mit Ratten zeigten eine reversible Beeinträchtigung der männlichen Fertilität. Nach einer täglichen Gabe von 500 mg/kg Körpergewicht über einen bestimmten Zeitraum wurde die Arzneimittelgabe 10 Tage lang unterbrochen (neuer spermiogenetischer Zyklus). Die Fertilität und allgemeine Zeugungskraft normalisierten sich danach wieder.
Teratologische Studien mit Ratten zeigten nach einer oralen Gabe von 500 mg/kg Körpergewicht pro Tag keinerlei unerwünschte Wirkungen. Die jeweils unschädliche Dosis bei Tests bezüglich einer Wirkung auf die prä- und postnatale Entwicklung betrug 200 mg/kg Körpergewicht.
Mutagenität und Karzinogenität
Die für Sulfasalazin verfügbaren Ergebnisse aus In-vitro- und In-vivo-Mutagenitätsstudien sind nicht eindeutig.
In zweijährigen oralen Karzinogenitätsstudien wurde eine erhöhte Inzidenz von Blasen- und NierenÜbergangszell-Papillomen bzw. hepatozellulären Adenomen/Karzinomen in Ratten bzw. Mäusen nach einer Behandlung mit Sulfasalazin beobachtet. Die zurzeit vorliegenden epidemiologischen Daten weisen nicht auf ein tumorerzeugendes Potenzial von Sulfasalazin beim Menschen hin.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Povidon K 25, Stearinsäure (Ph. Eur.) [pflanzlich], Magnesiumstearat (Ph. Eur.) [pflanzlich], hochdisperses Siliciumdioxid, Crospovidon, Talkum, Carmellose-Natrium (Ph. Eur.), Natriumcitrat (Ph. Eur.), Macrogol 6000, Propylenglykol, Methacrylsäure-Ethylacrylat-Copolymer-(1 : 1)-Dispersion 30 % (Ph. Eur.), Titandioxid (E 171).
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
5 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
Weiße HD-PE-Röhrchen aus Niederdruckpolyethylen mit LD-PE-Schnappdeckel aus Hochdruckpolyethylen.
70 Filmtabletten 100 Filmtabletten 300 Filmtabletten 500 (5 x 100) Filmtabletten
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Sanofi-Aventis Deutschland GmbH 65926 Frankfurt am Main Postanschrift:
Postfach 80 08 60 65908 Frankfurt am Main Telefon: (01 80) 2 22 20 101
Telefax: (01 80) 2 22 20 111
E-Mail: medinfo.de@sanofi.com
8. ZULASSUNGSNUMMER
16571.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 15. Oktober 1993
Datum der letzten Verlängerung der Zulassung: 31. Oktober 2001
10. STAND DER INFORMATION
März 2015
11. VERKAUFSAB GRENZUNG
Verschreibungspflichtig.
Sulfapyridin-Mittelwertskurven:
Acetyl-Sulfapyridin-Mittelwertskurven:
14
0,06 €/Anruf (dt. Festnetz); max. 0,42 €/min (Mobilfunk).