Predni M Tablinen 16Mg
1
1
Fachinformation Predni M Tablinen® 16 mg
1. BEZEICHNUNG DES ARZNEIMITTELS
Predni M Tablinen® 16 mg
Tabletten
Wirkstoff: Methylprednisolon
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Tablette enthält 16 mg Methylprednisolon.
Sonstiger Bestandteil mit bekannter Wirkung:
Enthält Lactose (siehe Abschnitt 4.4).
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Weiße, runde, gewölbte Tabletten mit einseitiger Kreuzbruchkerbe.
Die Tablette kann in gleiche Hälften bzw. Viertel geteilt werden.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Predni M Tablinen 16 mg sind angezeigt zur Behandlung von Erkrankungen, die einer systemischen Therapie mit Glukokortikoiden bedürfen.
Hierzu gehören je nach Erscheinungsform und Schweregrad:
Rheumatische Gelenkerkrankungen/Rheumatologie
- Aktive rheumatoide Arthritis mit schweren progredienten Verlaufsformen, z. B. schnell destruierend verlaufende Form und/oder extraartikuläre Manifestationen,
- juvenile idiopathische Arthritis mit schwerer systemischer Verlaufsform (StillSyndrom) oder mit lokal nicht beeinflussbarer Iridozyklitis.
Pneumologie
- Asthma bronchiale (gleichzeitig empfiehlt sich die Verabreichung von Bronchodilatatoren),
- akute Exazerbation einer COPD (empfohlene Therapiedauer bis zu 10 Tagen),
- interstitielle Lungenerkrankungen, wie akute Alveolitis, Lungenfibrose,
Langzeittherapie chronischer Formen der Sarkoidose in den Stadien II und III (bei Atemnot, Husten und Verschlechterung der Lungenfunktionswerte).
Erkrankungen der oberen Luftwege
- Schwere Verlaufsformen von Pollinosis und Rhinitis allergica, nach Versagen intranasal verabreichter Glukokortikoide.
Dermatologie
Erkrankungen der Haut und Schleimhäute, die aufgrund ihres Schweregrades und/oder
Ausdehnung bzw. Systembeteiligung nicht oder nicht ausreichend mit topischen
Glukokortikoiden behandelt werden können.
Dazu gehören:
- allergische, pseudoallergische und infektallergische Erkrankungen, z. B. akute Urtikaria, anaphylaktoide Reaktionen, Arzneimittelexantheme, Erythema exsudativum multiforme, toxische epidermale Nekrolyse (Lyell-Syndrom), Pustulosis acuta generalisata, Erythema nodosum, akute febrile neutrophile Dermatose (SweetSyndrom), allergisches Kontaktekzem,
- Vaskulitiden, z. B. Vasculitis allergica, Polyarteriitis nodosa,
- Autoimmunerkrankungen, z. B. Dermatomyositis, systemische Sklerodermie (indurative Phase), chronisch diskoider und subakut kutaner Lupus erythematodes.
Hämatologie/Tumorerkrankungen
- Autoimmunhämolytische Anämie,
- Prophylaxe und Therapie von Zytostatika-induziertem Erbrechen (Anwendung im Rahmen antiemetischer Schemata).
Gastroenterologie/Hepatologie
- Colitis ulcerosa, Morbus Crohn.
Substitutionstherapie
- Nebennierenrindeninsuffizienz jeglicher Genese (z. B. Morbus Addison, adrenogenitales Syndrom, Z. n. Adrenalektomie, ACTH-Mangel) jenseits des Wachstumsalters (Mittel der ersten Wahl sind Hydrokortison und Kortison),
- Stresszustände nach langfristiger Kortikoidtherapie.
Predni M Tablinen 16 mg können weiterhin angewendet werden
- zur Immunsuppression nach Transplantation im Rahmen üblicher Kombinationstherapien,
- als ergänzende Maßnahme bei einer Zytostatika- oder Strahlentherapie im Rahmen bestehender Schemata zur Kombinationstherapie, palliativen Therapie bzw. antiemetischen Therapie.
4.2 Dosierung und Art der Anwendung
Die Höhe der Dosierung ist abhängig von der Art und Schwere der Erkrankung und vom individuellen Ansprechen des Patienten. Im Allgemeinen werden relativ hohe Initialdosen angewendet, die bei akuten schweren Verlaufsformen deutlich höher sein müssen als bei chronischen Erkrankungen. Je nach klinischer Symptomatik und Ansprechverhalten kann unterschiedlich schnell auf eine möglichst niedrige Erhaltungsdosis reduziert werden. Speziell bei chronischen Erkrankungen ist oft eine Langzeitbehandlung mit niedrigen Erhaltungsdosen erforderlich.
Als allgemeine Dosierungsempfehlungen für Methylprednisolon können gelten:
Anfangsdosen:
Für Erwachsene 12-160 mg täglich.
Für Kinder 0,8-1,5 mg/kg Körpergewicht, jedoch nicht mehr als 80 mg täglich.
Erhaltungsdosen:
Für Erwachsene 4-12 mg täglich, kurzzeitig bis 16 mg täglich (bei bestimmten Erkrankungen auch
1 -2 mg täglich).
Für Kinder 2-4 mg täglich, kurzzeitig bis 8 mg täglich (bei bestimmten Erkrankungen auch
1-2 mg täglich).
Bei den einzelnen Indikationen gelten folgende Dosierungsempfehlungen:
Obstruktive Atemwegserkrankungen:
Initial 32-40 mg Methylprednisolon täglich, Dosisreduktion um 8 mg alle 4 Tage. Nach 3-4 Wochen Beendigung der Therapie, ggf. Umstellung auf inhalierbare Glukokortikoide. Gleichzeitig empfiehlt sich die Verabreichung von Bronchodilatatoren. Bei nicht ausreichendem Ansprechen schwerer Asthmaformen längerfristige Therapie mit der geringstmöglichen Dosis von 4-8 mg Methylprednisolon täglich. Die Therapie sollte zirkadian erfolgen, eine alternierende Therapie ist meist nicht möglich. Bei starken nächtlichen und frühmorgendlichen Beschwerden kann die Tagesdosis auf % morgens und A abends (18.00 bis 20.00 Uhr) aufgeteilt werden.
Interstitielle Lungenerkrankungen:
Akute Alveolitis: initial 32-40 mg Methylprednisolon täglich für 1 Woche (bei Bedarf auf 2 Gaben pro Tag verteilt), danach langsame Dosisreduktion mit Umstellung auf einmal tägliche Applikation.
Lungenfibrose:
Initial 24-32 mg Methylprednisolon täglich, ggf. in Kombination mit Azathioprin oder Penicillamin. Langsame Dosisreduktion auf individuelle Erhaltungsdosen von 4-8 mg Methylprednisolon täglich.
Sarkoidose:
Initial 32-40 mg Methylprednisolon täglich bis zum Wirkungseintritt, ggf. auf 2 Einzelgaben verteilt. Abbau der Therapie innerhalb 4-6 Wochen, dabei Umstellung auf einmal tägliche Gabe. Chronische Formen der Stadien II und III benötigen eine Langzeittherapie mit Tagesdosen von 812 mg Methylprednisolon, wobei eine alternierende Gabe bevorzugt werden sollte.
Pollinosis, Rhinitis allergica:
Zusätzlich zu Antihistaminika und lokal wirksamen Prophylaktika und Antiallergika, wenn diese nicht ausreichend wirken oder die Gefahr der Beteiligung der mittleren und kleinen Atemwege besteht:
Kurzzeittherapie mit initial 16 mg Methylprednisolon täglich morgens für 4 Tage (nur in Einzelfällen initial höhere Dosis erforderlich). Dosisreduktion auf 8 mg Methylprednisolon täglich für weitere 4 Tage. Beendigung der Therapie nach 8 Tagen, bei nicht ausreichendem Ansprechen ggf. Fortsetzung der Behandlung für 1 -2 Wochen mit 4-8 mg Methylprednisolon täglich.
Hauterkrankungen:
Je nach Schweregrad und Verlaufsform können initial 80-160 mg Methylprednisolon indiziert sein. Die Dosisreduktion erfolgt schnell, so dass die Therapie im Allgemeinen nach 2-4 Wochen beendet werden kann. Nur in wenigen Fällen ist eine länger dauernde Therapie über Wochen und Monate notwendig.
Autoimmunerkrankungen:
Je nach Schweregrad und Organbeteiligung initial 40-160 mg Methylprednisolon täglich, dann langsame Reduzierung auf die Erhaltungsdosis, die unter Umständen über Jahre erforderlich ist. Bei akuten Verläufen kann initial eine hoch dosierte Stoßtherapie notwendig sein.
Rheumatische Gelenkerkrankungen:
Initial 16-24 mg Methylprednisolon täglich, bei viszeraler Beteiligung auch bis 60 mg Methylprednisolon täglich. Anzustreben ist eine Erhaltungsdosis, die nicht über 6 mg Methylprednisolon täglich liegt.
Blutkrankheiten:
Autoimnumhämolvtischc Anämie: initial 80-160 mg Methylprednisolon täglich, nach Ansprechen der Therapie (meist innerhalb von 2 Wochen) langsamer Abbau auf die Erhaltungsdosis.
Colitis ulcerosa und Morbus Crohn:
Initial 40-80 mg Methylprednisolon täglich, dann langsamer Abbau der Dosis. Bei Colitis ulcerosa sollte die Therapie möglichst schnell beendet werden. Ist bei Morbus Crohn eine Langzeittherapie erforderlich, sollte die alternierende Gabe angestrebt werden.
Substitutionstherapie bei Nebennierenrindeninsuffizienz:
4-8 mg Methylprednisolon täglich, falls erforderlich zusammen mit einem Mineralokortikoid.
Immunsuppression nach Transplantation im Rahmen üblicher Kombinationstherapien:
Die Dosierung erfolgt gemäß dem verwendeten immunsuppressiven Protokoll. Die klinische Situation entscheidet über den völligen Dosisabbau oder die Notwendigkeit einer Erhaltungsdosis.
Ergänzende Maßnahme bei einer Zytostatika- oder Strahlentherapie im Rahmen bestehender Schemata zur Kombinationstherapie, palliativen bzw. antiemetischen Therapie:
Die Dosierung erfolgt gemäß dem verwendeten Tumorprotokoll bzw. antiemetischen Schema.
Die klinische Situation entscheidet über den völligen Dosisabbau oder die Notwendigkeit einer Erhaltungsdosis.
Hinweis:
Die Tablette kann in gleiche Hälften bzw. Viertel geteilt werden.
Art und Dauer der Anwendung
Die Tabletten werden zu oder nach dem Essen, vornehmlich nach dem Frühstück. unzerkaut mit ausreichend Flüssigkeit eingenommen.
Die Tagesdosis sollte in der Regel morgens (zwischen 6.00 und 8.00 Uhr) einmalig verabreicht werden (zirkadiane Therapie). Die Möglichkeit zur alternierenden Therapie (Einnahme einer 2-Tage-Dosis an jedem 2. Tag morgens auf einmal) ist in Abhängigkeit vom Krankheitsbild und der individuellen Reaktion zu prüfen.
Sobald ein befriedigendes Behandlungsergebnis erreicht ist, wird die Dosis bis zur erforderlich erachteten Erhaltungsdosis reduziert oder beendet.
Vorgehen beim Absetzen:
a) Hohe und höchste Dosen über wenige Tage:
Sofort absetzen.
b) Behandlung über 3-4 Wochen:
Tagesdosen über 12 mg Methylprednisolon: tägliche Reduktion um 4 mg.
Tagesdosen von 12 mg Methylprednisolon: Reduktion um 2 mg alle 2-3 Tage oder um 4 mg alle 4-6 Tage.
c) Langzeittherapie mit Erhaltungsdosis:
Nach länger dauernder Behandlung, insbesondere mit vergleichsweise hohen Dosen, darf Methylprednisolon nicht abrupt, sondern muss ausschleichend abgesetzt werden. Reduktion der Dosis um 2 mg alle 2-3 Tage, in der letzten Woche Einnahme von 2 mg Methylprednisolon jeden 2. Tag. Gegebenenfalls Kontrolle des adrenalen Regelkreises.
Wahl der Darreichungsformen:
Methylprednisolon steht von verschiedenen Anbietern in Form von Tabletten zu 4, 8, 16, 32 und 40 mg zur Verfügung.
4.3 Gegenanzeigen
Überempfindlichkeit gegen Methylprednisolon, andere Glukokortikoide oder einen der sonstigen Bestandteile.
Für die kurzfristige Anwendung bei vitaler Indikation oder bei Substitutionstherapie gibt es sonst keine Kontraindikationen.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Bei schweren Infektionen dürfen Predni M Tablinen 16 mg nur unter gleichzeitiger spezifischer antiinfektiöser Therapie angewendet werden. Eine Pharmakotherapie mit Predni M Tablinen 16 mg sollte nur unter strengster Indikationsstellung und ggf. zusätzlicher, gezielter antiinfektiöser Therapie durchgeführt werden bei folgenden Erkrankungen:
- akute Virusinfektionen (z. B. Herpes zoster, Herpes simplex, Varizellen, Keratitis herpetica),
- HBsAG-positive chronisch aktive Hepatitis,
- circa 8 Wochen vor bis 2 Wochen nach Schutzimpfungen mit Lebendimpfstoffen,
- systemische Mykosen und Parasitosen (z. B. Nematoden, Amöben),
- Poliomyelitis,
- Lymphadenitis nach BCG-Impfung,
- akute und chronische bakterielle Infektionen,
- bei Tuberkulose in der Anamnese (cave: Reaktivierung!) Anwendung nur unter Tuberkulostatika-Schutz und sorgfältiger Überwachung.
Zusätzlich sollte eine Pharmakotherapie mit Predni M Tablinen 16 mg nur unter strenger Indikationsstellung und ggf. zusätzlicher spezifischer Therapie durchgeführt werden bei:
- Magen-Darm-Ulzera,
- schwerer Osteoporose,
- schwer einstellbarer Hypertonie,
- schwer einstellbarem Diabetes mellitus,
- psychiatrischen Erkrankungen (auch anamnestisch),
- Eng- und Weitwinkelglaukom,
- Hornhautulzerationen und Hornhautverletzungen.
Wegen der Gefahr einer Darmperforation mit Peritonitis dürfen Predni M Tablinen 16 mg nur bei zwingender Indikation und unter entsprechender Überwachung angewendet werden bei:
- schwerer Colitis ulcerosa mit drohender Perforation, mit Abszessen oder eitrigen Entzündungen,
- Divertikulitis,
- Enteroanastomosen (unmittelbar postoperativ).
Die Zeichen einer peritonealen Reizung nach gastrointestinaler Perforation können bei Patienten, die hohe Dosen von Glukokortikoiden erhalten, fehlen.
Während der Anwendung von Predni M Tablinen 16 mg ist bei Diabetikern ein eventuell erhöhter Bedarf an Insulin oder oralen Antidiabetika zu berücksichtigen und die Stoffwechseleinstellung muss regelmäßig kontrolliert werden.
Während der Behandlung mit Predni M Tablinen 16 mg ist bei Patienten mit Hypertonie eine regelmäßige Blutdruckkontrolle erforderlich.
Patienten mit schwerer Herzinsuffizienz sind sorgfältig zu überwachen, da die Gefahr einer Verschlechterung besteht.
Bei Behandlung einer Myasthenia gravis kann es initial zu einer Symptomverschlechterung bis hin zu einer myasthenischen Krise kommen; deshalb sollte die Einstellung auf Kortikosteroide stationär erfolgen. Die Therapie mit Predni M Tablinen 16 mg sollte einschleichend begonnen werden, insbesondere bei schwerer facio-pharyngealer Symptomatik und Minderung des Atemvolumens.
Die Behandlung mit Predni M Tablinen 16 mg kann die Symptomatik einer bestehenden oder sich entwickelnden Infektion verschleiern und somit die Diagnostik erschweren.
Eine Behandlung mit Glukokortikoiden kann durch Immunsuppression zu einem erhöhten Infektionsrisiko führen, auch durch solche Krankheitserreger, die ansonsten selten Infektionen verursachen (sog. opportunistische Keime).
Impfungen mit Totimpfstoffen sind grundsätzlich möglich. Es ist jedoch zu beachten, dass die Immunreaktion und damit der Impferfolg bei höheren Dosierungen der Kortikoide beeinträchtigt werden kann. Daher wird bei Patienten unter Erhaltungstherapie mit höherer Dosierung (ausgenommen bei Substitutionstherapie) eine Impfung nicht empfohlen.
Bei einer langdauernden Therapie mit Predni M Tablinen 16 mg sind regelmäßige ärztliche Kontrollen (einschließlich augenärztlicher Kontrollen in dreimonatigen Abständen) angezeigt; bei vergleichsweise hohen Dosen ist auf eine ausreichende Kaliumzufuhr und auf Natriumrestriktion zu achten und der Serum-Kalium-Spiegel zu überwachen.
Kommt es während der Behandlung mit Predni M Tablinen 16 mg zu besonderen körperlichen Stresssituationen (Unfall, Operation, Geburt etc.), kann eine vorübergehende Dosiserhöhung erforderlich werden. Wegen der möglichen Gefährdung in Stresssituationen sollte für den Patienten bei länger dauernder Therapie ein Kortikoidausweis ausgestellt werden.
Abhängig von Dauer und Dosierung der Behandlung muss mit einem negativen Einfluss auf den Calciumstoffwechsel gerechnet werden, so dass eine Osteoporose-Prophylaxe zu empfehlen ist. Dies gilt vor allem bei gleichzeitig bestehenden Risikofaktoren wie familiärer Veranlagung, höherem Lebensalter, nach der Menopause, ungenügender Eiweiß- und Calciumzufuhr, starkem Rauchen, übermäßigem Alkoholgenuss sowie Mangel an körperlicher Aktivität. Die Vorbeugung besteht in ausreichender Calcium- und Vitamin-D-Zufuhr sowie körperlicher Aktivität. Bei bereits bestehender Osteoporose sollte zusätzlich eine medikamentöse Therapie erwogen werden.
Bei Beendigung oder gegebenenfalls Abbruch einer Langzeitgabe ist an folgende Risiken zu denken: Exazerbation bzw. Rezidiv der Grundkrankheit, akute NNR-Insuffizienz (insbesondere in Stresssituationen, z. B. während Infektionen, nach Unfällen, bei verstärkter körperlicher Belastung), Cortison-Entzugssyndrom.
Spezielle Viruserkrankungen (Windpocken, Masern) können bei Patienten, die mit Glukokortikoiden behandelt werden, besonders schwer, manchmal auch lebensbedrohlich, verlaufen. Insbesondere gefährdet sind immunsupprimierte Kinder und Personen ohne bisherige Windpocken- oder Maserninfektion. Wenn diese Personen während einer Behandlung mit Predni M Tablinen 16 mg Kontakt zu Personen haben, die an Masern, Windpocken oder Herpes zoster erkrankt sind, sollte gegebenenfalls eine vorbeugende Behandlung eingeleitet werden.
Bei Hypothyreose oder bei Leberzirrhose können vergleichsweise niedrige Dosierungen ausreichen bzw. kann eine Dosisreduktion erforderlich sein; und eine sorgfältige Überwachung sollte erfolgen.
Kinder
Bei Kindern sollte die Indikation aufgrund der wachstumshemmenden Wirkung von Methylprednisolon streng gestellt und das Längenwachstum bei Langzeittherapie mit Predni M Tablinen 16 mg regelmäßig kontrolliert werden.
Die Anwendung von Predni M Tablinen 16 mg kann bei Dopingkontrollen zu positiven Ergebnissen führen. Zudem kann es bei Anwendung von Predni M Tablinen 16 mg als Dopingmittel zu einer Gefährdung der Gesundheit kommen.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Predni M Tablinen 16 mg nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Arzneimittel, die CYP3A4 inhibieren, wie Ketoconazol und Itraconazol:
Die Kortikoidwirkung kann verstärkt werden.
Diltiazem:
Inhibition des Metabolismus von Methylprednisolon (CYP3A4) und des P-Glykoproteins. Der Patient sollte bei Behandlungsbeginn mit Methylprednisolon überwacht werden. Eine Dosisanpassung von Methylprednisolon kann erforderlich sein.
Estrogene (z. B. Ovulationshemmer):
Die Kortikoidwirkung kann verstärkt werden.
Arzneimittel, die CYP3A4 induzieren, wie Rifampicin, Phenytoin, Carbamazepin, Barbiturate und Primidon:
Die Kortikoidwirkung kann vermindert werden.
Ephedrin:
Der Metabolismus von Glukokortikoiden kann beschleunigt und hierdurch deren Wirksamkeit abgeschwächt werden.
Antazida:
Aluminiumhydroxidhaltige Antazida reduzieren die Bioverfügbarkeit von Prednison. Entsprechende Untersuchungen für Methylprednisolon liegen nicht vor. Wechselwirkungen können somit nicht sicher ausgeschlossen werden. Es wird empfohlen, die Arzneimittel mit einem zeitlichen Abstand von ca. 2 Stunden einzunehmen.
Herzglykoside:
Die Glykosidwirkung kann durch Kaliummangel verstärkt werden.
Saluretika/Laxanzien:
Die Kaliumausscheidung kann erhöht werden.
Nicht depolarisierende Muskelrelaxanzien:
Die Muskelrelaxation kann länger anhalten (siehe auch Abschnitt 4.8).
Antidiabetika:
Die blutzuckersenkende Wirkung kann vermindert werden.
Cumarinderivate:
Die Antikoagulanzienwirkung kann abgeschwächt werden.
Praziquantel:
Durch Kortikosteroide ist ein Abfall der Praziquantel-Konzentration im Blut möglich.
Somatropin:
Die Wirkung von Somatropin kann vermindert werden.
Protirelin:
Der TSH-Anstieg nach Gabe von Protirelin kann reduziert sein.
Nichtsteroidale Antiphlogistika/Antirheumatika, Salicylate und Indometacin:
Die Gefahr von gastrointestinalen Ulzerationen und Blutungen kann erhöht werden.
Atropin, andere Anticholinergika:
Zusätzliche Augeninnendrucksteigerungen bei gleichzeitiger Anwendung mit Predni M Tablinen 16 mg sind möglich.
Chloroquin, Hydroxychloroquin, Mefloquin:
Es besteht ein erhöhtes Risiko des Auftretens von Myopathien, Kardiomyopathien.
Ciclosporin:
Die Blutspiegel von Ciclosporin können erhöht werden: Es besteht eine erhöhte Gefahr zerebraler Krampfanfälle.
ACE-Hemmstoffe:
Erhöhtes Risiko des Auftretens von Blutbildveränderungen.
Einfluss auf Untersuchungsmethoden:
Hautreaktionen auf Allergietests können unterdrückt werden.
4.6 Schwangerschaft und Stillzeit
Schwangerschaft
Während der Schwangerschaft soll eine Behandlung nur nach sorgfältiger Nutzen-RisikoAbwägung erfolgen.
Die Erfahrungen über die Sicherheit einer Anwendung von Methylprednisolon in der Schwangerschaft beim Menschen sind unzureichend.
Bei einer Langzeitbehandlung mit Glukokortikoiden während der Schwangerschaft sind Wachstumsstörungen des Fetus nicht auszuschließen. Methylprednisolon führte im Tierexperiment zur Ausbildung von Gaumenspalten (siehe Abschnitt 5.3). Ein erhöhtes Risiko für orale Spaltbildungen bei menschlichen Feten durch die Gabe von Glukokortikoiden während des ersten Trimenons wird diskutiert. Werden Glukokortikoide am Ende der Schwangerschaft gegeben, besteht für den Fetus die Gefahr einer Atrophie der Nebennierenrinde, die eine ausschleichende Substitutionsbehandlung des Neugeborenen erforderlich machen kann.
Stillzeit
Glukokortikoide gehen in geringen Mengen in die Muttermilch über. Die Belastung des Säuglings wird dabei in der Regel weniger als 1/100 der systemisch bei der stillenden Mutter zur Verfügung stehenden Dosis betragen. Vorsorglich sollte trotzdem bei Anwendung höherer Dosen oder bei einer Langzeitbehandlung abgestillt werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Unter Behandlung mit Predni M Tablinen 16 mg kann durch bestimmte unerwünschte Wirkungen, wie z. B. Verminderung der Sehschärfe (infolge Linsentrübung oder Erhöhung des Augeninnendruckes), Schwindel oder Kopfschmerzen, in seltenen Fällen die Fähigkeit z. B. zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt sein.
4.8 Nebenwirkungen
Die folgenden Nebenwirkungen sind ohne Häufigkeitsangaben angegeben (Häufigkeit nicht bekannt), da die Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar ist.
Hormonersatztherapie:
Geringes Nebenwirkungsrisiko bei Beachtung der empfohlenen Dosierungen.
Pharm akotherapie:
In Abhängigkeit von Therapiedauer und Dosis können folgende Nebenwirkungen auftreten:
Erkrankungen des Blutes und des Lymphsystems:
Leukozytose (initial, im Therapieverlauf reversibel), Lymphopenie, Eosinopenie, Polyglobulie, Thrombozytoseneigung.
Erkrankungen des Immunsystems:
Schwächung der Immunabwehr mit Erhöhung des Infektionsrisikos (bestimmte virusbedingte Erkrankungen (z. B. Varizellen, Herpes simplex oder - während der virämischen Phase - Herpes zoster) können einen schweren, manchmal auch lebensbedrohlichen Verlauf nehmen), Maskierung von Infektionen, Exazerbation latenter Infektionen, allergische Reaktionen.
Endokrine Erkrankungen:
Adrenale Suppression oder Atrophie und Induktion eines Cushing-Syndroms (typische Symptome Vollmondgesicht, Stammfettsucht und Plethora). Wachstumshemmung bei Kindern, Störungen der Sexualhormonsekretion (Amenorrhö, Hirsutismus, Impotenz).
Stoffwechsel- und Ernährungsstörungen:
Reversible epidurale, epikardiale oder mediastinale Lipomatosen.
Natriumretention mit Ödembildung, vermehrte Kaliumausscheidung mit möglicher Hypokaliämie (cave: Rhythmusstörungen!), verminderte Glukosetoleranz, Diabetes mellitus, Hypercholesterinämie und Hypertriglyceridämie, verstärkter Eiweißabbau.
Psychiatrische Erkrankungen:
Schwere Depressionen, Gereiztheit, Persönlichkeitsänderungen, Stimmungsschwankungen, Euphorie, Antriebs- und Appetitsteigerung, Psychosen, Schlafstörungen.
Erkrankungen des Nervensystems:
Pseudotumor cerebri (insbesondere bei Kindern), Manifestation einer latenten Epilepsie und Erhöhung der Anfallsbereitschaft bei manifester Epilepsie, Schwindel, Kopfschmerzen.
Augenerkrankungen:
Katarakt, insbesondere mit hinterer subkapsulärer Trübung, Glaukom, Verschlechterung der Symptome bei Hornhautulkus, Begünstigung viraler, fungaler und bakterieller Entzündungen am Auge.
Herzerkrankungen:
Progression der Stauungslunge bei Linksherzinsuffizienz.
Gefäßerkrankungen:
Hypertonie, Erhöhung des Arteriosklerose- und Thromboserisikos, Vaskulitis (auch als Entzugssyndrom nach Langzeittherapie).
Erkrankungen des Gastrointestinaltraktes:
Magen-Darm-Ulzera mit der Gefahr einer Perforation (z. B. Peritonitis), gastrointestinale Blutungen, Pankreatitis, Oberbauchbeschwerden.
Erkrankungen der Haut und des Unterhautzellgewebes:
Striae rubrae, Atrophie, Teleangiektasien, erhöhte Kapillarfragilität, Petechien, flächige Hautblutungen, Ekchymosen, Hypertrichose, Steroidakne, verzögerte Wundheilung, rosazeaartige (periorale) Dermatitis, Änderungen der Hautpigmentierung, Überempfindlichkeitsreaktionen, z. B. Arzneimittelexanthem.
Skelettmuskulatur-. Bindegewebs- und Knochenerkrankungen:
Muskelatrophie und -schwäche, bei Myasthenia gravis reversible Zunahme der Muskelschwäche bis hin zur myasthenischen Krise, Auslösung einer akuten Myopathie bei zusätzlicher Anwendung von nicht depolarisierenden Muskelrelaxanzien (siehe auch Abschnitt 4.5), Osteoporose (dosisabhängig, auch bei nur kurzzeitiger Anwendung möglich), in schweren Fällen mit der Gefahr von Knochenbrüchen, aseptische Knochennekrosen (Kopf des Oberarm- und Oberschenkelknochens), Sehnenruptur.
Hinweis:
Bei zu rascher Dosisreduktion nach langdauernder Behandlung kann es zu Beschwerden wie Muskel- und Gelenkschmerzen kommen.
Untersuchungen:
Gewichtszunahme.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Akute Intoxikationen mit Methylprednisolon sind nicht bekannt. Bei Überdosierungen ist mit verstärkten Nebenwirkungen (siehe Abschnitt 4.8), insbesondere auf Endokrinium, Stoffwechsel und Elektrolythaushalt, zu rechnen.
Ein Antidot für Methylprednisolon ist nicht bekannt.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Kortikosteroide zur systemischen Anwendung, Glukokortikoide, ATC-Code: H02AB04.
Methylprednisolon ist ein nicht fluoriertes Glukokortikoid zur systemischen Therapie. Methylprednisolon beeinflusst dosisabhängig den Stoffwechsel fast aller Gewebe. Im physiologischen Bereich ist diese Wirkung lebensnotwendig zur Aufrechterhaltung der Homöostase des Organismus in Ruhe und unter Belastung sowie zur Regulation von Aktivitäten des Immunsystems.
Bei Ausfall oder Insuffizienz der Nebennierenrinde kann Methylprednisolon, in physiologischen Dosen verabreicht, das endogene Kortisol (Hydrokortison) ersetzen. Es beeinflusst dabei im metabolischen Gleichgewicht den Kohlenhydrat-, Eiweiß- und Fettstoffwechsel. Dosiswirkungsbezogen entsprechen dabei
8 mg Methylprednisolon 40 mg Kortisol (Hydrokortison). Wegen der praktisch fehlenden mineralotropen Wirkung von Methylprednisolon muss jedoch in der Substitutionstherapie bei Ausfall der NNR-Funktion zusätzlich ein Mineralokortikoid gegeben werden.
Beim androgenitalen Syndrom ersetzt Methylprednisolon das durch Enzymdefekt fehlende Kortisol und hemmt die überhöhte Bildung von Kortikotropin in der Hypophyse sowie von Androgenen in der NNR. Wenn der Enzymdefekt auch die Synthese von Mineralokortikoid betrifft, muss dieses zusätzlich substituiert werden.
In höheren als den zur Substitution erforderlichen Dosen wirkt Methylprednisolon rasch antiphlogistisch (antiexsudativ und antiproliferativ) und verzögert immunsuppressiv. Es hemmt hierbei die Chemotaxis und Aktivität von Zellen des Immunsystems sowie die Freisetzung und Wirkung von Mediatoren der Entzündungs- und Immunreaktionen, z. B. von lysosomalen Enzymen, Prostaglandinen und Leukotrienen. Bei Bronchialobstruktion wird die Wirkung bronchialerweiternder Betamimetika verstärkt (permissiver Effekt).
Länger dauernde Therapie mit hohen Dosen führt zur Involution des Immunsystems und der NNR. Der bei Kortisol (Hydrokortison) deutlich vorhandene und beim Prednisolon noch nachweisbare mineralotrope Effekt besteht bei Methylprednisolon praktisch nicht mehr, so dass die Serumelektrolyte auch unter hohen Dosen von Predni M Tablinen 16 mg nahezu konstant und im Normbereich bleiben.
Die Wirkung von Methylprednisolon bei Atemwegsobstruktion beruht im Wesentlichen auf der Hemmung entzündlicher Prozesse, Unterdrückung oder Verhinderung eines Schleimhautödems, Hemmung der Bronchialkonstriktion, Hemmung bzw. Einschränkung der Schleimproduktion sowie Herabsetzung der Schleimviskosität. Diesen Wirkungen liegen folgende Mechanismen zugrunde: Gefäßabdichtung und Membranstabilisierung, Normalisierung von durch Dauergebrauch verminderter Ansprechbarkeit der Bronchialmuskulatur auf ß2-Sympathomimetika, Dämpfung der Typ-I-Reaktion ab der 2. Therapiewoche.
5.2 Pharmakokinetische Eigenschaften
Nach Einnahme von Methylprednisolon werden maximale Serumkonzentrationen von Methylprednisolon innerhalb von 1% Stunden erreicht, die Serumhalbwertszeit beträgt etwa 2 bis 3 Stunden. Dosisunabhängig werden 77 % an Eiweiß gebunden, und zwar nur an Albumin, nicht an Transkortin.
Methylprednisolon wird hauptsächlich in der Leber metabolisiert, weniger als 10 % der applizierten Dosis werden unverändert ausgeschieden. Die Metaboliten (11-Keto- und 20-Hydroxy-Verbindungen) sind hormonell inaktiv und werden vorwiegend renal eliminiert.
Innerhalb von 10 Stunden erscheinen etwa 85 % der applizierten Dosis im Urin, etwa 10 % in den Fäzes. Bei eingeschränkter Nierenfunktion ist die Metabolisierung von Methylprednisolon nicht beeinträchtigt, eine Dosisanpassung ist daher nicht erforderlich. Die Wirkdauer ist länger als die Verweilzeit im Serum, sie beträgt im mittleren Dosisbereich 12 bis 36 Stunden.
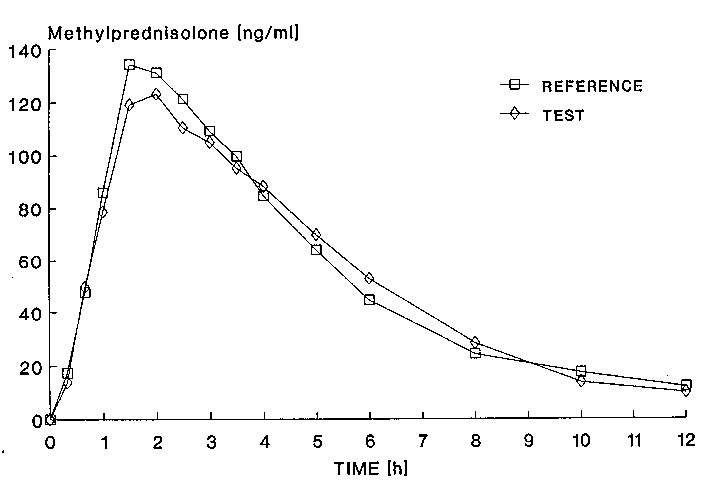
Bioverfügbarkeit
Eine im Jahr 1994 durchgeführte Bioverfügbarkeitsuntersuchung an 20 Probanden ergab im Vergleich zum Referenzpräparat:
Maximale Plasmakonzentration (Cmax): ng/ml
Testpräparat (2 Tabletten zu 8 mg)
148,8 ± 27,2
Referenzpräparat (2 Tabletten zu 8 mg)
150,5 ± 28,1
120
90
Zeitpunkt der maximalen Plasmakonzentration (tmax): min
Fläche unter der Konzentrations-Zeit-Kurve
(AUC): ng x h/ml 670 ± 137,4 671 ± 133,6
Angabe der Werte als Mittelwert und Streubreite.
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm:
5.3 Präklinische Daten zur Sicherheit
a) Akute Toxizität
Die akute orale Toxizität an der Ratte (LD50) ist größer als 4.000 mg/kg Körpergewicht. Als maximale orale Tagesdosis für den Menschen werden 80 bis 160 mg (ca. 1,3-2,6 mg/kg Körpergewicht und Tag) angegeben.
b) Chronische Toxizität
In den Tierexperimenten wurden als Ausdruck der pharmakodynamischen Wirkung Polyzythämie, Lymphopenie, Thymus- und Nebennierenrindenatrophie sowie eine vermehrte Glykogenspeicherung in der Leber festgestellt.
Nach chronischer Behandlung mit hohen Dosen (3 und 10 mg/kg Körpergewicht) kommt es zusätzlich zu geschwächter Infektionsabwehr, verminderter Aktivität des Knochenmarks, Atrophie der Skelettmuskulatur und von Hoden und Ovarien, Polydipsie, Diarrhö und genereller Verschlechterung des Allgemeinzustandes.
c) Mutagenes und tumorerzeugendes Potenzial
Methylprednisolon wurde keiner ausführlichen Mutagenitätsuntersuchung unterzogen. Der AMES-Test verlief negativ. Langzeitstudien am Tier auf eine tumorerzeugende Wirkung von Methylprednisolon liegen nicht vor.
d) Reproduktionstoxizität
Methylprednisolon ruft im Tierexperiment bei Mäusen Gaumenspalten hervor. Ratten und Kaninchen erwiesen sich als resistent für diese Schädigungen.
Die Erfahrungen über die Sicherheit einer Anwendung von Methylprednisolon in der Schwangerschaft beim Menschen sind unzureichend. Bisherige klinische Erfahrungen mit Glukokortikoiden im ersten Trimenon der Schwangerschaft ergeben keinen Hinweis auf ein erhöhtes teratogenes Risiko.
Glukokortikoide rufen im Tierversuch intrauterine Wachstumsstörungen hervor. Bei Langzeittherapie während der Schwangerschaft sind vergleichbare Wirkungen beim Menschen nicht auszuschließen.
Plazentagängigkeit
Methylprednisolon kann wie alle Kortikoide die Plazenta passieren.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Lactose-Monohydrat, vorverkleisterte Maisstärke, Carboxymethylstärke-Natrium (Typ A)
[Ph. Eur.], Magnesiumstearat (Ph. Eur.) [pflanzlich], hochdisperses Siliciumdioxid.
6.2 Inkompatibilitäten
Bisher sind keine bekannt.
6.3 Dauer der Haltbarkeit
Die Dauer der Haltbarkeit beträgt 18 Monate.
Dieses Arzneimittel soll nach Ablauf des Verfalldatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
6.5 Art und Inhalt des Behältnisses
Originalpackungen mit 10, 20, 30, 50 und 100 Tabletten.
7. INHABER DER ZULASSUNG Winthrop Arzneimittel GmbH
65927 Frankfurt am Main Telefon: (01 80) 2 02 00 101
Telefax: (01 80) 2 02 00 111
Mitvertrieb
Zentiva Pharma GmbH 65927 Frankfurt am Main
8. ZULASSUNGSNUMMER
32143.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 06.11.1996
Datum der letzten Verlängerung der Zulassung; 18.05.2005
10. STAND DER INFORMATION
März 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig.
13
0,06 €/Anruf (dt. Festnetz); max. 0,42 €/min (Mobilfunk).