Prelis 50Mg
Fachinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Prelis® 50 mg, Filmtabletten Prelis® 100 mg, Retardtabletten Prelis® 200 mg, Retardtabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: Metoprololtartrat
Die Wirksubstanz hat folgende Strukturformel:
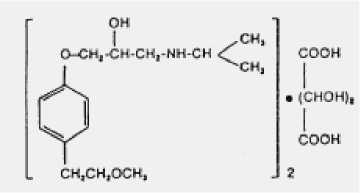
Das Molekulargewicht beträgt 684,82.
Prelis® 50 mg
1 Filmtablette enthält 50 mg Metoprololtartrat.
Prelis® 100 mg
1 Retardtablette enthält 100 mg Metoprololtartrat.
Prelis® 200 mg
1 Retardtablette enthält 200 mg Metoprololtartrat.
Prelis 50 mg enthält Lactose-Monohydrat.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Prelis 50 mg: blassrote, runde, leicht gewölbte Filmtablette mit einseitiger Bruchkerbe
Prelis® 100 mg: gelbe, runde, schwach gewölbte Retardtablette mit einseitiger Bruchkerbe
Prelis® 200 mg: gelbe, längliche Retardtablette mit beidseitiger Bruchkerbe Alle Stärken können in gleiche Teile halbiert werden.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
- Arterielle Hypertonie
- Koronare Herzkrankheit
- Hyperkinetisches Herzsyndrom (funktionelle Herzbeschwerden)
- Tachykarde Herzrhythmusstörungen
- Reinfarktprophylaxe
- Migräneprophylaxe
Prelis 50 mg zusätzlich: Akutbehandlung des Herzinfarktes
4.2 Dosierung, Art und Dauer der Anwendung
Die Dosierung sollte individuell - vor allem nach dem Behandlungserfolg - festgelegt werden. Es gelten folgende Richtdosen:
Prelis® 50 mg
Arterielle Hypertonie
1- bis 2-mal täglich 1 Tablette Prelis® 50 mg bzw. 1-mal täglich 1 bis 2 Tabletten Prelis® 50 mg (entsprechend 50-100 mg Metoprololtartrat).
Falls erforderlich kann die Tagesdosis auf 2-mal 2 Tabletten Prelis® 50 mg (entsprechend 200 mg Metoprololtartrat) erhöht werden.
Koronare Herzkrankheit
1- bis 2-mal täglich 1 Tablette Prelis 50 mg bzw. 1-mal täglich 1 bis 2 Tabletten Prelis® 50 mg (entsprechend 50-100 mg Metoprololtartrat).
Falls erforderlich kann die Tagesdosis unter Kontrolle des Blutdruckes auf 2-mal 2 Tabletten Prelis® 50 mg (entsprechend 200 mg Metoprololtartrat) erhöht werden.
Hyperkinetisches Herzsyndrom (sog. funktionelle Herzbeschwerden)
1- bis 2-mal täglich 1 Tablette Prelis® 50 mg bzw. 1-mal täglich 1 bis 2 Tabletten Prelis® 50 mg (entsprechend 50-100 mg Metoprololtartrat).
Falls erforderlich kann die Tagesdosis unter Kontrolle des Blutdruckes auf 2-mal 2 Tabletten Prelis® 50 mg (entsprechend 200 mg Metoprololtartrat) erhöht werden.
Tachykarde Herzrhythmusstörungen
1- bis 2-mal täglich 2 Tabletten Prelis® 50 mg (entsprechend 100-200 mg Metoprololtartrat).
Akutbehandlung des Herzinfarktes und Reinfarktprophylaxe
Prelis® 50 mg wird eingesetzt bei Patienten, für die keine Gegenanzeigen für eine Behandlung mit ß-Rezeptoren-Blockern bestehen.
a) Akutbehandlung
Bei akutem Herzinfarkt erfolgt die Behandlung möglichst umgehend nach Krankenhauseinweisung unter kontinuierlicher EKG- und Blutdruckkontrolle. Die Behandlung wird mit 5 mg Metoprololtartrat i.v. begonnen. Je nach Verträglichkeit können in Abständen von 2 Minuten weitere Einzeldosen von 5 mg Metoprololtartrat i.v. bis zu einer maximalen Gesamtdosis von bis zu 15 mg Metoprololtartrat verabreicht werden.
Wird die volle Dosis von 15 mg Metoprololtartrat i.v. vertragen, gibt man beginnend 15 Minuten nach der letzten intravenösen Injektion 1-mal 1 Tablette Prelis® 50 mg (entsprechend 50 mg Metoprololtartrat).
In den folgenden 48 Stunden wird alle 6 Stunden 1 Tablette Prelis® 50 mg verabreicht. Bei Patienten, die weniger als 15 mg Metoprololtartrat i.v. vertragen haben,
®
sollte die orale Anschlussbehandlung vorsichtig mit 1-mal % Tablette Prelis 50 mg (entsprechend 25 mg Metoprololtartrat) begonnen werden.
b) Erhaltungsdosis
Anschließend an die Akuttherapie werden 2-mal 2 Tabletten Prelis® 50 mg (entsprechend 200 mg Metoprololtartrat) gegeben. Bei behandlungsbedürftigem Abfall von Herzfrequenz und/oder Blutdruck oder anderen Komplikationen ist Prelis® 50 mg sofort abzusetzen.
Migräneprophylaxe
1 bis 2-mal täglich 2 Tabletten Prelis® 50 mg (entsprechend 100-200 mg Metoprololtartrat).
Prelis® 100 mg / Prelis® 200 mg Arterielle Hypertonie
1-mal täglich 1 Retardtablette Prelis® 100 mg bzw. % Retardtablette Prelis® 200 mg (entsprechend 100 mg Metoprololtartrat).
Koronare Herzkrankheit
1-mal täglich 1-2 Retardtabletten Prelis® 100 mg bzw. % -1 Retardtablette Prelis® 200 mg (entsprechend 100-200 mg Metoprololtartrat).
Hyperkinetisches Herzsyndrom (sog. funktionelle Herzbeschwerden)
1-mal täglich 1 Retardtablette Prelis® 100 mg bzw. % Retardtablette Prelis® 200 mg (entsprechend 100 mg Metoprololtartrat).
Tachykarde Herzrhythmusstörungen
1-mal täglich 1-2 Retardtabletten Prelis® 100 mg bzw. % -1 Retardtablette Prelis® 200 mg (entsprechend 100-200 mg Metoprololtartrat).
Reinfarktprophylaxe
Prelis® wird eingesetzt bei Patienten, für die keine Gegenanzeigen für eine Behandlung mit ß-Rezeptoren-Blockern bestehen.
Im Anschluss an die Behandlung der Akutphase des Herzinfarktes erfolgt die Erhaltungstherapie mit 1-mal täglich 1-2 Retardtabletten Prelis® 100 mg bzw. % -1 Retardtablette Prelis® 200 mg (entsprechend 100-200 mg Metoprololtartrat).
Bei behandlungsbedürftigem Abfall von Herzfrequenz und/oder Blutdruck oder anderen Komplikationen ist Prelis® sofort abzusetzen.
Migräneprophylaxe
1-mal täglich 1-2 Retardtabletten Prelis® 100 mg bzw. % -1 Retardtablette Prelis® 200 mg (entsprechend 100-200 mg Metoprololtartrat).
Hinweis:
- ®
Bei stark eingeschränkter Leberfunktion ist die Elimination von Prelis vermindert, so
dass unter Umständen eine Dosisreduktion erforderlich ist.
Prelis® 50 mg
Die Tabletten sind unzerkaut mit ausreichend Flüssigkeit nach den Mahlzeiten einzunehmen. Sie sollten bei Einmalgabe morgens bzw. bei zweimaliger Gabe morgens und abends eingenommen werden.
Prelis® 100 mg/Prelis® 200 mg
Die Retardtabletten sind unzerkaut mit ausreichend Flüssigkeit nach einer Mahlzeit einzunehmen.
Für alle Formen
Die Dauer der Anwendung ist zeitlich nicht begrenzt.
Sollte die Behandlung mit Prelis nach längerer Anwendung unterbrochen oder abgesetzt werden, sollte dies, da abruptes Absetzen zur Herzischämie mit Exazerbation einer Angina pectoris, zu einem Herzinfarkt oder zur Exazerbation einer Hypertonie führen kann, grundsätzlich langsam ausschleichend erfolgen.
4.3 Gegenanzeigen
®
Prelis darf nicht angewendet werden bei:
- Überempfindlichkeit gegen den Wirkstoff, einen der sonstigen Bestandteile oder andere ß-Rezeptoren-Blocker.
- manifester Herzinsuffizienz
- Schock
- AV-Block 2. oder 3. Grades
- Sinusknoten-Syndrom (sick sinus syndrome)
- sinuatrialem Block
- Bradykardie (Ruhepuls kleiner als 50 Schläge pro Minute vor Behandlungsbeginn)
- Hypotonie (systolisch kleiner als 90 mmHg)
- Azidose
- bronchialer Hyperreagibilität (z. B. bei Asthma bronchiale)
- Spätstadien peripherer Durchblutungsstörungen
- gleichzeitiger Gabe von MAO-Hemmstoffen (Ausnahme MAO-B-Hemmstoffe).
Die intravenöse Applikation von Calcium-Antagonisten vom Verapamil- oder Diltiazem-Typ oder anderen Antiarrhythmika (wie Disopyramid) bei Patienten, die mit Prelis® behandelt werden, ist kontraindiziert (Ausnahme Intensivmedizin).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Eine besonders sorgfältige ärztliche Überwachung ist erforderlich bei:
- AV-Block 1. Grades
- Diabetikern mit stark schwankenden Blutzuckerwerten (wegen möglicher schwerer hypoglykämischer Zustände)
- längerem strengen Fasten und schwerer körperlicher Belastung (wegen möglicher schwerer hypoglykämischer Zustände)
- Patienten mit Phäochromozytom (Nebennierenmarktumor) (Prelis® erst nach vorheriger a-Blockade verabreichen)
- Patienten mit eingeschränkter Leberfunktion (siehe Abschnitt 4.2).
Bei Patienten mit einer Psoriasis in der Eigen- oder Familienanamnese sollte die Verordnung von ß-Rezeptoren-Blockern nur nach sorgfältiger Nutzen-RisikoAbwägung erfolgen.
ß-Rezeptoren-Blocker können die Empfindlichkeit gegenüber Allergenen und die Schwere anaphylaktischer Reaktionen erhöhen. Deshalb ist eine strenge Indikationsstellung bei Patienten mit schweren Überempfindlichkeitsreaktionen in der Vorgeschichte und bei Patienten unter Desensibilisierungstherapie (Vorsicht, überschießende anaphylaktische Reaktionen) geboten.
Auswirkungen bei Fehlgebrauch zu Dopingzwecken:
Die Anwendung von Prelis® kann bei Dopingkontrollen zu positiven Ergebnissen führen. Die gesundheitlichen Folgen der Anwendung von Prelis® als Dopingmittel können nicht abgesehen werden, schwerwiegende Gesundheitsgefährdungen sind nicht auszuschließen.
Wichtige Informationen über bestimmte sonstige Bestandteile in Prelis- 50 mg Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Prelis® 50 mg nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Folgende Wechselwirkungen zwischen dem vorliegenden und anderen Arzneimitteln sind zu beachten:
Insulin, orale Antidiabetika: Die Wirkung kann verstärkt oder verlängert werden. Warnzeichen einer Hypoglykämie - insbesondere Tachykardie und Tremor - sind verschleiert oder abgemildert. Daher sind regelmäßige Blutzuckerkontrollen erforderlich.
Trizyklische Antidepressiva, Barbiturate, Phenothiazine, Nitroglycerin, Diuretika, Vasodilatatoren, andere blutdrucksenkende Mittel: Verstärkter Blutdruckabfall möglich (besondere Vorsicht bei Prazosin).
Kalzium-Antagonisten vom Nifedipin-Typ: Verstärkte Blutdrucksenkung und in Einzelfällen Ausbildung einer Herzinsuffizienz möglich.
Antiarrhytmika: Die kardiodepressiven Wirkungen können sich addieren.
Kalzium-Antagonisten vom Verapamil- oder Diltiazem-Typ, andere Antiarrhythmika (wie Disopyramid): Eine sorgfältige Überwachung der Patienten ist angezeigt, da es zu Hypotension, Bradykardie oder anderen Herzrhythmusstörungen kommen kann.
Hinweis
Die intravenöse Applikation von Kalzium-Antagonisten vom Verapamil- und Diltiazem-Typ oder anderen Antiarrhythmika (wie Disopyramid) bei Patienten, die mit Prelis® behandelt werden, ist kontraindiziert (Ausnahme Intensivmedizin).
Herzglykoside, Reserpin, a-Methyldopa, Guanfacin oder Clonidin: Bei gleichzeitiger Anwendung mit Prelis® kann es zu einem stärkeren Absinken der Herzfrequenz bzw. zu einer Verzögerung der Überleitung kommen.
Clonidin: Nach abruptem Absetzen bei gleichzeitiger Anwendung von Prelis kann der Blutdruck überschießend ansteigen. Clonidin darf daher erst abgesetzt werden,
®
wenn einige Tage zuvor die Verabreichung von Prelis beendet wurde. Anschließend kann Clonidin stufenweise (siehe Fachinformation Clonidin) abgesetzt werden.
Noradrenalin, Adrenalin oder andere sympathomimetisch wirkende Substanzen (z. B. enthalten in Hustenmitteln, Nasen- und Augentropfen): Bei gleichzeitiger Anwendung von Prelis® ist ein beträchtlicher Blutdruckanstieg möglich.
Adrenalin: Unter Prelis -Therapie kann es zu einer verminderten Ansprechbarkeit auf die zur Behandlung der allergischen Reaktion gewöhnlich eingesetzte AdrenalinDosis kommen.
Monoaminooxidase-(MAO)-Hemmer sollten wegen möglicher überschießender Hypertension nicht zusammen mit Prelis® eingenommen werden.
®
Indometacin, Rifampicin: Reduzierung der blutdrucksenkenden Wirkung von Prelis möglich.
®
Cimetidin: Die Wirkung von Prelis kann verstärkt werden.
®
Lidocain: Verminderte Ausscheidung durch Prelis möglich.
Narkotika: Die gleichzeitige Anwendung kann eine verstärkte Blutdrucksenkung zur Folge haben. Die negativ inotrope Wirkung der beiden vorgenannten Arzneimittel kann sich addieren.
Periphere Muskelrelaxantien (z. B. Suxamethonium, Tubocuram): Die neuromuskuläre Blockade kann durch die ß-Rezeptoren-Hemmung von Prelis® verstärkt werden. Für den Fall, dass Prelis® vor Eingriffen in Allgemeinnarkose oder vor der Anwendung peripherer Muskelrelaxanzien nicht abgesetzt werden kann, muss der Narkosearzt über die Behandlung mit Prelis® informiert werden.
Metoprolol ist ein Substrat des Cytochrom-P450-Isoenzyms CYP2D6. Der Plasmaspiegel von Metoprolol kann durch die gleichzeitige Gabe von CYP2D6 hemmenden Substraten erhöht und durch die Gabe von CYP2D6 induzierenden Wirkstoffen gesenkt werden. Die zur Erhöhung des Metoprolol-Plasmaspiegels führenden Substanzen sind u. a. Antiarrhythmika, Antihistaminika, H2-Rezeptor-Antagonisten, Antidepressiva, Antipsychotika und COX-2-Inhibitoren.
4.6 Schwangerschaft und Stillzeit
Metoprolol darf in der Schwangerschaft nur nach strenger Nutzen-Risiko-Abwägung angewendet werden, da bislang keine ausreichend gut dokumentierten Studien zu einer Anwendung an schwangeren Frauen existieren.
Metoprolol zeigte im Tierversuch keine teratogene Eigenschaften (siehe 5.3). Metoprolol passiert die Plazenta und kann im Feten zu Bradykardie, Hypotonie und Hypoglykämie führen. Betablocker reduzieren die plazentare Durchblutung, was zu Frühgeburten oder zum intrauterinen Fruchttod führen kann. Das Risiko von kardialen und pulmonalen Komplikationen bei pränatal Metoprolol-exponierten Neugeborenen ist in der Postpartalperiode erhöht.
Metoprolol sollte 48-72 Stunden vor dem errechneten Geburtstermin abgesetzt werden. Wenn dies nicht möglich ist, müssen die Neugeborenen für die Dauer 48-72
Stunden nach der Geburt sorgfältig auf Anzeichen einer ß-Blockade überwacht werden.
Metoprolol geht in die Muttermilch über. In der Muttermilch erreicht Metoprolol in etwa das Dreifache der bei der Mutter gemessenen Serumkonzentration. Obwohl nach therapeutischen Dosierungen nicht mit unerwünschten Wirkungen zu rechnen ist (Ausnahme sind „slow metabolizer“), sollten gestillte Säuglinge auf Anzeichen einer ß-Blockade hin beobachtet werden.
Zusätzlich für Prelis® 50 mg: Um die mit der Muttermilch aufgenommene Wirkstoffmenge gering zu halten, sollte 3-4 Stunden nach der Einnahme des Medikaments nicht gestillt werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Die Behandlung mit diesem Arzneimittel bedarf der regelmäßigen ärztlichen Kontrolle. Durch individuell auftretende unterschiedliche Reaktionen kann das Reaktionsvermögen so weit verändert sein, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr, zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt wird. Dies gilt in verstärktem Maße bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig Häufig Gelegentlich Selten Sehr selten Nicht bekannt
(> 1/10)
(> 1/100 - < 1/10)
(> 1/1.000 - < 1/100)
(> 1/10.000 - < 1/1.000)
(< 1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Erkrankungen des Blutes und des Lymphsystems Sehr selten: Thrombozytopenie, Leukopenie
Erkrankungen des Nervensystems
Häufig: Parästhesien und Kältegefühl an den Extremitäten, Müdigkeit, de
pressive Verstimmungen, Schwindelgefühl, Verwirrtheit, Kopfschmerzen, Schwitzen, Albträume oder verstärkte Traumaktivität, Schlafstörungen und Halluzinationen insbesondere zu Beginn der Behandlung
Gelegentlich: Muskelschwäche oder Muskelkrämpfe
Sehr selten: Persönlichkeitsveränderungen (z. B. Gefühlsschwankungen, kurzdauernder Gedächtnisverlust)
Augenerkrankungen
Gelegentlich: Konjunktivitis, verminderter Tränenfluss (dies ist beim Tragen von Kontaktlinsen zu beachten)
Sehr selten: Sehstörungen
Erkrankungen des Ohrs und des Labyrinths Sehr selten: Hörstörungen, Ohrensausen
Herzerkrankungen, Gefäßerkrankungen
Gelegentlich: verstärkter Blutdruckabfall, Synkopen, Palpitationen, Bradykardie, atrioventrikuläre Überleitungsstörungen oder Verstärkung einer Herzinsuffizienz mit peripheren Ödemen und/oder Belastungsdyspnoe Sehr selten: Bei Patienten mit Angina pectoris ist eine Verstärkung der Anfälle nicht auszuschließen.
Auch eine Verstärkung der Beschwerden bei Patienten mit peripheren Durchblutungsstörungen (einschließlich Patienten mit Raynaud-Syndrom) wurde beobachtet.
Erkrankungen der Atemwege, des Brustraums und Mediastinums Infolge einer möglichen Erhöhung des Atemwegswiderstandes kann es bei Patienten mit Neigung zu bronchospastischen Reaktionen (insbesondere bei obstruktiven Atemwegserkrankungen) zu Atemnot kommen.
Des Weiteren wurden in Einzelfällen ein allergischer Schnupfen (Rhinitis allergica) berichtet.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Sehr selten: Bei Langzeittherapie Arthropathie (Mono- und Polyarthritis).
Erkrankungen des Gastrointestinaltraktes
Häufig: vorübergehende Magen-Darm-Beschwerden (Übelkeit, Erbrechen,
Leibschmerzen, Obstipation, Diarrhö)
Gelegentlich: Mundtrockenheit
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: allergische Hautreaktionen (Rötung, Juckreiz, Exantheme, Photo-
sensitivität)
In Einzelfällen: Haarausfall
Erkrankungen der Geschlechtsorgane und der Brustdrüse In Einzelfällen: Induratio penis plastica (Peyronie's disease)
Sehr selten wurden Libido- und Potenzstörungen beobachtet.
Leber- und Gallenerkrankungen
Sehr selten: Erhöhung der Transaminasen (GOT, GPT) im Serum oder Auftreten einer Hepatitis
Gelegentlich kann ein latenter Diabetes mellitus in Erscheinung treten oder ein manifester Diabetes mellitus sich verschlechtern. Nach längerem strengen Fasten oder schwerer körperlicher Belastung kann es bei gleichzeitiger Prelis® 100 mg-Therapie zu hypoglykämischen Zuständen kommen.
Warnzeichen einer Hypoglykämie (insbesondere Tachykardie und Tremor) können verschleiert werden.
Unter der Therapie mit Prelis kann es zu Störungen im Fettstoffwechsel kommen. Bei meist normalem Gesamtcholesterin wurde eine Verminderung des HDL-Cholesterins und eine Erhöhung der Triglyzeride im Blut beobachtet.
Allgemeine Erkrankungen Sehr selten: Gewichtszunahme.
®
Prelis 100 mg kann die Symptome einer Thyreotoxikose maskieren.
Besondere Hinweise
ß-Rezeptoren-B locker können in Einzelfällen eine Psoriasis vulgaris auslösen, die Symptome dieser Erkrankung verschlechtern oder zu psoriasiformen Exanthemen führen.
ß-Rezeptoren-B locker können die Empfindlichkeit gegenüber Allergenen und die Schwere anaphylaktischer Reaktionen erhöhen. Bei Patienten mit schweren Überempfindlichkeitsreaktionen in der Vorgeschichte und bei Patienten unter Desensibilisierungstherapie kann es daher zu überschießenden anaphylaktischen Reaktionen kommen.
Bei schweren Nierenfunktionsstörungen wurde in Einzelfällen über eine Verschlechterung der Nierenfunktion unter Therapie mit ß-Rezeptoren-Blockern berichtet. Eine Anwendung von Prelis® sollte in diesen Fällen unter entsprechender Überwachung der Nierenfunktion erfolgen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
a) Symptome einer Überdosierung
Das klinische Bild ist in Abhängigkeit vom Ausmaß der Intoxikation im Wesentlichen von kardiovaskulären und zentralnervösen Symptomen geprägt. Überdosierung kann zu schwerer Hypotonie, Bradykardie bis zum Herzstillstand, Herzinsuffizienz und kardiogenem Schock führen. Zusätzlich können Atembeschwerden, Bronchospasmen, Erbrechen, Bewusstseinsstörungen, gelegentlich auch generalisierte Krampfanfälle auftreten.
b) Therapiemaßnahmen bei Überdosierung
Bei Überdosierung oder bedrohlichem Abfall der Herzfrequenz und/oder des Blutdrucks muss die Behandlung mit Prelis® abgebrochen werden.
Neben allgemeinen Maßnahmen der primären Giftelimination müssen unter intensivmedizinischen Bedingungen die vitalen Parameter überwacht und gegebenenfalls korrigiert werden. Als Gegenmittel können gegeben werden:
Atropin: 0,5-2 mg intravenös als Bolus
Glukagon: Initial 1-10 mg intravenös anschließend 2-2,5 mg pro Std. als Dauer
infusion
Sympathomimetika in Abhängigkeit von Körpergewicht und Effekt:
Dopamin, Dobutamin, Isoprenalin, Orciprenalin oder Adrenalin.
Bei therapierefraktärer Bradykardie sollte eine temporäre Schrittmachertherapie durchgeführt werden.
Bei Bronchospasmus können ß2-Sympathomimetika als Aerosol (bei ungenügender Wirkung auch intravenös) oder Aminophyllin intravenös gegeben werden.
Bei generalisierten Krampfanfällen empfiehlt sich die langsame intravenöse Gabe von Diazepam.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: ß-Rezeptoren-Blocker ATC-Code: C07AB02
Metoprolol ist ein schwach lipophiler ß-Rezeptoren-Blocker mit relativer ß1-Selektivität ("Kardioselektivität"), ohne intrinsische sympathomimetische Aktivität (ISA) und nur schwach ausgeprägter membranstabilisierender Wirkung.
Die Substanz senkt in Abhängigkeit von der Höhe des Sympathikotonus die Frequenz und die Kontraktionskraft des Herzens, die AV-Überleitungs-geschwindigkeit und die Plasma-Renin-Aktivität. Metoprolol kann durch Hemmung von ß2-Rezeptoren eine Erhöhung des Tonus der glatten Muskulatur bewirken.
5.2 Pharmakokinetische Eigenschaften
Nach oraler Applikation wird Metoprolol nahezu vollständig (ca. 95 %) aus dem Gastrointestinaltrakt resorbiert. Da Metoprolol einem ausgeprägten First-passMetabolismus unterliegt, beträgt die systemische Verfügbarkeit nur ca. 50 %. Maximale Plasmaspiegel werden nach 1,5-2 Stunden erreicht.
Die Plasmaproteinbindung liegt bei ca. 12 %; das relative Verteilungsvolumen beträgt 5,6 l/kg.
Metoprolol wird fast vollständig in der Leber metabolisiert. Zwei der drei Hauptmetaboliten zeigen schwach ß-blockierende Eigenschaften, sind jedoch klinisch nicht relevant. Bei Leberzirrhose muss wegen der dann verminderten Metabolisierungsrate mit erhöhten Plasmaspiegeln an unverändertem Metoprolol gerechnet werden. Metoprolol und seine Metabolite werden zu ca. 95 % - davon ca. 10 % unverändert -renal eliminiert. Die Eliminationshalbwertszeit von Metoprolol beträgt 3-5 Stunden.
Bioverfügbarkeit:
Prelis® 50 mg
Mehrere in den Jahren 1977-1981 an 36 Probanden durchgeführte Bioverfügbarkeitsuntersuchungen mit Prelis® 50 mg Filmtabletten und an 16 Probanden mit 100 mg Metoprololtartrat-Lösung ergaben folgende Werte (Mittelwerte* und ± Standardabweichung):
Testpräparat 2 x Prelis® 50 mg Filmtabletten
Referenzpräparat 100 mg Metoprolol-tartrat-Lösung
|
Maximale Plasmakonzentration (Cmax): |
402± 181 |
390±169 |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax, median): |
1,89 ± 0,73 |
1,56 ± 0,31 |
|
Fläche unter der Konzentrati-ons-Zeit-Kurve (AUC): |
2486±1711 |
2452±1765 |
|
*Es handelt sich um Mittelwerte aus verschiedenen Prüfungen. | ||
|
Prelis® 100 mg Eine im Jahre 1979 an 6 Probanden durchgeführte Bioverfügbarkeitsuntersuchung nach Einmalgabe von Prelis® 100 mg Retardtabletten ergab im Vergleich zum nicht retardierten Referenzpräparat folgende Werte (Mittelwerte und Streubreite): | ||
|
Testpräparat Prelis® 100 mg Retardtabletten |
Referenzpräparat nicht retardiert | |
|
Maximale Plasmakonzentration (Cmax): |
87,8 (40-192) |
166,8 (79-436) |
|
Zeitpunkt der maximalen Plasma- 4 konzentration (tmax, median): |
1,5 | |
|
Fläche unter der Konzentrations Zeit-Kurve (AUC): |
- 1,018 (0,261-3,179) |
1,150 (0,413-3,404) |
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm:
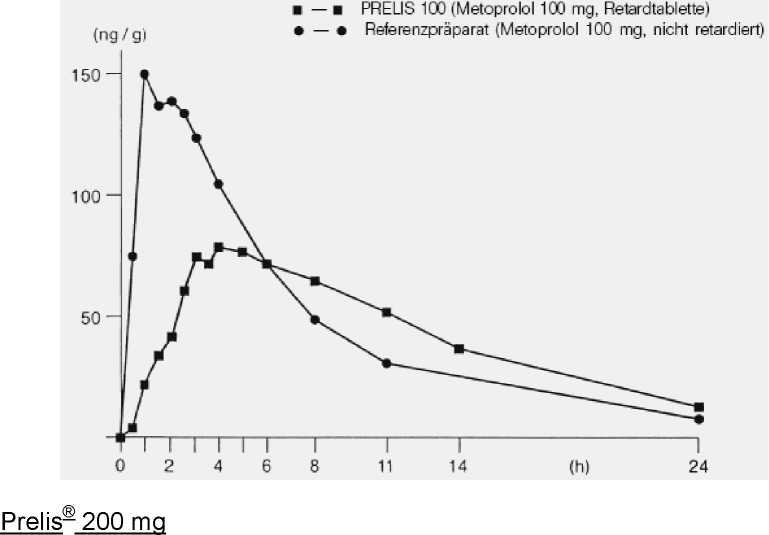
Eine im Jahre 1981 an 6 Probanden durchgeführte Bioverfügbarkeitsuntersuchung
®
nach Einmalgabe von Prelis 200 mg (teilbare Retardtablette) ergab im Vergleich zum Referenzpräparat Metoprolol 200 mg Retardtabletten (nicht teilbar) folgende Werte (Mittelwert und Streubreite):
|
Testpräparat Prelis® 200 mg Retardtabletten |
Referenzpräparat Metoprolol-Retardtabletten (nicht teilbar) |
Referenzpräparat (nicht retardiert) 2 x 100 mg | |
|
Maximale Plasmakonzentration |
189 (70-324) |
137 (99-214) |
351 (88-797) |
|
(Cmax): Zeitpunkt der maximalen Plasma-konzentration (tmax, median): |
3 |
5 |
1 |
|
Fläche unter der Kon-zentrations-Zeit-Kurve |
1463 |
1261 |
1944 |
|
(AUC): |
(742-2695) |
(631-1406) |
(441-4311) |
Das Referenzpräparat Metoprolol 200 mg Retardtabletten wurde in einer weiteren Studie gegen nicht retardierte Tabletten, 2 x 100 mg (s. 3. Spalte) geprüft.
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität
Siehe Abschnitt 4.9 „Überdosierung“.
Chronische Toxizität
Untersuchungen zur chronischen Toxizität an verschiedenen Tierspezies erbrachten keine Hinweise auf substanzbedingte toxische Effekte.
Tumorerzeugendes und mutagenes Potenzial
Es liegen Ergebnisse von Kanzerogenitätsstudien an Ratten und Mäusen vor, aus denen sich kein tumorerzeugendes Potenzial ableiten lässt.
Metoprolol wurde keiner ausführlichen Mutagenitätsprüfung unterzogen; bisherige Untersuchungen ergaben keine Hinweise auf ein mutagenes Potenzial.
Reproduktionstoxizität
Die präklinischen Daten aus den üblichen Studien zur Mutagenität und Kanzerogeni-tät deuten auf kein Gefährdungspotential für den Menschen hin. Untersuchungen an zwei Tierspezies (Ratte und Kaninchen) haben keine Hinweise auf teratogene Eigenschaften von Metoprolol ergeben.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Prelis® 50 mg mikrokristalline Cellulose Lactose-Monohydrat
Carboxymethylstärke-Natrium (Typ A) (Ph.Eur.) hochdisperses Siliciumdioxid
Povidon (K30)
Hypromellose
Magnesiumstearat (Ph.Eur.)[pflanzl.]
Talkum
Titandioxid (E171)
Polysorbat 80 Eisen-(III)-oxid (E172)
Prelis® 100 mg
Calciumhydrogenphosphat-Dihydrat
Poly(ethylacrylat-co-methylmethacrylat)
Hypromellose mikrokristalline Cellulose hochdisperses Siliciumdioxid hydriertes Rizinusöl Magnesiumstearat (Ph.Eur.)[pflanzl.]
Talkum
Titandioxid (E171)
Polysorbat 80 Eisen-(III)-oxid gelb (E172)
Prelis® 200 mg
Poly(ethylacrylat-co-methylmethacrylat)
Hypromellose Glyceroldistearat Typ I mikrokristalline Cellulose Calciumhydrogenphosphat-Dihydrat hochdisperses Siliciumdioxid Talkum
Magnesiumstearat (Ph.Eur.)[pflanzl.]
Titandioxid (E171)
Polysorbat 80 Eisen-(III)-oxid gelb (E172)
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Die Dauer der Haltbarkeit beträgt:
Prelis® 50 mg: 5 Jahre
Prelis® 100 mg: 3 Jahre
Prelis® 200 mg: 5 Jahre
Prelis soll nach Ablauf des Verfallsdatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Prelis® 50 mg
Vor Feuchtigkeit schützen!
Prelis® 100 mg Keine.
Prelis® 200 mg
Nicht über +25°C lagern!
6.5 Art und Inhalt des Behältnisses
Prelis® 50 mg Blisterpackungen mit 30 Filmtabletten (N1)
50 Filmtabletten (N2)
100 Filmtabletten (N3)
Klinikpackung mit 500 (10x50) Filmtabletten
Prelis® 100 mg Blisterpackungen mit
30 Retardtabletten (N1)
50 Retardtabletten (N2)
100 Retardtabletten (N3)
Klinkpackung mit 500 (10x50) Retardtabletten
Prelis® 200 mg Blisterpackungen mit 30 Retardtabletten (N1)
50 Retardtabletten (N2)
100 Retardtabletten (N3)
Klinikpackung mit 500 (10x50) Retardtabletten
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
mibe GmbH Arzneimittel Münchener Straße 15 06796 Brehna Telefon: 034954/247-0 Telefax: 034954/247-100
8. ZULASSUNGSNUMMERN
Prelis® 50 mg: 7400.00.01 Prelis® 100 mg: 7400.00.00 Prelis® 200 mg: 7400.01.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/ VERLÄNGERUNG DER ZULASSUNG
Prelis® 50 mg: 26.02.1990 / 23.10.2008 Prelis® 100 mg: 26.02.1990 / 23.10.2008 Prelis® 200 mg: 26.02.1990 / 23.10.2008
10. STAND DER INFORMATION
Mai 2015
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
15 / 15