Presomen 28 Compositum 0,6 Mg/5 Mg
1
Fachinformation
(Zusammenfassung der Merkmale des Arzneimittels)
1. BEZEICHNUNG DES ARZNEIMITTELS
Presomen® 28 compositum 0,3 mg/5 mg Presomen® 28 compositum 0,6 mg/5 mg Presomen® conti 0,6 mg/2 mg
Konjugierte Estrogene, Medrogeston
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Presomen 28 compositum 0,3 mg/5 mg:
1 schokoladenbraun überzogene Tablette enthält 0,3 mg konjugierte Estrogene aus dem Harn trächtiger Stuten.
1 apricot überzogene Tablette enthält 0,3 mg konjugierte Estrogene aus dem Harn trächtiger Stuten und 5 mg Medrogeston.
Presomen 28 compositum 0,6 mg/5 mg:
1 weiß überzogene Tablette enthält 0,6 mg konjugierte Estrogene aus dem Harn trächtiger Stuten. 1 dunkelrosa überzogene Tablette enthält 0,6 mg konjugierte Estrogene aus dem Harn trächtiger Stuten und 5 mg Medrogeston.
Presomen conti 0,6 mg/2 mg:
1 ocker überzogene Tablette enthält 0,6 mg konjugierte Estrogene aus dem Harn trächtiger Stuten und 2 mg Medrogeston.
Sonstige Bestandteile mit bekannter Wirkung: Lactose, Sucrose
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Presomen 28 compositum 0,3 mg/5 mg:
Überzogene Tabletten, rund, bikonvex.
14 schokoladenbraun überzogene Tabletten, 14 apricot überzogene Tabletten.
Presomen 28 compositum 0,6 mg/5 mg:
Überzogene Tabletten, rund, bikonvex.
14 weiß überzogene Tabletten, 14 dunkelrosa überzogene Tabletten.
Presomen conti 0,6 mg/2 mg: Überzogene Tabletten, rund, bikonvex. 28 ocker überzogene Tabletten.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Hormonsubstitutionstherapie (HRT) bei Estrogenmangelsymptomen nach der Menopause.
Presomen 28 compositum 0,3 mg/5 mg bzw. Presomen 28 compositum 0,6 mg/5 mg sollte nur bei postmenopausalen Frauen angewendet werden, soweit der Eintritt in die natürliche Menopause mindestens 6 Monate zurückliegt.
Presomen conti 0,6 mg/2 mg sollte nur bei postmenopausalen Frauen angewendet werden, soweit der Eintritt in die natürliche Menopause mindestens 12 Monate zurückliegt.
Prävention einer Osteoporose bei postmenopausalen Frauen mit hohem Frakturrisiko, die eine Unverträglichkeit oder Kontraindikation gegenüber anderen zur Osteoporoseprävention zugelassenen Arzneimitteln aufweisen (siehe Abschnitt 4.4).
4.2 Dosierung und Art der Anwendung
Für hysterektomierte Frauen wird empfohlen, kein Estrogen-Gestagen-Kombinationspräparat anzuwenden, außer wenn eine Endometriose in der Vorgeschichte bekannt ist.
Dosierung
Presomen 28 compositum 0,3 mg/5 mg:
Kontinuierlich-sequenzielles Einnahmeschema.
1 überzogene Tablette täglich. Vom 1. bis 14. Einnahmetag täglich eine schokoladenbraun überzogene Tablette. Vom 15. bis 28. Einnahmetag täglich eine apricot überzogene Tablette. Nach dem Aufbrauchen des Blisters wird die Einnahme am folgenden Tag, d.h. ohne Einnahmepause, mit einem neuen Blister fortgesetzt.
Presomen 28 compositum 0,6 mg/5 mg:
Kontinuierlich-sequenzielles Einnahmeschema.
1 überzogene Tablette täglich. Vom 1. bis 14. Einnahmetag täglich eine weiß überzogene Tablette. Vom 15. bis 28. Einnahmetag täglich eine dunkelrosa überzogene Tablette.
Nach dem Aufbrauchen des Blisters wird die Einnahme am folgenden Tag, d.h. ohne Einnahmepause, mit einem neuen Blister fortgesetzt.
Presomen conti 0,6 mg/2 mg:
Die Einnahme von Presomen conti 0,6 mg/2 mg erfolgt kontinuierlich kombiniert. Das bedeutet, in jeder überzogenen Tablette sind konjugierte Estrogene und Medrogeston enthalten. Die jeweiligen Wirkstoffmengen sind in allen überzogenen Tabletten gleich.
Tägliche Einnahme einer überzogenen Tablette ohne Einnahmepause.
Nach dem Aufbrauchen des Blisters wird die Einnahme am folgenden Tag, d.h. ohne Einnahmepause, mit einem neuen Blister fortgesetzt.
Frauen nach natürlicher Menopause können die Therapie mit Presomen conti 0,6 mg/2 mg 12 Monate nach ihrer letzten natürlichen Menstruation jederzeit beginnen.
Nach einer chirurgisch induzierten Menopause kann mit der Therapie sofort begonnen werden.
Art der Anwendung
Alle aufgeführten Presomen-Formen:
Patientinnen, die mit einer HRT beginnen oder Frauen, die vorher eine kontinuierlichkombinierte Therapie eingenommen haben, können jederzeit mit der Einnahme von Presomen starten. Patientinnen, die von anderen HRT-Präparaten auf Presomen wechseln, sollten entsprechend ihrem bisherigen Einnahmeschema - ggf. ohne tablettenfreies Intervall - nach dem Ende der Estrogen-Gestagen-Phase mit der Einnahme von Presomen beginnen.
Presomen kann unabhängig von den Mahlzeiten - unzerkaut mit ausreichend Flüssigkeit -eingenommen werden. Die Einnahme sollte möglichst immer zur gleichen Tageszeit erfolgen.
Für den Fall, dass eine Dosis vergessen wurde, sollte die überzogene Tablette so bald wie möglich eingenommen werden. Wenn jedoch mehr als 12 Stunden verstrichen sind, wird empfohlen, mit der nächsten im Blister folgenden Tablette fortzufahren, ohne die vergessene Tablette einzunehmen. Die Wahrscheinlichkeit einer Durchbruchblutung oder Schmierblutung kann erhöht sein.
Die Dauer der Anwendung bestimmt der behandelnde Arzt.
Ist eine Unterbrechung oder vorzeitige Beendigung der Therapie aus ärztlicher Sicht angezeigt, so müssen keine speziellen Maßnahmen beachtet werden. Die Wahrscheinlichkeit einer Abbruchblutung kann erhöht sein.
Behandlung von Wechseljahrsbeschwerden:
Sowohl für den Beginn als auch für die Fortführung einer Behandlung postmenopausaler Symptome ist die niedrigste wirksame Dosis für die kürzest mögliche Therapiedauer anzuwenden (siehe auch 4.4).
Osteoporoseprävention:
Siehe Abschnitt 5.1.
Kinder und Jugendliche:
Für Presomen gibt es keine relevante Indikation für die Anwendung bei Kindern und Jugendlichen.
4.3 Gegenanzeigen
• Bestehender oder früherer Brustkrebs bzw. ein entsprechender Verdacht
• Estrogenabhängiger maligner T umor bzw. ein entsprechender Verdacht (vor allem Endometriumkarzinom)
• Gestagenabhängige Neoplasie bzw. ein entsprechender Verdacht
• Nicht abgeklärte Blutung im Genitalbereich
• Unbehandelte Endometriumhyperplasie
• Frühere oder bestehende venöse thromboembolische Erkrankungen (z.B. tiefe Venenthrombose, Lungenembolie)
• Bekannte thrombophile Erkrankungen (z.B. Protein C-, Protein S- oder AntithrombinMangel, siehe Abschnitt 4.4)
• Bestehende oder erst kurze Zeit zurückliegende arterielle thromboembolische Erkrankungen (z.B. Angina pectoris, Myokardinfarkt)
• Akute Lebererkrankung oder zurückliegende Lebererkrankungen, solange sich die relevanten Leberenzymwerte nicht normalisiert haben
• Porphyrie
• Überempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Eine HRT sollte nur zur Behandlung solcher postmenopausaler Beschwerden begonnen werden, welche die Lebensqualität beeinträchtigen. Nutzen und Risiken sollten in jedem Einzelfall mindestens jährlich sorgfältig gegeneinander abgewogen werden. Eine HRT sollte nur so lange fortgeführt werden, wie der Nutzen die Risiken überwiegt.
Es liegen nur begrenzte Daten zur Bewertung der Risiken einer HRT bei vorzeitiger Menopause vor. Da jedoch das absolute Risiko bei jüngeren Frauen niedriger ist, könnte das Nutzen-RisikoVerhältnis bei jüngeren Frauen günstiger sein als bei älteren.
Medizinische Untersuchung/Kontrolluntersuchungen
Vor Beginn bzw. Wiederaufnahme einer Hormonsubstitutionstherapie ist eine vollständige Eigen- und Familienanamnese der Patientin zu erheben. Die körperliche Untersuchung (einschließlich Unterleib und Brust) sollte sich an diesen Anamnesen sowie den Kontraindikationen und Warnhinweisen orientieren. Während der Behandlung werden regelmäßige Kontrolluntersuchungen empfohlen, die sich in Häufigkeit und Art nach der individuellen Risikosituation der Frau richten. Die Frauen sollten darüber aufgeklärt werden, welche Veränderungen der Brüste sie dem Arzt mitteilen müssen (siehe „Brustkrebs“ weiter unten). Die Untersuchungen, einschließlich bildgebender Verfahren wie Mammographie, sind entsprechend der gegenwärtig üblichen Vorsorgepraxis und den klinischen Notwendigkeiten der einzelnen Frau durchzuführen.
Situationen, die eine Überwachung erfordern
Die Patientinnen sollten engmaschig überwacht werden, wenn eine der folgenden Situationen bzw. Erkrankungen vorliegt oder früher vorlag bzw. sich während einer Schwangerschaft oder einer zurückliegenden Hormonbehandlung verschlechtert hat. Dies gilt auch für den Fall, dass eine der nachfolgend genannten Situationen oder Erkrankungen im Laufe der aktuellen Hormonsubstitutionstherapie mit Presomen auftritt bzw. sich verschlechtert:
• Leiomyom (Uterusmyom) oder Endometriose
• Risikofaktoren für Thromboembolien (siehe unten)
• Risikofaktoren für estrogenabhängige Tumore, z.B. Auftreten von Mammakarzinom bei Verwandten 1. Grades
• Hypertonie
• Lebererkrankungen (z.B. Leberadenom)
• Diabetes mellitus mit oder ohne Beteiligung der Gefäße
• Cholelithiasis
• Migräne oder (schwere) Kopfschmerzen
• Systemischer Lupus erythematodes (SLE)
• Endometriumhyperplasie in der Vorgeschichte (siehe unten)
• Epilepsie
• Asthma
• Otosklerose.
Gründe für einen sofortigen Therapieabbruch
Die Therapie ist bei Vorliegen einer Kontraindikation sowie in den folgenden Situationen abzubrechen:
• Ikterus oder Verschlechterung der Leberfunktion
• Signifikante Erhöhung des Blutdrucks
• Einsetzen migräneartiger Kopfschmerzen
• Schwangerschaft.
Endometriumhyperplasie und -krebs
• Bei Frauen mit intaktem Uterus ist bei einer längerfristigen Estrogen-Monotherapie das Risiko für Endometriumhyperplasie und -karzinom erhöht. In Abhängigkeit von der Behandlungsdauer und der Estrogendosis erhöht sich das Endometriumkarzinomrisiko bei Anwenderinnen einer Estrogen-Monotherapie um den Faktor 2 bis 12 gegenüber NichtAnwenderinnen (siehe Abschnitt 4.8). Nach Beendigung der Therapie kann das Risiko für mindestens 10 Jahre erhöht bleiben.
• Die zusätzliche zyklische Gabe eines Gestagens für die Dauer von mindestens 12 Tagen pro Monat bzw. pro 28-Tage-Zyklus oder die kontinuierliche kombinierte Estrogen-Gestagen-Behandlung von Frauen mit intaktem Uterus kompensiert das zusätzliche Risiko, das von der Estrogen-Monotherapie ausgeht.
• Durchbruch- und Schmierblutungen können während der ersten Monate der Behandlung auftreten. Wenn solche Blutungen einige Zeit später im Verlauf der Therapie auftreten oder nach Therapieende anhalten, muss die Ursache ermittelt und u.U. eine Biopsie des Endometriums durchgeführt werden, um eine maligne Erkrankung des Endometriums auszuschließen.
Brustkrebs
Die vorliegenden Erkenntnisse weisen auf ein insgesamt erhöhtes, von der Anwendungsdauer abhängiges Brustkrebsrisiko für Frauen hin, die Estrogen-Gestagen-Kombinationen anwenden. Möglicherweise gilt dies auch für eine HRT mit Estrogen-Monopräparaten.
Kombinierte Estrogen-Gestagen-Therapie:
• In einer randomisierten placebokontrollierten Studie, der Women’s Health Initiative study (WHI-Studie), und in epidemiologischen Studien ergab sich übereinstimmend ein erhöhtes Brustkrebsrisiko bei Frauen, die im Rahmen einer HRT Estrogen-Gestagen-Kombinationen angewendet haben. Das erhöhte Risiko zeigte sich nach etwa drei Jahren (siehe Abschnitt 4.8).
Estrogen-Monotherapie:
• Die WHI-Studie zeigte kein erhöhtes Brustkrebsrisiko bei hysterektomierten Frauen unter einer Estrogen-Monotherapie. Beobachtungsstudien haben unter einer Estrogen-Monotherapie meist ein geringfügig erhöhtes Risiko für eine Brustkrebsdiagnose gezeigt, das jedoch wesentlich niedriger war als das Risiko bei Anwenderinnen von Estrogen-Gestagen-Kombinationen (siehe Abschnitt 4.8).
Das erhöhte Risiko zeigt sich nach einigen Anwendungsjahren, kehrt jedoch einige (spätestens fünf) Jahre nach Behandlungsende wieder auf das altersentsprechende Grundrisiko zurück.
Eine HRT, insbesondere eine kombinierte Behandlung mit Estrogenen und Gestagenen, führt zu einer erhöhten Brustdichte in der Mammographie, was sich nachteilig auf die radiologische Brustkrebsdiagnostik auswirken kann.
Ovarialkarzinomrisiko
Das Ovarialkarzinom ist viel seltener als Brustkrebs. Epidemiologische Erkenntnisse einer großen Meta-Analyse lassen auf ein leicht erhöhtes Risiko bei Frauen schließen, die im Rahmen einer HRT Estrogen-Monoarzneimittel oder kombinierte Estrogen-Gestagen-Arzneimittel anwenden, das sich innerhalb von 5 Anwendungsjahren zeigt und nach Beendigung der Behandlung im Laufe der Zeit abnimmt.
Einige weitere Studien, einschließlich der WHI-Studie, deuten darauf hin, dass das entsprechende Risiko unter der Anwendung einer kombinierten HRT vergleichbar oder geringfügig niedriger ist (siehe Abschnitt 4.8).
Venöse Thromboembolie
• Eine HRT ist mit einem 1,3 - 3-fach erhöhten Risiko für venöse Thromboembolien (VTE) verbunden, v. a. für tiefe Venenthrombosen oder Lungenembolien. Im ersten Jahr einer HRT ist das Auftreten einer VTE wahrscheinlicher als später (siehe Abschnitt 4.8).
• Patientinnen mit bekannter Thrombophilie haben ein erhöhtes VTE-Risiko. Eine HRT kann dieses Risiko erhöhen und ist daher bei diesen Patientinnen kontraindiziert (siehe Abschnitt 4.3).
• Zu den allgemein anerkannten VTE-Risikofaktoren gehören die Anwendung von Estrogenen, ein höheres Alter, größere Operationen, längere Immobilisierung, erhebliches Übergewicht (BMI > 30 kg/m2), Schwangerschaft/Wochenbett, systemischer Lupus erythematodes (SLE) und Krebs. Es besteht kein Konsens über die mögliche Rolle von Varizen bei VTE.
Wie bei allen postoperativen Patienten müssen die prophylaktischen Maßnahmen zur Verhinderung einer VTE nach einer Operation berücksichtigt werden. Bei längerer
Immobilisierung nach einer elektiven Operation wird empfohlen, die HRT 4 bis 6 Wochen vor dem Eingriff auszusetzen. Die Behandlung sollte erst dann wieder aufgenommen werden, wenn die Frau wieder vollständig mobilisiert ist.
• Bei Frauen ohne VTE in der Vorgeschichte aber mit Verwandten ersten Grades, die bereits in jungen Jahren an VTE erkrankten, kann ein Thrombophilie-Screening in Erwägung gezogen werden. Vorher sollte die Patientin eingehend über die begrenzte Aussagekraft dieses Verfahrens beraten werden (es wird nur ein Teil der Defekte identifiziert, die zu einer Thrombophilie führen). Wird ein thrombophiler Defekt festgestellt und sind außerdem Thrombosen bei Verwandten bekannt oder ist der festgestellte Defekt schwerwiegend (z.B. Antithrombin-, Protein-S- und/oder Protein-C-Mangel oder eine Kombination von Defekten), so ist eine HRT kontraindiziert.
• Bei Patientinnen unter einer dauerhaften Behandlung mit Antikoagulantien sollte vor der Anwendung einer HRT das Risiko-Nutzen-Verhältnis sorgfältig abgewogen werden.
• Sollte sich eine VTE nach Beginn der HRT entwickeln, muss das Arzneimittel abgesetzt werden. Die Patientinnen sollten darauf hingewiesen werden, dass sie sofort Kontakt mit einem Arzt aufnehmen müssen, wenn sie mögliche Symptome einer Thromboembolie bemerken (insbesondere schmerzhafte Schwellung eines Beins, plötzlicher Schmerz im Brustkorb, Atemnot).
Koronare Herzkrankheit
Es gibt keine Hinweise aus randomisierten kontrollierten Studien, dass eine kombinierte HRT mit Estrogen und Gestagen oder eine Estrogen-Monotherapie Frauen vor einem Myokardinfarkt schützt, unabhängig davon, ob bei ihnen eine koronare Herzkrankheit vorliegt oder nicht.
Kombinierte Estrogen-Gestagen-Therapie:
• Das relative Risiko einer koronaren Herzkrankheit ist unter einer kombinierten HRT mit Estrogen und Gestagen geringfügig erhöht. Da das Ausgangsrisiko für eine koronare Herzkrankheit in hohem Maß altersabhängig ist, ist die Zahl der zusätzlich auftretenden Fälle, die auf die HRT aus Estrogen und Gestagen zurückgehen, bei prämenopausalen Frauen sehr gering. Die Zahl steigt jedoch mit zunehmendem Alter.
Estrogen-Monotherapie:
• In randomisierten kontrollierten Studien wurden keine Hinweise für ein erhöhtes Risiko einer koronaren Herzkrankheit bei hysterektomierten Frauen unter einer Estrogen-Monotherapie gefunden.
Ischämischer Schlaganfall
Die kombinierte Behandlung mit Estrogen und Gestagen und die Estrogen-Monotherapie sind mit einem bis zu 1,5-fach erhöhten Schlaganfallrisiko verbunden. Das relative Risiko ist unabhängig vom Alter und der Zeitspanne, die seit der Menopause vergangen ist. Da allerdings das Grundrisiko, einen Schlaganfall zu erleiden, in hohem Maß altersabhängig ist, nimmt das Gesamtrisiko eines Schlaganfalls für Frauen unter einer HRT mit zunehmendem Alter zu (siehe Abschnitt 4.8).
Sonstige Erkrankungszustände
• Estrogene können eine Flüssigkeitsretention bewirken; daher müssen Patientinnen mit kardialen oder renalen Funktionsstörungen sorgfältig beobachtet werden.
• Frauen mit vorbestehender Hypertriglyceridämie müssen während einer Estrogen- oder Hormonsubstitutionstherapie engmaschig überwacht werden, weil im Zusammenhang mit einer Estrogentherapie unter derartigen Umständen von seltenen Fällen eines starken Triglyceridanstiegs im Plasma mit der Folge einer Pankreatitis berichtet wurde.
• Estrogene erhöhen die Konzentration des thyroxinbindenden Globulins (TBG), wodurch es zu einem Anstieg des gesamten zirkulierenden Schilddrüsenhormons kommt, was anhand des proteingebundenen Jods (PBI), des T4-Spiegels (Säulen- oder Radioimmunassay) oder T3-Spiegels (Radioimmunassay) gemessen wird. Die T3-Harzaufnahme ist herabgesetzt, was einen TBG-Anstieg widerspiegelt. Die freien T4- und T3-Konzentrationen verändern sich nicht. Andere Bindungsproteine können im Serum erhöht sein, wie das kortikoidbindende Globulin (CBG) und das geschlechtshormonbindende Globulin (sex hormone binding globulin/SHBG), was zu einem Ansteigen der zirkulierenden Kortikosteroide bzw. Sexualhormone führt. Freie oder biologisch aktive Hormonkonzentrationen bleiben unverändert. Andere Plasmaproteine können erhöht sein (Angiotensinogen/Reninsubstrat, Alpha-1-Antitrypsin, Coeruloplasmin).
• Unter einer HRT verbessern sich die kognitiven Fähigkeiten nicht. Es gibt Hinweise auf ein erhöhtes Risiko für eine wahrscheinliche Demenz bei Frauen, die bei Beginn einer kontinuierlich kombinierten HRT oder einer Estrogen-Monotherapie älter als 65 Jahre waren.
• Patientinnen mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption, der seltenen hereditären Fructose-Intoleranz oder Saccharase-Isomaltase-Mangel sollten Presomen nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
• Der Metabolismus der Estrogene und Gestagene kann durch die gleichzeitige Anwendung von Substanzen verstärkt werden, die Arzneimittel-metabolisierende Enzyme, vor allem die Cytochrom P450-Enzyme, induzieren; zu diesen Substanzen gehören u. a. Antikonvulsiva (z.B. Phenobarbital, Phenytoin, Carbamazepin) und Antiinfektiva (z.B. Rifampizin, Rifabutin, Nevirapin, Efavirenz).
• Ritonavir und Nelfinavir haben, wenn sie zeitgleich mit Steroidhormonen angewandt werden, enzymstimulierende Eigenschaften, obwohl sie eigentlich als starke Enzymhemmer bekannt sind.
• Pflanzliche Arzneimittel, die Johanniskraut (Hypericum perforatum) enthalten, können den Metabolismus der Estrogene und Gestagene induzieren.
• Klinisch kann ein erhöhter Estrogen- und Gestagenmetabolismus zu einer verminderten Wirkung dieser Hormone und zu Veränderungen des uterinen Blutungsmusters führen.
• Estrogene können den Metabolismus von anderen Substanzen beeinflussen:
Estrogene inhibieren per se die Arzneistoff-metabolisierenden Enzyme CYP450 durch kompetitive Hemmung.
• Dies sollte insbesondere bei Arzneistoffen mit einem geringen therapeutischen Fenster wie z.B. Tacrolimus und Cyclosporin A (CYP450 3A4, 3A3), Fentanyl (CYP450 3A4),
Theophyllin (CYP450 1A2) bedacht werden.
• Klinisch bedeutet dies einen Anstieg dieser betroffenen Substanzen bis zu toxischen Plasmakonzentrationen. Daher ist eine sorgfältige Überwachung über einen längeren Zeitraum notwendig und eine Dosisreduzierung von Tacrolimus, Fentanyl, Cyclosporin A und Theophyllin zu erwägen.
• Veränderungen der Estrogen-Serum-Konzentration können die Ergebnisse bestimmter endokriner und Leberfunktionstests beeinflussen (siehe 4.4).
• Es sind keine Studien zu Wechselwirkungen mit Medrogeston durchgeführt worden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Presomen wirkt nicht kontrazeptiv.
Presomen ist in der Schwangerschaft nicht indiziert. Wenn es während der Behandlung mit
Presomen zur Schwangerschaft kommt, sollte die Behandlung sofort abgebrochen werden.
Für Medrogeston liegen keine klinischen Daten über eine Exposition während der
Schwangerschaft vor. Tierstudien zeigten keine Reproduktionstoxizität.
Die meisten zurzeit vorliegenden epidemiologischen Studien, die hinsichtlich einer
unbeabsichtigten Exposition des Fetus mit Kombinationen von Estrogenen und anderen
Gestagenen relevant sind, zeigen keine teratogenen oder fetotoxischen Wirkungen.
Stillzeit:
Presomen ist in der Stillzeit nicht indiziert.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Presomen hat keinen oder vernachlässigbaren Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig Häufig Gelegentlich Selten Sehr selten Nicht bekannt
(> 1/10)
(> 1/100 bis < 1/10)
(> 1/1.000 bis < 1/100)
(> 1/10.000 bis < 1/1.000)
(< 1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Patientinnen, die im Rahmen klinischer Studien ein Jahr lang mit konjugierten equinen Estrogen/Medrogeston-Präparaten behandelt wurden, wiesen folgende Nebenwirkungen auf:
Siehe Tabelle:
|
Systemorganklassen nach MedDRA |
Sehr häufig > 1/10 |
Häufig > 1/100 < 1/10 |
Gelegentlich > 1/1.000 < 1/100 |
|
Infektionen und parasitäre Erkrankungen |
Vaginale Infektionen |
Otitis externa | |
|
Gutartige, bösartige und unspezifische Neubildungen (einschließlich Zysten und Polypen) |
Vergrößerung von Leiomyomen |
Brustkrebs | |
|
Psychiatrische Erkrankungen |
Depression, emotionale Labilität |
Schlaflosigkeit, verringerte Libido | |
|
Erkrankungen des Nervensystems |
Kopfschmerzen, Schwindel |
Migräne, Synkope | |
|
Herzerkrankungen |
Tachykardie | ||
|
Gefäßerkrankungen |
Hypertension, Phlebitis |
Lungenembolie | |
|
Erkrankungen des Gastrointestinaltrakts |
Nausea, abdominale Schmerzen, Dyspepsie, Blähungen |
Diarrhoe, Ösophagitis, anorektale Beschwerden (schmerzhafter Stuhldrang) | |
|
Leber- und Gallenerkrankungen |
Cholelithiasis, Gallenkolik, Hyperbilirubin- aemie | ||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Haarausfall |
Hautjucken |
|
Systemorganklassen nach MedDRA |
Sehr häufig > 1/10 |
Häufig > 1/100 < 1/10 |
Gelegentlich > 1/1.000 < 1/100 |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Beinkrämpfe, Rückenschmerzen |
Arthralgie | |
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Brustspannen, Schmerzen der Brüste, Zwischenblutungen |
Metrorrhagie, Veränderungen des Endometriums, Ausfluss aus der Scheide |
Endometriumhyperplasie, Dysmenorrhoe, Menstruationsstörungen, vulvovaginale Erkrankungen, Unterleibschmerzen, Vergrößerung der Brüste |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Schmerzen |
peripheres Ödem, Asthenie | |
|
Untersuchungen |
YGTP-Erhöhung, Gewichtszunahme |
Erhöhung der alk. Phosphatase im Blut, SGOT- und SGPT-Erhöhung, Gewichtsabnahme |
Über folgende unerwünschte Wirkungen wurde im Zusammenhang mit Estrogen-Gestagen-Therapien berichtet
Die Häufigkeiten unerwünschter Arzneimittelwirkungen sind unbekannt, wenn diese nicht ausdrücklich aufgeführt werden.
Infektionen und parasitäre Erkrankungen:
Vaginale Candidiasis
Gutartige, bösartige und unspezifische Neubildungen (einschließlich Zysten und Polypen): Brustkrebs (siehe unten), estrogenabhängige gutartige Neubildungen sowie bösartige Tumore wie z.B. Endometriumkarzinom (siehe unten), Ovarialkarzinom, Vergrößerung von gestagenabhängigen Neubildungen wie z.B. Meningiomen, Vergrößerung von Uterusmyomen
Erkrankungen des Immunsystems:
Überempfindlichkeitsreaktionen, systemischer Lupus erythematodes
Stoffwechsel- und Ernährungsstörungen:
Veränderungen im Kohlenhydratmetabolismus
Psychiatrische Erkrankungen:
Depression, Veränderungen der Libido
Erkrankungen des Nervensystems:
Wahrscheinliche Demenz (siehe 4.4), Verschlimmerung einer Epilepsie, Chorea, Migräne, Schwindel, Kopfschmerz
Augenerkrankungen:
Kontaktlinsenunverträglichkeit, Steilstellung der kornealen Kurvatur
Herzerkrankungen:
Herzinfarkt
Gefäßerkrankungen:
Venöse thromboembolische Ereignisse, d.h. Thrombosen der tiefen Bein- bzw. Beckenvenen sowie Lungenembolien (VTE). Diese treten bei Anwenderinnen einer HRT häufiger auf als bei Nicht-Anwenderinnen. Für weitere Informationen siehe 4.3 und 4.4.
Arterielle Thromboembolien (z.B. Schlaganfall, intestinale Ischämie). Für weitere Informationen siehe 4.3 und 4.4.
Erkrankungen des Gastrointestinaltrakts:
Übelkeit, Erbrechen, abdominale Krämpfe, Blähungen
Leber- und Gallenerkrankungen:
Veränderungen der Leberfunktion, manchmal verbunden mit Gelbsucht, abdominalen Schmerzen, Asthenie oder Unwohlsein, Gallenblasenerkrankungen
Erkrankungen der Haut und des Unterhautzellgewebes:
Angioödem, Erythema multiforme, Erythema nodosum, vaskuläre Purpura, Chloasma oder Melasma, die nach Ende der Arzneimitteleinnahme fortbestehen können, allergische Hautreaktionen (z.B. Hautausschlag, Juckreiz, Nesselsucht)
Erkrankungen der Nieren und Harnwege:
Zystitisähnliche Beschwerden, Harninkontinenz
Erkrankungen der Geschlechtsorgane und der Brustdrüse:
Endometriumhyperplasie, Durchbruchblutungen, Dysmenorrhoe, Entzugsblutungen, dem prämenstruellen Syndrom vergleichbare Beschwerden, Veränderung der Portioerosion sowie des Grades der zervikalen Sekretion, vaginaler Fluor, Empfindlichkeit der Brüste, Vergrößerung der Brüste, fibrozystische Brustveränderungen
Kongenitale, familiäre und genetische Erkrankungen:
Verschlechterung einer Porphyrie
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Ödem
Untersuchungen:
Gewichtszunahme oder Gewichtsabnahme
Weitere Erläuterungen zu einigen der oben genannten Nebenwirkungen:
Brustkrebs
• Bei Frauen, die eine kombinierte Estrogen-Gestagen-Therapie über mehr als 5 Jahre durchgeführt hatten, war das Risiko für eine Brustkrebsdiagnose bis zu 2-fach erhöht.
• Bei Anwenderinnen einer Estrogen-Monotherapie ist das erhöhte Risiko deutlich geringer als bei Anwenderinnen von Estrogen-Gestagen-Kombinationspräparaten.
• Die Höhe des Risikos ist abhängig von der Anwendungsdauer (siehe Abschnitt 4.4).
• Die Ergebnisse der größten randomisierten, placebokontrollierten Studie (WHI-Studie) und der größten epidemiologischen Studie (MWS) sind nachfolgend dargestellt:
Million Women Study (MWS) - Geschätztes zusätzliches Brustkrebsrisiko nach 5-jähriger HRT
|
Altersgruppe (Jahre) |
Zusätzliche Fälle bei 1.000 HRT-Nicht-Anwenderinnen über einen Zeitraum von 5 Jahrena |
Relatives Risiko (95 % KI)# |
Zusätzliche Fälle bei 1.000 HRT-Anwenderinnen über einen Zeitraum von 5 Jahren (95 % KI) |
|
Estrogen-Monotherapie | |||
|
50 - 65 |
9 - 12 |
1,2 |
1 - 2 (0 - 3) |
|
Estrogen-Gestagen-Kombinationstherapie | |||
|
50 - 65 |
9 - 12 |
1,7 |
6 (5 - 7) |
|
# Relatives Risiko insgesamt. Das relative Risiko ist nicht konstant, sondern steigt mit zunehmender Anwendungsdauer. Hinweis: Da die Grundinzidenzen für Brustkrebs in den EU-Ländern unterschiedlich sind, variiert auch entsprechend die Anzahl der zusätzlichen Brustkrebsfälle. | |||
a Ermittelt aus Angaben für die Grundinzidenz in Industrienationen
* Bei Beschränkung der Auswertung auf Frauen, die vor der Studie keine HRT angewendet hatten, erschien das Risiko während der ersten 5 Behandlungsjahre nicht erhöht; nach 5 Jahren war das Risiko höher als bei unbehandelten Frauen.
WHI-Studien in den USA - zusätzliches Brustkrebsrisiko nach 5-jähriger HRT
|
Altersgruppe (Jahre) |
Inzidenz bei 1.000 Frauen im PlaceboArm über einen Zeitraum von 5 Jahren |
Relatives Risiko (95 % KI) |
Zusätzliche Fälle bei 1.000 HRT-Anwenderinnen über einen Zeitraum von 5 Jahren (95 % KI) |
|
Estrogen-Monotherapie (CEE) | |||
|
50 - 79 |
21 |
0,8 (0,7 - 1,0) |
-4 (-6 - 0)b |
|
Estrogen & Gestagen (CEE + MPA) * | |||
|
50 - 79 |
17 |
1,2 (1,0 - 1,5) |
+4 (0 - 9) |
b WHI-Monostudie bei Frauen ohne Uterus, die kein erhöhtes Brustkrebsrisiko zeigte.
Endometriumkarzinom
Postmenopausale Frauen mit intaktem Uterus:
Ungefähr 5 von 1.000 Frauen mit intaktem Uterus, die keine HRT anwenden, entwickeln ein Endometriumkarzinom.
Bei Frauen mit intaktem Uterus wird die Anwendung einer Estrogen-Monotherapie nicht empfohlen, da diese das Risiko eines Endometriumkarzinoms erhöht (siehe Abschnitt 4.4).
In Abhängigkeit von der Dauer der Estrogen-Monotherapie und der Estrogendosis lag das Risiko eines Endometriumkarzinoms in epidemiologischen Studien bei 5 bis 55 zusätzlich diagnostizierten Fällen pro 1.000 Frauen im Alter zwischen 50 und 65 Jahren.
Durch Zugabe eines Gestagens zu der Estrogen-Monotherapie für mindestens 12 Tage pro Zyklus kann dieses erhöhte Risiko vermieden werden. In der Million Women Study war nach 5jähriger Anwendung einer kombinierten HRT (sequenziell oder kontinuierlich) das Risiko eines Endometriumkarzinoms nicht erhöht (RR 1,0 (95 % KI 0,8 - 1,2)).
Ovarialkarzinomrisiko
Die Anwendung von Estrogen-Monoarzneimitteln oder kombinierten Estrogen-Gestagen-Arzneimitteln zur HRT ist mit einem geringfügig erhöhten Risiko verbunden, dass ein Ovarialkarzinom diagnostiziert wird (siehe Abschnitt 4.4).
Aus einer Meta-Analyse von 52 epidemiologischen Studien geht ein erhöhtes Ovarialkarzinomrisiko für Frauen hervor, die zurzeit HRT anwenden, im Vergleich zu Frauen, die HRT nie angewendet haben (RR 1.43, 95 % CI 1.31-1.56). Bei Frauen im Alter zwischen 50 und 54 Jahren, die eine HRT 5 Jahre lang anwenden, tritt ein zusätzlicher Fall pro 2000 Anwenderinnen auf. Bei Frauen im Alter zwischen 50 und 54 Jahren, die keine HRT anwenden, werden über einen 5-Jahres-Zeitraum etwa 2 Fälle von Ovarialkarzinom pro 2000 Frauen diagnostiziert.
Venöse Thromboembolien
Das Risiko für das Auftreten einer venösen Thromboembolie (VTE), z.B. einer Thrombose der tiefen Bein- bzw. Beckenvenen oder einer Lungenembolie, ist bei einer HRT um das 1,3 - 3fache erhöht. Das Auftreten eines solchen Ereignisses ist während des ersten Behandlungsjahres wahrscheinlicher als in den Folgejahren der Behandlung (siehe Abschnitt 4.4). Die diesbezüglichen Ergebnisse der WHI-Studien sind im folgenden Abschnitt dargestellt:
WHI-Studien - zusätzliches Risiko für VTE nach 5-jähriger HRT
|
Altersgruppe (Jahre) |
Inzidenz pro 1.000 Frauen im Placebo-Arm über einen Zeitraum von 5 Jahren |
Relatives Risiko (95 % KI) |
Zusätzliche Fälle pro 1.000 HRT- Anwenderinnen nach 5 Jahren |
|
Orale Estrogen-Monotherapiec | |||
|
50 - 59 |
7 |
1,2 (0,6 - 2,4) |
1 (-3 - 10) |
|
Kombinierte orale Estrogen-Gestagen-Therapie | |||
|
50 - 59 |
4 |
2,3 (1,2 - 4,3) |
5 (1 - 13) |
c Studie bei Frauen ohne Uterus
Koronare Herzkrankheit
Bei Anwenderinnen einer kombinierten Estrogen-Gestagen-HRT im Alter von über 60 Jahren ist
das Risiko für die Entwicklung einer koronaren Herzkrankheit leicht erhöht (siehe Abschnitt 4.4).
Schlaganfall
• Die Anwendung einer Estrogen-Monotherapie oder einer kombinierten Estrogen-Gestagen-Therapie ist verbunden mit einem bis zu 1,5-fach erhöhten Risiko für einen ischämischen Schlaganfall. Das Risiko für einen hämorrhagischen Schlaganfall ist unter einer HRT nicht erhöht.
• Dieses relative Risiko ist unabhängig vom Alter oder von der Anwendungsdauer. Da das Ausgangsrisiko jedoch stark vom Alter abhängt, erhöht sich das Gesamtrisiko bei Frauen unter einer HRT mit zunehmendem Alter (siehe Abschnitt 4.4).
Zusammengefasste Zahlen aus beiden WHI-Studienarmen - zusätzliches Risiko für Schlaganfalld nach 5-jähriger HRT
|
Altersgruppe (Jahre) |
Inzidenz pro 1.000 Frauen im Placeboarm über 5 Jahre |
Relatives Risiko (95 % KI) |
Zusätzliche Fälle pro 1.000 HRT-Anwenderinnen über 5 Jahre |
|
50 - 59 |
8 |
1,3 (1,1 - 1,6) |
3 (1 - 5) |
|
d Es wurde nicht zwischen ischämischem und hämorrhagischem Sch |
aganfall unterschieden. | ||
In Zusammenhang mit einer Estrogen-/Gestagen-Behandlung wurden weitere unerwünschte Arzneimittelwirkungen berichtet
• Erkrankung der Gallenblase
• Haut- und Unterhauterkrankungen: Chloasma, Erythema multiforme, Erythema nodosum, vaskuläre Purpura
• wahrscheinliche Demenz bei Frauen im Alter von über 65 Jahren (siehe Abschnitt 4.4) Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger Allee 3
D-53175 Bonn
Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Bei einer Überdosierung können Symptome, wie z.B. Übelkeit, Erbrechen, Schläfrigkeit, Schwindelgefühl, Spannungsgefühl in den Brüsten und vaginale Blutungen auftreten. Eine evtl. notwendige Behandlung sollte sich an den Symptomen orientieren. Die vorstehende Information gilt auch für die Überdosierung bei Kindern.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Presomen 28 compositum 0,3 mg/5 mg und Presomen 28 compositum 0,6 mg/5 mg
Pharmakotherapeutische Gruppe: Kombination von konjugierten Estrogenen mit einem Gestagen (Medrogeston) zur kontinuierlich-sequenziellen Dosierung.
ATC-Code: G03F B 07
Presomen conti 0,6 mg/2 mg
Pharmakotherapeutische Gruppe: Kombination von konjugierten Estrogenen mit einem Gestagen (Medrogeston) in kontinuierlich-kombinierter Dosierung.
ATC-Code: G03F A
Konjugierte equine Estrogene
Die aktiven Wirkstoffe bestehen in erster Linie aus Hydrogensulfat-Estern von Estron, Equilinsulphaten und 17a/ß-Estradiol. Diese substituieren den Mangel der Estrogenproduktion bei menopausalen Frauen und mindern die damit verbundenen Beschwerden. Estrogene beugen dem Verlust an Knochenmasse nach der Menopause oder nach Ovarektomie vor.
Medrogeston
Da Estrogene das Endometriumwachstum fördern, erhöht die ungehinderte Estrogengabe das Risiko von Endometriumhyperplasie und -karzinom. Die Zugabe eines Gestagens reduziert das estrogenbedingte Risiko einer Endometriumhyperplasie bei Frauen ohne Hysterektomie deutlich.
Angaben zu klinischen Studien
• Linderung der durch den Estrogenmangel verursachten Symptome und Beeinflussung der Blutungen.
Eine Linderung der Wechseljahresbeschwerden wurde in den ersten Wochen der Behandlung erreicht.
In einer klinischen Prüfung mit postmenopausalen Frauen nach einem kontinuierlichsequenziellen Therapieschema mit Presomen 28 compositum 0,6 mg/5 mg traten bei 5,8% der Frauen regelmäßige Entzugsblutungen mit einer durchschnittlichen Dauer von 5 Tagen auf. Die Entzugsblutung begann meistens einen Tag vor der letzten Tablette der Gestagenphase. Durchbruchs- oder Schmierblutungen gab es bei 76% der Frauen in den ersten 3 Monaten der Therapie und bei 25,9% im 10. bis 12. Monat der Behandlung. Amenorrhoe (keine Blutung oder Schmierblutung) trat bei 50,5% der Zyklen im ersten Behandlungsjahr auf.
Fast 90% der Frauen berichteten, dass sie vom 10. bis 12. Behandlungsmonat mit Presomen conti 0,6 mg/2 mg blutungsfrei waren. Abbruchblutungen und/oder Schmierblutungen wurden von jeder zweiten Frau während der ersten drei Monate der Behandlung und von 10% der Frauen in der Zeitspanne vom 10. bis 12. Behandlungsmonat berichtet.
• Osteoporose-Prävention
Estrogenmangel in der Menopause geht mit einem erhöhten Knochenumsatz und einem Verlust an Knochenmasse einher. Die Wirkung von Estrogenen auf die Knochendichte ist dosisabhängig. Der Schutz ist offenbar so lange wirksam, wie die Behandlung fortgesetzt wird. Nach Beendigung der HRT ist der Verlust an Knochenmasse dem unbehandelter Frauen vergleichbar.
Aus der WHI-Studie und Metaanalysen weiterer Studien geht hervor, dass die aktuelle Anwendung einer HRT, allein oder in Kombination mit einem Gestagen, bei überwiegend gesunden Frauen das Risiko von Hüft-, Wirbelkörper- oder sonstigen osteoporotischen Frakturen reduziert. Eine HRT könnte auch Frakturen bei Frauen mit geringer Knochendichte und/oder nachgewiesener Osteoporose vorbeugen, hierfür liegen jedoch nur begrenzte Erkenntnisse vor.
5.2 Pharmakokinetische Eigenschaften
Konjugierte Estrogene
Estrogensulfate sind wasserlöslich und werden nach oraler Gabe gut resorbiert. Estrogensulfate zirkulieren als Konjugate. Estron, Equilin (konjugierte und freie Form) und 17ß-Estradiol werden extensiv an Plasmaproteine gebunden. Die Resorption und der Metabolismus der Estrogene kann durch verschiedene Faktoren beeinflusst werden, wie z.B. Diät, Rauchen und Körpergewicht. Die maximalen Plasmakonzentrationen werden nach 2 - 9 Stunden erreicht. Konjugiertes Estron und Equilin können bis zu 48 Stunden nach Einnahme im Plasma nachgewiesen werden und erreichen nach Absetzen ihre Ausgangswerte innerhalb einer Woche. Konjugierte Estrogene werden enzymatisch zu 17ß-Estrogenen reduziert und können rekonjugiert werden. Estrogene werden überwiegend renal als Konjugate, insbesondere Glucuronide, ausgeschieden. Hepatisch ausgeschiedene Estrogene können hydrolysiert enterohepatisch rückresorbiert werden.
Medrogeston
Medrogeston wird nach oraler Einnahme schnell resorbiert. Maximale Plasmakonzentrationen werden nach 1 - 4 Stunden erreicht. Medrogeston wird in der Leber vollständig zu Hydroxy-und Dihydroxymedrogeston metabolisiert. Die Eliminationshalbwertzeit nach einmaliger Gabe beträgt weniger als 24 Stunden. Die Metabolite werden glucuronisiert mit dem Urin ausgeschieden.
Eine mit 18 Probandinnen durchgeführte Studie, mit einmaliger oraler Applikation einer Dosiskombination von 0,6 mg konjugierten Estrogenen und 5 mg Medrogeston, ergab die in Abbildung 1 und Abbildung 2 dargestellten Konzentrations-Zeit-Kurven.
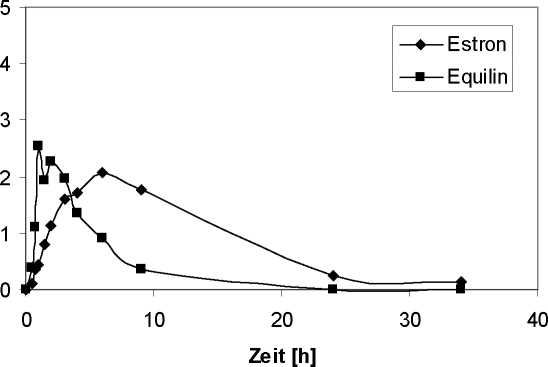
Abbildung 1 zeigt die in der Studie ermittelten mittleren Plasmakonzentrations-Zeit-Kurven für die estrogen wirksamen Hauptkomponenten (Estron, Equilin) nach einmaliger Einnahme einer Dosiskombination von 0,6 mg konjugierten Estrogenen und 5 mg Medrogeston.

0
10
20
Zeit [h]
30
40
Abbildung 2 zeigt die in der Studie ermittelte mittlere Plasmakonzentrations-Zeit-Kurve für Medrogeston nach einmaliger Einnahme einer Dosiskombination von 0,6 mg konjugierten Estrogenen und 5 mg Medrogeston.
Folgende pharmakokinetische Parameter der Hauptkomponenten von Presomen conti 0,6 mg/2 mg wurden in einer Pharmakokinetikstudie mit 18 Probanden nach oraler Verabreichung einer überzogenen Tablette ermittelt:
|
Cmax [ng/ml] |
Tmax [h] |
AUC [ng»h/ml] | |
|
Estron |
2,9 ± 1,3 |
4,0 (1,5 - 9,0) |
54,7 ± 28,8 |
|
Equilin |
3,9 ± 1,4 |
1,5 (0,8 - 3,0) |
21,0 ± 9,8 |
|
Medrogeston |
4,4 ± 1,8 |
2,0 (1,0 - 4,0) |
22,7 ± 14,2 |
Cmax und AUC sind Mittelwerte ± Standardabweichung Tmax sind Median-Werte
Die Bioverfügbarkeit von Presomen conti 0,6 mg/2 mg wurde bezüglich Estron und Equilin im Vergleich zu einer intravenösen Lösung und bezüglich Medrogeston gegen eine orale Lösung basierend auf den AUC-Werten ermittelt:
Estron: 34% absolute Bioverfügbarkeit (95% Konfidenzintervall von 25 - 47%)
Equilin: 37% absolute Bioverfügbarkeit (95% Konfidenzintervall von 28 - 49%)
Medrogeston: 58% relative Bioverfügbarkeit (95% Konfidenzintervall von 42 - 81%)
5.3 Präklinische Daten zur Sicherheit
Wegen ausgeprägter Speziesunterschiede besitzen tierexperimentelle Untersuchungsergebnisse mit Estrogenen nur einen beschränkten prädiktiven Wert für die Anwendung beim Menschen.
Bei Versuchstieren zeigten Estrogene bereits in relativ geringer Dosierung einen embryoletalen Effekt; Missbildungen des Urogenitaltrakts und Feminisierung männlicher Feten wurden beobachtet. Medrogeston zeigte im Tierexperiment Skelettmissbildungen und einen embryoletalen Effekt. In hohen Dosen wurde eine Feminisierung von männlichen Feten beobachtet.
Präklinische Daten für konjugierte Estrogene und Medrogeston aus konventionellen Studien zur chronischen Toxizität, Genotoxizität und zum karzinogenen Potential zeigen keine relevanten Risiken für den Menschen außer denen, die bereits in anderen Kapiteln der Fachinformation beschrieben sind.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Tablettenkern:
mikrokristalline Cellulose/inerte Cellulose, Tricalciumphosphat (Ph.Eur.), Lactose-Monohydrat, Sucrose, Macrogol 4000, Maisstärke, Carmellose-Natrium (Ph.Eur.), Magnesiumstearat (Ph.Eur.) [planzlich]
Filmüberzug:
Povidon K 25, Talkum, Schellack, Arabisches Gummi, Sucrose, leichtes Magnesiumoxid, Carmellose-Natrium (Ph.Eur.), Macrogol 6000, Titandioxid (E171), gebleichtes Wachs, Carnaubawachs
Zusätzliche Farbstoffe (nicht enthalten in den weißen Tabletten von Presomen compositum 0,6 mg/5 mg):
Lactose-Monohydrat, Eisenoxidhydrat (gelbes Eisenoxid) (E172), Eisen(III)-oxid (rotes Eisenoxid) (E172) und Eisen(II, 11I)-oxid (schwarzes Eisenoxid) (E172)
6.2 Inkompatibilitäten
Nicht zutreffend
6.3 Dauer der Haltbarkeit
5 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 30°C lagern
6.5 Art und Inhalt des Behältnisses
T ransparenter PVC/Aluminium-Blisterstreifen
Originalpackung mit:
• 28 überzogenen Tabletten
• 84 (= 3 x 28) überzogenen Tabletten
Unverkäufliches Muster mit:
• 28 überzogenen Tabletten
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen
7. INHABER DER ZULASSUNG
Mylan Healthcare GmbH
Freundallee 9A
30173 Hannover
Tel.-Nr.: 0511 / 6750-2400
Fax-Nr.: 0511 / 6750-3120
E-Mail: mylan.healthcare@mylan.com
8. ZULASSUNGSNUMMER(N)
Presomen 28 compositum 0,3 mg/5 mg:
4971.01.00
Presomen 28 compositum 0,6 mg/5 mg:
6075564.00. 00
Presomen conti 0,6 mg/2 mg:
50237.00. 00
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
Presomen 28 compositum 0,3 mg/5 mg:
01.04.1985 / 13.09.2013
Presomen 28 compositum 0,6 mg/5 mg:
07.12.2005 / keine weitere Verlängerung nötig nach Gesetz
Presomen conti 0,6 mg/2 mg:
09.01.2006 / 28.06.2013
10. STAND DER INFORMATION
02/2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig