Primovist 0,25 Mmol/Ml Injektionslösung, Fertigspritze
Gebrauchsinformation: Information für Anwender
Primovist® 0,25 mmol/ml Injektionslösung, Fertigspritze
Dinatriumgadoxetat
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie dieses Arzneimittel erhalten, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an den Arzt, der Ihnen Primovist verabreicht (den Radiologen), oder an das Personal des Krankenhauses/MRT-Zentrums.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Radiologen. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht
1. Was ist Primovist und wofür wird es angewendet?
2. Was sollten Sie vor dem Erhalt von Primovist beachten?
3. Wie ist Primovist anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Primovist aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist Primovist und wofür wird es angewendet?
Primovist ist ein Kontrastmittel für die Magnetresonanztomographie (MRT) der Leber. Es wird verwendet, um mögliche Veränderungen in der Leber besser erkennen und diagnostizieren zu können. Auffälligkeiten in der Leber lassen sich so besser beurteilen (Anzahl, Größe und Verteilung). Darüber hinaus kann der Arzt mit Primovist die Art von etwaigen Auffälligkeiten bestimmen, so dass sich die Zuverlässigkeit der Diagnose erhöht.
Das Kontrastmittel steht als intravenöse Injektionslösung zur Verfügung. Dieses Arzneimittel ist ein Diagnostikum.
Bei der MRT handelt es sich um ein medizinisch-diagnostisches Bildgebungsverfahren, das über ein kompliziertes System von Magneten und Radiowellen Wassermoleküle in gesunden und erkrankten Geweben erkennt und sichtbar macht.
2. Was sollten Sie vor dem Erhalt von Primovist beachten?
Primovist darf nicht angewendet werden,
- wenn Sie allergisch gegen Dinatriumgadoxetat oder einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses Arzneimittels sind.
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt, bevor Ihnen Primovist verabreicht wird, wenn Sie
- eine Allergie (z. B. Heuschnupfen, Nesselsucht) oder Asthma haben oder hatten.
- schon einmal eine Reaktion nach Kontrastmittelanwendung hatten.
- an einer eingeschränkten Nierenfunktion leiden.
Es wurden Fälle von Nephrogener Systemischer Fibrose (NSF) nach der Anwendung einiger gadoliniumhaltiger Kontrastmittel bei Patienten mit schwerer Störung der Nierenfunktion beobachtet. NSF ist eine Erkrankung, die zur Verdickung der Haut und des Bindegewebes führt und kann damit eine Einschränkung der Beweglichkeit der Gelenke, Muskelschwäche oder eine Funktionseinschränkung innerer Organe, die lebensbedrohlich sein können, zur Folge haben.
- eine ernsthafte Erkrankung des Herzens und der Blutgefäße haben.
- niedrige Kaliumwerte haben.
- oder ein Mitglied Ihrer Familie jemals Probleme mit der elektrischen Aktivität des Herzens, d. h. dem Herzrhythmus gehabt haben (Long-QT-Syndrom).
- nach Einnahme von Arzneimitteln Veränderungen von Herzrhythmus oder Herzschlag hatten.
Wenn eines dieser Kriterien auf Sie zutrifft, informieren Sie bitte Ihren Arzt, bevor Sie Primovist erhalten. Dieser entscheidet daraufhin, ob die geplante Untersuchung stattfinden kann oder nicht.
- Nach der Anwendung von Primovist kann es zu allergieartigen, mitunter auch schweren Reaktionen kommen. Verzögert auftretende Reaktionen (nach Stunden oder Tagen) sind nicht auszuschließen (siehe Abschnitt 4.).
- Informieren Sie Ihren Arzt, wenn Sie einen Herzschrittmacher tragen oder wenn sich eisenhaltige Implantate oder Clips in Ihrem Körper befinden.
Informieren Sie Ihren Arzt, wenn:
- Ihre Nieren nicht richtig arbeiten.
- Sie kürzlich ein Lebertransplantat erhalten haben oder bald erhalten werden.
Bevor Ihr Arzt entscheidet, ob er Primovist bei Ihnen anwendet, wird er möglicherweise einen Bluttest durchführen, um nachzuprüfen, wie gut Ihre Nieren arbeiten. Dies trifft speziell auf Sie zu, wenn Sie 65 Jahre oder älter sind.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Primovist wurden bei Patienten unter 18 Jahren nicht nachgewiesen, da nur begrenzte Erfahrungen über die Anwendung vorliegen. Weitere Informationen über die Anwendung von Primovist bei Kindern finden sich am Ende der Packungsbeilage.
Anwendung von Primovist zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt, wenn Sie andere Arzneimittel einnehmen/anwenden, kürzlich andere Arzneimittel eingenommen/angewendet haben oder beabsichtigen andere Arzneimittel einzunehmen/anzuwenden.
Hierzu zählen vor allem:
- Betablocker, die zur Behandlung von Bluthochdruck und anderen Herzkrankheiten angewendet werden;
- Arzneimittel, die den Herzrhythmus oder die Herzfrequenz verändern (z. B. Amiodaron, Sotalol);
- Rifampicin (Arzneimittel zur Behandlung von Tuberkulose).
Schwangerschaft und Stillzeit
Schwangerschaft
Sie müssen Ihren Arzt informieren, wenn Sie denken, dass Sie schwanger sind oder schwanger sein könnten, da Primovist in der Schwangerschaft nur angewendet werden sollte, wenn es unbedingt notwendig ist.
Stillzeit
Informieren Sie Ihren Arzt, wenn Sie stillen oder mit dem Stillen beginnen wollen. Ihr Arzt wird mit Ihnen besprechen, ob Sie das Stillen fortsetzen oder nach der Anwendung von Primovist das Stillen für 24 Stunden unterbrechen sollten.
Primovist enthält 82 mg Natrium je Dosis (auf Grundlage der durchschnittlichen Dosis für eine 70 kg schwere Person). Dies ist zu berücksichtigen, wenn Sie eine natriumarme Diät halten.
3. Wie ist Primovist anzuwenden?
Primovist wird unmittelbar vor der MRT-Untersuchung von einem Arzt über eine kleine Hohlnadel in eine Vene injiziert.
Nach der Injektion stehen Sie für mindestens 30 Minuten unter Beobachtung.
Die empfohlene Dosis beträgt:
Die für Sie geeignete Dosis von Primovist richtet sich nach Ihrem Körpergewicht:
0,1 ml Primovist je kg Körpergewicht.
Dosierung bei besonderen Patientengruppen
Die Anwendung von Primovist wird bei Patienten mit schweren Nierenfunktionsstörungen und Patienten, die kürzlich ein Lebertransplantat erhalten haben oder bald erhalten werden, nicht empfohlen. Ist die Anwendung jedoch erforderlich, sollten Sie nur eine Dosis von Primovist während eines Scans erhalten und ein zweiter Scan sollte erst nach mindestens 7 Tagen bei Ihnen durchgeführt werden.
Ältere Menschen
Es ist nicht notwendig, die Dosis anzupassen, wenn Sie 65 Jahre oder älter sind. Möglicherweise wird ein Bluttest durchgeführt, um zu prüfen, wie gut Ihre Nieren arbeiten.
Weitere Informationen zur Verabreichung und Handhabung von Primovist finden sich am Ende der Packungsbeilage.
Wenn Sie eine größere Menge von Primovist erhalten, als Sie sollten
Eine Überdosierung ist unwahrscheinlich. Sollte es tatsächlich zu einer Überdosierung kommen, so behandelt der Arzt sämtliche Symptome, die in der Folge auftreten.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Die meisten Nebenwirkungen sind leicht bis mittelschwer.
Die am häufigsten beobachteten Nebenwirkungen bei Patienten, die Primovist erhalten (Auftreten bei 5 oder mehr Behandelten von 1.000) sind Übelkeit (Krankheitsgefühl), Kopfschmerzen, Hitzegefühl, Blutdruckanstieg, Rückenschmerzen und Schwindel.
Die schwerwiegendste Nebenwirkung ist der anaphylaktoide Schock (schwerwiegende allergieähnliche Reaktion).
Wie auch bei anderen Kontrastmitteln kann es selten zu allergieartigen Reaktionen kommen, in sehr seltenen Fällen auch zu schweren Reaktionen (Schock), die gegebenenfalls eine sofortige ärztliche Behandlung erfordern.
Erste Anzeichen einer schweren Reaktion können in Form von leichten Schwellungen im Gesicht, der Lippen, der Zunge oder im Rachen, Husten, Juckreiz, Schnupfen, Niesen und Nesselsucht (Hautausschlag) auftreten. Wenn es bei Ihnen zu solchen Erscheinungen kommt oder Sie Probleme mit der Atmung haben, teilen Sie dies unverzüglich dem Personal der MRT-Abteilung mit.
Auch verzögerte Reaktionen sind möglich; diese können Stunden bis Tage nach der Anwendung von Primovist auftreten. Wenn Sie verzögerte Reaktionen bemerken, informieren Sie Ihren Arzt oder Radiologen.
Im Folgenden werden die berichteten/aufgetretenen Nebenwirkungen nach ihrer Häufigkeit aufgeführt:
|
Häufig kann bis zu 1 von 10 Behandelten betreffen |
Gelegentlich kann bis zu 1 von 100 Behandelten betreffen |
Selten kann bis zu 1 von 1.000 Behandelten betreffen |
Nicht bekannt Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar |
|
Kopfschmerzen |
Schwindel |
Unfähigkeit, still zu |
beschleunigter |
|
Übelkeit |
Taubheitsgefühl und Kribbeln |
sitzen/stehen (Akathisie) |
Herzschlag |
|
der Haut (Parästhesie) |
Zittern (Tremor) |
(Tachykardie) | |
|
Geschmacksstörungen |
Starker und/oder schneller |
Ruhelosigkeit | |
|
Geruchsstörungen |
Herzschlag (Palpitationen) |
Überempfindlichkeits- | |
|
Gesichtsrötung (Flushing) |
Unregelmäßiger Herzschlag |
reaktionen bzw. | |
|
Blutdruckanstieg |
(Zeichen eines |
allergieähnliche | |
|
Atembeschwerden |
Herzschenkelblocks) |
Reaktionen (z. B. | |
|
Erbrechen |
Beschwerden im Mund |
Schock, niedriger | |
|
Mundtrockenheit |
Erhöhte Speichelbildung |
Blutdruck, | |
|
Hautausschlag |
Hautausschlag mit |
Schwellungen der | |
|
Starker Juckreiz* |
Bläschen und Flecken |
Zunge oder des | |
|
Rückenschmerzen |
Vermehrtes Schwitzen |
Rachens, Nesselsucht | |
|
Schmerzen im Brustraum |
Gefühl von Unbehagen |
(Quaddeln), | |
|
Reaktionen an der Injektionsstelle** Hitzegefühl Schüttelfrost Müdigkeit Befindlichkeitsstörung |
Allgemeines Unwohlsein |
Schwellungen des Gesichts, laufende Nase (Rhinitis), Bindehautentzündung (Konjunktivitis), Bauchschmerzen, verminderte Berührungsempfindung der Haut (Hypästhesie), Niesen, Husten, Jucken, Blässe) |
* Starker Juckreiz (generalisierter Juckreiz, Jucken der Augen)
** Reaktionen an der Injektionsstelle (verschiedener Art) umfassen folgende Begriffe: Kontrastmittelaustritt aus dem Gefäß und Blutung in das umliegende Gewebe an der Injektionsstelle, Brennen an der Injektionsstelle, Kälte an der Injektionsstelle, Reizung an der Injektionsstelle, Schmerzen an der Injektionsstelle
Die folgenden Nebenwirkungen waren in einigen Fällen lebensbedrohlich oder tödlich: Schock und Atembeschwerden.
Kurz nach der Anwendung von Primovist kann es zu veränderten Laborwerten kommen. Wenn Sie Blut- oder Urinproben abgeben, teilen Sie daher bitte dem medizinischen Fachpersonal mit, dass Sie sich kürzlich einer Untersuchung mit Primovist unterzogen haben.
Es wurde über nephrogene systemische Fibrose (welche zu einer Verhärtung der Haut führt und auch die Weichteile und die inneren Organe betreffen könnte) im Zusammenhang mit der Anwendung von anderen Gadolinium-haltigen Kontrastmitteln berichtet.
Meldungen von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Radiologen. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Sie können Nebenwirkungen auch direkt anzeigen (siehe folgende Details). Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
Deutschland
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
Website: http://www.bfarm.de Österreich
Bundesamt für Sicherheit im Gesundheitswesen
Inst. Pharmakovigilanz
Traisengasse 5
1200 WIEN
ÖSTERREICH
Fax: + 43 (0) 50 555 36207
Website: http://www.basg.gv.at/
5. Wie ist Primovist aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen dieses Arzneimittel nach dem auf dem Etikett von Fertigspritze und auf der Faltschachtel nach „Verw. bis“ angegebenen Verfalldatum nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats.
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich. Dieses Arzneimittel ist sofort nach Anbruch zu verwenden.
Dieses Arzneimittel ist eine klare, farblose bis schwach gelbe Lösung. Es ist vor der Anwendung in Augenschein zu nehmen und darf bei starker Verfärbung, Vorhandensein von Partikeln oder Beschädigung des Behältnisses nicht verwendet werden.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
6. Inhalt der Packung und weitere Informationen Was Primovist enthält
- Der Wirkstoff ist: Dinatriumgadoxetat.
1 ml der Injektionslösung enthält 0,25 mmol Dinatriumgadoxetat entsprechend 181,43 mg Dinatriumgadoxetat.
- Die sonstigen Bestandteile sind: Trinatriumcaloxetat, Trometamol, Natriumhydroxid (zur pH-Einstellung), Salzsäure (zur pH-Einstellung) und Wasser für Injektionszwecke.
1 Fertigspritze mit 10,0 ml enthält 1814 mg Dinatriumgadoxetat.
Wie Primovist aussieht und Inhalt der Packung
Primovist ist eine klare, farblose bis schwach gelbe Flüssigkeit, die frei von sichtbaren Partikeln ist.
Deutschland
1 oder 5 Fertigspritzen mit 10,0 ml Injektionslösung (in 10-ml-Fertigspritzen aus Glas oder Kunststoff)
Österreich
1 Fertigspritze mit 10,0 ml Injektionslösung (in 10-ml-Fertigspritzen aus Glas oder Kunststoff)
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Pharmazeutischer Unternehmer
Deutschland Bayer Vital GmbH 51368 Leverkusen Telefon: 0214 30-51348 Telefax: 0214 30- 51603
E-Mail-Adresse: bayer-vital@bayerhealthcare.com Österreich
Bayer Austria GesmbH 1160 Wien
Hersteller
Bayer Pharma AG Müllerstrasse 178 13353 Berlin, Deutschland
Dieses Arzneimittel ist in den folgenden Mitgliedstaaten des Europäischen Wirtschaftsraumes (EWR) unter der Bezeichnung Primovist zugelassen:
Österreich, Belgien, Kroatien, Zypern, Tschechische Republik, Estland, Finnland, Deutschland, Griechenland, Ungarn, Irland, Italien, Lettland, Litauen, Luxemburg, Malta, Niederlande, Norwegen, Polen, Portugal, Slowakische Republik, Slowenien, Spanien, Schweden, Vereinigtes Königreich.
Diese Packungsbeilage wurde zuletzt überarbeitet im November 2015.
<------------------------------------------------------------------------------------------------------------------------>
Die folgenden Informationen sind nur für medizinisches Fachpersonal bestimmt:
Nierenfunktionsstörung
Es wird empfohlen, vor der Anwendung von Primovist bei allen Patienten das Vorliegen einer Nierenfunktionsstörung durch Labortests abzuklären.
In Zusammenhang mit der Anwendung einiger Gadolinium-haltiger Kontrastmittel wurde bei Patienten mit akuter oder chronischer schwerer Niereninsuffizienz (GFR < 30 ml/min/1,73 m2) über eine nephrogene systemische Fibrose (NSF) berichtet. Ein besonderes Risiko besteht bei Patienten, die sich einer Lebertransplantation unterziehen, da die Inzidenz eines akuten Nierenversagens in dieser Gruppe hoch ist. Da die Möglichkeit besteht, dass mit Primovist eine NSF auftritt, sollte es daher bei Patienten mit schwerer Einschränkung der Nierenfunktion und bei Patienten in der perioperativen Phase einer Lebertransplantation vermieden werden, es sei denn, die diagnostische Information ist notwendig und kann mit einer MRT ohne Kontrastmittelverstärkung nicht erhoben werden. Falls die Anwendung von Primovist nicht zu vermeiden ist, sollte die Dosis 0,025 mmol/kg Körpergewicht nicht übersteigen. Während eines Scans sollte nicht mehr als eine Dosis angewendet werden. Da keine
Informationen zur wiederholten Anwendung vorliegen, sollte die Injektion von Primovist nicht wiederholt werden, es sei denn, der Abstand zwischen den Injektionen beträgt mindestens 7 Tage.
Da die renale Clearance von Dinatriumgadoxetat bei älteren Menschen beeinträchtigt sein kann, ist es besonders wichtig, Patienten ab 65 Jahren bezüglich einer Nierenfunktionsstörung zu überprüfen.
Eine Hämodialyse kurz nach der Anwendung von Primovist kann nützlich sein, um Primovist aus dem Körper zu entfernen. Es gibt keine Hinweise dafür, dass die Einleitung einer Hämodialyse zur Prävention oder Behandlung einer NSF bei nicht bereits dialysierten Patienten geeignet ist.
Schwangerschaft und Stillzeit
Primovist darf während der Schwangerschaft nicht verwendet werden, es sei denn, dass eine Anwendung von Dinatriumgadoxetat aufgrund des klinischen Zustands der Frau erforderlich ist.
Ob das Stillen fortgesetzt oder nach der Verabreichung von Primovist für 24 Stunden unterbrochen wird, sollten der Arzt und die stillende Mutter entscheiden.
Kinder und Jugendliche
Eine Beobachtungsstudie wurde mit 52 pädiatrischen Patienten (im Alter von > 2 Monaten bis < 18 Jahren) durchgeführt. Patienten wurden für eine Primovist-verstärkte Leber-MRT ausgewählt um vermutete oder bekannte fokale Leberläsionen zu beurteilen. Zusätzliche diagnostische Information wurde erzielt, wenn Nativaufnahmen kombiniert mit kontrastmittelverstärkten Leber-MR-Aufnahmen mit reinen Nativaufnahmen verglichen wurden. Schwerwiegende unerwünschte Ereignisse wurden berichtet, jedoch wurde keines dieser Ereignisse vom Prüfarzt mit Primovist in Zusammenhang gebracht. Aufgrund des retrospektiven Charakters und der geringen Patientenanzahl in der Studie kann keine definitive Schlussfolgerung in Bezug auf die Wirksamkeit und Sicherheit in dieser Population gezogen werden.
Vor der Injektion
Primovist ist eine klare, farblose bis schwach gelbe Lösung, die frei von sichtbaren Partikeln ist. Das Kontrastmittel ist vor der Anwendung in Augenschein zu nehmen und darf bei starker Verfärbung, Vorhandensein von Partikeln oder Beschädigung des Behältnisses nicht verwendet werden.
Verabreichung
Primovist wird unverdünnt als intravenöse Bolusinjektion mit einer Flussgeschwindigkeit von ungefähr 2 ml/s verabreicht. Nach der Injektion sollte die intravenöse Kanüle/Schlauch mit physiologischer Kochsalzlösung (9 mg/ml) durchgespült werden.
- Der Patient sollte nach der Injektion für mindestens 30 min unter Beobachtung bleiben.
- Primovist darf nicht mit anderen Arzneimitteln gemischt werden.
- Eine intramuskuläre Injektion muss unbedingt vermieden werden.
Handhabung
Primovist ist gebrauchsfertig.
Die Fertigspritze unmittelbar vor der Untersuchung für die Injektion vorbereiten. Die Nadelkappe erst unmittelbar vor der Anwendung von der Fertigspritze entfernen. Die in einem Untersuchungsgang nicht verwendete Kontrastmittellösung ist in Übereinstimmung mit örtlichen Anforderungen zu verwerfen.
Das Abziehetikett zur Rückverfolgung auf den Fertigspritzen ist auf die Patientenakte zu kleben, um eine genaue Dokumentation des verwendeten Gadolinium-haltigen Kontrastmittels sicherzustellen.
Die verwendete Dosis ist ebenfalls anzugeben. Falls elektronische Patientenakten verwendet werden, sind die Arzneimittelbezeichnung, die Chargenbezeichnung und die Dosis darin zu dokumentieren.
Glasspritzen:
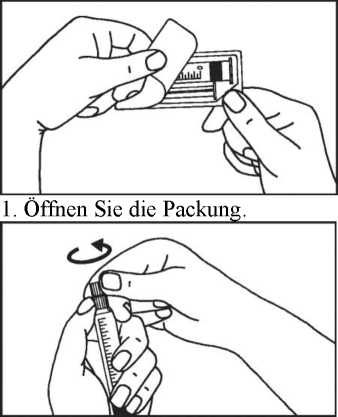
3. Brechen Sie die Schutzkappe ab.
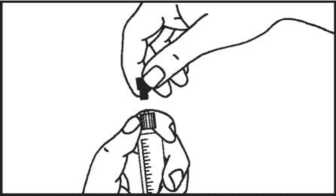
5. Entfernen Sie den Gummistopfen.
Kunststoffspritzen: INJEKTION PER HAND
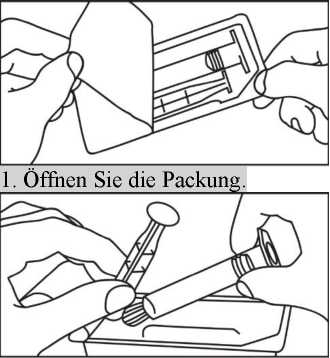
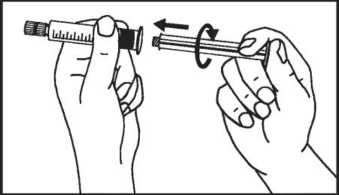
2. Schrauben Sie den Kolben an die Spritze.
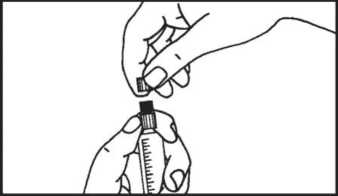
4. Entfernen Sie die Schutzkappe.
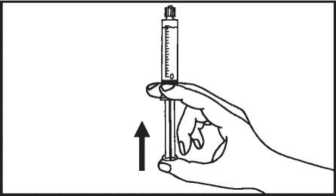
6. Entfernen Sie die Luft aus der Spritze.
INJEKTION MITTELS INJEKTOR
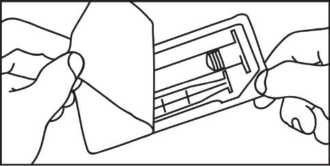
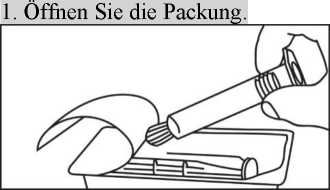
2. Nehmen Sie die Spritze und den Kolben aus 2. Nehmen Sie die Spritze aus der Packung.
der Packung.
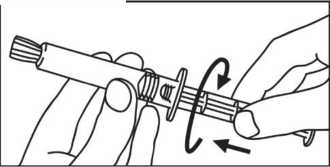
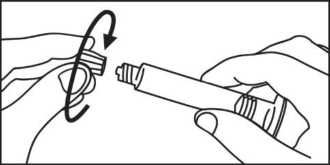
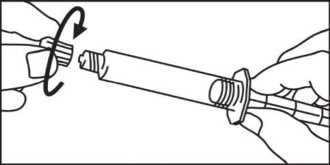
3. Drehen Sie den Kolben im Uhrzeigersinn in die 3. Öffnen Sie die Kappe durch Drehen. Spritze.
4. Verbinden Sie die Spritzenspitze mit dem Schlauchsystem im Uhrzeigersinn und fahren Sie fort nach den Anweisungen des Geräteherstellers.
4. Öffnen Sie die Kappe durch Drehen.
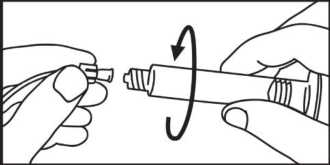
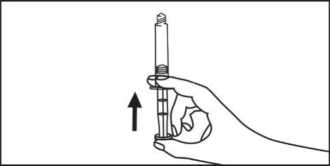
5. Entfernen Sie die Luft aus der Spritze.
Weitere Informationen zur Anwendung von Primovist finden sich in Abschnitt 3 der Packungsbeilage.
Zusätzliche Angaben:
Deutschland: Zul.-Nr.: 60470.00.00 Österreich: Z.Nr.: 1-25757
10