Priorix Tetra
Gebrauchsinformation: Information für Anwender Priorix Tetra®
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Masern-Mumps-Röteln-Varizellen-Lebendimpfstoff
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Ihr Kind diesen Impfstoff erhält, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
- Dieser Impfstoff wurde Ihrem Kind persönlich verschrieben. Geben Sie ihn nicht an Dritte weiter.
- Wenn Sie bei Ihrem Kind Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht
1. Was ist Priorix Tetra und wofür wird es angewendet?
2. Was sollten Sie vor der Einnahme von Priorix Tetra beachten?
3. Wie ist Priorix Tetra anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Priorix Tetra aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist Priorix Tetra und wofür wird es angewendet?
Priorix Tetra ist ein Impfstoff, der bei Kindern ab dem vollendeten 11. Lebensmonat bis zum vollendeten 13. Lebensjahr angewendet wird, um vor Erkrankungen, die durch Masern-, Mumps-, Röteln- und Varizellen (Windpocken)-Viren verursacht werden, zu schützen. Unter bestimmten Umständen kann Priorix Tetra auch Kindern ab dem vollendeten 9. Lebensmonat verabreicht werden.
Wie Priorix Tetra wirkt
Die Impfung mit Priorix Tetra bewirkt, dass das Immunsystem (das natürliche Abwehrsystem des Körpers) Antikörper (Abwehrstoffe) gegen Masern-, Mumps-, Röteln- und Windpocken-Viren bildet, die die Aufgabe haben, im Falle einer Ansteckung mit Masern, Mumps, Röteln bzw. Windpocken vor diesen Erkrankungen zu schützen.
Priorix Tetra ist ein Lebendvirusimpfstoff, wobei die darin enthaltenen Viren so stark abgeschwächt („attenuiert“) sind, dass sie in der Regel bei gesunden Personen keine Erkrankung auslösen können.
Wie jeder Impfstoff schützt Priorix Tetra möglicherweise nicht alle Geimpften vollständig.
2. Was sollten Sie beachten, bevor Ihr Kind Priorix Tetra erhält?
Priorix Tetra darf nicht angewendet werden,
- wenn Ihr Kind allergisch auf einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses Impfstoffes ist. Eine allergische Reaktion kann sich durch juckenden Hautausschlag, Atemnot und Schwellung des Gesichts oder der Zunge äußern;
- wenn Ihr Kind schon einmal eine allergische Reaktion auf einen Masern-, Mumps-, Röteln- und/oder Varizellen-Impfstoff gezeigt hat;
- wenn Ihr Kind allergisch auf Neomycin (ein Antibiotikum) reagiert. Eine bekannte Kontaktdermatitis (Hautausschlag, der entsteht, wenn die Haut in
direkten Kontakt mit allergieauslösenden Stoffen, wie Neomycin, kommt) auf Neomycin dürfte im Allgemeinen unproblematisch sein. Sie sollten jedoch zuerst mit Ihrem Arzt darüber sprechen;
- wenn Ihr Kind eine schwere Infektion mit Fieber hat. In diesen Fällen wird die Impfung verschoben, bis Ihr Kind wieder gesund ist. Ein leichter Infekt
wie z. B. eine Erkältung dürfte unproblematisch sein, Sie sollten jedoch zuerst mit Ihrem Arzt darüber sprechen;
- wenn Ihr Kind an einer Erkrankung leidet (wie z.B. Infektion mit dem Humanen Immundefizienz Virus (HIV) oder erworbenes Immundefizienz-Syndrom
(AIDS)) oder Arzneimittel einnimmt, die zu einer Schwächung des körpereigenen Abwehrsystems führen. Die Entscheidung, ob Ihr Kind geimpft wird, hängt vom Ausmaß der Immunschwäche ab.
- wenn Ihr Kind schwanger ist. Darüber hinaus sollte nach der Impfung eine Schwangerschaft über einen Zeitraum von einem Monat verhindert werden. Warnhinweise und Vorsichtsmaßnahmen
Sprechen Sie mit Ihrem Arzt oder Apotheker, bevor Ihr Kind mit Priorix Tetra geimpft wird,
- wenn bei Ihrem Kind schon einmal Krampfanfälle, einschließlich Fieberkrämpfe, in der Eigen- oder Familienanamnese aufgetreten sind. In diesem Fall ist eine engmaschige Überwachung nach der Impfung erforderlich, da besonders 5 bis 12 Tage nach der Gabe des Impfstoffes Fieber auftreten kann (siehe auch Abschnitt 4);
- wenn Ihr Kind schon einmal eine schwere allergische Reaktion auf Hühnereiweiß gezeigt hat;
- wenn Ihr Kind schon einmal nach einer Impfung gegen Masern, Mumps oder Röteln leicht Blutergüsse bekommen oder länger als üblich geblutet hat (siehe auch Abschnitt 4);
- wenn Ihr Kind ein geschwächtes Abwehrsystem, z.B. wegen einer HIV-Infektion, hat. In diesem Fall sollte Ihr Kind engmaschig überwacht werden, da die Immunantwort auf den Impfstoff möglicherweise nicht ausreichend ist, um einen Schutz vor der Erkrankung zu erzielen (siehe Abschnitt 2).
Nach der Impfung kann es bei Ihrem Kind zu einem windpockenähnlichen Ausschlag kommen (siehe auch Abschnitt 4). In diesem Fall sollte der Kontakt zu den folgenden Personen vermieden werden:
- Personen mit einer verminderten Widerstandsfähigkeit gegen Krankheiten,
- schwangere Frauen, die entweder noch nie an Windpocken erkrankt waren oder nicht gegen Windpocken geimpft sind.
Nach oder sogar vor einer Nadelinjektion kann es (meist bei Jugendlichen) zu einer Ohnmacht kommen. Informieren Sie daher den Arzt oder das medizinische Fachpersonal, wenn Ihr Kind bei einer früheren Injektion schon einmal ohnmächtig geworden ist.
Anwendung von Priorix Tetra zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt, wenn Ihr Kind andere Arzneimittel einnimmt, kürzlich andere Arzneimittel eingenommen hat oder beabsichtigt, andere Arzneimittel einzunehmen oder kürzlich andere Impfstoffe erhalten hat.
Wenn Ihr Kind eine Blutübertragung oder humane Antikörper (Immunglobuline) erhalten hat, wird Ihr Arzt die Impfung um mindestens 3 Monate verschieben.
Wenn bei Ihrem Kind ein Tuberkulintest (Hauttest auf Tuberkulose) geplant ist, sollte dieser vor, gleichzeitig oder erst 6 Wochen nach der Impfung mit Priorix Tetra durchgeführt werden.
Acetylsalicylsäure (eine Substanz, die in einigen Arzneimitteln zur Fiebersenkung und Schmerzlinderung enthalten ist) sollte bis zu 6 Wochen nach der Impfung mit Priorix Tetra nicht eingenommen werden.
Priorix Tetra ist eine eingetragene Marke der GlaxoSmithKline Biologicals S.A.
Priorix Tetra kann gleichzeitig mit Diphtherie-, Tetanus-, azellulären Pertussis (Keuchhusten)-, Haemophilus influenzae-Typ b-, inaktivierten Polio (Kinderlähmung)- und Hepatitis-B-Impfstoffen verabreicht werden. Die Injektionen werden an verschiedenen Gliedmaßen vorgenommen.
Schwangerschaft und Stillzeit
Priorix Tetra darf schwangeren Frauen nicht verabreicht werden.
Wenn Ihr Kind schwanger ist oder stillt, oder wenn es vermutet, schwanger zu sein, oder beabsichtigt, schwanger zu werden, fragen Sie Ihren Arzt oder Apotheker um Rat, bevor der Impfstoff verabreicht wird. Darüber hinaus ist es wichtig, dass Ihr Kind innerhalb eines Monats nach der Impfung nicht schwanger wird. Während dieser Zeit sollte Ihr Kind eine wirksame Verhütungsmethode anwenden, um eine Schwangerschaft zu verhindern.
Priorix Tetra enthält Sorbitol
Wenn Ihr Kind eine Unverträglichkeit gegen bestimmte Zucker hat, kontaktieren Sie bitte Ihren Arzt, bevor Ihr Kind den Impfstoff erhält.
3. Wie ist Priorix Tetra anzuwenden?
Priorix Tetra wird als Injektion unter die Haut im Bereich des Oberarms oder des äußeren Oberschenkels verabreicht.
Priorix Tetra ist für Kinder vom vollendeten 11. Lebensmonat bis zum vollendeten 13. Lebensjahr bestimmt. Ihr Arzt bestimmt den richtigen Zeitpunkt und die Anzahl der Dosen auf Basis der offiziellen Impfempfehlungen.
Der Impfstoff darf auf keinen Fall in ein Blutgefäß verabreicht werden.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieser Impfstoff Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Folgende Nebenwirkungen können nach Verabreichung dieses Impfstoffes auftreten:
♦ Sehr häufig (Nebenwirkungen, die bei mehr als 1 von 10 Impfstoffdosen auftreten können)
- Schmerzen und Rötung an der Injektionsstelle
- Fieber (38 °C oder höher)*
♦ Häufig (Nebenwirkungen, die bei bis zu 1 von 10 Impfstoffdosen auftreten können)
- Schwellung an der Injektionsstelle
- Fieber (höher als 39,5 °C)*
- Reizbarkeit
- Hautausschlag (Flecken und/oder Bläschen)
♦ Gelegentlich (Nebenwirkungen, die bei bis zu 1 von 100 Impfstoffdosen auftreten können)
- Ungewöhnliches Schreien, Unruhe, Schlaflosigkeit
- Unwohlsein, Lethargie, Müdigkeit
- Schwellung der Ohrspeicheldrüse
- Durchfall, Erbrechen
- Appetitlosigkeit
- Infektion der oberen Atemwege
- Schnupfen
- Lymphknotenschwellung
♦ Selten (Nebenwirkungen, die bei bis zu 1 von 1.000 Impfstoffdosen auftreten können)
- Mittelohrentzündung
- Fieberkrämpfe
- Husten
- Bronchitis
♦ Nach Verabreichung der ersten Dosis von Priorix Tetra wurde eine höhere Fieberrate gegenüber den beim gleichen Arztbesuch separat verabreichten Masern-Mumps-Röteln- und Varizellen-Impfstoffen beobachtet.
Während der Anwendung nach der Markteinführung von Masern-, Mumps-, Röteln- oder Varizellen-Impfstoffen von GlaxoSmithKline wurden bei wenigen Gelegenheiten folgende zusätzliche Nebenwirkungen berichtet:
- Gelenkschmerzen, Gelenkentzündung
- Allergische Reaktionen. Hautausschläge, die jucken und/oder bläschenförmig sein können, Schwellung der Augen und des Gesichts, Atem- oder Schluckbeschwerden, plötzlicher Blutdruckabfall und Bewusstlosigkeit. Solche Reaktionen treten im Allgemeinen auf, noch bevor Sie die Arztpraxis verlassen. Informieren Sie sofort einen Arzt, wenn Ihr Kind irgendeines dieser Symptome bemerkt.
- Kawasaki-Syndrom (wichtige Krankheitszeichen sind z. B. Fieber, Hautausschlag, Lymphknotenschwellung, Schleimhautentzündung und -ausschlag in Mund und Rachen)
- Entzündung der Hirnhäute, des Gehirns, des Rückenmarks und der peripheren Nerven, Schlaganfall, Guillain-Barre-Syndrom (aufsteigende Lähmungen bis hin zur Atemlähmung), Unsicherheit beim Gehen
- Punktförmige bzw. kleinfleckige Blutungen oder über das normale Maß hinaus auftretende Blutergüsse aufgrund eines Abfallens der Blutplättchenmenge
- Erythema exsudativum multiforme (Symptome sind rote, oft juckende Flecken, ähnlich dem Masern-Hautausschlag, die an den Gliedmaßen und manchmal im Gesicht und am restlichen Körper beginnen)
- Herpes zoster (Gürtelrose)
- Mumps-ähnliche Symptome
- Vorübergehende, schmerzhafte Hodenschwellung
Meldung von Nebenwirkungen
Wenn Sie bei Ihrem Kind Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser
Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut,
Paul-Ehrlich-Str. 51-59, 63225 Langen, Tel: +49 6103 77 0, Fax: +49 6103 77 1234, Website: www.pei.de anzeigen. Indem Sie Nebenwirkungen melden, können Sie
dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist Priorix Tetra aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen diesen Impfstoff nach dem auf dem Umkarton angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten
Tag des angegebenen Monats.
Kühl lagern und transportieren (2 °C-8 °C).
Nicht einfrieren.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Nach dem Auflösen sollte der Impfstoff umgehend verabreicht werden oder im Kühlschrank aufbewahrt werden (2 °C-8 °C). Wenn der Impfstoff nicht innerhalb von 24 Stunden verwendet wird, ist er zu verwerfen.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
6. Inhalt der Packung und weitere Informationen
Was Priorix Tetra enthält
- Die Wirkstoffe sind:
Masern-, Mumps-, Röteln- und Varicella-Viren (lebend, attenuiert)
- Die sonstigen Bestandteile sind:
Pulver: Aminosäuren, Lactose (wasserfrei), Mannitol, Sorbitol, Medium 199 Lösungsmittel: Wasser für Injektionszwecke
Wie Priorix Tetra aussieht und Inhalt der Packung
Priorix Tetra liegt als Pulver und Lösungsmittel zur Herstellung einer Injektionslösung (Pulver in einer Durchstechflasche für 1 Dosis und Lösungsmittel in einer Fertigspritze (0,5 ml)) mit oder ohne separaten Kanülen/Nadeln in den folgenden Packungsgrößen vor:
- Packungsgrößen zu 1 oder 10 mit jeweils 2 separaten Kanülen/Nadeln
- Packungsgrößen zu 1, 10, 20 oder 50 ohne Kanülen/Nadeln
Priorix Tetra ist ein weißes bis leicht rosafarbenes Pulver mit einem klaren, farblosen Lösungsmittel (Wasser für Injektionszwecke) zur Auflösung des Impfstoffes.
Es werden möglicherweise nicht alle Packungsgrößen von der axicorp Pharma GmbH in den Verkehr gebracht.
Import, Umverpackung und Vertrieb:
axicorp Pharma GmbH Max-Planck-Straße 36b D-61381 Friedrichsdorf
Diese Gebrauchsinformation wurde zuletzt überarbeitet im September 2013.
Die folgenden Informationen sind für medizinisches Fachpersonal bestimmt.
Wie bei allen injizierbaren Impfstoffen sollten für den seltenen Fall einer anaphylaktischen Reaktion nach der Verabreichung des Impfstoffes stets entsprechende medizinische Behandlungs- und Überwachungsmöglichkeiten sofort verfügbar sein.
Alkohol oder andere Desinfektionsmittel müssen vollständig von der Hautoberfläche verdunstet sein, ehe der Impfstoff injiziert wird, da diese Mittel die attenuiertejn Viren im Impfstoff inaktivieren können.
Priorix Tetra darf unter keinen Umständen intravasal oder intradermal verabreicht werden.
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Der rekonstituierte Impfstoff ist vor der Verabreichung per Augenschein auf Fremdpartikel und/oder physikalische Veränderungen zu untersuchen. Falls solche Abweichungen beobachtet werden, ist der Impfstoff zu verwerfen.
Der Impfstoff wird gelöst, indem der gesamte Inhalt der Fertigspritze mit dem Lösungsmittel in die Durchstechflasche mit dem Pulver gegeben wird.
Um die Kanüle/Nadel an der Spritze anzubringen, folgen Sie der Anleitung unten. Allerdings kann sich die mitgelieferte Spritze von der in der Anleitung beschriebenen Spritze etwas unterscheiden (d.h. ohne Schraubgewinde). In diesem Fall muss die Kanüle/Nadel ohne zu schrauben angebracht werden.
Nadel
Spritze
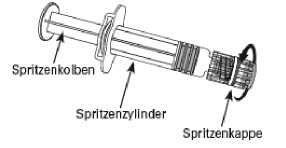
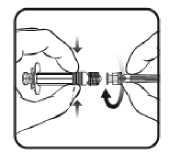
1. Halten Sie den Spritzenzylinder in einer Hand (vermeiden Sie, die Spritze am Kolben zu halten), drehen Sie die Spritzenkappe entgegen dem Uhrzeigersinn ab.
2. Um die Nadel an der Spritze anzubringen, drehen Sie die Nadel im Uhrzeigersinn in die Spritze bis sie fest sitzt (siehe Abbildung).
3. Entfernen Sie den Nadelschutz, der gelegentlich ein wenig fest sitzen kann.
Geben Sie das Lösungsmittel zum Pulver. Danach wird die Mischung gründlich geschüttelt, bis sich das Pulver vollständig gelöst hat.
Aufgrund geringfügig abweichender pH-Werte kann die Farbe des gelösten Impfstoffes von pfirsichfarben bis fuchsienrosa variieren. Diese Farbschwankungen stellen keine Beeinträchtigung der Wirksamkeit des Impfstoffes dar. Bei Beobachtung anderer Veränderungen ist der Impfstoff zu verwerfen.
Zur Verabreichung des Impfstoffes sollte eine neue Kanüle/Nadel verwendet werden.
Es ist der gesamte Inhalt der Durchstechflasche zu applizieren.
Nach dem Auflösen sollte der Impfstoff umgehend verabreicht oder im Kühlschrank aufbewahrt werden (2 °C-8 °C). Wenn der Impfstoff nicht innerhalb von 24 Stunden verwendet wird, ist er zu verwerfen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.