Profact Depot 6,3 Mg 2-Monatsimplantat
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Profact® Depot 6,3 mg 2-Monatsimplantat Wirkstoff: Buserelin
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Eine Fertigspritze mit zwei gleichen, stäbchenförmigen Implantaten enthält als wirksamen Bestandteil
6,6 mg Buserelinacetat (1:1), entsprechend 6,3 mg Buserelin.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Implantat.
Jedes Implantat besteht aus zwei cremefarbenen, stäbchenförmigen Implantaten.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Profact Depot 6,3 mg 2-Monatsimplantat ist angezeigt bei Erwachsenen zur Behandlung des fortgeschrittenen hormonempfindlichen Prostatakarzinoms. Profact Depot 6,3 mg 2-Monatsimplantat ist jedoch nicht angezeigt nach beidseitiger Orchiektomie, da es in diesem Fall zu keiner weiteren Absenkung des Testosteronspiegels kommt.
4.2 Dosierung und Art der Anwendung
Dosierung
Profact Depot 6,3 mg 2-Monatsimplantat dient zur Langzeitbehandlung des fortgeschrittenen Prostatakarzinoms.
Kinder und Jugendliche
Profact Depot 6,3 mg 2-Monatsimplantat sollte nicht bei Kindern angewendet werden. Die Unbedenklichkeit und Wirksamkeit von Profact Depot 6,3 mg 2-Monatsimplantat bei Kindern wurden nicht untersucht.
Art der Anwendung
Alle 2 Monate wird der Inhalt einer Fertigspritze (zwei Implantatstäbchen, zusammen entsprechend
6.3 mg Buserelin) subkutan unter die Bauchhaut injiziert (siehe Abschnitt 6.6). Der 2-monatige Abstand zwischen den Injektionen kann jedoch gelegentlich um bis zu 2 Wochen verlängert werden.
Vor der Injektion kann ein Lokalanästhetikum gegeben werden.
Es wird empfohlen, als Zusatztherapie etwa 5 Tage vor Beginn der Behandlung mit Profact Depot
6.3 mg 2-Monatsimplantat mit der Gabe eines Antiandrogens zu beginnen (siehe auch Abschnitt 4.4).
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff, LHRH-Analoga oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Es wird empfohlen, als Zusatztherapie etwa 5 Tage vor Beginn der Behandlung mit Profact Depot 6,3 mg 2-Monatsimplantat mit der Gabe eines Antiandrogens zu beginnen. Diese Zusatzmedikation muss über 3-4 Wochen parallel zur Behandlung mit Buserelin beibehalten werden. Nach diesem Zeitraum sind die Testosteronspiegel, als Reaktion auf Buserelin, gewöhnlich in den gewünschten Bereich gesunken.
Bei Patienten mit bekannten Metastasen, z. B. der Wirbelsäule, ist eine antiandrogene Zusatztherapie unerlässlich, um zu verhindern, dass es zu Beginn der Behandlung durch eine vorübergehende Aktivierung des Tumors und seiner Metastasen zu Komplikationen bis hin zur spinalen Kompression mit Paralysen kommt (siehe auch Abschnitt 4.8).
Die Reaktion auf die Buserelin-Therapie kann durch Messung der Serumkonzentrationen von prostataspezifischem Antigen (PSA) und Testosteron kontrolliert werden. Die Testosteronkonzentration steigt bei Behandlungsbeginn erst an und sinkt dann während eines Zeitraumes von zwei Wochen ab. Nach 2-4 Wochen sind die Testosteronspiegel auf Kastrationsniveau gesunken. Treten trotz ausreichender Testosteronunterdrückung keine klinische Besserung oder Veränderungen von PSA auf, so deutet dies auf eine Hormonunempfindlichkeit des Tumors hin.
Patienten mit bekannten Metastasen der Wirbelsäule sowie Patienten mit einem Risiko neurologischer Komplikationen oder Harnsperre sollten während der ersten Behandlungswochen engmaschig überwacht werden, wenn zu Therapiebeginn nicht gleichzeitig Antiandrogene gegeben werden.
Veröffentlichte epidemiologische Studien deuten auf einen Zusammenhang zwischen der Behandlung mit Gonadotropin-Releasing-Hormon-(GnRH-)Analoga und einem erhöhten Risiko für kardiovaskuläre Erkrankungen (wie Myokardinfarkt, plötzlicher Herztod und Schlaganfall) und Diabetes mellitus hin. Diese Risiken sollten vor Beginn und während der Behandlung bewertet und die Patienten sollten überwacht und entsprechend behandelt werden (siehe Abschnitt 4.8).
Bei Patienten mit Hypertonie werden regelmäßige Blutdruckkontrollen empfohlen (Gefahr einer Verschlechterung des Blutdruckniveaus).
QT-V erlängerung
Eine Androgendeprivationstherapie kann das QT-Intervall verlängern.
Bei Patienten mit einer Vorgeschichte von bzw. Risikofaktoren für QT-Verlängerungen und bei Patienten mit Begleitmedikationen, die das QT-Intervall verlängern können (siehe Abschnitt 4.5), sollte das Nutzen-Risiko-Verhältnis einschließlich des Potenzials für Torsade de pointes durch den Arzt vor der Anwendung von Profact Depot 6,3 mg 2-Monatsimplantat abgewogen werden.
Bei einigen Patienten, die mit GnRH-Analoga behandelt werden, ist eine Änderung der Glukosetoleranz zu beobachten (siehe Abschnitt 4.8). Bei Diabetikern wird eine regelmäßige Kontrolle der Blutzuckerspiegel empfohlen (Gefahr einer Verschlechterung der Stoffwechseleinstellung).
Aufgrund der Testosteronunterdrückung kann die Behandlung mit GnRH-Analoga das Risiko für Anämien erhöhen. Patienten sollten im Hinblick auf dieses Risiko untersucht und entsprechend behandelt werden (siehe Abschnitt 4.8).
Die Anwendung von LHRH-Analoga kann zu einer Abnahme der Knochendichte und zu einer Osteoporose sowie zu einem erhöhten Risiko für Knochenbrüche führen (siehe Abschnitt 4.8). Besondere Vorsicht ist bei Patienten mit zusätzlichen Risikofaktoren für Osteoporose, wie z. B. chronischer Alkoholmissbrauch, Rauchen, Langzeittherapie mit Antikonvulsiva oder Kortikosteroiden oder Osteoporose in der Familienanamnese, erforderlich. Es wird empfohlen, die Knochendichte regelmäßig zu kontrollieren (BMD) und vorsorgliche Maßnahmen während der Therapie durchzuführen, um Osteopenie/Osteoporose zu verhindern.
Bei Patienten, die mit GnRH-Agonisten, wie Buserelin, behandelt werden, besteht ein erhöhtes Risiko für das Auftreten einer Depression (die schwer sein kann). Die Patienten sollten darüber aufgeklärt und entsprechend behandelt werden, wenn Symptome auftreten. Patienten, die an Depressionen litten oder leiden, müssen sorgfältig überwacht und nötigenfalls behandelt werden (Gefahr des Wiederauftretens oder einer Verschlechterung der Depression).
Die Anwendung von Profact Depot 6,3 mg 2-Monatsimplantat kann bei Dopingkontrollen zu positiven Ergebnissen führen. Zudem kann es bei Missbrauch von Profact Depot 6,3 mg 2-Monatsimplantat als Dopingmittel zu einer Gefährdung der Gesundheit kommen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden keine besonderen Wechselwirkungsstudien durchgeführt.
Während der Behandlung mit Buserelin könnte die Wirkung von Antidiabetika abgeschwächt werden (siehe auch Abschnitt 4.8).
Da eine Androgendeprivationstherapie das QT-Intervall verlängern kann, ist die gleichzeitige Anwendung von Profact Depot 6,3 mg 2-Monatsimplantat mit Arzneimitteln, die bekanntermaßen das QT-Intervall verlängern, oder Arzneimitteln, die Torsade de pointes hervorrufen können wie Antiarrhythmika der Klasse IA (z. B. Chinidin, Disopyramid) oder Klasse III (z. B. Amiodaron, Sotalol, Dofetilid, Ibutilid), Methadon, Moxifloxacin, Neuroleptika usw. sorgfältig abzuwägen (siehe Abschnitt 4.4).
4.6 Fertilität, Schwangerschaft und Stillzeit
Aufgrund der Indikation darf Profact Depot 6,3 mg 2-Monatsimplantat nicht bei Frauen angewendet werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Bestimmte unerwünschte Wirkungen (z. B. Schwindel) können die Konzentrationsfähigkeit und das Reaktionsvermögen beeinträchtigen. Dies kann in Situationen, in denen diese Fähigkeiten von besonderer Bedeutung sind (z. B. beim Autofahren, Bedienen von Maschinen oder in ähnlichen Situationen), ein Risiko darstellen. Deshalb sollten die Patienten vor den möglichen Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen bei Auftreten dieser Nebenwirkung gewarnt werden.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Zu Beginn der Behandlung kommt es gewöhnlich zu einem kurzzeitigen Anstieg des SerumTestosteronspiegels, was zu einer vorübergehenden Aktivierung des Tumorgeschehens führen kann mit Folgeerscheinungen wie:
- Auftreten oder Verstärkung von Knochenschmerzen bei Patienten mit Metastasen,
- neurologische Ausfallerscheinungen aufgrund erhöhten Drucks durch den Tumor mit z. B. Muskelschwäche in den Beinen,
- erschwertes Urinieren, Hydronephrose oder Lymphstau,
- Thrombose mit Lungenembolie.
Diese Erscheinungen können weitgehend vermieden werden, wenn in der Anfangsphase der Buserelin-Behandlung gleichzeitig ein Antiandrogen gegeben wird (siehe auch Abschnitt 4.4).
Gutartige, bösartige und unspezifische Neubildungen (einschließlich Zysten und Polypen):
Sehr selten: Unter der Behandlung mit LHRH-Analoga wie Buserelin wurden Hypophysenadenome beschrieben. Sogar bei gleichzeitiger Behandlung mit Antiandrogen sehr selten leichte, vorübergehende Zunahme von Tumorschmerzen.
Erkrankungen des Blutes und des Lymphsystems:
Sehr selten: Thrombopenie, Leukopenie.
Erkrankungen des Immunsystems:
Gelegentlich: Überempfindlichkeitsreaktionen wie Hautrötung, Juckreiz, Hautausschläge (einschließlich Urtikaria).
Selten: schwere Überempfindlichkeitsreaktionen mit Bronchospasmus und allergischem Asthma mit Atemnot sowie in Einzelfällen anaphylaktischer/anaphylaktoider Schock.
In Fällen von anaphylaktischen/anaphylaktoiden Reaktionen kann eine chirurgische Entfernung des Implantats notwendig sein.
Stoffwechsel- und Ernährungsstörungen:
Sehr selten: verstärkter Durst, veränderter Appetit, Reduktion der Glukosetoleranz (kann bei Diabetikern zu einer Verschlechterung der Stoffwechseleinstellung führen).
Psychiatrische Erkrankungen:
Häufig: Libidoverlust, Stimmungsschwankungen und Depressionen (Langzeitanwendung). Gelegentlich: Stimmungsschwankungen und Depressionen (Kurzzeitanwendung).
Selten: Nervosität, emotionale Labilität, Angstgefühle.
Erkrankungen des Nervensystems:
Häufig: Kopfschmerzen.
Gelegentlich: Benommenheit, Schwindel.
Selten: Schlafstörungen, Gedächtnis- und Konzentrationsstörungen.
In Einzelfällen wurden bei anderen Darreichungsformen von Buserelin Parästhesien beobachtet. Augenerkrankungen:
Sehr selten: Sehstörungen (z. B. Verschwommensehen) und Druckgefühl hinter den Augen.
Erkrankungen des Ohrs und des Labyrinths:
Sehr selten: Tinnitus, Hörstörungen.
Herzerkrankungen:
Selten: Herzklopfen.
Nebenwirkungen aus Anwendungserfahrungen mit nicht bekannter Häufigkeit: QT-Verlängerung (siehe Abschnitte 4.4 und 4.5).
Gefäßerkrankungen:
Häufig: Hitzewallungen.
Selten: Verschlechterung des Blutdruckniveaus bei Patienten mit Bluthochdruck.
Erkrankungen des Gastrointestinaltrakts:
Gelegentlich: Verstopfung.
Selten: Übelkeit, Erbrechen, Durchfall.
Erkrankungen der Haut und des Unterhautzellgewebes:
Selten: Zu- oder Abnahme der Kopf- und Körperbehaarung.
Skelettmuskulatur-. Bindegewebs- und Knochenerkrankungen:
Sehr selten: Beschwerden und Schmerzen des Bewegungsapparates.
Die Anwendung von LHRH-Analoga kann zu einer Abnahme der Knochendichte und zu einer Osteoporose sowie zu einem erhöhten Risiko für Knochenbrüche führen. Das Risiko von Frakturen am Skelettsystem steigt mit zunehmender Therapiedauer.
Erkrankungen der Geschlechtsorgane und der Brustdrüse:
Häufig: Verlust der Potenz. Hodenatrophie.
Gelegentlich: Gynäkomastie (schmerzfrei).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Häufig: Schmerzen oder andere lokale Reaktionen (z. B. Rötung. Schwellung) an der Injektionsstelle. Gelegentlich: Ödeme (schwach ausgeprägt) an den Knöcheln und Unterschenkeln. Müdigkeit.
Sehr selten: Verschlechterung des Allgemeinbefindens.
Untersuchungen:
Gelegentlich: Erhöhung von Serum-Leberenzymwerten (z. B. Transaminasen). Gewichtszunahme oder -abnahme.
Selten: Veränderungen der Blutfettwerte. Erhöhung des Serum-Bilirubinwertes.
Die meisten der oben genannten Nebenwirkungen sind direkt oder indirekt eine Folge der Testosteronunterdrückung durch Buserelin (Androgenmangel-Symptome).
Pharmakoepidemiologische Daten deuten darauf hin. dass der Entzug von Androgenen das Risiko für Herz-Kreislauf-Erkrankungen. Diabetes mellitus und Anämie (Häufigkeit nicht bekannt) erhöht (siehe Abschnitt 4.4).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert. jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Symptome
Es wurde keine Intoxikation oder Überdosierung mit Buserelin beobachtet. Die möglichen Symptome einer Überdosierung von Buserelin sind erwartungsgemäß ähnlich wie die Nebenwirkungen, die bei normaler Anwendung auftreten können wie Schwäche, Kopfschmerzen, Nervosität, Hitzewallungen, Schwindel, Übelkeit, Bauchschmerzen, Ödeme an den unteren Extremitäten und Mastodynie sowie lokale Reaktionen an der Injektionsstelle (siehe Abschnitt 4.8).
Therapiemaßnahmen
Falls die Behandlung einer Überdosierung erforderlich ist, sollte sie sich an den Symptomen orientieren.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Gonadotropin-Releasing-Hormon-Analoga,
ATC-Code: L02AE01.
Wirkmechanismus
Buserelin ist ein hochaktives Analogon des natürlichen Gonadotropin-Releasing-Hormons (Gonadorelin; GnRH, LHRH). Der pharmakologische Effekt von Buserelin besteht initial in einer Stimulierung der Gonadotropinfreisetzung und der Testosteronsekretion. Danach folgt eine fortschreitende Abnahme von Testosteron bis in den Bereich einer Kastration.
Während die Gonadotropinfreisetzung unter der weiteren Behandlung mit Buserelin gehemmt wird, wird die Sekretion der anderen hypophysären Hormone (Wachstumshormon, Prolaktin, ACTH, TSH) nicht direkt beeinflusst. Die Sekretion der Nebennierensteroide bleibt unverändert.
Hinsichtlich des Ausschaltens der Testosteronstimulierung von Tumorgewebe ist Buserelin der Orchiektomie bei der Behandlung des Prostatakarzinoms gleichwertig.
5.2 Pharmakokinetische Eigenschaften
Resorption und Verteilung
Die Freisetzung von Buserelin aus dem Implantat wird durch den Abbau der Polymermatrix gesteuert. Das Freisetzungsprofil ist zweiphasig; der initialen Freisetzung (tmax < 1 Tag) folgt eine Phase mit einer langsamen, gleichmäßigen Freisetzung während des 2-monatigen Dosierungsintervalls (Dosierung 6,6 mg). Die Bioverfügbarkeit von Buserelin aus dem Implantat nach subkutaner Injektion beträgt etwa 50 %. Die systemischen Buserelin-Spiegel sind ausreichend, um während des gesamten Dosierungsintervalls eine Suppression des Testosterons bis in den Kastrationsbereich zu bewirken.
Buserelin zirkuliert im Serum vorwiegend in intakter, aktiver Form. Die Proteinbindung beträgt etwa 15 %. Nach präklinischen Daten reichert sich Buserelin vorzugsweise in Leber und Nieren sowie im Hypophysenvorderlappen - dem biologischen Zielorgan - an.
Biotransformation
In-vitro-Untersuchungen zeigten, dass Buserelin durch Peptidasen (Pyroglutamylpeptidase und chymotrypsinartige Endopeptidasen) in der Leber und in den Nieren inaktiviert wird. In der Hypophyse wird rezeptorgebundenes Buserelin durch membranständige Enzyme inaktiviert.
Elimination
Buserelin und seine inaktiven Metaboliten werden über die Nieren und - wie Tierversuche zeigen -auch über die Galle ausgeschieden.
5.3 Präklinische Daten zur Sicherheit
Die präklinischen Daten ergeben sich aus den bekannten pharmakologischen und endokrinologischen Wirkungen von Buserelinacetat. In den üblichen In-vitro- oder In-vivo-Tests wurde keine Genotoxizität beobachtet. Buserelinacetat-Implantate haben in Tierversuchen eine gute lokale Verträglichkeit gezeigt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Poly(glykolsäure-co-milchsäure) (1:3).
6.2 Inkompatibilitäten
Nicht zutreffend, da das Produkt in einem speziellen Applikator dargeboten wird.
6.3 Dauer der Haltbarkeit 3 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 30 °C lagern.
6.5 Art und Inhalt des Behältnisses
Fertigspritze mit einem stäbchenförmigen Implantat aus zwei Stäbchen in einem Einweg-Applikator, der aus Cellulosepropionat und rostfreiem Edelstahl besteht und sich in einem versiegelten Beutel aus einer Polyethylenterephthalat-/Aluminium-/LDPE-Verbundfolie befindet.
Packungsgröße: Packungen mit 1 Fertigspritze
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Handhabungshinweise
Bitte beachten Sie:
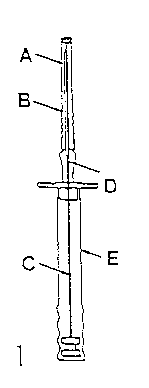
Um zu vermeiden, dass die Implantatstäbchen aus der Injektionsnadel (A) herausfallen, halten Sie den Applikator bis unmittelbar vor der Punktion senkrecht mit der Nadel nach oben.
A: Injektionskanüle B: Schutzkappe der Nadel C: Spritzenstempel D: Implantat
E: Schutzhülle des Spritzenstempels
1. Uberprüfen Sie nach Öffnen der Verpackung und Entnahme des Applikators, ob die 2
Implantatstäbchen im Sichtfenster des Griffstücks vorhanden sind. Gegebenenfalls sind sie durch leichtes Klopfen mit dem Finger auf die Schutzkappe der Injektionskanüle in das Sichtfenster zurückzubewegen. Der Applikator sollte sofort nach dem Öffnen der Verpackung benutzt werden.
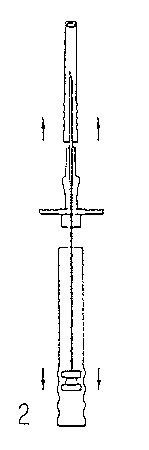
2. Desinfizieren Sie die Injektionsstelle im Bereich der seitlichen Bauchwand. Anschließend
entfernen Sie zunächst die Schutzhülse des Spritzenstempels (E) und dann die Schutzkappe der Injektionsnadel (B).
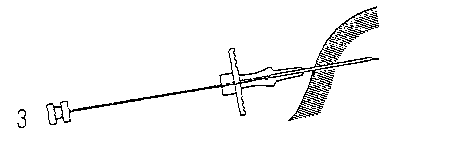
3. Heben Sie eine Hautfalte an, und fuhren Sie die Nadel etwa 3 cm weit in das Subkutangewebe ein (halten Sie den Applikator unmittelbar vor der Punktion in einer waagerechten Position oder mit der Nadelspitze leicht aufwärts gerichtet). Ziehen Sie den Applikator vor der Injektion der Implantate um 1-2 cm zurück.
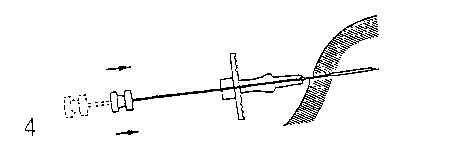
4. Injizieren Sie die Implantatstäbchen in das Subkutangewebe, indem Sie den Spritzenstempel vollständig vorschieben. Komprimieren Sie beim Zurückziehen der Nadel den Stichkanal, um die Stäbchen im Gewebe festzuhalten.
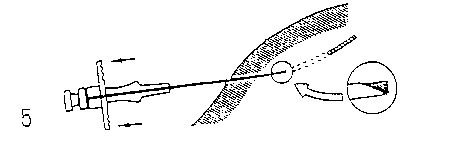
5. Um sicherzustellen, dass beide Implantate injiziert wurden, prüfen Sie, ob die Spitze des Spritzenstempels an der Nadelspitze sichtbar ist.
7. INHABER DER ZULASSUNG
Sanofi-Aventis Deutschland GmbH 65926 Frankfurt am Main
Postanschrift:
Postfach 80 08 60 65908 Frankfurt am Main
Telefon: (01 80) 2 22 20 101
Telefax: (01 80) 2 22 20 111
E-Mail: medinfo.de@sanofi.com
Mitvertrieb:
APOGEPHA Arzneimittel GmbH Kyffhäuserstr. 27 01309 Dresden Telefon: 0351 3363-3 Telefax: 0351 3363-440 E-Mail: info@apogepha.de
8. ZULASSUNGSNUMMER
35484.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 23. August 1995 Datum der letzten Verlängerung der Zulassung: 08. Juli 2005
10. STAND DER INFORMATION
Juni 2015
11. VERKAUFSABGRENZUNG V erschreibungspflichtig.
10
0,06 €/Anruf (dt. Festnetz); max. 0,42 €/min (Mobilfunk).