Pulmicort Topinasal 64 Μg
Fachinformation
(Zusammenfassung der Merkmale des Arzneimittels/SmPC)
1. Bezeichnung des Arzneimittels
Pulmicort® Topinasal® 64 gg 64 Mikrogramm; Nasenspray, Suspension
2. Qualitative und quantitative Zusammensetzung
1 ml Suspension enthält:
1,28 mg Budesonid 1 Sprühstoß enthält:
64 Mikrogramm Budesonid
Sonstiger Bestandteil mit bekannter Wirkung: Kaliumsorbat Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. Darreichungsform
Nasenspray, Suspension
4. Klinische Angaben
4.1 Anwendungsgebiete
- Behandlung und Vorbeugung von saisonaler allergischer Rhinitis (Heuschnupfen, bedingt durch Blüten- und/oder Graspollen)
- Behandlung von perennialer allergischer Rhinitis (z. B. Hausstaubmilben-, Schimmelpilz-, Nahrungsmittel-, Berufs- und anderen Allergien)
- Behandlung von Nasenpolypen
4.2 Dosierung und Art der Anwendung
Die Dosierung sollte individuell erfolgen. Der Patient sollte darüber informiert werden, dass die volle Wirkung von Budesonid erst nach einigen Behandlungstagen eintritt. Er sollte auf die niedrigste Dosis, mit der eine effektive Kontrolle der Symptome erreicht werden kann, eingestellt werden.
Allergische Rhinitis
Anfangsdosis
Erwachsene, Jugendliche und Kinder ab 6 Jahren:
Die empfohlene Anfangsdosis von 256 Mikrogramm kann einmal täglich morgens oder auf zwei Dosen verteilt jeweils morgens und abends verabreicht werden:
1- mal täglich morgens 2 Sprühstöße Pulmicort Topinasal 64 pg in jedes Nasenloch oder
2- mal täglich (morgens und abends) 1 Sprühstoß Pulmicort Topinasal 64 pg in jedes Nasenloch.
Bei Kindern sollte die Behandlung unter Anleitung eines Erwachsenen erfolgen.
Mit der Behandlung einer saisonalen allergischen Rhinitis sollte nach Möglichkeit begonnen werden, bevor der Patient Allergenen ausgesetzt ist.
Eine Begleittherapie kann manchmal notwendig sein, um die durch die Allergie am Auge verursachten Symptome zu behandeln.
Erhaltungsdosis
Die erwünschte klinische Wirkung stellt sich innerhalb von ca. 1 - 2 Wochen ein. Danach sollte die niedrigste Dosis gewählt werden, die den Patienten noch symptomfrei hält.
Bei einer Dosis größer als 256 Mikrogramm ist keine bessere Wirksamkeit zu erwarten.
Nasenpolypen
Die empfohlene Dosis zur Behandlung von Nasenpolypen beträgt 256 Mikrogramm und kann einmal täglich morgens oder auf zwei Dosen verteilt jeweils morgens und abends verabreicht werden:
1- mal täglich morgens 2 Sprühstöße Pulmicort Topinasal 64 pg in jedes Nasenloch oder
2- mal täglich (morgens und abends) 1 Sprühstoß Pulmicort Topinasal 64 pg in jedes Nasenloch.
Nachdem sich die erwünschte klinische Wirkung eingestellt hat, sollte die niedrigste Dosis gewählt werden, die den Patienten noch symptomfrei hält.
Art der Anwendung
1. Nase putzen.
2. Flasche schütteln. Braune Schutzkappe des Pumpsprays abnehmen (Abb. 1).
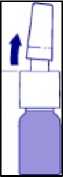
Abb. 1
3. Halten Sie die Flasche so wie in der Abbildung 2 gezeigt.
Vor der ersten Anwendung muss der Pumpmechanismus mehrmals betätigt werden, bis ein homogener Sprühnebel abgegeben wird. Dieser Vorgang ist zu wiederholen, wenn das Pumpspray mehr als 24 Stunden nicht benutzt wurde. Wendet man Pulmicort Topinasal 64 ^g in kürzeren Zeitabständen an, reicht es aus, den Pumpmechanismus nur 1-mal vorab zu betätigen.
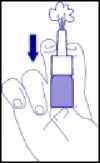
Abb. 2
4. Wie in Abbildung 3 dargestellt, Sprührohr in das linke und rechte Nasenloch einführen und jeweils die verordnete Anzahl an Sprühstößen einsprühen.
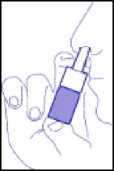
Abb. 3
5. Braune Schutzkappe wieder aufsetzen.
Die oberen Plastikteile sind regelmäßig zu reinigen:
Hierzu wird die braune Schutzkappe entfernt und der weiße Nasenapplikator vom Vorratsbehälter abgezogen. Die Schutzkappe und der Nasenapplikator werden dann in warmem Wasser gereinigt und nach Trocknung wieder auf den Vorratsbehälter aufgesteckt.
Der Nasenapplikator soll nicht mit Nadeln oder anderen scharfen, spitzen Gegenständen gereinigt werden.
Dauer der Anwendung
Um einen guten Behandlungserfolg zu gewährleisten, ist es wichtig, Pulmicort Topinasal 64 ^g regelmäßig (z. B. während der Pollensaison) anzuwenden.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Bei Infektionen der Nase durch Bakterien oder Pilze sollte Pulmicort Topinasal 64 ^g nur angewendet werden, wenn eine begleitende antibakterielle oder pilzbeseitigende Behandlung durchgeführt wird.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Eine verminderte Leberfunktion beeinflusst die Elimination von Kortikosteroiden, wodurch es zu einer reduzierten Eliminationsrate und einer erhöhten systemischen Exposition kommt. Auf mögliche systemische Wirkungen ist zu achten. Die intravenöse Pharmakokinetik von Budesonid ist jedoch bei Patienten mit Zirrhose und bei gesunden Probanden annähernd gleich. Die Pharmakokinetik nach oraler Einnahme von Budesonid wurde durch eine geschädigte Leberfunktion beeinträchtigt, was sich in einer erhöhten systemischen Verfügbarkeit zeigt. Dies ist jedoch für Pulmicort Topinasal 64 ^g nur von begrenzter klinischer Relevanz, da nach der nasalen Anwendung nur ein relativ geringer oraler Anteil systemisch verfügbar ist.
Besondere Vorsicht ist bei Patienten mit aktiver oder inaktiver Lungentuberkulose sowie bei Patienten mit Pilz- oder Virusinfektionen in den Atemwegen erforderlich.
Nasal anzuwendende Glukokortikoide können systemische Nebenwirkungen verursachen, insbesondere wenn hohe Dosen über einen längeren Zeitraum verschrieben werden. Das Auftreten dieser Nebenwirkungen ist jedoch viel unwahrscheinlicher als bei oralen Glukokortikoiden und kann bei einzelnen Patienten und verschiedenen Glukokortikoid-haltigen Formulierungen unterschiedlich ausfallen. Mögliche systemische Wirkungen können Cushing-Syndrom, cushingoide Symptome, Funktionsminderung der Nebennieren, Wachstumsverzögerung bei Kindern und Jugendlichen, Katarakt und Glaukom sein. Seltener können psychologische Effekte oder Verhaltensstörungen einschließlich psychomotorischer Hyperaktivität, Schlafstörungen, Angstzuständen, Depressionen oder Aggressionen (besonders bei Kindern) auftreten.
Die Langzeiteffekte nasaler Glukokortikoide bei Kindern sind nicht vollständig bekannt. Es wird empfohlen, regelmäßig die Körpergröße von Kindern zu kontrollieren, die unabhängig von der Art der Anwendung eine längerfristige Behandlung mit einem Glukokortikoid erhalten. Der Nutzen der Behandlung mit einem Glukokortikoid ist gegen die Möglichkeit einer Wachstumsverzögerung abzuwägen. Ist das Wachstum verlangsamt, sollte die Indikationsstellung überprüft und die Dosierung des nasalen Glukokortikoids auf die niedrigste Dosierung reduziert werden, die noch eine effektive Kontrolle der Symptome gewährleistet. Zusätzlich sollte die Überweisung des Kindes bzw. Jugendlichen an einen Spezialisten für pädiatrische Pneumologie in Betracht gezogen werden.
Es wurde über eine Wachstumsverzögerung bei Kindern berichtet, die nasale Kortikoide in zugelassenen Dosen erhielten.
Wechsel der Art der Anwendung
Vorsicht ist geboten, wenn Patienten von systemischer Steroidbehandlung auf Pulmicort Topinasal umgestellt werden und wenn es Gründe gibt, anzunehmen, dass deren Nebennierenfunktion eingeschränkt ist.
Bei Überschreitung der empfohlenen Dosierung kann eine klinisch relevante Funktionsminderung der Nebennierenrinde mit einer verminderten Produktion bzw. einer bei erhöhtem Bedarf (Stresssituation) nicht mehr ausreichend steigerbaren Produktion körpereigener Glukokortikoide auftreten. In solchen Fällen sollte in Stresssituationen (z. B. vor Operationen) eine vorübergehende zusätzliche Glukokortikoidgabe zum Ausgleich der verminderten natürlichen Glukokortikoidproduktion erwogen werden.
Kaliumsorbat kann örtlich begrenzte Hautreizungen (z. B. Kontaktdermatitis) hervorrufen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es sind keine Wechselwirkungen zwischen Budesonid und anderen Arzneimitteln zur Behandlung von Rhinitis beobachtet worden.
Der Metabolismus von Budesonid erfolgt in erster Linie über CYP3A4. Inhibitoren dieses Enzyms, z. B. Ketoconazol, Itraconazol, Ciclosporin, Ethinylestradiol und Troleandomycin, können daher die systemische Verfügbarkeit von Budesonid um ein Vielfaches erhöhen. Die Kombination sollte vermieden werden, da keine Daten vorliegen auf die sich eine Dosierungsempfehlung stützen könnte. Wenn dies nicht möglich ist, sollte der Zeitraum zwischen den entsprechenden Therapien so lang wie möglich sein. Eine Reduzierung der Budesonid-Dosis kann ebenfalls in Erwägung gezogen werden. Im Rahmen der Kurzzeitbehandlung hat dies eine geringe klinische Bedeutung. Die gleichzeitige Gabe von Cimetidin und Budesonid kann zu einer leichten Anhebung des Budesonid-Plasmaspiegels führen, die klinisch jedoch keine Bedeutung hat.
Bei Frauen, die auch Östrogene oder orale Kontrazeptiva erhielten, sind erhöhte KortikoidPlasmaspiegel und verstärkte Kortikoidwirkungen beobachtet worden. Allerdings wurden keine signifikanten Veränderungen bei gleichzeitiger Einnahme von Budesonid und einem niedrig dosierten oralen Kombinationskontrazeptivum festgestellt.
Aufgrund einer möglichen Funktionsminderung der Nebennieren kann ein ACTH-Stimulationstest zur Diagnose von Hypophyseninsuffizienz falsche Ergebnisse zeigen (niedrige Werte).
4.6 Schwangerschaft und Stillzeit
Schwangerschaft
Ergebnisse aus prospektiven epidemiologischen Studien sowie weltweite Erfahrungen nach der Markteinführung haben kein erhöhtes Risiko für die Anwendung von inhalativ oder nasal appliziertem Budesonid in der frühen Phase der Schwangerschaft ergeben. Wie bei anderen Arzneimitteln erfordert die Anwendung von Budesonid während der Schwangerschaft jedoch eine Abwägung des Nutzens für die Mutter gegen das Risiko für den Fetus. Eine Anwendung sollte so kurz wie möglich erfolgen.
Stillzeit
Budesonid geht in die Muttermilch über. Bei Anwendung therapeutischer Dosen von Budesonid sind jedoch keine Auswirkungen auf den Säugling zu erwarten. Budesonid kann daher während der Stillzeit angewendet werden.
Die systemische Exposition von gestillten Säuglingen asthmatischer Mütter, die eine Erhaltungstherapie mit inhalativem Budesonid (200 oder 400 Mikrogramm zweimal täglich) erhalten, ist vernachlässigbar. In einer Studie zur Pharmakokinetik betrug bei beiden Dosierungsstufen die bestimmte tägliche Dosis des Säuglings 0,3 % der täglichen Dosis der Mutter. Die durchschnittliche Plasmakonzentration beim Säugling wurde auf 1/600 der mütterlichen Plasmakonzentration geschätzt, wobei eine vollständige orale Bioverfügbarkeit beim Säugling angenommen wurde. Die Budesonid-Konzentrationen in Plasmaproben des Säuglings lagen alle unterhalb der quantitativen Nachweisgrenze.
Aufgrund von Daten zu inhalativem Budesonid und wegen der linearen pharmakokinetischen Eigenschaften von Budesonid innerhalb des therapeutischen Dosisintervall nach nasaler, inhalativer, oraler und rektaler Anwendung, werden gestillte Kinder vermutlich nur geringen Dosen ausgesetzt.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Budesonid hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Bei Umstellung von einer oralen oder parenteralen Kortikoidtherapie auf Pulmicort Topinasal 64 gg können Begleiterkrankungen außerhalb des Nasenbereiches wieder auftreten, die unter der oralen bzw. parenteralen Kortikoidbehandlung unterdrückt waren. Solche Begleiterkrankungen sind z. B. allergische Bindehautentzündung und allergische Hauterscheinungen. Diese bedürfen gegebenenfalls einer zusätzlichen Behandlung.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: sehr häufig (> 1/10), häufig (> 1/100 bis < 1/10), gelegentlich (> 1/1000 bis < 1/100), selten (> 1/10 000 bis < 1/1000), sehr selten (< 1/10 000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
|
Erkrankungen der Atemwege, des Brustraums und des Mediastinums |
Häufig Sehr selten |
lokale Symptome wie Reizungen der Schleimhaut, hämorrhagische Sekretion und Nasenbluten (unmittelbar nach Anwendung) Perforationen des Nasenseptums, Ulzerationen der Nasenschleimhaut, Dysphonie |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Selten |
Osteoporose (bei lang andauernder Anwendung) |
|
Augenerkrankungen |
Selten |
erhöhter Augeninnendruck (Glaukom) und Linsentrübung (Katarakt) bei lang andauernder Anwendung |
|
Erkrankungen des Immunsystems |
Gelegentlich |
sofortige oder verzögerte Überempfindlichkeitsreaktionen (einschließlich Urtikaria, Ausschlag, Exantheme, Juckreiz, Dermatitis, Angioödeme) |
|
Sehr selten |
anaphylaktische Reaktionen | |
|
Endokrine Erkrankungen |
Selten |
Anzeichen und Symptome, die auf systemische Glukokortikoideffekte hinweisen, einschließlich Funktionsminderung der Nebennieren und Wachstumsverzögerung bei Kindern (siehe Abschnitt 4.4) |
Nasal anzuwendende Glukokortikoide können systemische Nebenwirkungen verursachen, insbesondere wenn hohe Dosen über einen längeren Zeitraum verschrieben werden (siehe Abschnitt 4.4).
Kinder und Jugendliche
Es wurde über Wachstumsverzögerungen bei Kindern berichtet, die mit nasalen Glukokortikoiden behandelt wurden. Aufgrund des Risikos von Wachstumsverzögerungen bei Kindern sollte das Wachstum, wie in Abschnitt 4.4 beschrieben, überwacht werden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Eine akute Überdosierung mit Pulmicort Topinasal 64 ^g, die Gegenmaßnahmen erforderlich macht, ist praktisch nicht möglich, selbst bei einmaliger Anwendung aller entnehmbaren Dosen von Pulmicort Topinasal 64 ^g. Es ist nicht zu erwarten, dass akute Überdosierungen mit Budesonid klinisch relevant sind. Wird Pulmicort Topinasal 64 ^g über einen langen Zeitraum (über Monate) in einer Dosierung angewendet, die die empfohlene Dosierung überschreitet (siehe 4.2), ist das Auftreten von Nebenwirkungen möglich.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Topisches Glukokortikoid
ATC-Code: R01A D05
Budesonid ist ein Glukokortikoid mit hoher lokaler Kortikoidwirkung und besitzt eine antientzündliche, antiallergische, antiexsudative und antiödematöse Aktivität.
Durch diese Eigenschaften wird eine verringerte Freisetzung von Mediatoren aus Mastzellen, Basophilen aber auch Makrophagen an der Nasenschleimhaut erreicht.
Als spezifischer Wirkmechanismus von Budesonid werden folgende Einflussmaßnahmen diskutiert:
Nach der Diffusion ins Gewebe dringt das Steroidmolekül in die Zelle ein und wird dort reversibel an einen Steroidrezeptor gebunden.
Dieser Steroidrezeptorkomplex wirkt direkt oder indirekt auf die Regulation der Transkription bestimmter Gene. Man schätzt die direkte Bindung des Steroidrezeptorkomplexes an die DNA geregelten Gene pro Zelle auf 10 bis 100 (Barnes, 1996). Dabei kommt einer erhöhten Transkription für bestimmte Proteine, wie z. B. der Beta-2-Rezeptoren (permissiver Effekt), durch Bindung des Steroidrezeptorkomplexes an ein Glukokortikoid-responsives Element (+ GRE) eine Bedeutung für den Steroideffekt zu.
Neueste Erkenntnisse lassen den Schluss zu, dass der wesentliche Effekt der inhalativen Steroide über eine indirekte Hemmung der Gentranskription erfolgt, durch Blockierung von Transkriptionsfaktoren wie dem Aktivator-Protein-1 (AP-1) und dem nukleären Faktor-KB (NF-kB). Dadurch wird die Transkription von Entzündungsmediatoren, insbesondere auch der Zytokine, unterbunden. Zytokine steuern ganz wesentlich das entzündliche Geschehen. So wird z. B. durch Interleukin-5 (IL-5) das Knochenmark zur vermehrten Produktion von Eosinophilen angeregt. Gleichzeitig aktiviert Interleukin-5 diese Entzündungszelle und erlaubt ihr Überleben im Lungengewebe. Andere Zytokine, wie z. B. der Tumor-Nekrose-Faktor-a (TNF-a) und Interleukin-1ß (IL-1ß), aktivieren die Transkriptionsfaktoren AP-1 und NF-kB und unterhalten so den Entzündungsprozess.
Aufgrund der raschen Metabolisierung von verschluckten oder in die Blutbahn gelangten Budesonidanteilen in der Leber sind auch bei Langzeitanwendungen in therapeutischen Dosen klinisch relevante unerwünschte systemische Steroideffekte, wie z. B. eine Suppression der körpereigenen Cortisolproduktion, im Allgemeinen nicht zu erwarten.
Kinder und Jugendliche Klinische Wirksamkeit
Die klinische Wirksamkeit von Pulmicort Topinasal wurde bei mehreren tausend Erwachsenen und Kindern beurteilt. Die meisten Studien wurden mit einmal täglich, nasal angewendetem Pulmicort Topinasal in über das Pumpspray abgegebenen Dosen von 32 bis 256 Mikrogramm durchgeführt. Beispiele repräsentativer Studien, die die Anwendung von Pulmicort Topinasal zur Behandlung von Kindern bei saisonaler und perennialer allergischen Rhinitis bewerten, sind unten aufgeführt. Der primäre Wirksamkeitsendpunkt war der kombinierte Nasalsymptom-Score (combined nasal symptom score[CNSS]), welcher die Summe aus einzelnen Scores zu drei nasalen Symptomen (Verstopfung, Sekretfluss und Niesen, jeweils bewertet auf einer Skala von 0-3) darstellt.
Saisonale allergische Rhinitis
Eine 2-wöchige, randomisierte, doppelblinde, Placebo-kontrollierte Studie mit Parallelgruppen beurteilte die Wirksamkeit und Sicherheit von je einmal täglich angewendetem Pulmicort Topinasal 16, 32 und 64 Mikrogramm bei 400 Kindern (im Alter von 2 bis 5 Jahren) mit allergischer Rhinitis (saisonal und perennial). Es gab eine deutliche Reduktion bezüglich der CNSS-Ausgangswerte in allen Behandlungsgruppen, einschließlich der Placebogruppe. Der Unterschied zwischen Pulmicort Topinasal und der Behandlung mit Placebo war statistisch nicht signifikant.
Perenniale allergische Rhinitis
Eine 6-wöchige, randomisierte, doppelblinde, Placebo-kontrollierte Studie mit Parallelgruppen beurteilte die Wirksamkeit und Sicherheit von einmal täglich angewendetem Pulmicort Topinasal 128 Mikrogramm bei 202 Kindern (im Alter von 6 bis 16 Jahren) mit perennialer allergischer Rhinitis.
Die primären Wirksamkeitsendpunkte waren der gemessene CNSS-Wert und der Wert des inspiratorischen Spitzenflusses (peak nasal inspiratory fbw[PNIF]). Pulmicort Topinasal verbesserte sowohl den CNSS- als auch den PNIF-Wert statistisch signifikant gegenüber Placebo. Die Wirkung von Pulmicort Topinasal trat 12 Stunden nach der ersten Dosierung in Bezug auf CNSS und 48 Stunden in Bezug auf PNIF ein.
Klinische Sicherheit
In einer randomisierten, doppelblinden, Placebo-kontrollierten Studie zum Wachstum erhielten 229 vorpubertäre Kinder im Alter von 4 bis 8 Jahren nach einer 6-monatigen Ausgangsperiode über einen Zeitraum von 12 Monaten entweder Pulmicort Topinasal 64 Mikrogramm einmal täglich oder Placebo. In dieser Studie war die Wachstumsgeschwindigkeit in der mit Pulmicort Topinasal und der mit Placebo behandelten Gruppe nach 12 Behandlungsmonaten ähnlich: Der mittlere Unterschied in der Wachstumsgeschwindigkeit (Placebo gegenüber Pulmicort Topinasal) betrug 0,27 cm/Jahr (95 %-Konfidenz-Intervall: -0,07 bis 0,62).
Einfluss auf die Plasmakortisolkonzentration
Die Anwendung von empfohlenen Dosen von Pulmicort Topinasal führt nicht zu klinisch relevanten Veränderungen der basalen Plasmakortisolkonzentration oder der ACTH-Stimulation. Bei gesunden Probanden wurde nach einer kurzzeitigen Anwendung von Pulmicort Topinasal eine dosisabhängige Suppression der Plasmakortisol- und Urinkortisolkonzentration beobachtet.
5.2 Pharmakokinetische Eigenschaften
Die nasale Applikation von Budesonid bei saisonalen und chronischen Rhinitiden führt neben der Resorption über die Nasenschleimhaut auch zu einer gastrointestinalen Resorption des Wirkstoffs, weil bei vermehrter Schleimproduktion in der Nase Wirkstoffanteile zusammen mit dem Sekret verschluckt werden. Der verschluckte Anteil führt aufgrund des hohen First-pass-Effekts für Budesonid nur zu sehr niedrigen Plasmaspiegeln.
Die systemische Verfügbarkeit von Budesonid aus Pulmicort Topinasal 64 pg bezogen auf einen Hub beträgt 33 %. Bei Erwachsenen beträgt die maximale Plasmakonzentration nach Verabreichung von 256 Mikrogramm Budesonid aus Pulmicort Topinasal 64 pg 0,64 nmol/l und wird innerhalb von 0,7 Stunden erreicht. Die Fläche unter der Kurve (AUC) beträgt nach der Verabreichung von 256 Mikrogramm Budesonid aus Pulmicort Topinasal 64 pg 2,7 nmol*h/l bei Erwachsenen.
Das Verteilungsvolumen von Budesonid beträgt ungefähr 3 l/kg. Die Plasmaproteinbindung beträgt im Mittel 85 - 90 %.
Bei klinisch relevanten Dosen ist die Kinetik von Budesonid dosisproportional.
Budesonid wird in sehr hohem Maße (90 %) bei der ersten Leberpassage zu Metaboliten mit niedrigerer Glukokortikosteroidaktivität biotransformiert.
Die Glukokortikosteroidaktivität der Hauptmetaboliten 6-beta-Hydroxybudesonid und 16-alpha-Hydroxyprednisolon beträgt weniger als 1 % der Budesonidaktivität. Budesonid wird hauptsächlich über CYP3A4, eine Untergruppe des Cytochrom-P-450-Systems, metabolisiert. Budesonid unterliegt keiner lokalen metabolischen Inaktivierung in der Nase.
Die Metaboliten werden unverändert oder in konjugierter Form hauptsächlich über die Nieren ausgeschieden. Intaktes Budesonid ist im Urin nicht nachgewiesen worden. Die systemische Clearance von Budesonid ist hoch (bei Erwachsenen ungefähr 1,2 l/min) und die Plasmahalbwertszeit beträgt nach i.v.-Dosierung bei Erwachsenen durchschnittlich 2 - 3 Stunden, bei Kindern um 1,5 Stunden (für weitere Informationen siehe unter Kinder und Jugendliche.
Bei Patienten mit saisonaler und perennialer allergischer Rhinitis hat sich bei Pulmicort Topinasal im Vergleich zu Placebo innerhalb von 10 Stunden nach der ersten Dosis eine Verbesserung der nasalen Symptome gezeigt. Diese Aussage beruht auf zwei doppelblinden, Placebo-kontrollierten, randomisierten, Parallelgruppen-Studien. Eine dieser Studien wurde mit Patienten mit saisonaler allergischer Rhinitis durchgeführt, die in einem Pollenexpositionsraum (Environmental Exposure Unit [EEU]) Beifußpollen ausgesetzt wurden. Die andere 4-wöchige, multizentrische Studie wurde mit Patienten mit perennialer allergischer Rhinitis durchgeführt.
Kinder und Jugendliche
Budesonid hat eine systemische Clearance von ungefähr 0,5 l/min bei asthmatischen Kindern im Alter von 4 bis 6 Jahren. Pro kg Körpergewicht haben Kinder eine Clearance, die ungefähr 50 % größer ist als die bei Erwachsenen. Die terminale Halbwertszeit von Budesonid nach Inhalation beträgt bei asthmatischen Kindern ungefähr 2,3 Stunden. Diese entspricht ungefähr der von gesunden Erwachsenen. Die Fläche unter der Konzentrations-Zeit-Kurve (AUC) beträgt bei Kindern 5,5 nmol*h/l nach der Anwendung von 256 Mikrogramm Budesonid aus Pulmicort Topinasal. Dies zeigt eine höhere systemische Glukokortikosteroid-Exposition bei Kindern als bei Erwachsenen. Bei klinisch empfohlenen Dosen ist die Pharmakokinetik von Budesonid dosisproportional und die Plasma-Exposition korreliert mit dem Gewicht des Patienten. Deshalb sollte dies bei der Festlegung der Dosis für Kinder und Jugendliche in Betracht gezogen werden.
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität
Die akute Toxizität von Budesonid wurde bei verschiedener Applikationsart bei Ratten und Mäusen untersucht. Die nachfolgende Tabelle gibt die Ergebnisse wieder.
|
Spezies |
Applikationsart |
LD50 (mg/kg) |
|
Maus |
oral |
> 800 |
|
Ratte |
subkutan |
20 |
|
Ratte |
oral |
400 |
Subakute und chronische Toxizität
Budesonid wurde inhalativ über 12 Monate bei Hunden und Ratten verabreicht.
Selbst bei 10 - 40fach höheren Dosen als im klinischen Gebrauch wurden keine Zeichen lokaler toxischer Effekte in den Atemwegen beobachtet.
Kanzerogenität
In einer Kanzerogenitätsstudie wurde eine erhöhte Inzidenz von Gliomen im Gehirn männlicher Ratten gefunden, die in einer Wiederholungsstudie nicht verifiziert werden konnte. In dieser Studie unterschied sich die Inzidenz in den mit Verum behandelten Gruppen (Budesonid, Prednisolon, Triamcinolonacetonid) und in der Kontrollgruppe nicht.
Leberveränderungen (vornehmlich hepatozelluläre Neoplasmen), die sowohl in der ersten Kanzerogenitätsstudie als auch in der Wiederholungsstudie für Budesonid gefunden wurden, traten in gleichem Maße auch bei den Referenzglukokortikoiden auf. Diese Effekte sind höchstwahrscheinlich als Rezeptoreffekt zu interpretieren und stellen somit einen Klasseneffekt dar. Entsprechende Veränderungen wurden beim Menschen bisher nicht beobachtet.
Reproduktionstoxikologie
Kortikoide zeigen bei Reproduktionsstudien in Tierversuchen teratogene Aktivitäten (z. B. Gaumenspalte, skelettale Anomalien). Die klinische Relevanz dieser Eigenschaften ist bisher nicht geklärt. Budesonid zeigte bei Nagern die schon von anderen Kortikoiden bekannten Veränderungen.
Mutagenität
Die mutagenen Eigenschaften von Budesonid wurden in sechs unterschiedlichen Testmodellen überprüft. Budesonid zeigte in keinem dieser Tests mutagene oder klastogene Eigenschaften.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Mikrokristalline Cellulose - Carmellose-Natrium (89:11), D-Glucose, Polysorbat 80, Natriumedetat (Ph.Eur.), Kaliumsorbat (Ph.Eur.), Salzsäure 7 % zur pH-Wert-Einstellung, gereinigtes Wasser
6.2 Inkompatibilitäten
Inkompatibilitäten sind bisher nicht bekannt.
6.3 Dauer der Haltbarkeit
2 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 30 °C lagern.
Nicht einfrieren.
Behältnis aufrecht lagern.
6.5 Art und Inhalt des Behältnisses
Braunglasflasche mit Dosierpumpe und Nasenapplikator
Packungsgrößen:
1 Pumpspray zu 6 ml mit mindestens 120 Einzeldosen [N 1]
10 (10 x 1) Pumpsprays zu je 6 ml mit je mindestens 120 Einzeldosen (Klinikpackung)
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
AstraZeneca GmbH 22876 Wedel
Telefon: 0 41 03 / 70 80 Produktanfragen: 0800 22 88 660 Telefax: 0 41 03 / 708 32 93 E-Mail: azinfo@astrazeneca.com
8. Zulassungsnummer
42883.01.00
9. Datum der Erteilung der Zulassung/Verlängerung der Zulassung
20.12.2000/24.03.2010
10. Stand der Information
September 2013
11. Verkaufsabgrenzung
Verschreibungspflichtig