Pulmicort Turbohaler
Fachinformation
(Zusammenfassung der Merkmale des Arzneimittels/SmPC)
1. Bezeichnung des Arzneimittels
Pulmicort® Turbohaler®
200 Mikrogramm/Dosis Pulver zur Inhalation
2. Qualitative und quantitative Zusammensetzung
Eine Einzeldosis zu 0,2 mg Pulmicort Turbohaler enthält 0,2 mg Budesonid. Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. Darreichungsform
Pulver zur Inhalation
4. Klinische Angaben
4.1 Anwendungsgebiete
Glukokortikoid
- Behandlung eines persistierenden Asthma bronchiale, bei dem die Therapie mit inhalativ anzuwendendem Glukokortikoid indiziert ist
- Behandlung einer mittelgradigen bis schweren chronisch obstruktiven Lungenerkrankung (Stadium IIb und III), bei der spirometrisch ein Ansprechen auf inhalativ anzuwendende Glukokortikoide nachgewiesen werden konnte.
Hinweis:
Pulmicort Turbohaler ist nicht zur Behandlung des akuten Asthmaanfalls geeignet.
4.2 Dosierung und Art der Anwendung
Die Dosierung sollte sich an den Erfordernissen des Einzelfalles und dem klinischen Ansprechen des Patienten orientieren. Dabei sollte nach Stabilisierung der Krankheitssymptome auf die niedrigste Erhaltungsdosis, mit der eine effektive Kontrolle des Asthmas aufrechterhalten werden kann, eingestellt werden. Die Tagesdosis sollte in 2 Gaben (morgens und abends) aufgeteilt werden, in besonderen Fällen (mangelnde Wirksamkeit im Dosierungsintervall) kann sie auch auf 3 - 4 Einzelgaben aufgeteilt werden. In der Regel sollte die Tageshöchstdosis bei Kindern von 5 bis 12 Jahren 0,8 mg und bei Jugendlichen und Erwachsenen 1,6 mg Budesonid nicht überschreiten.
Die folgenden Dosierungsangaben können als Richtlinie gelten:
Erwachsene und Jugendliche über 12 Jahre:
Als Standarddosis wird morgens und abends je 1 Hub Pulmicort Turbohaler (= 0,4 mg Budesonid täglich) empfohlen.
Die Maximaldosis beträgt täglich 8 Hübe Pulmicort Turbohaler (= 1,6 mg Budesonid).
Kinder von 5 bis 12 Jahren:
Als Standarddosis wird morgens und abends je 1 Hub Pulmicort Turbohaler (= 0,4 mg Budesonid täglich) empfohlen.
Die Maximaldosis beträgt täglich 4 Hübe Pulmicort Turbohaler (= 0,8 mg Budesonid).
Bei leichtem bis mittelschwerem Asthma kann für Erwachsene und Jugendliche über 12 Jahre und für Kinder von 5 bis 12 Jahren eine Behandlung mit einmal 1 Hub Pulmicort Turbohaler abends (= 0,2 mg Budesonid) ausreichend sein. Diese hat sich in Studien für viele Patienten als wirkäquivalent zu einer zweimal täglichen Gabe von 0,1 mg Budesonid erwiesen.
Bei einer Verschlechterung des Asthmas unter der Einmalgabe ist auf eine zweimal tägliche Gabe umzustellen. Wenn für die Asthmatherapie höhere Dosen als 0,4 mg Budesonid täglich benötigt werden, müssen diese auf jeden Fall in zwei Dosen aufgeteilt werden.
Bei inspiratorischen Flüssen von ca. 35 - 60 l/min durch den Turbohaler®, die von der Mehrzahl der Patienten (auch Kindern) erreicht werden, ist eine für die therapeutische Wirksamkeit ausreichende Deposition gewährleistet. Auch bei inspiratorischen Flüssen unter 35 l/min ist ein therapeutischer Effekt belegt. Die Wirksamkeit von Pulmicort Turbohaler ist der herkömmlicher GlukokortikoidTreibgasdosieraerosole mindestens gleichwertig.
Bei Patienten, die bisher inhalative Steroide aus herkömmlichen Treibgasdosieraerosolen erhalten haben, ist in der stabilen Phase in vielen Fällen eine Dosisreduktion möglich.
Pulmicort Turbohaler sollte regelmäßig in den empfohlenen Zeitabständen eingesetzt werden. Bei Stabilisierung der Krankheitssymptome sollte die tägliche Dosis von Pulmicort Turbohaler bis zur
niedrigst möglichen Erhaltungsdosis reduziert werden. Grundsätzlich ist Pulmicort Turbohaler ein Arzneimittel zur Langzeitbehandlung des Asthma bronchiale.
Bei der Erhaltungstherapie von Asthma können orale Glukokortikoide möglicherweise durch Pulmicort ersetzt werden bzw. deren Dosis signifikant reduziert werden. Bei Beginn der Umstellung von oralen Steroiden zu Pulmicort sollte sich der Patient in einer relativ stabilen Phase befinden. Eine hohe Dosis Pulmicort wird dann in Kombination mit dem vorher eingenommenem Steroid über ungefähr 10 Tage gegeben. Danach sollte die orale Steroiddosis schrittweise (z. B. um 2,5 mg Prednisolon oder dessen Äquivalent jeden Monat) bis zur niedrigsten möglichen Dosis reduziert werden. In vielen Fällen ist es möglich, die orale Steroidgabe komplett durch Pulmicort zu ersetzen. Für weitere Informationen zum Absetzen von Kortikoiden siehe Abschnitt 4.4.
Hinweis:
Um eine falsche Anwendung zu vermeiden, ist eine gründliche Einweisung des Patienten in den korrekten Gebrauch vorzunehmen. Kinder sollten dieses Arzneimittel nur unter Aufsicht eines Erwachsenen anwenden.
Anleitung zur Benutzung von Pulmicort Turbohaler:
Pulmicort Turbohaler ist ein Mehrfachdosis-Inhalator, der sehr geringe Mengen Pulver abgibt (Abb. 1). Wenn durch das Mundstück eingeatmet wird, wird das Pulver in die Lungen transportiert. Daher ist es wichtig, dass tief und kräftig durch das Mundstück eingeatmet wird.

Schutzkap

Mundstück ^
Dosisanzeige
(Fenster)
Dosierrad ^
(Abb. 1)
Wie ein neuer Inhalator zur Anwendung vorzubereiten ist:
Bevor ein Pulmicort Turbohaler-Inhalator zum ersten Mal angewendet wird, muss er wie folgt vorbereitet werden:
- Durchsichtige Schutzfolie vom Pulmicort Turbohaler-Inhalator entfernen, indem diese an der dafür vorgesehenen Stelle (siehe rote Markierungen auf der Schutzfolie) eingerissen wird.
- Schutzkappe abschrauben und abnehmen.
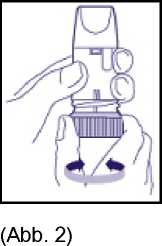
- Inhalationsgerät aufrecht halten. Das braune Dosierrad zeigt nach unten. Mundstück nicht festhalten, wenn das Dosierrad gedreht wird. Dosierrad jeweils bis zum Anschlag in die eine Richtung und dann in die andere Richtung (Abb. 2) drehen. In welche Richtung zuerst gedreht
wird, ist nicht entscheidend. Dabei ist ein Klickgeräusch zu hören. Vorgang wiederholen, d. h. das braune Dosierrad in beide Richtungen drehen.
Der Pulmicort Turbohaler-Inhalator ist jetzt gebrauchsfertig. Um eine Dosis zu inhalieren, ist wie im Folgenden beschrieben fortzufahren.
Wie der Inhalator anzuwenden ist:
Bei jeder Inhalation ist zu beachten:
1. Schutzkappe abschrauben und abnehmen.
2. Inhalationsgerät aufrecht halten. Das braune Dosierrad zeigt nach unten. Mundstück nicht festhalten, wenn das Dosierrad gedreht wird.
3. Vor jeder Inhalation muss aus dem Wirkstoffvorrat eine Einzeldosis bereitgestellt werden, die dann inhaliert werden kann. Dies erfolgt durch einmaliges Hin- und Herdrehen des braunen Dosierrades bis zum Anschlag (Abb. 2). In welche Richtung zuerst gedreht wird, ist nicht entscheidend. Dabei ist ein Klickgeräusch zu hören. Eine Überdosierung ist auch bei versehentlicher Mehrfachbetätigung des Dosierrades nicht möglich.
4. Zunächst ohne das Gerät tief ausatmen, erst dann das Mundstück mit den Lippen umschließen und tief und kräftig durch das Gerät einatmen (Abb. 3). Nicht auf dem Mundstück kauen oder beißen, da die Möglichkeit besteht, dass sich das Mundstück lockert oder ablöst!
Das Gerät darf nicht mehr benutzt werden, wenn es beschädigt ist oder sich das Mundstück von selbst abgelöst hat.
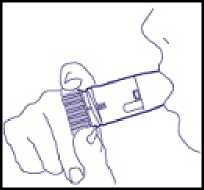
(Abb. 3)
5. Das Gerät vom Mund absetzen und den Atem einige Sekunden anhalten. Nicht durch das Gerät ausatmen!
Falls mehr als eine Inhalation verordnet wurde, sind die Schritte 2 bis 5 zu wiederholen.
6. Schutzkappe unmittelbar nach Gebrauch wieder fest aufschrauben.
Hinweise
Niemals durch das Gerät ausatmen.
Schutzkappe immer unmittelbar nach Gebrauch wieder aufschrauben.
Da jede Dosis nur reinen Wirkstoff enthält und keine Hilfsstoffe, spürt man in den meisten Fällen das Auftreffen der Teilchen auf die Mundschleimhaut nicht. Nur selten tritt ein leicht bitterer Geschmack auf. Auch wenn das Arzneimittel nach der Inhalation möglicherweise weder zu schmecken noch zu spüren ist, kann davon ausgegangen werden, dass die Dosis inhaliert wurde, wenn die Anweisungen befolgt wurden. Um das Risiko einer oropharyngealen Candida-Infektion zu vermindern, sollte der Patient Pulmicort Turbohaler vor einer Mahlzeit anwenden oder nach der Inhalation den Mund ausspülen.
Reinigung des Mundstücks:
Mundstück einmal in der Woche äußerlich nur mit einem trockenen Tuch reinigen. Kein Wasser oder andere Flüssigkeiten benutzen, um das Mundstück zu reinigen.
Wann ist der Inhalt des Gerätes aufgebraucht?
Beim Erscheinen einer roten Markierung in der Dosisanzeige (Fenster) unter dem Mundstück sind noch ca. 20 Inhalationen zulässig (Abb. 4).
Mundstück

rote Markierung
noch 20 Inhalationen zulässig
(Abb. 4)
Erreicht die rote Markierung den unteren Fensterrand, sind diese ca. 20 Einzeldosen verbraucht (Abb. 5).
Darüber hinaus sollte aus technischen Gründen nicht weiter inhaliert werden, obwohl noch eine Restmenge an Wirkstoff im Gerät enthalten ist.
rote Markierung
Das Geräusch, das beim Schütteln des Turbohalers auftritt, wird durch das Trockenmittel verursacht und gibt keine Auskunft über den Füllstand des Turbohaler®.
4.3 Gegenanzeigen
Überempfindlichkeit gegen Budesonid.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Budesonid ist nicht zur Behandlung eines akuten Asthmaanfalls geeignet, bei dem die Anwendung eines schnell wirksamen Bronchodilators notwendig ist.
Besondere Vorsicht ist bei Patienten mit aktiver oder inaktiver Lungentuberkulose erforderlich. Pulmicort Turbohaler soll nur angewendet werden, wenn gleichzeitig eine wirksame tuberkulostatische Therapie durchgeführt wird.
Besondere Vorsicht ist bei Patienten mit Mykosen oder Virusinfektionen im Bereich der Atemwege erforderlich. Pulmicort Turbohaler soll nur angewendet werden, wenn diese angemessen behandelt werden.
Eine Leberfunktionsstörung beeinflusst die Elimination von Kortikosteroiden. Dadurch kommt es bei der Behandlung mit Pulmicort Turbohaler, ähnlich wie unter der Behandlung mit anderen Glukokortikoiden, zu einer reduzierten Eliminationsrate und zu einer Zunahme der systemischen Verfügbarkeit. Auf mögliche systemische Wirkungen ist zu achten, deshalb sollten die Plasmakortisolwerte bei diesen Patienten regelmäßig kontrolliert werden.
Die gleichzeitige Anwendung mit Ketoconazol, HIV-Proteasehemmern oder anderen stark wirksamen CYP3A4-Inhibitoren sollte vermieden werden. Wenn dies nicht möglich ist, sollte der Zeitraum zwischen den entsprechenden Therapien so lang wie möglich (siehe auch Abschnitt 4.5).
Bei Patienten, bei denen eine Notfallbehandlung mit einem hoch dosierten Kortikosteroid oder eine Langzeittherapie mit der empfohlenen Maximaldosis eines inhalativen Kortikosteroids notwendig war, besteht möglicherweise das Risiko einer Funktionsminderung der Nebennieren. Anzeichen und Symptome einer Funktionsminderung der Nebennieren können bei diesen Patienten auftreten,
wenn sie starkem Stress ausgesetzt sind. In Stressphasen (z. B. bei schweren Infektionen, Verletzungen) oder vor geplanten Operationen sollte eine zusätzliche Gabe von systemischen Kortikosteroiden in Erwägung gezogen werden.
Wie bei anderen Inhalationstherapien auch kann es nach der Anwendung von Pulmicort Turbohaler zu einem paradoxen Bronchospasmus mit plötzlicher Verstärkung von pfeifenden Atemgeräuschen kommen. In diesem Fall sollte das inhalative Budesonid umgehend abgesetzt, der Patient ärztlich untersucht und gegebenenfalls eine alternative Therapie eingeleitet werden.
Vereinzelt können während der Anwendung von inhalativ anzuwendenden Kortikosteroiden systemische Nebenwirkungen auftreten, höchstwahrscheinlich in Abhängigkeit von der Dosis, Anwendungsdauer, zusätzlichen oder vorausgegangenen Kortikosteroidtherapien und individuellen Faktoren. Diese Wirkungen sind jedoch bei oralen Kortikosteroiden viel wahrscheinlicher als unter der Inhalationsbehandlung. Mögliche systemische Wirkungen sind Cushing-Syndrom, cushingoide Symptome, Funktionsminderung der Nebennierenrinde, Wachstumsverzögerung bei Kindern und Jugendlichen, verringerte Knochendichte, Katarakt und Glaukom. Seltener können psychologische Effekte oder Verhaltensstörungen einschließlich Hyperaktivität, Schlafstörungen, Angstzuständen, Depressionen oder Aggressionen (besonders bei Kindern) auftreten (siehe Abschnitt 4.8).
Es wird empfohlen, die Körpergröße von Kindern, die über einen längeren Zeitraum mit Kortikoiden zur Inhalation behandelt werden, regelmäßig zu kontrollieren. Bei einer Wachstumsverzögerung sollte die Behandlung hinsichtlich einer Reduktion der inhalativen Kortikosteroiddosis überdacht werden. Der Nutzen der Kortikoidtherapie ist gegen das mögliche Risiko einer Wachstumshemmung sorgfältig abzuwägen. Zusätzlich sollte die Überweisung des Kindes bzw. Jugendlichen an einen Spezialisten für pädiatrische Pneumologie in Betracht gezogen werden.
Bei Wachstumsverzögerung und um mögliche systemische Wirkungen zu verringern, ist es wichtig, dass die Behandlung überprüft und das inhalative Kortikosteroid auf die niedrigste Dosis eingestellt wird, mit der eine wirksame Kontrolle gewährleistet ist.
Um das Risiko einer Candida-Infektion im Mund-Rachen-Bereich zu verringern, sollte Pulmicort Turbohaler vor den Mahlzeiten angewendet oder der Mund nach jeder Inhalation ausgespült werden. Gegebenenfalls kann eine antimykotische Therapie der Candidose und bei einigen Patienten eine Unterbrechung der Behandlung mit Pulmicort Turbohaler erforderlich sein (siehe Abschnitt 4.2).
Pneumonie bei COPD-Patienten
Eine Zunahme der Inzidenz von Pneumonien, einschließlich Pneumonien, die eine Krankenhauseinweisung erfordern, wurde bei COPD-Patienten beobachtet, die inhalative Kortikosteroide erhalten. Es gibt einige Hinweise darauf, dass ein erhöhtes Risiko für Pneumonien mit einer erhöhten Steroid-Dosierung einhergeht. Dies konnte jedoch nicht eindeutig in allen Studien gezeigt werden.
Es gibt keinen eindeutigen klinischen Nachweis für Unterschiede im Ausmaß des Pneumonierisikos innerhalb der Klasse der inhalativen Kortikosteroide.
Ärzte sollten bei COPD-Patienten auf eine mögliche Entwicklung einer Pneumonie achten, da sich die klinischen Merkmale einer solchen Entzündung mit den Symptomen von COPD-Exazerbationen überschneiden.
Risikofaktoren für eine Pneumonie bei COPD-Patienten umfassen derzeitiges Rauchen, höheres Alter, niedrigen Body Mass Index (BMI) und schwere COPD-Ausprägungen.
Sonstige Hinweise
Hinweise für nicht mit Kortikoiden vorbehandelte Patienten:
Bei Patienten, die zuvor keine oder nur gelegentlich eine kurz dauernde Kortikoidbehandlung erhalten haben, sollte die vorschriftsmäßige, regelmäßige Anwendung von Pulmicort Turbohaler nach ca. 1 Woche zu einer Verbesserung der Atmung führen. Starke Verschleimung und entzündliche Veränderungen können allerdings die Bronchien so weit verstopfen, dass Budesonid lokal nicht voll wirksam werden kann. In diesen Fällen sollte die Einleitung der Therapie mit systemischen Kortikoiden (beginnend mit 40 - 60 mg Prednisonäquivalent pro Tag) ergänzt werden. Die Inhalationen werden auch nach schrittweisem Abbau der systemischen Kortikoidgabe fortgesetzt.
Hinweise für die Umstellung kortikoidabhängiger Patienten auf die Inhalationsbehandlung:
Patienten, die systemisch mit Kortikoiden behandelt werden, sollten zu einem Zeitpunkt auf Pulmicort Turbohaler umgestellt werden, an dem ihre Beschwerden unter Kontrolle sind. Bei diesen Patienten, deren Nebennierenrindenfunktion gewöhnlich eingeschränkt ist, muss die systemische Kortikoidgabe allmählich abgesetzt und darf nicht plötzlich unterbrochen werden. Zu Beginn der Umstellung sollte Pulmicort Turbohaler für etwa 1 Woche zusätzlich verabreicht werden. Dann wird die systemische Kortikoidtagesdosis entsprechend dem jeweiligen Ansprechen im Abstand von 1 -2 Wochen um 2,5 mg Prednisonäquivalent herabgesetzt.
Während der Umstellungsphase können bei einigen Patienten unspezifische Beschwerden wie Gelenk- und Muskelschmerzen, Erschöpfung oder Depression auftreten. Wenn in seltenen Fällen Symptome wie Müdigkeit, Kopfschmerzen, Übelkeit und Erbrechen auftreten, sollte ein unzureichender Kortikoideffekt als Ursache in Erwägung gezogen werden. In diesem Fall kann gelegentlich eine zeitweise Erhöhung der Dosis systemisch wirksamer Kortikoide erforderlich sein.
Kommt es innerhalb der ersten Monate nach Umstellung von der systemischen Kortikoidgabe auf die Inhalationsbehandlung zu besonderen Stresssituationen oder Notfällen (z. B. schwere Infektionen, Verletzungen, Operationen), kann eine erneute systemische Gabe von Kortikoiden notwendig werden.
Nach Umstellung können Symptome auftreten, die durch die vorhergehende systemische Gabe von Glukokortikoiden unterdrückt waren, wie z. B. allergische Rhinitis, allergische Ekzeme, rheumatoide Beschwerden. Diese Symptome sollten mit geeigneten Arzneimitteln zusätzlich behandelt werden.
Exazerbation der Krankheitssymptome durch akute Atemwegsinfektionen:
Bei Verschlimmerung der Krankheitssymptome durch akute Atemwegsinfektionen ist die Gabe entsprechender Antibiotika zu erwägen. Die Dosis von Pulmicort Turbohaler kann gegebenenfalls angepasst werden, unter Umständen ist die systemische Gabe von Glukokortikoiden indiziert.
Die Anwendung von Pulmicort Turbohaler kann bei Dopingkontrollen zu positiven Ergebnissen führen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Pulmicort Turbohaler kann die Wirksamkeit von Beta-2-Sympathomimetika zur Inhalation verstärken.
Der Metabolismus von Budesonid erfolgt in erster Linie über CYP3A4, eine Untergruppe des Cytochrom-P-450-Enzyms. Inhibitoren dieses Enzyms, z. B. Ketoconazol, Itraconazol, Clotrimazol, Ritonavir, Ciclosporin, Ethinylestradiol und Troleandomycin, können daher die systemische Verfügbarkeit von Budesonid um ein Vielfaches erhöhen (siehe Abschnitt 4.4). Die Kombination sollte vermieden werden, da keine Daten vorliegen, auf die sich eine Dosierungsempfehlung stützen könnte. Wenn dies nicht möglich ist, sollte der Zeitraum zwischen den entsprechenden Therapien so lang wie möglich sein. Eine Reduzierung der Budesonid-Dosis kann ebenfalls in Erwägung gezogen werden.
Begrenzte Daten bezüglich dieser Art von Wechselwirkung für hoch dosiertes Budesonid zur Inhalation weisen daraufhin, dass ein deutlicher Anstieg der Plasmaspiegel (im Durchschnitt um das 4fache) auftreten kann, wenn Itraconazol, 200 mg einmal täglich, gleichzeitig mit Budesonid zur Inhalation (Einzeldosis von 1000 Mikrogramm) angewendet wird. In-vivo-Studien haben gezeigt, dass die Gabe von Ketoconazol und Itraconazol einen Anstieg der systemischen BudesonidKonzentration bewirken kann. Dies hat eine geringe klinische Bedeutung bei einer Kurzzeitbehandlung (1-2 Wochen), sollte aber bei Langzeitbehandlungen beachtet werden.
Die gleichzeitige Gabe von Cimetidin und Budesonid kann zu einer leichten Anhebung des Budesonid-Plasmaspiegels führen, die klinisch jedoch keine Bedeutung hat.
Bei Frauen, die auch Östrogene oder orale Kontrazeptiva erhielten, sind erhöhte KortikoidPlasmaspiegel und verstärkte Kortikoidwirkungen beobachtet worden. Allerdings wurden keine signifikanten Veränderungen bei gleichzeitiger Einnahme von Budesonid und einem niedrig dosierten oralen Kombinationskontrazeptivum festgestellt.
Aufgrund einer möglichen Funktionsminderung der Nebennieren kann ein ACTH-Stimulationstest zur Diagnose von Hypophyseninsuffizienz falsche Ergebnisse zeigen (niedrige Werte).
4.6 Schwangerschaft und Stillzeit
Schwangerschaft
Ergebnisse aus prospektiven, epidemiologischen Studien sowie weltweite Erfahrungen nach der Markteinführung konnten größtenteils kein erhöhtes Risiko für das Auftreten von unerwünschten Wirkungen auf die Gesundheit des Fetus / Neugeborenen durch inhalativ angewendetes Budesonid während der Schwangerschaft feststellen. Sowohl für Fetus als auch Mutter ist es wichtig, eine adäquate Asthmatherapie während der Schwangerschaft beizubehalten. Wie bei anderen Arzneimitteln erfordert die Anwendung von Budesonid während der Schwangerschaft jedoch eine Abwägung des Nutzens für die Mutter gegen das Risiko für den Fetus. Eine Anwendung sollte so kurz wie möglich erfolgen. Es ist die zur Aufrechterhaltung einer Asthmakontrolle erforderliche geringste wirksame Dosis an Budesonid einzusetzen.
Stillzeit
Budesonid geht in die Muttermilch über. Bei Anwendung therapeutischer Dosen von Pulmicort Turbohaler sind jedoch keine Auswirkungen auf den Säugling zu erwarten. Pulmicort Turbohaler kann daher während der Stillzeit angewendet werden.
Die systemische Exposition von gestillten Säuglingen asthmatischer Mütter, die eine Erhaltungstherapie mit inhalativem Budesonid (200 oder 400 Mikrogramm zweimal täglich) erhalten, ist vernachlässigbar. In einer Studie zur Pharmakokinetik betrug bei beiden Dosierungsstufen die bestimmte tägliche Dosis des Säuglings 0,3 % der täglichen Dosis der Mutter. Die durchschnittliche Plasmakonzentration beim Säugling wurde auf 1/600 der mütterlichen Plasmakonzentration geschätzt, wobei eine vollständige orale Bioverfügbarkeit beim Säugling angenommen wurde. Die Budesonid-Konzentrationen in Plasmaproben des Säuglings lagen alle unterhalb der quantitativen Nachweisgrenze.
Aufgrund von Daten zu inhalativem Budesonid und wegen der linearen pharmakokinetischen Eigenschaften von Budesonid innerhalb des therapeutischen Dosisintervall nach nasaler, inhalativer, oraler und rektaler Anwendung werden gestillte Kinder vermutlich nur geringen Dosen ausgesetzt.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Budesonid hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: sehr häufig (> 1/10), häufig (> 1/100 bis < 1/10), gelegentlich (> 1/1000 bis < 1/100), selten (> 1/10 000 bis < 1/1000), sehr selten (< 1/10 000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Infektionen und parasitäre Erkrankungen
Häufig: Pneumonie (bei COPD-Patienten), oropharyngeale Candida-Infektion, Risikominimierung durch Anwendung vor einer Mahlzeit oder alternativ Ausspülen des Mundes nach Inhalation
Erkrankungen des Immunsystems
Selten: Sofortige oder verzögerte Überempfindlichkeitsreaktionen (einschließlich Urtikaria, Hautausschlag, Juckreiz, Kontaktdermatitis, Angioödeme und anaphylaktische Reaktionen)
Endokrine Erkrankungen
Selten: Suppression der Hypothalamus-Hypophysenvorderlappen-Nebennierenrinden-Achse, Auftreten weiterer glukokortikoidüblicher Wirkungen
Psychiatrische Erkrankungen
Selten: Verhaltensstörungen, Nervosität, Ruhelosigkeit, Hyperaktivität und Aggressivität (hauptsächlich bei Kindern)
Gelegentlich: Angstzustände*, Depressionen*
Häufigkeit nicht bekannt: Schlafstörungen
Erkrankungen des Nervensystems Gelegentlich: Tremor
Augenerkrankungen Gelegentlich: Katarakt*
Häufigkeit nicht bekannt: Glaukom
Erkrankungen der Atemwege, des Brustraums und des Mediastinums Häufig: Reizungen im Rachenraum, Husten, Heiserkeit Selten: paradoxe Bronchospasmen, Dysphonie
Erkrankungen der Haut und des Unterhautzellgewebes Selten: Blutergüsse
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen Gelegentlich: Muskelkrämpfe Häufigkeit nicht bekannt: Osteoporose
Hinweise
Vereinzelt können während der Anwendung von inhalativ anzuwendenden Kortikosteroiden systemische Nebenwirkungen auftreten, höchstwahrscheinlich in Abhängigkeit von der Dosis, Anwendungsdauer, zusätzlichen oder vorausgegangenen Kortikosteroidtherapien und individuellen Faktoren (siehe Abschnitt 4.4).
Die Stressanpassung kann behindert sein. In Dosen bis zu 0,8 mg Budesonid pro Tag konnte in der Langzeitanwendung bei der Mehrzahl der Patienten keine Suppression der Nebennierenrinde gefunden werden. Bei Dosen bis zu 1,6 mg Budesonid pro Tag ist ein relevanter Effekt nicht auszuschließen. Anzeichen und Symptome, die auf systemische Glukokortikoideffekte hinweisen, einschließlich Funktionsminderung der Nebennieren und Wachstumsverzögerung bei Kindern, sind selten. Aufgrund des Risikos der Wachstumsverzögerung bei Kindern und Jugendlichen sollte das Wachstum wie in Abschnitt 4.4 dargelegt überwacht werden.
*Bei der Zusammenfassung von klinische Prüfungen mit 13.119 Patienten unter der Behandlung mit inhaliertem Budesonid und 7.278 Patienten unter Placebo, ergab sich eine Häufigkeit für das Auftreten von Angstzuständen von 0,52% (inhalatives Budesonid) und 0,63% (Placebo); die Wahrscheinlichkeit für das Auftreten von Depressionen war 0,67% (inhalatives Budesonid) und 1,15% (Placebo). In placebokontrollierten Studien wurde eine Wahrscheinlichkeit für das Auftreten von einer Katarakt unter Placebo von „ gelegentlich“ festgestellt.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome einer Überdosierung
Es ist nicht zu erwarten, dass akute Überdosierungen mit Budesonid, selbst nach sehr hohen Dosen, klinisch relevant sind. Akute Intoxikationen mit Pulmicort Turbohaler sind nicht bekannt.
Bei kurzfristiger Überdosierung kann eine Suppression der Hypothalamus-Hypophysenvorderlappen-Nebennierenrinden-Funktion eintreten. Bei längerfristiger Überdosierung kann es zusätzlich zur Nebennierenrindenatrophie und zu glukokortikoidüblichen Wirkungen, wie einer erhöhten Anfälligkeit für Infektionen, kommen. Die Stressanpassung kann behindert sein.
Therapiemaßnahmen bei Überdosierung
Bei kurzfristiger Überdosierung ist grundsätzlich keine spezielle Notfallbehandlung erforderlich. Bei fortgesetzter Inhalationsbehandlung in vorgeschriebener Dosierung sollte sich die Funktion der Hypothalamus-Hypophysenvorderlappen-Nebennierenrinden-Achse nach ca. 1 - 2 Tagen normalisieren.
In Stresssituationen kann eine „ Kortikoidschutzbehandlung" (z. B. hoch dosierte Gabe von Hydrocortison) erforderlich sein.
Bei Nebennierenrindenatrophie gilt der Patient als steroidabhängig und ist auf die entsprechende Erhaltungsdosis eines systemischen Steroids einzustellen, bis sich der Zustand stabilisiert hat.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Glukokortikoid zur Inhalation, Antiasthmatikum ATC-Code: R03B A02
Budesonid, der Wirkstoff von Pulmicort Turbohaler, ist ein Glukokortikoid mit hoher lokaler Kortikoidwirkung und besitzt eine antientzündliche, antiallergische, antiexsudative und antiödematöse Aktivität. Durch diese Eigenschaften werden folgende Wirkungen im Bronchialbereich erreicht:
1. Hemmung der Bildung, Speicherung und Freisetzung von Mediatoren aus Mastzellen, Basophilen und Makrophagen.
2. Dämpfung der Hyperreagibilität des Bronchialsystems auf exogene Reize.
3. Verminderung der cholinergen Reize und dadurch Abnahme der Sekretproduktion.
4. Abdichtung der epithelialen und endothelialen Membranen.
5. Abnahme der entzündlichen Erscheinungen (Ödem, zelluläre Infiltration).
6. Budesonid normalisiert, wie alle Kortikosteroide, die Ansprechbarkeit auf Beta-2-Sympathomimetika.
Als spezifischer Wirkmechanismus von Pulmicort Turbohaler wird die Induktion spezifischer Proteine, wie z. B. Makrocortin, diskutiert. Die Synthese dieser für die spezifische Wirkung der
Steroide wichtigen Proteine benötigt eine gewisse Zeit und erklärt, dass der volle therapeutische Effekt von Pulmicort Turbohaler nicht sofort eintritt.
Makrocortin greift durch Hemmung der Phospholipase A2 in den Arachidonsäurestoffwechsel ein und verhindert so die Bildung entzündungsauslösender Mediatoren, wie z. B. Leukotriene, Prostaglandine und Thromboxane.
Budesonid hat in Provokationsuntersuchungen einen antianaphylaktischen und antientzündlichen Effekt gezeigt, der zu einer Abnahme der bronchialen Obstruktion sowohl bei der allergischen Sofortreaktion als auch Spätreaktion führt. Budesonid setzt bei Patienten mit hyperreagiblem Bronchialsystem die Empfindlichkeit gegenüber inhalativen Reizen herab und senkt damit die Anfallsbereitschaft. Budesonid ist auch vorbeugend wirksam bei anstrengungsinduziertem Asthma, einer besonderen Form des hyperreagiblen Bronchialsystems.
Nach einer einzigen Dosis wird schon nach wenigen Stunden eine Verbesserung der Lungenfunktion erreicht. Der volle Effekt von Budesonid ist erst nach mehreren Behandlungstagen zu erwarten. Die Wirkdauer einer einzelnen Dosis beträgt ca. 12 Stunden.
Aufgrund der raschen Metabolisierung von verschluckten oder in die Blutbahn gelangten Budesonid-Anteilen in der Leber sind auch bei Langzeitanwendungen in therapeutischen Dosen klinisch relevante unerwünschte systemische Steroideffekte, wie z. B. eine Depression der körpereigenen Kortisolproduktion, nicht zu erwarten.
Studien, in denen gesunde Probanden mit Pulmicort Turbohaler behandelt wurden, haben eine dosisabhängige Wirkung auf die Plasma- und Urinkortisolwerte gezeigt. ACTH-Tests beweisen, dass Pulmicort Turbohaler in den empfohlenen Dosierungen einen signifikant geringeren Einfluss auf die Nebennierenfunktion hat als Prednison 10 mg.
Eine Atrophie der Bronchialschleimhaut wurde auch bei einer Langzeitanwendung nicht beobachtet. Kinder und Jugendliche
Zu Behandlungsbeginn ist eine geringe, in der Regel jedoch vorübergehende Wachstumsreduktion (ca. 1 cm) beobachtet worden, die üblicherweise während des ersten Behandlungsjahres auftritt. Langzeitstudien im Rahmen eines klinischen Praxisalltags deuten darauf hin, dass Kinder und Jugendliche, die mit Budesonid zur Inhalation behandelt werden, im Durchschnitt ihre Zielkörpergröße als Erwachsene erreichen. In einer doppelblinden Langzeitstudie, in der die Budesoniddosis generell nicht auf die geringste, wirksame Dosis titriert wurde, blieben die Kinder und Jugendlichen, die mit Budesonid zur Inhalation behandelt wurden, als Erwachsene jedoch im Durchschnitt 1,2 cm kleiner als diejenigen, die Placebo erhielten. Bezüglich der Titration auf die
geringste, wirksame Dosis und hinsichtlich der Überwachung des Wachstums bei Kindern, siehe Abschnitt 4.4.
Spaltlampenuntersuchungen wurden bei 157 Kindern (im Alter von 5 bis 16 Jahren) durchgeführt, die 3 bis 6 Jahre mit einer durchschnittlichen Tagesdosis von 504 Mikrogramm Budesonid zur Inhalation behandelt wurden. Die Ergebnisse wurden mit 111 gleichaltrigen asthmatischen Kindern verglichen. Budesonid zur Inhalation war nicht mit einem erhöhten Auftreten einer Cataracta subcapsularis posterior verbunden.
5.2 Pharmakokinetische Eigenschaften
Resorption
Nach oraler Inhalation über den Pulmicort Turbohaler werden Spitzenplasmakonzentrationen von Budesonid innerhalb von 30 Minuten erreicht. Die maximale Plasmakonzentration nach wiederholter zweimal täglicher Inhalation einer Dosis von 800 Mikrogramm Budesonid beträgt ca. 4 nmol/l. Die maximale Plasmakonzentration und das Profil der Fläche unter der Konzentrations-Zeit-Kurve erhöht sich linear zur Dosis, ist aber nach wiederholter Dosis (3 Wochen Behandlungsdauer) im Vergleich zur Einmaldosis leicht erhöht (20-30 %). Die Deposition in der Lunge gesunder Probanden wurde auf 34 % + 10 % der abgemessenen Dosis (arithmetisches Mittel + SD) geschätzt, während 22 % im Mundstück verblieben und der Rest (ungefähr 45 % der abgemessenen Dosis) verschluckt wurde. Die biologische Verfügbarkeit des oral verschluckten Anteils liegt bei nur 10 %.
Verteilung
Das Verteilungsvolumen von Budesonid beträgt ungefähr 3 l/kg. Die Plasmaproteinbindung beträgt im Mittel 85-90 %.
Biotransformation
Budesonid wird in sehr hohem Maße (ca. 90 %) bei der ersten Leberpassage zu Metaboliten mit niedrigerer Glukokortikosteroidaktivität metabolisiert. Die Glukokortikosteroidaktivität der Hauptmetaboliten 6-beta-Hydroxybudesonid und 16-alpha-Hydroxyprednisolon beträgt weniger als 1 % der Budesonid-Aktivität. Damit sind systemische Bioverfügbarkeit und Toxizität begrenzt. Budesonid wird hauptsächlich über CYP3A4, eine Untergruppe des Cytochrom-P-450-Systems, metabolisiert.
Elimination
Die Metaboliten werden unverändert oder in konjugierter Form hauptsächlich über die Nieren ausgeschieden. Unverändertes Budesonid ist im Urin nicht nachgewiesen worden. Die systemische Clearance von Budesonid ist bei Erwachsenen hoch (ungefähr 1,2 l/min) und die terminale Plasmahalbwertszeit beträgt nach i.v.-Dosierung bei Erwachsenen durchschnittlich 2-3 Stunden.
Linearität
Bei klinisch relevanten Dosen ist die Pharmakokinetik von Budesonid dosisproportional.
Kinder und Jugendliche
Budesonid hat eine systemische Clearance von ungefähr 0,5 l/min bei asthmatischen Kindern im Alter von 4 bis 6 Jahren. Pro kg Körpergewicht haben Kinder eine Clearance, die ungefähr 50 % größer ist als die bei Erwachsenen. Die terminale Halbwertszeit von Budesonid nach Inhalation beträgt bei asthmatischen Kindern ungefähr 2,3 Stunden. Diese entspricht ungefähr der von gesunden Erwachsenen. Die Plasmakonzentration erreicht den Cmax-Wert (4,85 nmol/l) bei asthmatischen Kindern, die mit Pulmicort Turbohaler behandelt werden (800 Mikrogramm als Einzeldosis), 13,8 Minuten nach Inhalation, wonach sie dann rapide abfällt. Die Fläche unter der Konzentrations-Zeit-Kurve (AUC) betrug 10,3 nmol/l. Der AUC-Wert ist generell vergleichbar mit dem, der bei gleicher Dosis bei Erwachsenen beobachtet wurde, allerdings tendiert der Cmax-Wert bei Kindern zu höheren Werten. Die Deposition in der Lunge bei Kindern (31 % der abgemessenen Dosis) ist ähnlich der, die bei gesunden Erwachsenen gemessen wurde (34 % der abgemessenen Dosis).
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität:
Die akute Toxizität von Budesonid wurde bei verschiedenen Applikationsarten bei Ratten und Mäusen untersucht. Die nachfolgende Tabelle gibt die Ergebnisse wieder:
|
Spezies |
Applikationsart |
LD50 (mg/kg) |
|
Maus |
oral |
> 800 |
|
Ratte |
subkutan |
20 |
|
Ratte |
oral |
400 |
Subakute und chronische Toxizität:
Budesonid wurde Hunden und Ratten inhalativ über 12 Monate verabreicht. Selbst bei 10 - 40fach höheren Dosen als im klinischen Gebrauch wurden keine Zeichen lokaler toxischer Effekte in den Atemwegen beobachtet.
Mutagenes und tumorerzeugendes Potenzial:
Die mutagenen Eigenschaften von Budesonid wurden in sechs unterschiedlichen Testmodellen überprüft. Budesonid zeigte in keinem dieser Tests mutagene oder klastogene Eigenschaften.
In einer Kanzerogenitätsstudie wurde eine erhöhte Inzidenz von Gliomen im Gehirn männlicher Ratten gefunden, die in einer Wiederholungsstudie nicht verifiziert werden konnte. In dieser Studie unterschied sich die Inzidenz in den mit Verum behandelten Gruppen (Budesonid, Prednisolon, Triamcinolonacetonid) und in der Kontrollgruppe nicht.
Leberveränderungen (vornehmlich hepatozelluläre Neoplasmen), die sowohl in der ersten Kanzerogenitätsstudie als auch in der Wiederholungsstudie für Budesonid gefunden wurden, traten in gleichem Maße auch bei den Referenzglukokortikoiden auf. Diese Effekte sind höchstwahrscheinlich als Rezeptoreffekt zu interpretieren und stellen somit einen Klasseneffekt dar.
Reproduktionstoxizität:
Glukokortikoide zeigen bei Reproduktionsstudien in Tierversuchen teratogene Aktivitäten (z. B. Gaumenspalte, skelettale Anomalien). Die klinische Relevanz dieser Eigenschaften ist bisher nicht geklärt. Budesonid zeigte bei Nagern die schon von anderen Glukokortikoiden bekannten Veränderungen; diese waren bei Budesonid im Vergleich zu anderen topischen Kortikoiden jedoch oft weniger ausgeprägt.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Keine
6.2 Inkompatibilitäten
Keine bekannt
6.3 Dauer der Haltbarkeit
Die Dauer der Haltbarkeit beträgt 2 Jahre.
Dieses Arzneimittel soll nach Ablauf des Verfallsdatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 30 °C lagern.
Behältnis fest verschlossen halten, um den Inhalt vor Feuchtigkeit zu schützen.
Bitte nur das verordnete Präparat benutzen und die Inhalatoren nicht untereinander austauschen.
6.5 Art und Inhalt des Behältnisses
Pulmicort Turbohaler ist ein Mehrfachdosis-Pulverinhalator, welcher Pulver zur Inhalation enthält, das durch die Atemluft angesaugt wird.
Der Pulverinhalator besteht aus verschiedenen Kunststoffen.
Originalpackung:
Packung mit 1 Pulverinhalator zu 50 mg Pulver (enthält 100 Einzeldosen zu je 0,2 mg Budesonid) [N 1]
Packung mit 1 Pulverinhalator zu 75 mg Pulver (enthält 200 Einzeldosen zu je 0,2 mg Budesonid) [N 2]
Klinikpackung (gebündelt):
Packung mit 10 (10 x 1) Pulverinhalatoren zu je 50 mg Pulver (1 Pulverinhalator enthält 100 Einzeldosen zu je 0,2 mg Budesonid)
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
AstraZeneca GmbH
22876 Wedel
Telefon: 0 41 03 / 70 80
Produktanfragen: 0800 22 88 660
Telefax: 0 41 03 / 708 32 93
E-Mail: azinfo@astrazeneca.com
8. Zulassungsnummer
28528.00.00
9. Datum der Erteilung der Zulassung/Verlängerung der Zulassung
Datum der Erteilung der Zulassung: 29.11.1993
Datum der letzten Verlängerung der Zulassung: 11.03.2005
10. Stand der Information
Juli 2016
11. Verkaufsabgrenzung
Verschreibungspflichtig