Regaine Frauen Schaum
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels)
1. Bezeichnung des Arzneimittels
Regaine® Frauen Schaum, 50 mg/g Schaum zur Anwendung auf der Haut (Kopfhaut)
2. Qualitative und quantitative Zusammensetzung
1 g Schaum enthält 50 mg Minoxidil.
Sonstige Bestandteile mit bekannter Wirkung: Butylhydroxytoluol (Ph.Eur.)
(E321), Stearylalkohol (Ph.Eur.) und Cetylalkohol (Ph.Eur.).
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Schaum zur Anwendung auf der Haut (Kopfhaut).
Weißer bis fast weißer Schaum.
4. Klinische Angaben
4.1 Anwendungsgebiete
Regaine Frauen Schaum stabilisiert bei Frauen den Verlauf der androgenetischen Alopezie vom weiblichen Typ (charakteristische, anlagebedingte diffuse Kopfhaarverdünnung im Parietalbereich), fördert das Haarwachstum und kann so dem Fortschreiten dieser Alopezie entgegenwirken.
4.2 Dosierung und Art der Anwendung
Haar und Kopfhaut sollten vor der lokalen Anwendung von Regaine Frauen Schaum trocken sein.
Dosierung
Eine Dosis von 1 g (entsprechend dem Volumen einer halben Schutzkappe) Regaine Frauen Schaum sollte 1-mal täglich mit den Fingerspitzen auf die betroffene Kopfhautfläche aufgetragen werden.
Die Dosis von 1 g Schaum pro Tag sollte unabhängig von der Größe der betroffenen Kopfhautfläche nicht überschritten werden.
Kinder/Jugendliche
Regaine Frauen Schaum darf bei Kindern und Jugendlichen unter 18 Jahren nicht angewendet werden, da für diese Patientengruppe keine Ergebnisse zur Wirksamkeit und Sicherheit aus kontrollierten klinischen Studien vorliegen.
Art der Anwendung
Anwendung auf der Haut (Kopfhaut)
• Es ist nicht notwendig, die Haare vor der Anwendung zu waschen.
Um das Behältnis zu öffnen, werden die Pfeile auf Dose und Schutzkappe in eine
Linie übereinander gebracht. Dann Schutzkappe abziehen.
• Das Behältnis wird mit dem Sprühkopf senkrecht nach unten gehalten. Durch Betätigung des Sprühkopfs wird eine Schaummenge entsprechend dem Volumen einer halben Schutzkappe auf die Hand oder auf eine glatte, flache Schale oder Untertasse gesprüht. Die Schaummenge sollte das Volumen einer halben Schutzkappe nicht überschreiten. Dabei kann die Schutzkappe als Vergleichsmaßstab verwendet werden (siehe Abbildungen).
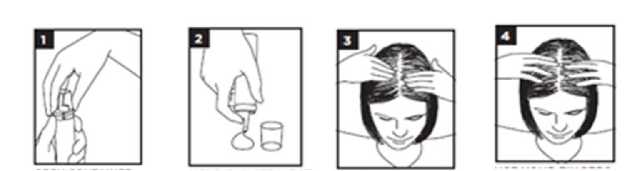
• Der Schaum schmilzt möglicherweise schnell, wenn er in Kontakt mit der warmen Haut kommt. Wenn die Finger warm sind, sollten sie vorher mit kaltem Wasser abgespült werden. Vor Anwendung des Schaums sind die Hände sorgfältig abzutrocknen.
• Insbesondere bei langem Haar kann es sein, dass das Haar mehrfach gescheitelt werden muss, um den Schaum auf die Kopfhaut aufzutragen. Daher bietet es sich an, den Schaum auf eine glatte, flache Schale oder Untertasse zu sprühen.
• Das Haar wird dazu im ausgedünnten Bereich gescheitelt, damit der Schaum auf einen möglichst großen Teil der Kopfhaut verteilt werden kann. Eine ausreichende Menge des Schaums wird mit den Fingerspitzen auf die betroffenen Stellen der Kopfhaut verteilt und beginnend am Hinterkopf Richtung Vorderkopf sanft einmassiert.
• Das Haar wird noch mindestens 2-mal auf jeder Seite vom Mittelscheitel aus gesehen gescheitelt und der restliche Schaum wie oben beschrieben verteilt, bis der ganze Schaum verbraucht ist.
• Nach dem Auftragen des Schaumes sind die Hände und die eventuell verwendete Schale/Untertasse zu waschen, um versehentlichen Kontakt mit Augen und Schleimhäuten zu vermeiden.
Die Dose wird nach jeder Anwendung verschlossen, indem die Schutzkappe wieder auf das Behältnis aufgesetzt wird. Damit ist sie vor dem Zugriff von Kindern geschützt. Nach Auftragen von Regaine Frauen Schaum können die Haare wie gewohnt frisiert und gestylt werden. Um zu vermeiden, dass Regaine Frauen Schaum abgewaschen wird, sollte die Kopfhaut jedoch für ca. 4 Stunden nicht befeuchtet werden.
Dauer der Anwendung
Im Allgemeinen ist eine 1-mal tägliche Behandlung über 3 Monate erforderlich, bevor ein Effekt erkennbar ist. Um die Wirkung aufrecht zu erhalten wird empfohlen, die 1-mal tägliche Anwendung kontinuierlich fortzusetzen. Es wird kein besseres Ergebnis erzielt, wenn Regaine Frauen in größeren Mengen oder öfter als 1-mal täglich angewendet wird. Derzeit liegen ausreichende klinische Erfahrungen über die Wirksamkeit des Schaumes bei Frauen bei Anwendung bis zu 52 Wochen vor. Stellt sich innerhalb von 6 Monaten der gewünschte Behandlungserfolg nicht ein, sollte die Therapie abgebrochen werden.
4.3 Gegenanzeigen
• Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
• Anwendung anderer topischer Arzneimittel auf der Kopfhaut
• plötzlich auftretender oder ungleichmäßiger Haarausfall
• Schwangerschaft
• Stillzeit.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Regaine Frauen Schaum ist hochentzündlich, daher sollte Regaine Frauen Schaum nicht in der Nähe von Feuer oder offener Flamme angewendet werden. Während und unmittelbar nach der Anwendung sollte auch nicht geraucht werden.
Vor einer Behandlung mit Regaine Frauen Schaum sollte die Patientin gründlich untersucht werden und ihre Anamnese abgeklärt werden. Endokrinologische Ursachen, zugrunde liegende Systemerkrankungen oder eine Mangelernährung müssen ausgeschlossen werden. In diesen Fällen ist ggfs. eine spezifische Behandlung einzuleiten. Regaine Frauen Schaum sollte nicht angewendet werden, wenn die Ursache des Haarausfalls nicht bekannt ist, bei fehlenden familiären Hinweisen auf Haarausfall oder Verdünnung der Kopfhaare, bei Haarausfall nach einer Entbindung, bei einer Infektion der Kopfhaut oder wenn die Kopfhaut gerötet oder entzündet ist oder schmerzt.
Wenden Sie Regaine Frauen Schaum nur auf der normalen gesunden Kopfhaut an.
Regaine Frauen Schaum ist nur zur äußerlichen Anwendung auf der Kopfhaut bestimmt. Tragen Sie den Schaum nicht auf andere Körperteile auf.
Die Behandlung mit Regaine Frauen Schaum soll bei Patienten mit Hinweisen auf eine Herz-Kreislauf-Erkrankung oder Herzrhythmusstörungen und bei Bluthochdruckpatienten einschließlich der Patienten, die mit Antihypertonika behandelt werden, nicht erfolgen.
Die Patientin sollte Regaine Frauen Schaum absetzen und einen Arzt aufsuchen, wenn eine Erniedrigung des Blutdrucks festgestellt wird, oder wenn eine oder mehrere der folgenden Erscheinungen auftreten: Brustschmerzen, beschleunigter Herzschlag, Schwächegefühl oder Schwindel, plötzliche unerklärliche Gewichtszunahme, geschwollene Hände oder Füße, anhaltende Rötung oder Reizung der Kopfhaut, oder wenn andere unerwartete neue Symptome auftreten (siehe Abschnitt 4.8).
Um die Wirkung aufrecht zu erhalten, muss die Behandlung kontinuierlich fortgesetzt werden. Nach Absetzen von Minoxidil tritt erneut Haarausfall auf.
Innerhalb der ersten 2 bis 6 Wochen der Behandlung kann es zu einem vorübergehenden Anstieg der Zahl ausgefallener Haare kommen. Dieser Effekt beruht darauf, dass bei den mit Minoxidil behandelten Haarfollikeln die Ruhephase (Telogenphase) des Haarzyklus verkürzt und die Wachstumsphase (Anagenpha-se) schneller erreicht wird. Damit wird das Wachstum neuer Haare stimuliert, diese schieben die „alten" nicht mehr aktiven Haare aus der Kopfhaut aus. So entsteht zunächst der Eindruck eines vermehrten Haarausfalls. Dieser wird jedoch von einem verstärkten Nachwachsen der Haare begleitet. Der Effekt geht innerhalb einiger Wochen zurück und kann als erstes Anzeichen der MinoxidilWirkung interpretiert werden.
Wird Minoxidil auf andere Körperflächen als die Kopfhaut aufgetragen, kann es dort zu unerwünschtem Haarwuchs kommen.
Vereinzelt wurde von Patienten mit sehr hellem Haar bei gleichzeitigem Gebrauch von Haarpflegeprodukten oder nach Schwimmen in stark chlorhaltigem Wasser über geringgradige Veränderungen der Haarfarbe (leichte Blondfärbung) berichtet.
Ein wiederholtes Auftragen von Regaine Frauen Schaum auf das Haar statt auf die Kopfhaut könnte aufgrund der Inhaltsstoffe in Regaine Frauen Schaum zu verstärkter Trockenheit und/oder Steifheit der Haare führen.
Bei versehentlichem Kontakt mit empfindlichen Stellen (Augen, Hautschürfungen, Schleimhäuten) müssen diese mit reichlich kaltem Wasser gespült werden.
Die versehentliche Einnahme kann schwere kardiovaskuläre Nebenwirkungen verursachen. Daher muss dieses Arzneimittel außerhalb der Reichweite von Kindern aufbewahrt werden.
Kinder und Jugendliche
Regaine Frauen Schaum darf bei Kindern und Jugendlichen unter 18 Jahren nicht angewendet werden, da für diese Patientengruppe keine Ergebnisse zur Wirksamkeit und Sicherheit aus kontrollierten klinischen Studien vorliegen.
Regaine Frauen Schaum enthält Butylhydroxytoluol (BHT), Stearylalkohol und Cetylalkohol, die örtlich begrenzt Hautreizungen (z. B. Kontaktdermatitis) hervorrufen können. Butylhydroxytoluol kann darüber hinaus Reizungen der Augen und der Schleimhäute hervorrufen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Derzeit liegen keine Hinweise zu Wechselwirkungen von Regaine Frauen Schaum mit anderen Mitteln vor. Obwohl klinisch nicht nachgewiesen, besteht theoretisch die Möglichkeit, dass durch resorbiertes Minoxidil eine orthostatische Hypotonie bei Patienten, die gleichzeitig periphere Vasodilatatoren einnehmen, verstärkt werden kann.
Regaine Frauen Schaum soll auf der Kopfhaut nicht zusammen mit anderen Dermatika oder mit Substanzen, die die Hautresorption verstärken, angewendet werden.
Pharmakokinetische Arzneimittelwechselwirkungsstudien beim Menschen zeigten, dass die perkutane Resorption von Minoxidil durch Tretinoin und Dithranol durch eine erhöhte Permeabilität des Stratum corneums verstärkt wird. Betame-thasondipropionat erhöht die lokale Gewebekonzentration von Minoxidil und vermindert die systemische Absorption von Minoxidil.
4.6 Fertilität, Schwangerschaft und Stillzeit
Fertilität
Nach subkutaner Gabe (mit einem Vielfachen der Dosis beim Menschen) wurde bei Tieren eine Verminderung der Konzeptionsrate festgestellt (siehe Abschnitt 5.3). Aufgrund der geringen systemischen Exposition nach topischer Anwendung ist dieser Befund für die therapeutische Anwendung von Regaine Frauen Schaum vermutlich nicht relevant.
Schwangerschaft
Es gibt keine einschlägigen kontrollierten Studien an schwangeren Frauen. Studien an Tieren zeigten ein Risiko für den Fetus bei Dosierungen, die weit höher waren, als die für die Anwendung beim Menschen vorgesehenen Dosierungen. Möglicherweise besteht auch für den menschlichen Fetus ein Risiko (siehe Abschnitt 5.3).
Regaine Frauen ist in der Schwangerschaft kontraindiziert (siehe 4.3).
Stillzeit
Systemisch absorbiertes Minoxidil geht in die Muttermilch über. Regaine Frauen ist in der Stillzeit kontraindiziert (siehe 4.3).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es ist nicht zu erwarten, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt wird.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig: Häufig: Gelegentlich: Selten:
Sehr selten: Nicht bekannt:
> 1/10
> 1/100 bis <1/10
> 1/1.000 bis <1/100
> 1/10.000 bis <1/1.000 < 1/10.000
Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar
Die nachfolgende Tabelle enthält Daten zu Nebenwirkungen aus einer placebokontrollierten Studie mit 5 % Minoxidil topischem Schaum einmal täglich an Frauen, aus einer placebo-kontrollierten Studie von 5 % Minoxidil Schaum zweimal täglich an Männern, sowie Daten aus 7 placebo-kontrollierten Studien an Männern und Frauen, die mit topischer Minoxidil-Lösung (2 % und 5 %) behandelt wurden.
|
Systemorganklasse und |
Nebenwirkungen |
|
Häufigkeit |
|
Erkrankungen des Nervensystems | |
|
Sehr häufig |
Kopfschmerzen |
|
Gefäßerkrankungen | |
|
Häufig |
Bluthochdruck |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums | |
|
Häufig |
Dyspnoe |
|
Erkrankungen der Haut und des Unterhautzellgewebes | |
|
Häufig |
Dermatitis, acneiforme Dermatitis, Hautausschlag, Hypertrichose, Juckreiz |
|
Lokale Nebenwirkungen an der Kopfhaut: Stechen / Brennen, Juckreiz, Trockenheit / Schuppung und Follikulitis | |
|
Hypertrichose im Gesicht | |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | |
|
Häufig |
Peripheres Ödem |
|
Untersuchungen | |
|
Häufig |
Gewichtszunahme |
In der aktiv-kontrollierten Studie mit 5% Minoxidil Schaum einmal täglich und 2% Minoxidil Lösung zweimal täglich bei Frauen wurde in beiden Behandlungsgruppen Hypertrichose im Gesicht beobachtet.
Nebenwirkungen seit Markteinführung
Weitere Nebenwirkungen wie sie seit Markteinführung mit Minoxidil-Formulierungen (einschließlich 2 % Lösung, 5 % Lösung und 5 % Schaum bei Männern und Frauen) beobachtet wurden, sind in der nachfolgenden Tabelle aufgeführt. Die Häufigkeitskategorien der Nebenwirkungen basieren dabei
1) auf ihrer Inzidenz in entsprechend durchgeführten klinischen Studien oder epidemiologischen Studien, wenn verfügbar oder
2) ihre Häufigkeit wird gelistet als „Nicht bekannt", wenn keine Häufigkeiten vorliegen.
|
Systemorganklasse und Häufigkeit |
Nebenwirkungen |
|
Erkrankungen des Immunsystems | |
|
Nicht bekannt |
Angioödem (mit Symptomen wie z.B. Ödeme der Lippen, des Mundes, der Zunge und des Rachens, Schwellung der Lippen, der Zunge und des Mundrachenraumes) Hypersensibilität (einschließlich Gesichtsödem, generalisierter Hautausschlag, allgemeiner Juckreiz, Gesichtsschwellung und Enge-gefühl im Hals) Allergische Kontaktdermatitis |
|
Erkrankungen des Nervensystems | |
|
Gelegentlich |
Schwindel |
|
Augenerkrankungen | |
|
Nicht bekannt |
Augenreizungen |
|
Herzerkrankungen | |
|
Nicht bekannt |
Tachykardie Palpitationen |
|
Gefäßerkrankungen | |
|
Nicht bekannt |
Hypotonie |
|
Erkrankungen des Gastrointestinaltrakts | |
|
Gelegentlich |
Übelkeit |
|
Nicht bekannt |
Erbrechen |
Erkankungen der Haut und
|
des Unterhautzellgewebes | |
|
Nicht bekannt |
Beschwerden am Verabreichungsort, die auch die Ohren und das Gesicht betreffen können, wie Juckreiz, Hautreizungen, Schmerzen, Hautrötung, Ödeme, trockene Haut und entzündlicher Hautausschlag bis zur Exfoliation, Dermatitis, Blasenbildung, Blutung und Ulzeration Vorübergehender Haarverlust Veränderungen der Haarfarbe |
|
veränderte Haarstruktur | |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Nicht bekannt |
Schmerzen im Brustbereich |
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des NutzenRisiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Die Anwendung von Regaine Frauen Schaum hat keine Hinweise auf eine entsprechend hohe Resorption des Wirkstoffs Minoxidil gegeben, die zu einer systemischen Wirkung führen könnte. Wenn die Anwendungshinweise befolgt werden, ist eine Überdosierung unwahrscheinlich.
Eine erhöhte Resorption des in Regaine Frauen Schaum enthaltenen Wirkstoffs bedingt durch falsche Anwendung (z. B. die Applikation in höherer Dosierung als empfohlen und auf größere Körperflächen oder andere Körperflächen als die Kopfhaut), patientenspezifische Unterschiede, eine ungewöhnliche Empfindlichkeit oder eine Beeinträchtigung der Hautbarriere aufgrund von Entzündungen oder krankhaften Hautveränderungen der Kopfhaut (z.B. Hautabschürfungen oder Schuppenflechte auf der Kopfhaut) kann jedoch zu systemischen Effekten führen.
Nach Auftragen auf Hautstellen mit beeinträchtigter Hautbarriere kann es möglicherweise zu systemischen Effekten kommen.
Nach versehentlichem Verschlucken kann es aufgrund der Wirkstoffkonzentra tion von Minoxidil in Regaine Frauen zu systemischen Effekten entsprechend der pharmakologischen Wirkung des Wirkstoffs kommen (1 g Regaine Frauen Schaum enthalten 50 mg Minoxidil, was 50 % der maximal empfohlenen Tagesdosis zur Behandlung der Hypertonie entspricht).
Aufgrund der systemischen Wirkungen von Minoxidil kann es zu folgenden Nebenwirkungen kommen:
Herzerkrankungen: beschleunigter Herzschlag, Hypotonie, Lethargie Allgemeine Erkrankungen: Flüssigkeitsansammlung und dadurch plötzliche Gewichtszunahme
Erkrankungen des Nervensystems: Schwindel Behandlung
Bei Überdosierung mit Minoxidil sollte eine symptomatische und unterstützende Behandlung erfolgen.
Klinisch signifikante Tachykardien können mit ß-Rezeptorenblockern, Ödeme mit Diuretika beherrscht werden.
Eine übermäßige Blutdrucksenkung kann durch intravenöse Infusion von physiologischer Kochsalzlösung behandelt werden. Sympathomimetika wie Adrenalin und Noradrenalin sind aufgrund ihrer übermäßigen kardiostimulativen Wirkung zu vermeiden.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Andere Dermatologika. ATC-Code: D11AX01
Wirkmechanismus
Topisches Minoxidil stimuliert das Haarwachstum bei Patienten mit Haarausfall im frühen bis mittleren Stadium (androgenetische Alopezie). Der genaue Wirkungsmechanismus, über den Minoxidil das Haarwachstum stimuliert, ist nicht vollständig bekannt. Jedoch kann Minoxidil den Haarausfall bei androgenetischer Alopezie aufhalten, indem es:
- das Haarwachstum in der Anagenphase stimuliert
- die Anagenphase verlängert
- die Telogenphase verkürzt, wodurch die Anagenphase schneller erreicht wird. Pharmakodynamische Wirkungen
Als peripherer Vasodilatator erhöht Minoxidil die Mikrozirkulation an den Haarfollikeln. Minoxidil stimuliert den Vascular Endothelial Growth Factor (VEGF), der vermutlich für die erhöhte kapillare Durchlässigkeit verantwortlich ist, und weist damit auf eine stark metabolische Aktivität hin, die in der Anagenphase zu beobachten ist.
Bei systemischer Resorption wirkt Minoxidil als peripherer Vasodilatator (siehe Abschnitt 4.9 Überdosierung).
Klinische Studien
Die Wirksamkeit von 5 % Minoxidil Schaum bei Haarausfall vom weiblichen Typ wurde in zwei klinischen Phase-III-Studien bei Frauen untersucht (Studiennr. MINALO3004 bzw. MINALO3005).
In einer radomisierten, aktiv-kontrollierten Doppelblind-Multicenter-Studie wurde die Anwendung von 5 % Minoxidil Schaum einmal täglich gegen Minoxidil 2 % Lösung zweimal täglich über 52 Wochen geprüft.
Als primärer Zielparameter für die Wirksamkeit wurde die Veränderung der Anzahl der Intermediär- und Terminalhaare innerhalb eines definierten Messareals in Woche 24 mittels Makrofotografie ermittelt. Minoxidil 5 % Schaum einmal täglich und Minoxidil 2 % Lösung zweimal täglich führten zu allen Messzeitpunkten zu einer Zunahme der Anzahl der Haare, und zu einer mäßig verbesserten Kopfhautabdeckung nach 24 und 52 Wochen. Studienteilnehmer, die 5 % topischen Minoxidilschaum erhielten, wiesen 24 Wochen nach der Behandlung ein Wachstum von 23,7 Haaren/cm2 (Zunahme um 15,8 %) gegenüber dem Ausgangswert auf, und nach 52 Wochen einen Erhaltungswert von
18,1 Haaren/cm2 (Zunahme um 12,6 % ebenfalls gegenüber dem Ausgangswert). Demgegenüber wiesen Studienteilnehmer unter der Behandlung von 2 % topischer Minoxidillösung nach 24 Wochen ein Wachstum von 23,8 Haaren/cm2 (Zunahme um 16,2 %) gegenüber dem Ausgangswert auf, und nach 52 Wochen einen Erhaltungswert von 19,4 Haaren/cm2 (Zunahme um 13,6 % ebenfalls gegenüber dem Ausgangswert). Der maximale Effekt zeigte sich also nach 24 Wochen.
In der zweiten randomisierten, placebo-kontrollierten Doppelblind-Multicenter-Studie wurde die Anwendung von 5 % Minoxidil Schaum einmal täglich gegen die wirkstofffreie Grundlage jeweils über 24 Wochen geprüft. Die primären Zielparameter für die Wirksamkeit waren die Veränderung der Anzahl der Intermediär- und Terminalhaare innerhalb eines definierten Messareals vor Behandlung und in Woche 24 gemessen mittels Makrofotografie, und die subjektive Bewertung des Behandlungserfolgs mittels Vergleich der Fotografien bewertet in Woche 24 anhand einer 7-Punkt-Skala gegenüber Behandlungsbeginn. Nach 24 Wochen wurde für beide primäre Endpunkte ein moderater aber signifikanter Effekt (p<0.0001) gezeigt, d.h. für die Veränderung der Anzahl der Haare innerhalb eines definierten Messareals und für die Selbstbeurteilung der Kopfhautbedeckung. Nach 24 Wochen wiesen Studienteilnehmer, die 5 % Minoxidilschaum erhielten, ein Wachstum von 13,5 Haaren/cm2 (Zunahme um 9,4 %) gegenüber dem Ausgangswert auf und Studienteilnehmer unter Placebo von 4,0 Haaren/cm2 (Zunahme um 2,7 %). Die Selbstbeurteilung der Veränderung der Kopfhautbedeckung anhand einer 7-Punkt-Skala, wobei 0 für keine Veränderung, -1 bis -3 für eine zunehmende Verschlechterung und +1 bis +3 für eine zunehmende Verbesserung der Kopfhautbedeckung steht, führte zu folgenden Ergebnissen: Nach 24 Wochen der Behandlung wurde in der mit 5 % Minoxidilschaum behandelten Gruppe eine um 0,74 Punkte verbesserte Kopfhautbedeckung beobachtet, während es in der Placebogruppe 0,06 Punkte waren.
Die beiden Wirksamkeitsstudien zeigen, dass bei Frauen mit Haarverlust vom weiblichen Typ die Anwendung von 5 % Minoxidil Schaum einmal täglich nach 12 - 24 Wochen den Haarwuchs fördert, die Bedeckung der Kopfhaut und die Haardichte mäßig verbessert. Der maximale Effekt wurde im Mittel nach 12 bzw. 24 Wochen erreicht. Durch eine weitere Behandlung war keine Zunahme des Effektes zu erzielen.
5.2 Pharmakokinetische Eigenschaften
Resorption
Die pharmakokinetischen Eigenschaften von 5 % topischem Minoxidilschaum wurden in einer zweiarmigen, offenen, randomisierten, Cross-Over-Studie bei Frauen und Männern erhoben.
28 weibliche Studienteilnehmer durchliefen alle Phasen der Studie und wurden in der statistischen Analyse berücksichtigt. Bei Frauen war die systemische Resorption von 5 % topischem Minoxidilschaum einmal täglich vergleichbar mit der der topischen 2 % Minoxidillösung zweimal täglich. Die relative Resorptionsrate des 5 % Minoxidilschaums einmal täglich im Vergleich zu 2 % Minoxidillösung zweimal täglich bezogen auf die AUC betrug 101,9 %, mit einem 90 % Konfidenzintervall von 67,6 % bis 153,7 %; die relative Absorption bezogen auf die Cmax betrug 119,3 %, mit einem 90 % Konfidenzintervall von 90,5 % bis 157,4 %.
Diese Studie zeigte auch, dass die systemische Resorption einer 5 % Schaumformulierung zweimal täglich bei Männern etwa halb so hoch war wie die einer topischen 5 % Minoxidillösung zweimal täglich. Bei Anwendung des Schaums war die durchschnittliche AUC (0 - 12 h) 8,81 ng * h/ml bzw. Cmax 1,11 ng/ml und betrug damit nur etwa 50 % der AUC (0 - 12 h) bzw. Cmax bei Anwendung der Lösung (18,71 ng * h/ml bzw. 2,13 ng/ml). Die Zeit bis zur maximalen Minoxidilkonzentration (Tmax) für den 5 % Schaum von 5,42 Stunden war vergleichbar mit der Tmax der 5 % Lösung von 5,79 Stunden.
Details zur topischen Resorption von Minoxidil im Vergleich zur Resorption von oralen Formulierungen sind verfügbar aus Studien mit topischer Minoxidillösung. Etwa 1 - 2 % einer topisch verabreichten Minoxidillösung wird systemisch resorbiert, im Vergleich zu 90 bis 100 % der oralen Formulierungen.
In einer Studie an Männern betrug die AUC der Minoxidil-Serumkonzentration für die 2 % Lösung im Durchschnitt 7,54 ng * h/ml im Vergleich zu einer durchschnittlichen AUC von 35,1 ng * h/ml für eine oralen Formulierung von 2,5 mg.
Die durchschnittliche Plasmakonzentration (Cmax) für die topische Lösung betrug 1,25 ng/ml im Vergleich zu 18,5 ng/ml nach oraler Gabe von 2,5 mg.
In einer Studie von Ferry et al.1996, trat eine statistisch signifikante Zunahme der Herzfrequenz bei mittleren Minoxidil-Serumspiegeln ab ca. 20 ng/ml auf.
In der pivotalen Studie MINALO3004 (Frauen) wurden Minoxidil-Serumspiegel beim Screening und in Woche 24 sowie 52 bestimmt. Die mittleren MinoxidilSerumspiegel waren bei Anwendung von 5 % Minoxidilschaum einmal täglich und 2 % Minoxidillösung zweimal täglich vergleichbar und lagen bei beiden Behandlungsgruppen unter 1 ng/ml. Der höchste individuelle Plasmaspiegel war in der Minoxidillösung-Gruppe im Vergleich zur Minoxidil-Schaumgruppe größer (max. 12,0 ng/mL vs. 3,9 ng/ml).
Verteilung
Durch in vitro Ultrafiltration konnte eine reversible Bindung an Plasmaproteine zwischen 37 - 39 % nachgewiesen werden.
Da nur etwa 1 - 2 % des topisch verabreichten Minoxidils resorbiert wird, ist das Ausmaß der Plasmaproteinbindung in vivo nach topischer Applikation nicht klinisch signifikant.
Das Verteilungsvolumen nach 12-stündiger intravenöser Verabreichung von 1,37 mg bis 27,4 mg Minoxidil im Steady State lag jeweils zwischen 76,0 und 82,8 l.
Biotransformation
Nach topischer Verabreichung werden etwa 60 % des absorbierten Minoxidils zu Glucuroniden, hauptsächlich über die Leber, metabolisiert.
Elimination
Die Halbwertszeit von topischem Minoxidil beträgt 22 Stunden im Vergleich zu 1,49 Stunden bei oralen Darreichungsformen. 97 % des Minoxidils werden über den Urin und 3 % über die Faeces ausgeschieden.
Die renale Clearance von Minoxidil und seinen Glucuroniden basierend auf Daten oraler Darreichungsformen beträgt im Durchschnitt 261 ml/min bzw. 290 ml/min.
Nach Beendigung der Behandlung werden etwa 95 % des topisch angewendeten Minoxidils innerhalb von 4 Tagen ausgeschieden.
5.3 Präklinische Daten zur Sicherheit
Präklinische Studien zeigten keine Gefährdung für den Menschen basierend auf konventionellen Studien zu Sicherheit, Pharmakologie, Toxizität bei wiederholter Gabe, Genotoxizität oder karzinogenem Potenzial.
Mutagenität
Minoxidil zeigte keine Hinweise auf mutagenes oder genotoxisches Potential in einer Reihe von in vivo oder in vitro Assays.
Karzinogenität
Eine hohe Inzidenz von hormon-induzierten Tumoren wurde an Ratten und Mäusen beobachtet. Diese Tumore fanden ihre Ursache in einem sekundären hormonellen Effekt (Hyperprolaktinämie), der nur an Nagern bei extrem hohen Dosen beobachtet wurde und dem Effekt von Reserpin ähnelt.
Die Anwendung von topischem Minoxidil hat keinen Effekt auf den Hormonstatus von Frauen gezeigt. Daher stellen hormon-induzierte Tumore kein karzinogenes Risiko für den Menschen dar.
Teratogenität
Studien zur Reproduktionstoxizität an Ratten und Kaninchen mit sehr hohen Aussetzungsraten im Vergleich zu der vorgesehenen Exposition für den Menschen, haben Hinweise auf eine maternale Toxizität und ein Risiko für den Fetus ergeben. Es besteht ein geringes Risiko für den menschlichen Fetus.
Fertilität
Minoxidildosen von mehr als 9 mg/kg (zumindest das 25-fache der menschlichen Exposition) subkutan an Ratten verabreicht waren mit einer reduzierten Konzeptions- und Implantationsrate, sowie einer Reduktion der Zahl lebensfähiger Jungtiere verbunden.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Ethanol
Butylhydroxytoluol (Ph.Eur.) (E321)
Milchsäure
Citronensäure
Glycerol
Cetylalkohol (Ph.Eur.)
Stearylalkohol (Ph.Eur.)
Polysorbat 60 gereinigtes Wasser
Treibgas: Propan / Butan / 2-Methylpropan.
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
2 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
Gefahr. Extrem entzündbares Aerosol.
Behälter steht unter Druck: Kann bei Erwärmung bersten. Von Hitze, heißen Oberflächen, Funken, offenen Flammen und anderen Zündquellen fernhalten. Nicht rauchen. Nicht gegen offene Flamme oder andere Zündquelle sprühen. Nicht durchstechen oder verbrennen, auch nicht nach Gebrauch. Vor Sonnenbestrahlung schützen. Nicht Temperaturen über 50 °C aussetzen
6.5 Art und Inhalt des Behältnisses
Aluminiumbehältnis 60 g Inhalt mit Innenbeschichtung basierend auf Polyamidi-mid Polymeren, Ventilsystem, Sprühkopf und kindergesicherte Schutzkappe aus Polypropylen Homopolymer. Das Behältnis steht unter Druck.
Regaine Frauen Schaum ist erhältlich als:
Packung mit 2 Dosen Schaum a 60 g
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den regionalen Anforderungen zu beseitigen.
7. Inhaber der Zulassung
Johnson & Johnson GmbH Johnson & Johnson Platz 2 41470 Neuss
Tel.: 00800 260 260 00 (kostenfrei)
8. Zulassungsnummer
90282.00.00
9. Datum der Erteilung der Zulassung / Verlängerung der Zulassung
Datum der Erteilung der Zulassung: 20. Oktober 2014
10. Stand der Information
Dezember 2015
11. Verkaufsabgrenzung
Apothekenpflichtig
Wichtiger Hinweis für den Gebrauch
Nach der Anwendung von Regaine Frauen Schaum kann es bei Kontakt mit empfindlichen Textilien und Oberflächen, wie z. B. Kopfkissen oder Hüten, unter Umständen zu Verfärbungen kommen. Dies gilt insbesondere solange der Schaum noch feucht auf der Kopfhaut ist.
spcde-v01-2015-12-01-reg-fr-foam-5
14 von 14