Risperdal Consta 50 Mg
FACHINFORMATION
1. BEZEICHNUNG DER ARZNEIMITTEL
RISPERDAL CONSTA 25 mg Pulver und Lösungsmittel zur Herstellung einer intramuskulären DepotInjektionssuspension
RISPERDAL CONSTA 37,5 mg Pulver und Lösungsmittel zur Herstellung einer intramuskulären Depot-Injektionssuspension
RISPERDAL CONSTA 50 mg Pulver und Lösungsmittel zur Herstellung einer intramuskulären DepotInjektionssuspension
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Durchstechflasche enthält entweder 25 mg, 37,5 mg oder 50 mg Risperidon.
1 ml hergestellte Suspension enthält entweder 12,5 mg, 18,75 mg oder 25 mg Risperidon.
Sonstiger Bestandteil mit bekannter Wirkung 1 ml hergestellte Suspension enthält 3 mg Natrium.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver und Lösungsmittel zur Herstellung einer Depot-Injektionssuspension.
Durchstechflasche mit Pulver
Weißes bis gebrochen weißes, frei fließendes Pulver
Vorgefertigte Spritze mit Lösungsmittel zur Herstellung der gebrauchsfertigen Suspension Klare, farblose wässrige Lösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
RISPERDAL CONSTA ist indiziert zur Erhaltungstherapie der Schizophrenie bei Patienten, die zurzeit mit oralen Antipsychotika stabilisiert sind.
4.2 Dosierung und Art der Anwendung
Dosierung
Erwachsene
Anfangsdosis:
Für die meisten Patienten beträgt die empfohlene Dosis 25 mg intramuskulär alle zwei Wochen.
Für Patienten mit einer feststehenden Dosis von oralem Risperidon über zwei Wochen oder mehr, soll das folgende Umstellungsschema beachtet werden. Patienten, die mit einer Dosis von 4 mg oder weniger oralem Risperidon behandelt wurden, sollen 25 mg RISPERDAL CONSTA erhalten, während für
Patienten, die mit höheren oralen Dosen behandelt wurden, eine höhere Dosis RISPERDAL CONSTA von 37,5 mg in Betracht gezogen werden soll.
Wenn Patienten derzeit kein orales Risperidon einnehmen, soll die Dosierung der oralen Vorbehandlung bei der Wahl der i.m. Anfangsdosis berücksichtigt werden. Die empfohlene Anfangsdosis beträgt 25 mg RISPERDAL CONSTA alle zwei Wochen. Bei Patienten, die mit höheren oralen Dosen von Antipsychotika behandelt wurden, sollte eine höhere Dosis RISPERDAL CONSTA von 37,5 mg in Betracht gezogen werden.
Während der dreiwöchigen Latenzphase, die auf die erste RISPERDAL CONSTA Injektion folgt (siehe Abschnitt 5.2), muss eine ausreichende antipsychotische Versorgung mit oralem Risperidon oder dem bisherigen Antipsychotikum sichergestellt werden.
RISPERDAL CONSTA darf bei akuter Exazerbation einer Schizophrenie während der dreiwöchigen Latenzphase, die auf die erste RISPERDAL CONSTA Injektion folgt, ohne die Sicherstellung einer hinreichenden antipsychotischen Versorgung mit oralem Risperidon oder dem bisherigen Antipsychotikum nicht angewendet werden.
Erhaltungsdosis:
Für die meisten Patienten beträgt die empfohlene Dosis 25 mg intramuskulär alle zwei Wochen. Einige Patienten können von höheren Dosen von 37,5 mg oder 50 mg profitieren. Eine Dosiserhöhung soll nicht öfter als alle 4 Wochen vorgenommen werden. Die Auswirkung dieser Dosisanpassung ist nicht eher als 3 Wochen nach der ersten Injektion mit der höheren Dosis zu erwarten. In klinischen Studien mit 75 mg wurde kein zusätzlicher Nutzen beobachtet. Dosierungen über 50 mg alle 2 Wochen werden nicht empfohlen.
Ältere Patienten
Es ist keine Dosisanpassung erforderlich. Die empfohlene Dosis beträgt 25 mg intramuskulär alle zwei Wochen. Bei Patienten, die derzeit nicht mit oralem Risperidon behandelt werden, ist die empfohlene Dosis 25 mg RISPERDAL CONSTA alle zwei Wochen. Für Patienten mit einer feststehenden Dosis oralem Risperidon über zwei Wochen oder mehr, soll das folgende Umstellungsschema beachtet werden. Patienten, die mit einer Dosis von 4 mg oder weniger oralem Risperidon behandelt wurden, sollen 25 mg RISPERDAL CONSTA erhalten, während für Patienten, die mit höheren oralen Dosen behandelt wurden, eine höhere Dosis RISPERDAL CONSTA von 37,5 mg in Betracht gezogen werden soll.
Während der dreiwöchigen Latenzphase, die auf die erste RISPERDAL CONSTA Injektion folgt (siehe Abschnitt 5.2), muss eine ausreichende antipsychotische Versorgung sichergestellt werden. Es liegen nur begrenzt klinische Daten von RISPERDAL CONSTA bei älteren Patienten vor. RISPERDAL CONSTA soll bei älteren Patienten mit Vorsicht angewendet werden.
Einschränkung der Leber- und Nierenfunktion
RISPERDAL CONSTA wurde nicht bei Patienten mit eingeschränkter Leber- oder Nierenfunktion untersucht.
Wenn Patienten mit eingeschränkter Leber- oder Nierenfunktion mit RISPERDAL CONSTA behandelt werden sollen, wird eine Anfangsdosis von zweimal täglich 0,5 mg oralem Risperidon während der ersten Woche empfohlen. In der zweiten Woche kann 1 mg zweimal täglich oder 2 mg einmal täglich gegeben werden. Wenn eine tägliche orale Gesamtdosis von mindestens 2 mg gut vertragen wird, kann eine Injektion von 25 mg RISPERDAL CONSTA alle 2 Wochen verabreicht werden.
Während der dreiwöchigen Latenzphase, die auf die erste RISPERDAL CONSTA Injektion folgt (siehe Abschnitt 5.2), muss eine ausreichende antipsychotische Versorgung sichergestellt werden.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von RISPERDAL CONSTA bei Kindern unter 18 Jahren ist nicht erwiesen. Es liegen keine Daten vor.
Art der Anwendung
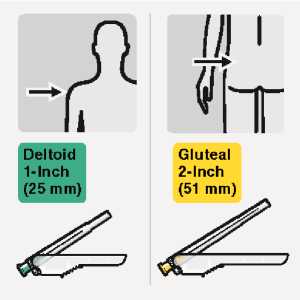
RISPERDAL CONSTA soll alle zwei Wochen tief intramuskulär unter Verwendung der entsprechenden Spezialnadel in den Delta- oder Glutealmuskel verabreicht werden. Für die deltoidale Verabreichung benutzen Sie die 1-Inch-Nadel (25 mm) für Injektionen abwechselnd in einen der beiden Arme. Für die gluteale Verabreichung benutzen Sie die 2-Inch-Nadel (50 mm) für Injektionen abwechselnd in eine der beiden Gesäßhälften. Nicht intravenös anwenden (siehe Abschnitte 4.4 und 6.6).
Hinweise zur Rekonstitution des Arzneimittels vor der Anwendung, siehe Abschnitt 6.6.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Bei Risperidon-naiven Patienten wird empfohlen, die Verträglichkeit mit oralem Risperidon zu überprüfen, bevor die Behandlung mit RISPERDAL CONSTA begonnen wird (siehe Abschnitt 4.2).
Ältere Patienten mit Demenz
RISPERDAL CONSTA wurde nicht bei älteren Patienten mit Demenz untersucht, daher ist es zur Anwendung bei dieser Patientengruppe nicht indiziert. RISPERDAL CONSTA ist nicht zur Behandlung von Verhaltensstörungen, die mit Demenz-Erkrankungen zusammenhängen, zugelassen.
Gesamtmortalität
Eine Meta-Analyse von 17 kontrollierten klinischen Studien mit atypischen Antipsychotika, einschließlich RISPERDAL, ergab, dass die Mortalität älterer Patienten mit Demenz, die mit atypischen Antipsychotika behandelt wurden, höher war als unter Placebo. In placebokontrollierten Studien mit RISPERDAL in dieser Patientenpopulation lag die Mortalitätsinzidenz bei den mit RISPERDAL behandelten Patienten bei 4,0% verglichen mit 3,1% bei den Patienten unter Placebo. Die Odds-Ratio (95% Konfidenzintervall) betrug 1,21 (0,7; 2,1). Das mittlere Alter (Altersspanne) der Patienten, die verstorben sind, lag bei 86 Jahren (Altersspanne 67-100).
Die Daten zweier großer Anwendungsstudien zeigten, dass ältere Menschen mit Demenz-Erkrankungen, die mit konventionellen (typischen) Antipsychotika behandelt wurden, einem leicht erhöhten Mortalitätsrisiko im Vergleich zu nicht mit Antipsychotika Behandelten ausgesetzt sind. Anhand der vorliegenden Studiendaten kann eine genaue Höhe dieses Risikos nicht angegeben werden und die Ursache für die Risikoerhöhung ist nicht bekannt.
Gleichzeitige Anwendung mit Furosemid
In den placebokontrollierten Studien mit oralem RISPERDAL wurde bei älteren Patienten mit Demenz, die mit Furosemid plus Risperidon behandelt wurden, eine höhere Mortalitätsinzidenz (7,3%; mittleres Alter 89 Jahre, Altersspanne 75-97 Jahre) im Vergleich zu Patienten, die Risperidon allein (3,1%; mittleres Alter 84 Jahre, Altersspanne 70-96 Jahre) oder Furosemid allein (4,1%; mittleres Alter 80 Jahre, Altersspanne 67-90 Jahre) erhalten hatten, beobachtet. Die erhöhte Mortalitätsinzidenz bei Patienten, die mit Furosemid plus Risperidon behandelt wurden, wurde in zwei von vier klinischen Studien beobachtet. Die gleichzeitige Anwendung von Risperidon und anderen Diuretika (hauptsächlich Thiazid-Diuretika, welche in niedriger Dosierung angewendet wurden) war nicht mit ähnlichen Befunden verbunden.
Ein pathophysiologischer Mechanismus zur Erklärung dieser Beobachtung konnte nicht identifiziert und kein einheitliches Muster der Todesursachen festgestellt werden. Nichtsdestoweniger ist Vorsicht angezeigt und sind Risiken und Nutzen dieser Kombination oder der gleichzeitigen Behandlung mit anderen potenten Diuretika vor Therapieentscheidung abzuwägen. Es zeigte sich keine erhöhte Mortalitätsinzidenz bei den Patienten, die andere Diuretika als begleitende Behandlung zu Risperidon erhalten hatten. Behandlungsunabhängig war Dehydratation ein allgemeiner Risikofaktor für Mortalität und soll daher sorgfältig bei älteren Patienten mit Demenz vermieden werden.
Unerwünschte zerebrovaskuläre Ereignisse (CVAEs)
In placebokontrollierten Studien bei älteren Patienten mit Demenz war die Inzidenz von zerebrovaskulären Ereignissen wie Insult (einschließlich Todesfolge) und transitorischen ischämischen Attacken bei den mit RISPERDAL behandelten Patienten signifikant höher (ungefähr um das 3-fache erhöht) im Vergleich zu den Patienten, die Placebo erhielten (mittleres Alter 85 Jahre; Altersspanne 73-93 Jahre). Die gepoolten Daten aus sechs placebokontrollierten Studien bei hauptsächlich älteren Patienten (> 65 Jahre) mit Demenz belegten, dass CVAEs (schwerwiegend und nicht schwerwiegend, kombiniert) bei 3,3% (33/1009) der Patienten auftraten, die mit Risperidon behandelt wurden, sowie bei 1,2% (8/712) der mit Placebo behandelten Patienten. Die Odds-Ratio (95% genaues Konfidenzintervall) betrug 2,96 (1,34; 7,50). Der Mechanismus für dieses erhöhte Risiko ist nicht bekannt. Ein erhöhtes Risiko für andere Antipsychotika oder andere Patientenpopulationen kann nicht ausgeschlossen werden. RISPERDAL CONSTA sollte bei Patienten mit erhöhtem Risiko für einen Schlaganfall mit Vorsicht angewendet werden.
Orthostatische Hypotonie
Aufgrund der alpha-blockierenden Aktivität von Risperidon kann, insbesondere zu Beginn der Behandlung, eine (orthostatische) Hypotonie auftreten. Eine klinisch signifikante Hypotonie wurde nach Markteinführung bei gleichzeitiger Anwendung von Risperidon und einer blutdrucksenkenden Behandlung beobachtet. Risperidon soll bei Patienten mit bekannten Herz-Kreislauf-Erkrankungen (z. B. Herzinsuffizienz, Myokardinfarkt, Reizleitungsstörungen, Dehydrierung, Hypovolämie oder zerebrovaskulären Erkrankungen) deshalb nur mit Vorsicht angewendet werden. Wenn eine klinisch relevante orthostatische Hypotonie fortbesteht, soll der Nutzen gegenüber dem Risiko einer weiteren Behandlung mit RISPERDAL CONSTA abgewogen werden.
Leukopenie, Neutropenie und Agranulozytose
Fälle von Leukopenie, Neutropenie und Agranulozytose wurden unter Behandlung mit Antipsychotika, einschließlich RISPERDAL CONSTA, berichtet. Eine Agranulozytose wurde nach Markteinführung sehr selten (< 1/10.000 Patienten) berichtet.
Patienten mit einer klinisch signifikant niedrigen Leukozytenzahl (WBC) in der Vorgeschichte oder einer Arzneimittel-induzierten Leukopenie/Neutropenie sollten während der ersten Monate der Therapie überwacht werden, und ein Absetzen von RISPERDAL CONSTA sollte bei den ersten Anzeichen eines klinisch signifikanten Abfalls des WBC in Betracht gezogen werden, wenn andere Ursachen ausgeschlossen sind.
Patienten mit klinisch signifikanter Neutropenie sollten sorgfältig auf Fieber oder andere Symptome hin oder auf Anzeichen einer Infektion hin überwacht werden. Eine sofortige Behandlung sollte erfolgen, wenn solche Symptome oder Anzeichen auftreten. Bei Patienten mit einer schweren Neutropenie (absolute Neutrophilenzahl < 1 x 109/l) soll RISPERDAL CONSTA abgesetzt und der WBC bis zur Erholung des Blutbildes beobachtet werden.
Tardive Dyskinesie/Extrapyramidale Symptome (TD/EPS)
Arzneimittel mit Dopaminrezeptor-antagonistischen Eigenschaften werden mit der Induktion von tardiven Dyskinesien in Verbindung gebracht, die durch unwillkürliche rhythmische Bewegungen, vor allem der Zunge und/oder des Gesichtes, charakterisiert sind. Das Auftreten extrapyramidaler Symptome ist ein Risikofaktor für tardive Dyskinesien. Wenn Anzeichen oder Symptome einer tardiven Dyskinesie auftreten, soll ein Absetzen sämtlicher Antipsychotika in Betracht gezogen werden.
Malignes neuroleptisches Syndrom (MNS)
In Verbindung mit Antipsychotika wurde über ein malignes neuroleptisches Syndrom berichtet, das durch Hyperthermie, Muskelsteifigkeit, autonome Instabilität, Bewusstseinstrübungen und erhöhte Serum-Kreatinphosphokinase-Werte gekennzeichnet ist. Zusätzliche Symptome können Myoglobinurie (Rhabdomyolyse) und akutes Nierenversagen einschließen. In einem solchem Fall sollen alle Antipsychotika, einschließlich RISPERDAL CONSTA, abgesetzt werden.
Morbus Parkinson und Demenz mit Lewy-Körperchen
Bei der Verschreibung antipsychotischer Arzneimittel, einschließlich RISPERDAL CONSTA, für Patienten mit Morbus Parkinson oder Demenz mit Lewy-Körperchen (DLK) sollen Ärzte jeweils die Risiken gegenüber dem Nutzen abwägen. Der Morbus Parkinson kann sich unter Risperidon verschlimmern. Beide Gruppen können sowohl ein erhöhtes Risiko für ein malignes neuroleptisches Syndrom als auch eine erhöhte Empfindlichkeit gegenüber Antipsychotika aufweisen; diese Patienten wurden aus klinischen Studien ausgeschlossen.
Manifestationen dieser erhöhten Empfindlichkeit können Verwirrtheit, Abstumpfung, Gleichgewichtsstörungen mit häufigen Stürzen, zusätzlich zu extrapyramidalen Symptomen sein.
Überempfindlichkeitsreaktionen
Vor Behandlungsbeginn mit RISPERDAL CONSTA sollte die Verträglichkeit von oralem Risperidon nachgewiesen werden. Dennoch wurde nach Markteinführung bei Patienten, die vorher orales Risperidon toleriert hatten, in seltenen Fällen über eine anaphylaktische Reaktion berichtet (siehe Abschnitte 4.2 und 4.8).
Wenn Überempfindlichkeitsreaktionen auftreten, muss die Behandlung mit RISPERDAL CONSTA abgebrochen werden. Es sind allgemeine unterstützende Maßnahmen entsprechend der klinischen Symptomatik einzuleiten und der Patient ist bis zum Rückgang der Anzeichen und Symptome zu überwachen (siehe Abschnitte 4.3 und 4.8).
Hyperglykämie und Diabetes mellitus
Während der Behandlung mit RISPERDAL CONSTA wurde über Hyperglykämie, Diabetes mellitus und Exazerbation eines vorbestehenden Diabetes mellitus berichtet. In einigen Fällen wurde über eine vorhergehende Zunahme des Körpergewichts berichtet, was ein prädisponierender Faktor sein kann. Verbunden damit wurde sehr selten über eine Ketoazidose und selten über ein diabetisches Koma berichtet. Eine entsprechende klinische Überwachung in Übereinstimmung mit den gültigen Richtlinien zur antipsychotischen Behandlung wird empfohlen. Patienten, die mit atypischen Antipsychotika, einschließlich RISPERDAL CONSTA, behandelt werden, sollten auf Symptome von Hyperglykämie (wie abnorm gesteigerte Trinkmenge und Durstgefühl, Polyurie, abnorm gesteigerte Nahrungsaufnahme und Schwäche) und Patienten mit Diabetes mellitus sollten regelmäßig auf eine Verschlechterung der Glucosekontrolle überwacht werden.
Gewichtszunahme
Bei der Anwendung von RISPERDAL CONSTA wurde über eine signifikante Gewichtszunahme berichtet. Das Gewicht sollte regelmäßig überprüft werden.
Hyperprolaktinämie
Hyperprolaktinämie ist eine häufige Nebenwirkung bei der Behandlung mit RISPERDAL CONSTA. Es wird eine Überwachung des Prolaktin-Plasmaspiegels empfohlen, wenn Patienten Anzeichen von möglicherweise Prolaktin-assoziierten Nebenwirkungen aufweisen (z. B. Gynäkomastie, Menstruationsstörungen, Anovulation, Fertilitätsstörungen, verminderte Libido, Erektionsstörungen, Galaktorrhö).
Studien an Gewebekulturen deuten darauf hin, dass ein Zellwachstum bei humanen Tumoren der Brust durch Prolaktin stimuliert werden kann. Obwohl bislang in klinischen und epidemiologischen Studien keine klare Assoziation mit der Anwendung von Antipsychotika gezeigt werden konnte, ist bei Patienten mit entsprechender medizinischer Vorgeschichte Vorsicht geboten.
RISPERDAL CONSTA soll bei Patienten mit vorbestehender Hyperprolaktinämie und bei Patienten mit möglicherweise prolaktinabhängigen Tumoren mit Vorsicht angewendet werden.
QT-V erlängerung
Nach Markteinführung wurde sehr selten über eine Verlängerung des QT-Intervalls berichtet. Wie bei anderen Antipsychotika ist Vorsicht geboten, wenn Risperidon Patienten mit bekannten kardiovaskulären Erkrankungen, einer QT-Verlängerung in der Familienanamnese, Bradykardie oder Elektrolytstörungen (Hypokaliämie, Hypomagnesiämie) verordnet wird, weil dadurch das Risiko arrhythmogener Wirkungen erhöht werden kann. Bei Kombination mit anderen Arzneimitteln, die das QT-Intervall verlängern, ist ebenfalls Vorsicht geboten.
Krampfanfälle
Bei Patienten mit Krampfanfällen oder sonstigen Erkrankungen in der Anamnese, die potentiell die Anfallsschwelle herabsetzen können, soll RISPERDAL CONSTA mit Vorsicht angewendet werden.
Priapismus
Aufgrund der alpha-adrenerg blockierenden Wirkung kann unter der Behandlung mit RISPERDAL CONSTA Priapismus auftreten.
Regulierung der Körpertemperatur
Störungen der Fähigkeit des Körpers, seine Kerntemperatur zu senken, wurden mit Antipsychotika in Verbindung gebracht. Eine entsprechende Sorgfalt empfiehlt sich daher bei der Verschreibung von RISPERDAL CONSTA für Patienten, bei denen es umständehalber zu einem Anstieg der Körpertemperatur kommen kann, z. B. durch intensive körperliche Betätigung, extreme Hitzeeinwirkung, gleichzeitige Behandlung mit Arzneimitteln mit anticholinerger Wirkung oder durch Dehydrierung.
Thromboembolie-Risiko
Im Zusammenhang mit der Anwendung von Antipsychotika sind Fälle von venösen Thromboembolien (VTE) berichtet worden. Da Patienten, die mit Antipsychotika behandelt werden, häufig erworbene Risikofaktoren für VTE aufweisen, sollten alle möglichen Risikofaktoren für VTE vor und während der Behandlung mit RISPERDAL CONSTA identifiziert und Präventivmaßnahmen ergriffen werden.
Intraoperatives Floppy Iris Syndrom
Bei Patienten, die mit Arzneimitteln mit alpha1a-adrenerg antagonistischer Wirkung, einschließlich RISPERDAL CONSTA, behandelt wurden, wurde während Kataraktoperationen ein intraoperatives Floppy Iris Syndrom (IFIS) beobachtet (siehe Abschnitt 4.8).
Ein IFIS kann das Risiko von Komplikationen am Auge während und nach der Operation erhöhen. Die derzeitige oder frühere Anwendung von Arzneimitteln mit alpha1a-adrenerg antagonistischer Wirkung sollte dem Ophthalmologen vor dem Eingriff mitgeteilt werden. Der potentielle Nutzen des Absetzens einer alpha1-blockierenden Therapie vor einer Kataraktoperation ist nicht erwiesen und muss gegen das Risiko des Absetzens der antipsychotischen Therapie abgewogen werden.
In präklinischen Studien mit Risperidon wurde eine antiemetische Wirkung beobachtet. Diese Wirkung kann, falls sie beim Menschen auftritt, die Anzeichen und Symptome einer Überdosierung bestimmter Arzneimittel oder bestimmter Erkrankungen wie gastrointestinale Obstruktion, Reye-Syndrom und eines Hirntumors verschleiern.
Einschränkung der Nieren- oder Leberfunktion
RISPERDAL CONSTA wurde nicht bei Patienten mit Nieren- oder Leberinsuffizienz untersucht, obwohl orales Risperidon untersucht worden ist. RISPERDAL CONSTA sollte in dieser Patientengruppe mit Vorsicht angewendet werden (siehe Abschnitt 4.2).
Anwendung
Vorsicht ist geboten, um eine versehentliche Injektion von RISPERDAL CONSTA in ein Blutgefäß zu vermeiden.
Sonstige Bestandteile
RISPERDAL CONSTA enthält Natrium, aber weniger als 1 mmol (23 mg) Natrium pro Dosis, d.h., es ist nahezu "natriumfrei".
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die Wechselwirkungen von RISPERDAL CONSTA mit gleichzeitig angewendeten anderen Arzneimitteln wurden nicht systematisch untersucht. Die in diesem Abschnitt beschriebenen Daten zu Arzneimittelwechselwirkungen basieren auf Studien mit oral verabreichtem RISPERDAL.
Pharmakodynamische Wechselwirkungen
Arzneimittel, die bekanntermaßen das QT-Intervall verlängern
Wie bei anderen Antipsychotika, ist Vorsicht geboten, wenn Risperidon mit Arzneimitteln verschrieben wird, die bekanntermaßen das QT-Intervall verlängern, wie z. B. Antiarrhythmika (z. B. Chinidin, Disopyramid, Procainamid, Propafenon, Amiodaron, Sotalol), trizyklische Antidepressiva (u. a. Amitriptylin), tetrazyklische Antidepressiva (u. a. Maprotilin), einige Antihistaminika, andere Antipsychotika, einige Malaria-Mittel (u. a. Chinin und Mefloquin) sowie andere Arzneimittel, die einen unausgeglichenen Elektrolythaushalt (Hypokaliämie, Hypomagnesiämie) oder Bradykardie verursachen, oder solche, die den hepatischen Metabolismus von Risperidon hemmen. Die Auflistung ist beispielhaft und nicht vollständig.
Zentral wirksame Arzneimittel und Alkohol
Aufgrund eines erhöhten Risikos einer Sedierung soll Risperidon in Kombination mit anderen zentral wirksamen Substanzen, insbesondere mit Alkohol, Opiaten, Antihistaminika und Benzodiazepinen mit Vorsicht angewendet werden.
Levodopa und Dopamin-Agonisten
RISPERDAL CONSTA kann die Wirkung von Levodopa und anderen Dopamin-Agonisten antagonisieren. Wenn diese Kombination als notwendig erachtet wird, insbesondere im Endstadium von Morbus Parkinson, soll die niedrigste effektive Dosis bei jeder Behandlung verordnet werden.
Arzneimittel mit blutdrucksenkender Wirkung
Nach Markteinführung wurde eine klinisch signifikante Hypotonie bei gleichzeitiger Anwendung von Risperidon und einer blutdrucksenkenden Behandlung beobachtet.
Risperidon wird hauptsächlich über CYP2D6 und in geringerem Maße über CYP3A4 metabolisiert. Sowohl Risperidon als auch sein aktiver Metabolit 9-Hydroxy-Risperidon sind Substrate des P-Glykoproteins (P-gp). Wirkstoffe, die die CYP2D6-Aktivität verändern oder die die CYP3A4-und/oder P-gp-Aktivität stark hemmen oder induzieren, können die Pharmakokinetik der aktiven antipsychotischen Fraktion des Risperidons beeinflussen.
Starke CYP2D6-Inhibitoren
Eine gleichzeitige Anwendung von RISPERDAL CONSTA mit starken CYP2D6-Inhibitoren kann die Plasmakonzentrationen von Risperidon, aber nur in geringem Ausmaß die der aktiven antipsychotischen Fraktion, erhöhen. Höhere Dosen eines starken CYP2D6-Inhibitors können die Konzentrationen der aktiven antipsychotischen Fraktion des Risperidons erhöhen (z. B. Paroxetin, siehe unten). Es wird erwartet, dass andere CYP2D6-Inhibitoren, wie Chinidin, die Risperidon-Plasmakonzentrationen in gleicher Weise beeinflussen können. Wenn die gleichzeitige Anwendung von Paroxetin, Chinidin oder anderer starker CYP2D6-Inhibitoren, besonders bei hohen Dosen, begonnen oder beendet wird, soll der Arzt die Dosierung von RISPERDAL CONSTA neu bewerten.
CYP3A4- und/oder P-gp-Inhibitoren
Eine gleichzeitige Anwendung von RISPERDAL CONSTA mit einem starken CYP3A4- und/oder P-gp-Inhibitor kann die Plasmakonzentrationen der aktiven antipsychotischen Fraktion des Risperidons erheblich erhöhen. Wenn die gleichzeitige Anwendung von Itraconazol oder eines anderen starken CYP3A4- und/oder P-gp-Inhibitors begonnen oder beendet wird, soll der Arzt die Dosierung von RISPERDAL CONSTA neu bewerten.
CYP3A4- und/oder P-gp-Induktoren
Eine gleichzeitige Anwendung von RISPERDAL CONSTA mit einem starken CYP3A4- und/oder P-gp-Induktor kann die Plasmakonzentrationen der aktiven antipsychotischen Fraktion des Risperidons vermindern. Wenn die gleichzeitige Anwendung von Carbamazepin oder eines anderen starken CYP3A4- und/oder P-gp-Induktors begonnen oder beendet wird, soll der Arzt die Dosierung von RISPERDAL CONSTA neu bewerten. Die Wirkung von CYP3A4-Induktoren ist zeitabhängig und es kann nach Beginn der Anwendung mindestens 2 Wochen dauern, bis die maximale Wirkung erreicht wird. Umgekehrt kann es nach dem Absetzen der Behandlung mindestens 2 Wochen dauern, bis die CYP3A4-Induktion zurückgegangen ist.
Arzneimittel mit hoher Plasmaproteinbindung
Wenn RISPERDAL CONSTA zusammen mit Arzneimitteln mit hoher Plasmaproteinbindung angewendet wird, findet keine klinisch relevante gegenseitige Verdrängung der Arzneimittel von den Plasmaproteinen statt.
Bei Komedikation sollte die entsprechende Produktinformation konsultiert werden, um sich über den Stoffwechselweg und eine möglicherweise notwendige Dosisanpassung zu informieren.
Kinder und Jugendliche
Studien zur Erfassung von Wechselwirkungen wurden nur bei Erwachsenen durchgeführt. Die Relevanz der Ergebnisse dieser Studien für pädiatrische Patienten ist nicht bekannt.
Beispiele
Im Folgenden sind Beispiele von Arzneimitteln aufgeführt, die möglicherweise interagieren könnten oder bei denen keine Interaktion mit Risperidon nachgewiesen wurde:
Wirkung anderer Arzneimittel auf die Pharmakokinetik von Risperidon
Antibiotika:
• Erythromycin, ein mäßiger CYP3A4- und ein P-gp-Inhibitor, verändert die Pharmakokinetik von Risperidon und der aktiven antipsychotischen Fraktion nicht.
• Rifampicin, ein starker CYP3A4- und ein P-gp-Induktor, vermindert die Plasmakonzentrationen der aktiven antipsychotischen Fraktion.
Cholinesterasehemmer:
• Donepezil und Galantamin, beide CYP2D6- und CYP3A4-Substrate, zeigen keine klinisch relevante Wirkung auf die Pharmakokinetik von Risperidon und der aktiven antipsychotischen Fraktion.
Antiepileptika:
• Es wurde gezeigt, dass Carbamazepin, ein starker CYP3A4- und ein P-gp-Induktor, die Plasmakonzentration der aktiven antipsychotischen Fraktion des Risperidons vermindert. Ähnliche Effekte wurden z. B. bei Phenytoin und Phenobarbital, die ebenfalls sowohl CYP3A4-Leberenzyme als auch P-gp induzieren, beobachtet.
• Topiramat verminderte geringfügig die Bioverfügbarkeit von Risperidon, aber nicht die der aktiven antipsychotischen Fraktion. Daher ist diese Wechselwirkung vermutlich nicht klinisch relevant.
Antimykotika:
• Itraconazol, ein starker CYP3A4- und ein P-gp-Inhibitor, erhöhte bei einer Dosis von 200 mg/Tag und Risperidondosen von 2 bis 8 mg/Tag die Plasmakonzentrationen der aktiven antipsychotischen Fraktion um ca. 70%.
• Ketoconazol, ein starker CYP3A4- und ein P-gp-Inhibitor, erhöhte bei einer Dosis von 200 mg/Tag die Plasmakonzentrationen von Risperidon und verminderte die Plasmakonzentrationen von 9-Hydroxy-Risperidon.
Antipsychotika:
• Phenothiazine können die Plasmakonzentrationen von Risperidon aber nicht die der aktiven antipsychotischen Fraktion erhöhen.
Antivirale Mittel:
• Proteaseinhibitoren: Es liegen keine strukturierten Studiendaten vor; da jedoch Ritonavir ein starker CYP3A4-Inhibitor und ein schwacher CYP2D6-Inhibitor ist, können Ritonavir und Ritonavir-geboosterte Proteaseinhibitoren potentiell die Konzentrationen der aktiven antipsychotischen Fraktion des Risperidons erhöhen.
Betablocker:
• Einige Betablocker können die Plasmakonzentrationen von Risperidon aber nicht die der aktiven antipsychotischen Fraktion erhöhen.
Calciumkanalblocker
• Verapamil, ein mäßiger CYP3A4- und ein P-gp-Inhibitor, erhöht die Plasmakonzentrationen von Risperidon und der aktiven antipsychotischen Fraktion.
Arzneimittel gegen gastrointestinale Erkrankungen:
• H2-Rezeptorantagonisten: Cimetidin und Ranitidin, beide schwache CYP2D6- und CYP3A4-Inhibitoren, erhöhen die Bioverfügbarkeit von Risperidon, aber nur geringfügig die der aktiven antipsychotischen Fraktion.
SSRIs und trizyklische Antidepressiva:
• Fluoxetin, ein starker CYP2D6-Inhibitor, erhöht die Plasmakonzentrationen von Risperidon aber nur in geringem Ausmaß die der aktiven antipsychotischen Fraktion.
• Paroxetin, ein starker CYP2D6-Inhibitor, erhöht die Plasmakonzentrationen von Risperidon, aber bei Dosen bis zu 20 mg/Tag, nur in geringem Ausmaß die der aktiven antipsychotischen Fraktion. Höhere Dosen von Paroxetin könnten jedoch die Konzentrationen der aktiven antipsychotischen Fraktion des Risperidons erhöhen.
• Trizyklische Antidepressiva können die Plasmakonzentrationen von Risperidon aber nicht die der aktiven antipsychotischen Fraktion erhöhen. Amitriptylin beeinflusst die Pharmakokinetik von Risperidon oder der aktiven antipsychotischen Fraktion nicht.
• Sertralin, ein schwacher CYP2D6-Inhibitor und Fluvoxamin, ein schwacher CYP3A4-Inhibitor, sind bei Dosen bis zu 100 mg/Tag nicht mit klinisch signifikanten Änderungen der
Konzentrationen der aktiven antipsychotischen Fraktion des Risperidons assoziiert. Sertralin- oder Fluvoxamin-Dosen von mehr als 100 mg/Tag könnten jedoch die Konzentrationen der aktiven antipsychotischen Fraktion des Risperidons erhöhen.
Wirkung von Risperidon auf die Pharmakokinetik anderer Arzneimittel
Antiepileptika:
• Risperidon zeigt keine klinisch relevante Wirkung auf die Pharmakokinetik von Valproat oder Topiramat.
Antipsychotika:
• Aripiprazol, ein CYP2D6- und CYP3A4-Substrat: Risperidontabletten oder -injektionen hatten keinen Einfluss auf die Pharmakokinetik der Summe aus Aripiprazol und seines aktiven Metaboliten Dehydroaripiprazol.
Digitalisglykoside:
• Risperidon zeigt keine klinisch relevante Wirkung auf die Pharmakokinetik von Digoxin.
Lithium:
• Risperidon zeigt keine klinisch relevante Wirkung auf die Pharmakokinetik von Lithium. Gleichzeitige Anwendung von Risperidon mit Furosemid
• Siehe Abschnitt 4.4 bezüglich der erhöhten Mortalität bei älteren Patienten mit Demenz, die gleichzeitig Furosemid erhalten.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen keine hinreichenden Daten zur Anwendung von Risperidon bei schwangeren Frauen vor. Risperidon erwies sich im Tierversuch als nicht teratogen; es wurden jedoch andere Arten einer Reproduktionstoxizität beobachtet (siehe Abschnitt 5.3). Das potenzielle Risiko für den Menschen ist nicht bekannt.
Neugeborene, die während des dritten Trimenons der Schwangerschaft gegenüber Antipsychotika (einschließlich RISPERDAL CONSTA) exponiert sind, sind durch Nebenwirkungen einschließlich extrapyramidaler Symptome und/oder Entzugserscheinungen gefährdet, deren Schwere und Dauer nach der Entbindung variieren können. Es gab Berichte über Agitiertheit, erhöhten oder erniedrigten Muskeltonus, Tremor, Somnolenz, Atemnot oder Störungen bei der Nahrungsaufnahme. Dementsprechend sollten Neugeborene sorgfältig überwacht werden.
RISPERDAL CONSTA sollte während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich.
Stillzeit
In Tierstudien werden Risperidon und 9-Hydroxy-Risperidon in die Milch ausgeschieden. Es wurde gezeigt, dass Risperidon und 9-Hydroxy-Risperidon in geringen Mengen auch in die menschliche Muttermilch ausgeschieden werden. Es liegen keine Daten zu Nebenwirkungen bei gestillten Säuglingen vor. Daher ist der Vorteil des Stillens gegen die potentiellen Risiken für das Kind abzuwägen.
Fertilität
Wie auch andere Arzneimittel, die Dopamin-D2-Rezeptoren antagonisieren, erhöht RISPERDAL CONSTA den Prolaktinspiegel. Eine Hyperprolaktinämie kann hypothalamisches GnRH unterdrücken, was zu einer reduzierten Gonadotropinsekretion der Hypophyse führt. Dies kann in der Folge durch Beeinträchtigung der gonadalen Steroidgenese sowohl bei Frauen als auch bei Männern die Reproduktionsfähigkeit beeinträchtigen.
Es wurden in den präklinischen Studien keine relevanten Effekte beobachtet.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
RISPERDAL CONSTA hat aufgrund seiner potenziellen Einflüsse auf das Nervensystem und visueller Effekte (siehe Abschnitt 4.8) geringen oder mäßigen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Den Patienten ist deshalb anzuraten, kein Fahrzeug zu lenken und keine Maschinen zu bedienen, bis ihre individuelle Empfindlichkeit bekannt ist.
4.8 Nebenwirkungen
Die am häufigsten berichteten Nebenwirkungen (Häufigkeit > 1/10) sind: Schlaflosigkeit, Angst, Kopfschmerzen, Infektion der oberen Atemwege, Parkinsonismus und Depression.
Die dem Anschein nach dosisabhängigen Nebenwirkungen schließen Parkinsonismus und Akathisie ein.
Schwerwiegende Reaktionen an der Injektionsstelle einschließlich Nekrose an der Injektionsstelle, Abszess, Cellulitis, Ulkus, Hämatom, Zyste und Nodulus wurden nach Markteinführung berichtet. Die Häufigkeit ist nicht bekannt (auf Grundlage der verfügbaren Daten nicht abschätzbar). Vereinzelte Fälle erforderten einen chirurgischen Eingriff.
Nachstehend aufgeführt ist eine vollständige Auflistung der im Rahmen klinischer Studien und nach Markteinführung gemeldeten Nebenwirkungen mit Risperidon, wobei die Häufigkeitskategorie nach klinischen Studien mit RISPERDAL CONSTA berechnet wurde. Hierbei werden die folgenden Begriffe und Häufigkeiten verwendet: sehr häufig (> 1/10), häufig (> 1/100 bis < 1/10), gelegentlich (> 1/1000 bis < 1/100), selten (> 1/10.000 bis < 1/1000), sehr selten (< 1/10.000).
Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
|
Systemorgan klasse |
Nebenwirkung | ||||
|
Häufigkeit | |||||
|
Sehr häufig |
Häufig |
Gelegentlich |
Selten |
Sehr selten | |
|
Infektionen und parasitäre Erkrankungen |
Infektion der oberen Atemwege |
Pneumonie, Bronchitis, Sinusitis, Harnwegsinfektion, Influenza |
Atemwegsinfektion, Cystitis, Ohrinfektion, Augeninfektion, Tonsillitis, Onychomykose, Cellulitis, Infektion, lokalisierte Infektion, virale Infektion, Acarodermatitis, subkutaner Abszess | ||
|
Erkrankungen des Blutes und des Lymphsystems |
Anämie |
Leukozytenzahl erniedrigt, Thrombozytopenie, Hämatokrit reduziert |
Agranulozytosec, Neutropenie, Eosinophilen-zahl erhöht | ||
|
Erkrankungen des Immunsystems |
Überempfind lichkeit |
anaphylaktische Reaktionc | |||
|
Endokrine Erkrankungen |
Hyperprolakti- nämiea |
Glucose im Urin |
inadäquate Sekretion des | ||
|
antidiuretischen Hormons | |||||
|
Stoffwechsel- und Ernährungs störungen |
Hyperglykämie, Gewichtszu nahme, gesteigerter Appetit, Gewichtsab nahme, verminderter Appetit |
Diabetes mellitusb, Anorexie, Triglyzeride erhöht, Cholesterin erhöht |
Wasser-Intoxikationc, Hypoglykämie, Hyperinsulinä-miec, Polydipsie |
diabetische Ketoazidose | |
|
Psychiatrische Erkrankungen |
Schlaflosigkeitd, Depression, Angst |
Schlafstörungen, Agitiertheit, verminderte Libido |
Manie, Verwirrtheit, Anorgasmie, Nervosität, Albträume |
Abstumpfung | |
|
Erkrankungen des Nervensystems |
Parkinsonismusd, Kopfschmerzen |
Sedierung/Som- nolenz, Akathisied, Dystonied, Schwindel, Dyskinesied, Tremor |
tardive Dyskinesie, zerebrale Ischämie, Bewusstlosig keit, Konvulsiond, Synkope, psychomotori sche Hyperaktivität, Gleichgewichtsstörung, anomale Koordination, posturaler Schwindel, Aufmerksamkeitsstörung, Dysarthrie, Dysgeusie, Hypästhesie, Parästhesie |
malignes neuroleptisches Syndrom, zerebrovaskuläre Störung, fehlende Reaktion auf Stimuli, verminderter Bewusstseinsgrad, diabetisches Koma, Titubation des Kopfes | |
|
Augenerkran kungen |
verschwommenes Sehen |
Konjunktivitis, trockenes Auge, erhöhter Tränenfluss, okulare Hyperämie |
Okklusion der retinalen Arterie, Glaukom, Störung der Augenbewegung, Augenrollen, Photophobie, Verkrustung des Lidrandes, Floppy Iris Syndrom (intraoperativ)c | ||
|
Erkrankungen des Ohrs |
Vertigo, Tinnitus, Ohrenschmerzen | ||||
|
Herzerkran- |
Tachykardie |
Vorhofflimmern, |
Sinusarrhythmie |
|
kungen |
AV-Block, Erregungsleitungsstörungen, QT-Verlänge-rung im EKG, Bradykardie, EKG-Verände-rungen, Palpita-tionen | ||||
|
Gefäßerkran kungen |
Hypotonie, Hypertonie |
orthostatische Hypotonie |
Lungenembolie, Venenthrombose, Erröten | ||
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Dyspnoe, pharyngolarynge aler Schmerz, Husten, verstopfte Nase |
Hyperventilation, Kongestion der Atemwege, Keuchen, Epistaxis |
Schlaf-ApnoeSyndrom, Aspirationspneumonie, Lungenstauung, Rasselgeräusche der Lunge, Dysphonie, respiratorische Störung | ||
|
Erkrankungen des Gastrointesti naltrakts |
Bauchschmerzen, abdominale Beschwerden, Erbrechen, Übelkeit, Obstipation, Gastroenteritis, Diarrhö, Dyspepsie, Mundtrockenheit, Zahnschmerzen |
Stuhlinkontinenz, Dysphagie, Flatulenz |
Pankreatitis, mechanischer Ileus, geschwollene Zunge, Koprostase, Cheilitis |
paralytischer Ileus | |
|
Erkrankungen der Haut und des Unterhautzell gewebes |
Hautausschlag |
Pruritus, Alopezie, Ekzem, trockene Haut, Erythem, Hautverfärbung, Akne, seborrhoeisches Ekzem |
Arzneimittel exanthem, Urtikaria, Hyperkeratose, Schuppen, Hauterkrankung, Hautläsion |
Angioödem | |
|
Skelettmusku latur-, Bindegewebs- und Knochener krankungen |
Muskelspasmen, muskuloskeletta-le Schmerzen, Rückenschmerzen, Arthralgie |
Kreatinphospho-kinase erhöht, Gelenksteifigkeit, Gelenkschwellung, Muskelschwäche, Nackenschmer zen |
Rhabdomyolyse, anomale Körperhaltung | ||
|
Erkrankungen der Nieren und Harnwege |
Harninkontinenz |
Pollakisurie, Harnretention, Dysurie | |||
|
Schwanger- |
Arzneimittelent- |
|
schaft, Wochenbett und perinatale Erkrankungen |
zugssyndrom des Neugeborenen0 | ||||
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
erektile Dysfunktion, Amenorrhö, Galaktorrhö |
Ejakulationsstörungen, verspätete Menstruation, Menstruationsstörungend, Gynäkomastie, sexuelle Dysfunktion, Brustschmerzen, Brustbeschwerden, vaginaler Ausfluss |
Priapismusc, Stauungserscheinungen der Brust, Brustvergrößerung, Sekretion aus der Brustdrüse | ||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Ödemd, Pyrexie, Thoraxschmerzen, Asthenie, Fatigue, Schmerzen, Reaktion an der Injektionsstelle |
Gesichtsödem, Schüttelfrost, Körpertemperatur erhöht, anomaler Gang, Durst, Thoraxbeschwerden, Unwohlsein, anomales Gefühl, Indurationc |
Hypothermie, Körpertemperatur erniedrigt, peripheres Kältegefühl, Arzneimittelentzugssyndrom, Beschwerden | ||
|
Leber- und Gallenerkrankungen |
Transaminasen erhöht, Gamma-Glutamyltrans-ferase erhöht |
Leberenzyme erhöht |
Ikterus | ||
|
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen |
Sturz |
anwendungsbe dingte Schmerzen |
a Eine Hyperprolaktinämie kann in einigen Fällen zu Gynäkomastie, Menstruationsstörungen, Amenorrhö, Anovulation, Galaktorrhö, Fertilitätsstörungen, verminderter Libido und Erektionsstörungen führen. b In placebokontrollierten Studien wurde Diabetes mellitus bei 0,18% der mit Risperidon behandelten
Studienteilnehmern berichtet im Vergleich zu einer Rate von 0,11% in der Placebogruppe. Die Gesamtinzidenz aus allen klinischen Studien betrug 0,43% bei allen mit Risperidon behandelten Studienteilnehmern. c Nicht beobachtet in klinischen Studien mit RISPERDAL CONSTA, aber nach der Markteinführung von Risperidon. d Extrapyramidale Störungen können auftreten: Parkinsonismus (verstärkte Speichelsekretion, muskuloskelettale Steifheit, Parkinsonismus, vermehrter Speichelfluss, Zahnradphänomen, Bradykinesie, Hypokinesie,
Maskengesicht, Muskelanspannung, Akinesie, Steifheit der Nackenmuskulatur, Muskelsteifheit, parkinsonähnlicher Gang und anomaler Glabellareflex, parkinsonähnlicher Ruhetremor), Akathisie (Akathisie, innere Unruhe, Hyperkinesie und Restless-Legs-Syndrom),Tremor, Dyskinesie (Dyskinesie, Muskelzuckungen, Choreoathetose, Athetose und Myoklonie), Dystonie. Dystonie einschließlich Dystonie, Hypertonie, Torticollis, unwillkürliche Muskelkontraktionen, Muskelkontraktur, Blepharospasmus, Okulogyration, Zungenparalyse, Gesichtsspasmus, Laryngospasmus, Myotonie, Opisthotonus, oropharyngealer Spasmus, Pleurothotonus, Zungenspasmus und Trismus. Es ist anzumerken, dass ein breiteres Spektrum an Symptomen aufgeführt ist, welches nicht notwendigerweise extrapyramidalen Ursprungs ist. Schlaflosigkeit schließt ein Einschlafstörung,
Durchschlafstörung; Konvulsion schließt ein Grand-Mal-Anfall; Menstruationsstörungen schließt ein
unregelmäßige Menstruation, Oligomenorrhö; Ödem schließt ein generalisiertes Ödem, peripheres Ödem, eindrückbares Ödem.
Nebenwirkungen, die mit Paliperidon-Formulierungen beobachtet wurden
Paliperidon ist der aktive Metabolit von Risperidon, daher sind die Nebenwirkungsprofile dieser Substanzen (einschließlich der oralen und injizierbaren Formulierungen) relevant füreinander.
Zusätzlich zu den oben aufgeführten Nebenwirkungen wurden die folgenden Nebenwirkungen bei der Anwendung von Paliperidon-Formulierungen beobachtet, wobei diese auch unter RISPERDAL CONSTA auftreten könnten.
Herzerkrankungen
posturales orthostatisches Tachykardiesyndrom Anaphylaktische Reaktion
Nach Markteinführung wurde bei Patienten, die vorher orales Risperidon toleriert hatten, in seltenen Fällen über eine anaphylaktische Reaktion nach Injektion von RISPERDAL CONSTA berichtet (siehe Abschnitt 4.4).
Klasseneffekte
Wie bei anderen Antipsychotika, wurden nach Markteinführung sehr selten Fälle einer QT-Verlängerung unter Risperidon berichtet. Andere klassenbezogene kardiale Effekte, die unter Antipsychotika, die das QT-Intervall verlängern, berichtet wurden, umfassen ventrikuläre Arrhythmie, Kammerflimmern, ventrikuläre Tachykardie, plötzlichen Tod, Herzstillstand und Torsade de Pointes.
Venöse Thromboembolien
Fälle von venösen Thromboembolien (einschließlich Fällen von Lungenembolie und Fällen von tiefer Venenthrombose) sind im Zusammenhang mit der Anwendung von Antipsychotika berichtet worden (Häufigkeit nicht bekannt).
Gewichtszunahme
In einer 12-wöchigen, placebokontrollierten Doppelblindstudie kam es bei 9% der Patienten, die mit RISPERDAL CONSTA behandelt wurden, im Vergleich zu 6% der Patienten, die mit Placebo behandelt wurden, zu einer Gewichtszunahme von > 7% des Körpergewichts am Endpunkt der Studie. Während der 1-jährigen offenen Studie zu RISPERDAL CONSTA lagen die Änderungen des Körpergewichts bei einzelnen Patienten im Allgemeinen innerhalb von ± 7% des Ursprungsgewichtes; bei 25% der Patienten kam es zu einer Zunahme des Körpergewichts von > 7%.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: http://www.bfarm.de, anzuzeigen.
4.9 Überdosierung
Da eine Überdosis bei parenteralen weniger wahrscheinlich ist als bei oralen Arzneimitteln, werden Informationen zur oralen Verabreichung dargestellt.
Symptome
Im Allgemeinen wurden Anzeichen und Symptome berichtet, die sich aus einer Verstärkung der bekannten pharmakologischen Wirkungen von Risperidon ergeben. Diese umfassen Benommenheit und
Sedierung, Tachykardie und Hypotonie sowie extrapyramidale Symptome. Bei Überdosierung wurden QT-Verlängerung und Konvulsionen berichtet. Über Torsade de Pointes wurde in Zusammenhang mit einer kombinierten Überdosis von oralem RISPERDAL und Paroxetin berichtet.
Im Fall einer akuten Überdosierung sollte die Möglichkeit in Betracht gezogen werden, dass noch andere Arzneimittel beteiligt waren.
Behandlung
Die Atemwege sind freizumachen und offenzuhalten und eine ausreichende Sauerstoffversorgung und Beatmung ist sicherzustellen. Es ist sofort mit einer Überwachung der Herz-Kreislauf-Funktion zu beginnen, und diese soll auch eine kontinuierliche Ableitung des EKGs einschließen, um mögliche Arrhythmien zu erfassen.
Es gibt kein spezifisches Antidot für RISPERDAL. Daher sollten geeignete unterstützende Maßnahmen eingeleitet werden. Hypotonie und Kreislaufkollaps sollen mit entsprechenden Maßnahmen, wie intravenöser Flüssigkeitszufuhr und/oder Sympathomimetika, behandelt werden. Im Fall von schweren extrapyramidalen Symptomen sollen Anticholinergika verabreicht werden. Eine engmaschige Überwachung und Kontrolle soll bis zur Wiederherstellung des Patienten fortgesetzt werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: andere Antipsychotika, ATC-Code: N05AX08 Wirkmechanismus
Risperidon ist ein selektiver monoaminerger Antagonist mit einzigartigen Eigenschaften. Er besitzt eine hohe Affinität für serotonerge 5-HT2- und dopaminerge D2-Rezeptoren. Risperidon bindet ebenfalls an alpha1-adrenerge Rezeptoren und, mit geringerer Affinität, an H1-histaminerge und alpha2-adrenerge Rezeptoren. Risperidon hat keine Affinität zu cholinergen Rezeptoren. Obwohl Risperidon ein starker D2-Antagonist ist, der bekanntermaßen die positiven Symptome der Schizophrenie verbessert, verursacht er eine geringere Dämpfung der motorischen Aktivität und Induktion der Katalepsie als klassische Antipsychotika. Ein ausgewogener zentraler Serotonin- und Dopamin-Antagonismus kann die Neigung zu extrapyramidalen Nebenwirkungen verringern und die therapeutische Wirksamkeit auf negative und affektive Symptome der Schizophrenie erweitern.
Klinische Wirksamkeit
Die Wirksamkeit von RISPERDAL CONSTA (25 mg und 50 mg) bei der Behandlung von manifesten psychotischen Störungen (Schizophrenie, schizoaffektive Störung) wurde in einer placebokontrollierten Studie über 12 Wochen bei erwachsenen psychotischen, stationären und ambulanten Patienten nachgewiesen, welche die DSM-IV-Kriterien für Schizophrenie erfüllten.
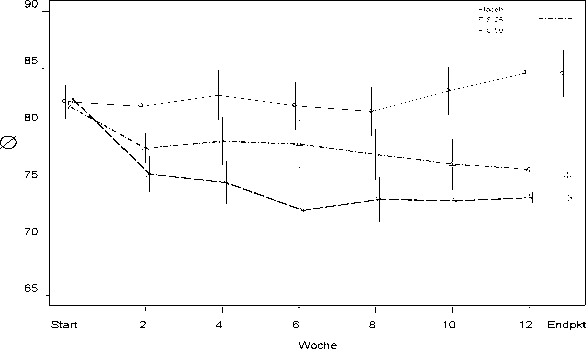
In einer 12-wöchigen Vergleichsstudie zeigte sich RISPERDAL CONSTA bei stabilen Patienten mit Schizophrenie ebenso wirksam wie die orale Tablettenform. Die Langzeitsicherheit und -wirksamkeit (50 Wochen) von RISPERDAL CONSTA wurde ebenfalls in einer offenen-Studie mit stabilen psychotischen, stationären und ambulanten Patienten evaluiert, welche die DSM-IV-Kriterien für Schizophrenie oder eine schizoaffektive Störung erfüllten. Die Wirksamkeit von RISPERDAL CONSTA blieb über die Zeit erhalten (Abbildung 1).
Mittelwert des PANSS-Gesamtscores über die Zeit (LOCF) bei Patienten mit Schizophrenie.
Abbildung 1.
5.2 Pharmakokinetische Eigenschaften
Resorption
Die Resorption von Risperidon aus RISPERDAL CONSTA ist vollständig.
Das Freisetzungsprofil nach einer einzelnen intramuskulären Injektion von RISPERDAL CONSTA besteht aus einer kleinen initialen Freisetzung von Risperidon (< 1% der Dosis), gefolgt von einer 3-wöchigen Latenzphase. Die hauptsächliche Freigabe von Risperidon beginnt von der 3. Woche an, bleibt von der 4. bis zur 6. Woche bestehen und sinkt ab der 7. Woche. Deshalb muss eine orale antipsychotische Zusatzmedikation während der ersten 3 Wochen der Behandlung mit RISPERDAL CONSTA verabreicht werden (siehe Abschnitt 4.2).
Die Kombination des Freisetzungsprofils und des Dosierungsschemas (intramuskuläre Injektion alle zwei Wochen) führt zu anhaltenden therapeutischen Plasmakonzentrationen. Die therapeutischen Plasmakonzentrationen bleiben 4 bis 6 Wochen nach der letzten RISPERDAL CONSTA-Injektion erhalten.
Nach wiederholten intramuskulären Injektionen von 25 oder 50 mg RISPERDAL CONSTA alle zwei Wochen schwankten die medianen Plasmatal- und -spitzenkonzentrationen der aktiven antipsychotischen Fraktion zwischen 9,9 und 19,2 ng/ml bzw. 17,9 und 45,5 ng/ml. Es wurde bei Patienten, denen alle 2 Wochen 25-50 mg injiziert wurden, keine Akkumulation von Risperidon während der Langzeitanwendung (12 Monate) beobachtet.
Die obigen Studien wurden mit intramuskulären Injektionen in den Glutealmuskel durchgeführt. Intramuskuläre Injektionen in den Delta- und Glutealmuskel in der gleichen Dosierung sind bioäquivalent und daher austauschbar.
Verteilung
Risperidon wird schnell verteilt. Das Verteilungsvolumen beträgt 1-2 l/kg. Im Plasma wird Risperidon an Albumin und alpha1-saures Glykoprotein gebunden. Die Plasmaproteinbindung von Risperidon beträgt 90%, die des aktiven Metaboliten 9-Hydroxy-Risperidon 77%.
Biotransformation und Elimination
Risperidon wird durch CYP2D6 zu 9-Hydroxy-Risperidon verstoffwechselt, das eine ähnliche pharmakologische Wirkung wie Risperidon besitzt. Risperidon und 9-Hydroxy-Risperidon bilden die aktive antipsychotische Fraktion. CYP2D6 unterliegt einem genetischen Polymorphismus. Extensive CYP2D6-Metabolisierer wandeln Risperidon schnell in 9-Hydroxy-Risperidon um, während schlechte CYP2D6-Metabolisierer es viel langsamer umwandeln. Obwohl extensive CYP2D6-Metabolisierer niedrigere Risperidon und höhere 9-Hydroxy-Risperidon Konzentrationen als schlechte Metabolisierer aufweisen, ist die Pharmakokinetik von Risperidon und 9-HydroxyRisperidon zusammen (d. h. der aktiven antipsychotischen Fraktion) nach Einmal- und Mehrfachgabe bei extensiven und schlechten CYP2D6-Metabolisierern vergleichbar.
Ein weiterer Stoffwechselweg von Risperidon ist die N-Dealkylierung. In-vitro-Studien in humanen Leber-Mikrosomen zeigten, dass Risperidon bei einer klinisch relevanten Konzentration nicht substantiell den Metabolismus von Arzneimitteln hemmt, die durch die Cytochrom-P450-Isozyme, einschließlich CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 und CYP3A5, metabolisiert werden. Eine Woche nach der Verabreichung von oralem Risperidon sind 70% der Dosis mit dem Urin und 14% mit dem Stuhl ausgeschieden. Im Urin entsprechen Risperidon und 9-Hydroxy-Risperidon 35-45% der oral verabreichten Dosis. Bei dem Rest handelt es sich um inaktive Metaboliten. Die Eliminationsphase ist ca. 7 bis 8 Wochen nach der letzten RISPERDAL CONSTA-Injektion abgeschlossen.
Linearität
Nach einzelnen Gaben von RISPERDAL CONSTA ist die Pharmakokinetik von Risperidon in einem Dosisbereich von 12,5-75 mg linear. Die Pharmakokinetik von alle 2 Wochen injiziertem Risperidon ist ebenfalls in einem Dosisbereich von 25-50 mg linear.
Ältere Patienten, Leber- und Niereninsuffizienz
Eine PK-Studie mit einer Einmalgabe von oralem Risperidon zeigte durchschnittlich um 43% höhere aktive Plasmakonzentrationen der aktiven antipsychotischen Fraktion, eine 38% längere Halbwertszeit und eine verringerte Clearance der aktiven antipsychotischen Fraktion von 30% bei älteren Patienten. Bei Erwachsenen mit mäßiger Niereninsuffizienz betrug die Clearance der aktiven Fraktion ~48% der Clearance von jungen, gesunden Erwachsenen (Altersspanne 25-35 Jahre). Bei Erwachsenen mit schwerer Niereninsuffizienz betrug die Clearance der aktiven Fraktion ~31% der Clearance von jungen, gesunden Erwachsenen. Die Halbwertszeit der aktiven Fraktion betrug 16,7 h bei jungen Erwachsenen,
24,9 h bei Erwachsenen mit mäßiger Nierenfunktionsstörung (oder ~1,5-mal so lang wie bei jungen Erwachsenen) und 28,8 h bei solchen mit schwerer Nierenfunktionsstörung (oder ~1,7-mal so lang wie bei jungen Erwachsenen).
Die Plasmakonzentrationen von Risperidon waren bei Patienten mit Leberinsuffizienz normal; die mittlere freie Fraktion von Risperidon im Plasma war jedoch um 37,1% erhöht.
Die orale Clearance und die Eliminationshalbwertszeit von Risperidon und der aktiven Fraktion waren bei Erwachsenen mit mäßiger und schwerer Leberinsuffizienz nicht signifikant abweichend von den Parametern bei jungen, gesunden Erwachsenen.
Pharmakokineti sche/Pharmakodynamische Beziehung
Bei der Beurteilung der Kontrollen in jeder der Phase-III-Studien, in denen Wirksamkeit und Sicherheit untersucht wurden, bestand keine Beziehung zwischen den Plasmakonzentrationen der aktiven antipsychotischen Fraktion und der Änderung des PANSS Gesamtscores (Positive and Negative Syndrome Scale) bzw. des ESRS Gesamtscores (Extrapyramidale Symptom Rating Scale).
Geschlecht, ethnische Zugehörigkeit und Rauchgewohnheiten
Eine populationspharmakokinetische Analyse zeigte keine offensichtlichen Auswirkungen von Geschlecht, ethnischer Zugehörigkeit oder Rauchgewohnheiten auf die Pharmakokinetik von Risperidon oder der aktiven antipsychotischen Fraktion.
5.3 Präklinische Daten zur Sicherheit
Vergleichbar zu den (sub)chronischen Toxizitätsstudien mit oralem Risperidon bei Ratten und Hunden, waren die Hauptauswirkungen der Behandlung mit RISPERDAL CONSTA (bis zu 12 Monate intramuskuläre Verabreichung) die prolaktinvermittelte Stimulation der Brustdrüse, Veränderungen am männlichen und weiblichen Genitaltrakt und Auswirkungen auf das zentrale Nervensystem (ZNS), die mit der pharmakodynamischen Aktivität von Risperidon zusammenhängen. In einer Toxizitätsstudie, in der junge Ratten mit oralem Risperidon behandelt wurden, wurden eine erhöhte Sterblichkeit der Jungtiere und eine Verzögerung der körperlichen Entwicklung beobachtet. In einer 40-wöchigen Studie, in der junge Hunde mit oralem Risperidon behandelt wurden, war die sexuelle Reifung verzögert. Basierend auf der AUC war das Längenwachstum der Knochen von Hunden bei einem 3,6-fachen der oralen Höchstdosis für jugendliche Menschen (1,5 mg/Tag), nicht betroffen, während Auswirkungen auf die langen Röhrenknochen und die sexuelle Reifung bei einem 15-fachen der oralen Höchstdosis für jugendliche Menschen beobachtet wurden.
Bei Ratten und Kaninchen zeigte Risperidon keine teratogene Wirkung. In Reproduktionsstudien an Ratten mit Risperidon zeigten sich negative Auswirkungen auf das Paarungsverhalten der Eltern und auf das Geburtsgewicht und das Überleben der Nachkommen. Bei Ratten war die intrauterine Exposition mit Risperidon mit kognitiven Defiziten im Erwachsenenalter assoziiert. Andere Dopamin-Antagonisten wirkten sich negativ auf das Lernvermögen und die motorische Entwicklung der Nachkommen aus, wenn sie bei trächtigen Tieren angewendet wurden.
Die Verabreichung von RISPERDAL CONSTA an männliche und weibliche Ratten über 12 und 24 Monate rief bei einer Dosis von 40 mg/kg/2 Wochen eine Osteodystrophie hervor. Die osteodystrophe Dosis bei Ratten war, bezogen auf mg/m2, 8-mal höher als die maximale empfohlene Humandosis und ist assoziiert mit einer Plasmaexposition, die doppelt so hoch war wie die maximal erwartete Exposition beim Menschen bei der maximal empfohlenen Dosis. Bei Hunden, die über 12 Monate mit bis zu 20 mg/kg/2 Wochen RISPERDAL CONSTA behandelt wurden, wurde keine Osteodystrophie beobachtet. Diese Dosis führte zu Plasmaexpositionen, die bis zu 14-mal höher als die maximal empfohlene Humandosis waren.
Es gab keine Hinweise für ein genotoxisches Potential.
Wie für einen potenten Dopamin-D2-Antagonisten zu erwarten, wurden in Kanzerogenitätsstudien mit oralem Risperidon bei Ratten und Mäusen Zunahmen von Adenomen der Hypophyse (Maus), Adenomen des endokrinen Pankreas (Ratte) und Adenomen der Brustdrüse (beide Spezies) beobachtet. In einer intramuskulären Kanzerogenitätsstudie mit RISPERDAL CONSTA an Wistar (Hannover) Ratten (Dosen von 5 und 40 mg/kg/2 Wochen) wurden erhöhte Inzidenzen von Tumoren des endokrinen Pankreas, der Hypophyse und des Nebennierenmarks bei 40 mg/kg beobachtet, während Brustdrüsentumore bei 5 und 40 mg/kg auftraten. Diese Tumore, die nach oraler und intramuskulärer Arzneimittelgabe beobachtet wurden, können mit dem lange anhaltenden Dopamin-D2-Antagonismus und der Hyperprolaktinämie zusammenhängen. Studien an Gewebekulturen legen nahe, dass das Zellwachstum bei humanen Brusttumoren durch Prolaktin stimuliert werden kann. Eine Hyperkalzämie, von der postuliert wird, dass sie zu einer erhöhten Inzidenz von Tumoren des Nebennierenmarks bei mit RISPERDAL CONSTA behandelten Ratten beiträgt, wurde in beiden Dosisgruppen beobachtet. Es gibt keinen Hinweis darauf, dass eine Hyperkalzämie Phäochromozytome beim Menschen verursachen könnte.
Bei männlichen Ratten, die mit RISPERDAL CONSTA behandelt wurden, traten bei 40 mg/kg/2 Wochen renale tubuläre Adenome auf. Bei der Niedrig-Dosis, der 0,9% Kochsalz- oder der Microsphären-Kontrollgruppe traten keine renalen Tumore auf. Der Mechanismus, der den renalen Tumoren in den männlichen Wistar (Hannover) Ratten zugrunde liegt, die mit RISPERDAL CONSTA behandelt wurden, ist unbekannt. Eine behandlungsbezogene Erhöhung der Inzidenz renaler Tumore trat nach oraler Gabe von Risperidon in Karzinogenitätsstudien mit Wistar (Wiga) Ratten oder bei Swiss Mäusen nicht auf. Studien zur Untersuchung der Substamm-Unterschiede im Tumor-Organprofil deuten darauf hin, dass sich der in den Karzinogenitätsstudien eingesetzte Wistar (Hannover) Sub-Stamm beträchtlich vom in den oralen Karzinogenitätsstudien eingesetzten Wistar (Wiga) Sub-Stamm bezüglich spontaner altersbezogener nicht-neoplastischer Nierenveränderungen, Anstiege des Prolaktinspiegels im Serum und durch Risperidon bedingte Veränderungen der Niere unterscheidet. Es gibt keine Daten, die auf Veränderungen der Nieren bei Hunden hindeuten, die chronisch mit RISPERDAL CONSTA behandelt wurden.
Die Bedeutung der Osteodystrophie, der Prolaktin-vermittelten Tumore und der vermuteten Substammspezifischen Nierentumore bei Ratten im Hinblick auf das humane Risiko ist unbekannt.
Bei Hunden und Ratten wurden nach der Applikation hoher Dosen RISPERDAL CONSTA lokale Irritationen an der Injektionsstelle beobachtet. In einer 24-monatigen intramuskulären Karzinogenitätsstudie an Ratten wurde weder in der Kontroll-, noch in der Wirkstoffgruppe eine erhöhte Inzidenz von Tumoren im Bereich der Injektionsstelle beobachtet.
In vitro und in vivo Tiermodelle zeigen, dass hohe Risperidon-Dosen eine Verlängerung des QT-Intervalls verursachen können, was mit einem theoretisch erhöhten Risiko von Torsade de Pointes bei Patienten assoziiert wurde.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Pulver zur Herstellung einer Injektionssuspension Polyglactin
Lösungsmittel Polysorbat 20
Carmellose-Natrium (Ph. Eur.)
Natriummonohydrogenphosphat-Dihydrat (Ph. Eur.)
Citronensäure Natriumchlorid Natriumhydroxid Wasser für Injektionszwecke
6.2 Inkompatibilitäten
RISPERDAL CONSTA darf außer mit den unter Abschnitt 6.6 aufgeführten, nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
3 Jahre bei 2-8°C.
Nach Herstellung der Injektionssuspension: Die chemische und physikalische Stabilität der gebrauchsfertigen Zubereitung wurde für 24 Stunden bei 25°C nachgewiesen.
Aus mikrobiologischer Sicht sollte die gebrauchsfertige Zubereitung sofort nach der Herstellung verwendet werden. Wenn die gebrauchsfertige Zubereitung nicht sofort eingesetzt wird, ist der Anwender für die Dauer und die Bedingungen der Aufbewahrung verantwortlich. Sofern die Herstellung der gebrauchsfertigen Zubereitung nicht unter kontrollierten und validierten aseptischen Bedingungen erfolgt, ist diese nicht länger als 6 Stunden bei 25°C aufzubewahren.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Die gesamte Packung im Kühlschrank (2°C - 8°C) lagern.
Wenn eine Kühlung nicht möglich ist, kann RISPERDAL CONSTA vor der Anwendung bis zu 7 Tage
bei einer Temperatur nicht über 25°C gelagert werden.
In der Originalverpackung aufbewahren.
Aufbewahrungsbedingungen nach Rekonstitution des Arzneimittels siehe Abschnitt 6.3.
6.5 Art und Inhalt des Behältnisses
Nadelfreie Entnahmevorrichtung aus der Durchstechflasche
- Eine Durchstechflasche mit Pulver zur Herstellung einer Depot-Injektionssuspension
- Ein West-Medimop-Durchstechflaschen-Adapter® zur Herstellung der Suspension (nachstehend als Adapter bezeichnet)
- Eine vorgefüllte Spritze mit Lösungsmittel für RISPERDAL CONSTA
- Zwei Terumo-SurGuard®-3-Nadeln zur intramuskulären Injektion (eine 21G UTW-1-Inch-Sicherheitsnadel (0,8 mm x 25 mm) mit Nadelschutzvorrichtung für die deltoidale Verabreichung und eine 20G TW-2-Inch-Sicherheitsnadel (0,9 mm x 51 mm) mit Nadelschutzvorrichtung für die gluteale Verabreichung).
RISPERDAL CONSTA ist in Originalpackungen mit 1 oder 5 Packungen (gebündelt) erhältlich.
Es werden möglicherweise nicht alle Packungen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Wichtige Informationen
Die Schritt-für-Schritt-Hinweise zur Handhabung von RISPERDAL CONSTA erfordern besondere Aufmerksamkeit, um eine erfolgreiche Verabreichung sicherzustellen.
Benutzen Sie die mitgelieferten Komponenten
Die Komponenten in dieser Packung sind speziell für die Anwendung mit RISPERDAL CONSTA entwickelt worden. RISPERDAL CONSTA darf nur mit dem Lösungsmittel aus dieser Packung rekonstituiert werden.
KEINE Komponenten aus dieser Packung austauschen.
Die rekonstituierte Suspension nicht aufbewahren
Die Dosis schnellstmöglich nach der Rekonstitution verabreichen, um ein Absetzen der Suspension zu verhindern.
Richtige Dosierung
Um die beabsichtigte Dosis von RISPERDAL CONSTA zu verabreichen, muss der gesamte Inhalt der Durchstechflasche verabreicht werden.
ZUR EINMALIGEN ANWENDUNG
Nicht wiederverwenden
Medizinprodukte benötigen spezielle Materialeigenschaften, um wie beabsichtigt zu funktionieren. Diese Eigenschaften wurden nur für die einmalige Anwendung geprüft. Jeder Versuch, das Medizinprodukt für eine spätere Wiederverwendung aufzubereiten, kann sich nachteilig auf die Unversehrtheit des Medizinprodukts auswirken oder zu einer Verschlechterung der Funktionsfähigkeit führen.
22
Inhalt der Packung West-Medimop-Adapter
Luer-Verbindungsstück
Spritzenkolben
Weiße Manschette
Dorn
Ummantelung
Farbige Kappe
Microspharen-Partikel
Lösungsmittel
Weiße Kappe
T ransparente
Nadelschutzkappe
(25 mm)
(51 m
m)
Nadelschutzvorrichtung
Entnahme der Packung Durchstechflasche mit dem Adapter verbinden
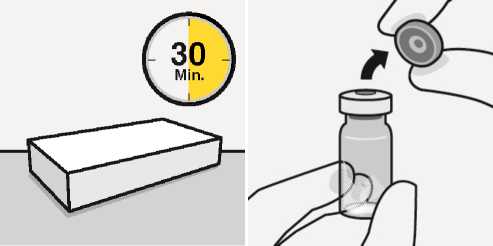
Warten Sie 30 Minuten
Vor der Rekonstitution die Packung aus dem Kühlschrank nehmen und mindestens 30 Minuten bei Raumtemperatur stehen lassen.
Nicht auf andere Weise erwärmen.
Kappe von der
Durchstechflasche
entfernen
Ziehen Sie die farbige Kappe von der Durchstechflasche ab.
Wischen Sie das Oberteil des grauen Stopfens mit einem Alkoholtupfer ab.
An der Luft trocknen lassen.
Nicht den grauen
Gummistopfen
entfernen.
Vorbereiten des Adapters
Halten Sie den sterilen Blister wie abgebildet. Ziehen Sie die Papierabdeckung ab und entfernen Sie sie.
Den Adapter nicht aus dem Blister nehmen.
Berühren Sie keinesfalls den Dorn im Inneren des Adapters. Dies führt zur Kontamination.
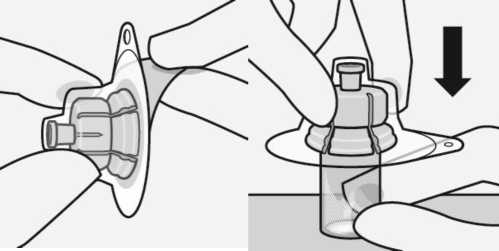
Verbinden des Adapters mit der Durchstechflasche
Stellen Sie die Durchstechflasche auf eine feste Fläche und halten Sie sie an der Basis fest. Richten Sie den Adapter mittig über dem grauen Gummistopfen aus. Drücken Sie den Adapter senkrecht auf die Oberseite der Durchstechflasche bis er sicher auf der Durchstechflasche einrastet.
Den Adapter nicht schräg aufsetzen, sonst kann Lösungsmittel bei der Überführung in die Durchstechflasche auslaufen.
Verbinden der vorgefüllten Spritze mit dem Adapter
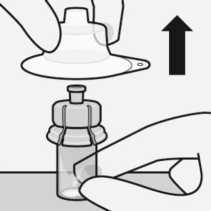
Entfernen des sterilen Blisters
Handhaltung
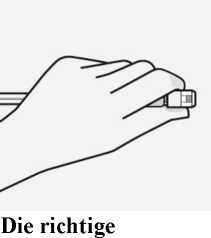
Halten Sie die Spritze an der weißen Manschette an der Spritzenspitze.
Die Spritze während des Zusammenbaus nicht am gläsernen Spritzenkörper festhalten.

rA-
Entfernen Sie den sterilen Blister nur vom Adapter, wenn Sie bereit sind, die weiße Kappe von der vorgefüllten Spritze zu entfernen.
Durchstechflasche aufrecht stellen, um ein Auslaufen zu verhindern. Durchstechflasche an der Basis festhalten und den sterilen Blister nach oben abziehen und entfernen.
Nicht schütteln.
Nicht das freiliegende Luer-Verbindungsstück auf dem Adapter berühren.
Dies führt zur Kontamination.
Entfernen der Kappe Halten Sie die Spritze an der weißen Manschette und brechen Sie die weiße Kappe ab. Die weiße Kappe nicht drehen oder abschneiden.
Die Spritzenspitze nicht berühren. Dies führt zur Kontamination.
Die abgebrochene Kappe kann entsorgt werden.
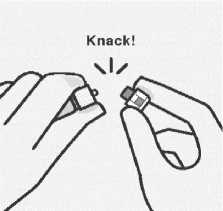
Verbinden der Spritze mit dem Adapter
Halten Sie den Adapter an der Ummantelung fest um ein Verdrehen zu vermeiden.
Halten Sie die Spritze an der weißen Manschette und stecken Sie dann die Spritzenspitze in das Luer-Verbindungsstück des Adapters.
Die Spritze nicht am gläsernen Spritzenkörper festhalten.
Dies kann zur Lockerung oder Ablösung der weißen Manschette führen.
Verbinden Sie die Spritze mit dem Adapter durch eine kräftige Bewegung im Uhrzeigersinn, bis sie festsitzt.
Nicht überdrehen. Ein Überdrehen kann zum Brechen der Spritzenspitze führen.
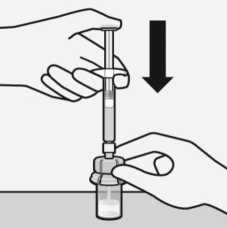
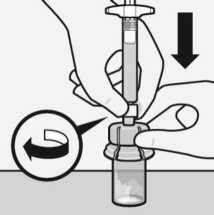
Lösungsmittel injizieren
Injizieren Sie den gesamten Inhalt des Lösungsmittels in die Durchstechflasche.
rA-•
Der Inhalt der Durchstechflasche steht nun unter Druck.
Halten Sie den Spritzenkolben mit dem Daumen heruntergedrückt.
Microsphären-Partikel mit dem Lösungsmittel
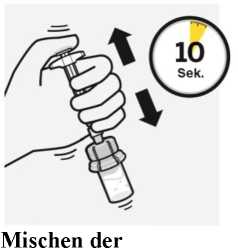
Während Sie den Spritzenkolben mit dem Daumen
heruntergedrückt halten, schütteln Sie die Durchstechflasche für mindestens 10 Sekunden lang kräftig, wie dargestellt. Überprüfen Sie die Suspension. Wenn die Suspension richtig vermischt ist, erscheint sie homogen, dickflüssig und milchig. Die Microsphären-Partikel sind in der Flüssigkeit sichtbar.
Fahren Sie sofort mit dem nächsten Schritt fort, damit sich die Suspension nicht absetzt.
Suspension in die Spritze
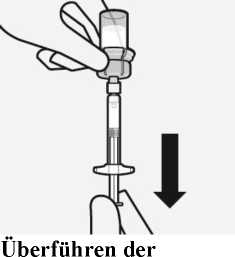
Drehen Sie die Durchstechflasche komplett um. Ziehen Sie langsam den Spritzenkolben nach unten, um den gesamten Inhalt aus der Durchstechflasche in die Spritze zu überführen.
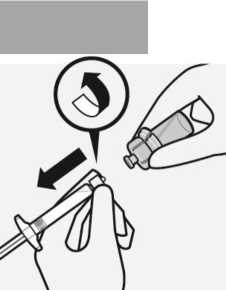
Entfernen des Adapters
Während Sie die weiße Manschette der Spritze halten, schrauben Sie die Spritze vom Adapter ab.
Ziehen Sie das Etikett an der perforierten Stelle von der Durchstechflasche ab und bringen Sie das abgezogene Etikett zur Kennzeichnung an der Spritze an.
Entsorgen Sie sowohl die Durchstechflasche als auch den Adapter sachgemäß.
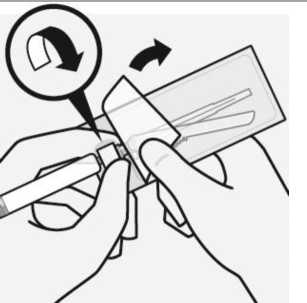
Wählen der geeigneten Nadel
Wählen Sie die Nadel aufgrund der Injektionsstelle aus.
(gluteal oder deltoidal).
Anbringen der Nadel
Öffnen Sie den Blister teilweise und ergreifen Sie damit die Nadel an der Basis, wie dargestellt.
Während Sie die weiße Manschette der Spritze festhalten, verbinden Sie die Spritze mit dem Luer-Verbindungsstück der Nadel durch eine kräftige Bewegung im Uhrzeigersinn, bis sie festsitzt.
Nicht das Luer-Verbindungsstück der Nadel berühren. Dies führt zur Kontamination.
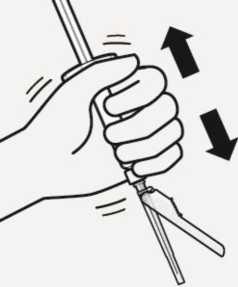
Erneutes Suspendieren der Microsphären-Partikel
Den Blister vollständig entfernen.
Schütteln Sie die Spritze nochmals kräftig direkt vor der Injektion, da sich die Microsphären-Partikel etwas abgesetzt haben.
transparenten
Nadelschutzkappe
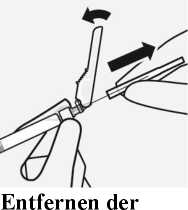
Kippen Sie die Nadelschutzvorrichtung zurück in Richtung der Spritze, wie dargestellt. Halten Sie die weiße Manschette der Spritze fest und ziehen Sie vorsichtig die transparente Nadelschutzkappe gerade von der Nadel ab.
Nicht die transparente Nadelschutzkappe drehen, da sich sonst das Luer-Verbindungsstück lockern kann.
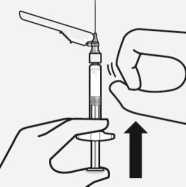
Entfernen von Luftblasen
Halten Sie die Spritze aufrecht und tippen Sie sie leicht an, um evtl. Luftblasen an die Oberfläche steigen zu lassen. Entfernen Sie die Luft aus der Spritze durch vorsichtiges und langsames Herunterdrücken des
Spritzenkolbens.
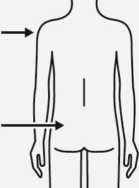
Injektion
Injizieren Sie sofort den gesamten Inhalt der Spritze intramuskulär (i.m.) in den ausgewählten Gluteal- oder Deltamuskel des Patienten.
Eine gluteale Injektion sollte in den oberen äußeren Quadranten des Glutealbereichs erfolgen.
Nicht intravenös verabreichen.
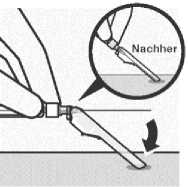
Sichern der Nadel in der
Schutzvorrichtung
Legen Sie die Nadelschutzvorrichtung mit einer Hand in einem
45°-Winkel auf eine harte, ebene Fläche. Drücken Sie mit einer kräftigen, schnellen Bewegung nach unten, bis die Nadel ganz in der Schutzvorrichtung eingerastet ist.
Um Nadelstichverletzungen vorzubeugen:
Nicht beide Hände benutzen.
Nicht absichtlich die Nadelschutzvorrichtung abziehen oder falsch handhaben. Nicht versuchen, die Nadel geradezubiegen oder die Nadelschutzvorrichtung einzurasten, wenn die Nadel verbogen oder beschädigt ist.
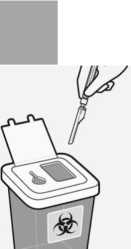
Richtiges Entsorgen der Nadeln
Prüfen Sie, ob die Nadelschutzvorrichtung vollständig eingerastet ist. Entsorgen Sie die Nadel in einem sicheren Behältnis. Entsorgen Sie auch die unbenutzte Nadel, die in der Packung
mitgeliefert wurde.
7. INHABER DER ZULASSUNG
JANSSEN-CILAG GmbH 41457 Neuss Telefon: (02137) 955-955 www.ianssen-cilag.de
8. ZULASSUNGSNUMMER(N)
RISPERDAL CONSTA 25 mg: 52995.00.00
RISPERDAL CONSTA 37,5 mg: 52995.01.00
RISPERDAL CONSTA 50 mg: 52995.02.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 25.04.2002
Datum der letzten Verlängerung der Zulassung: 29.07.2014
10. STAND DER INFORMATION
November 2015
11. VERKAUFSABGRENZUNG Verschreibungspflichtig
30