Ropivacain-Hcl Noridem 2 Mg/Ml Infusionslösung
Wortlaut der für die Fachinformation vorgesehenen Angaben
1. BEZEICHNUNG DES ARZNEIMITTELS
Ropivacain-HCl Noridem 2 mg/ml Injektionslösung Ropivacain-HCl Noridem 7,5 mg/ml Injektionslösung Ropivacain-HCl Noridem 10 mg/ml Injektionslösung Ropivacain-HCl Noridem 2 mg/ml Infusionslösung
2
QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Ropivacainhydrochlorid Monohydrat
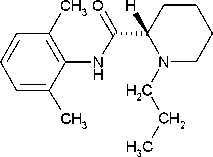
■ HCl ■ H2O
Molekülformel: C17H26N2O HCl H2O Molekulargewicht :328,9
Ropivacain-HCl Noridem 2 mg/ml Injektionslösung:
1 ml enthält 2,12 mg Ropivacainhydrochlorid Monohydrat (entsprechend 2 mg Ropivacainhydrochlorid).
1 Ampulle mit 10 ml bzw. 20 ml Injektionslösung enthält 21,2 mg bzw. 42,3 mg Ropivacainhydrochlorid Monohydrat (entsprechend 20 mg bzw. 40 mg Ropivacainhydrochlorid).
Ropivacain-HCl Noridem 7,5 mg/ml Injektionslösung:
1 ml enthält 7,94 mg Ropivacainhydrochlorid Monohydrat (entsprechend 7,5 mg Ropivacainhydrochlorid).
1 Ampulle mit 10 ml bzw. 20 ml Injektionslösung enthält 79,4 mg bzw. 158,7 mg Ropivacainhydrochlorid Monohydrat (entsprechend 75 mg bzw. 150 mg Ropivacainhydrochlorid).
Ropivacain-HCl Noridem 10 mg/ml Injektionslösung:
1 ml enthält 10,58 mg Ropivacainhydrochlorid Monohydrat (entsprechend 10 mg Ropivacainhydrochlorid).
1 Ampulle mit 10 ml bzw. 20 ml Injektionslösung enthält 105,8 mg bzw. 211,6 mg Ropivacainhydrochlorid Monohydrat (entsprechend 100 mg bzw. 200 mg Ropivacainhydrochlorid).
Ropivacain-HCl Noridem 2 mg/ml Infusionslösung:
1 ml Infusionslösung enthält 2,12 mg Ropivacainhydrochlorid Monohydrat (entsprechend 2 mg Ropivacainhydrochlorid).
1 Infusionsbeutel mit 100 ml bzw. 200 ml Infusionslösung enthält 211,6 mg bzw. 423,2 mg
Ropivacainhydrochlorid Monohydrat (entsprechend 200 mg bzw. 400 mg Ropivacainhydrochlorid).
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Injektionslösung für die perineurale und epidurale Anwendung (10 und 20 ml) Infusionslösung für die perineurale und epidurale Anwendung (100 und 200 ml)
Klare, farblose Lösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Ropivacain-HCl Noridem ist indiziert zur
1. Anästhesie in der Chirurgie
- Epiduralanästhesie für chirurgische Eingriffe einschließlich Kaiserschnitt
- Plexusblockaden
- Leitungs- und Infiltrationsanästhesie
2. Behandlung akuter Schmerzzustände
- kontinuierliche Epiduralinfusion oder intermittierende Bolusverabreichung zur postoperativen und geburtshilflichen Analgesie
- Leitungs- und Infiltrationsanästhesie
- kontinuierliche periphere Nervenblockade durch kontinuierliche Infusion oder intermittierende Bolusinjektionen, z. B zur Behandlung postoperativer Schmerzen.
3. Behandlung akuter Schmerzen bei Kindern (während und nach Operationen)
- kaudale Epiduralblockade bei Neugeborenen, Kleinkindern und Kindern bis einschliesslich
12 Jahren
- kontinuierliche epidurale Infusion bei Neugeborenen, Kleinkindern und Kindern bis einschliesslich 12 Jahren
4.2. Dosierung, Art und Dauer der Anwendung
Art der Anwendung: perineurale und epidurale Anwendung
Ropivacain soll nur von - oder unter der Aufsicht von -Ärzten angewendet werden, die in der Regionalanästhesie erfahren sind.
Erwachsene und Kinder älter als 12 Jahre
Die folgende Tabelle dient als Leitfaden für gebräuchliche Blockaden. Es soll die kleinste Dosis angewendet werden, die eine wirksame Blockade hervorruft. Für die Festlegung der Dosis sind die Erfahrungen des Klinikers sowie die Kenntnisse des Allgemeinzustandes des Patienten ausschlaggebend.
|
Chirurgische Anästhesie | |||||
|
Konz. |
Volumen |
Dosis |
Beginn |
Dauer | |
|
mg/ml |
ml |
mg |
Minuten |
Stunden | |
|
Lumbale Epiduralanästhesie Chirurgie |
7,5 |
15 bis 25 |
113 bis 188 |
10 bis 20 |
3 bis 5 |
|
10,0 |
15 bis 20 |
150 bis 200 |
10 bis 20 |
4 bis 6 | |
|
Kaiserschnitt |
7,5 |
15 bis 20 |
113 bis 1501-1 |
10 bis 20 |
3 bis 5 |
|
Thorakale Epiduralanästhesie Blockade bei postoperativem |
7,5 |
5 bis 15 |
38 bis 113 |
10 bis 20 |
n/z2) |
|
Schmerz |
(abhängig | ||||
|
vom | |||||
|
Injektionsort ) | |||||
|
Plexusblockaden (*) (Plexus-brachialis-Blockaden) |
7,5 |
30 bis 40 |
225 bis 3003) |
10 bis 25 |
6 bis 10 |
|
Leitungs- und Infiltrationsanästhesie (z.B. kleinere Nervenblockaden und Infiltration) |
7,5 |
1 bis 30 |
7,5 bis 225 |
1 bis 15 |
2 bis 6 |
|
Akute Schmerztherapie | |||||
|
Lumbale Epiduralanalgesie Bolus |
2,0 |
10 bis 20 |
20 bis 40 |
10 bis 15 |
0,5 bis 1,5 |
|
Intermittierende Injektion (top- |
2,0 |
10 bis 15 |
20 bis 30 | ||
|
up) |
(Minimum- | ||||
|
(z.B. Behandlung von |
intervall | ||||
|
Wehenschmerz) |
30 Min.) | ||||
|
Kontinuierliche epidurale Infusion, z.B. geburtshilfliche Analgesie |
2,0 |
6 bis 10 |
12 bis 20 |
n/z |
n/z |
|
ml/h |
mg/h | ||||
|
postoperative Analgesie |
2,0 |
6 bis 14 |
12 bis 28 |
n/z |
n/z |
|
ml/h |
mg/h | ||||
|
Thorakale Epiduralanalgesie Kontinuierliche Infusion |
2,0 |
6 bis 14 |
12 bis 28 |
n/z |
n/z |
|
(postoperative Schmerzen) |
ml/h |
mg/h | |||
|
Leitungs- und Infiltrationsanästhesie (z.B. kleinere Nervenblockaden und Infiltration) |
2,0 |
1 bis 100 |
2,0 bis 200 |
1 bis 5 |
2 bis 6 |
|
Periphere Nervenblockade (z.B. N. femoralis-Blockade oder interskalenäre Blockade) Kontinuierliche Infusion oder |
2,0 |
5 bis 10 |
10 bis 20 |
n/z |
n/z |
|
intermittierende Injektionen |
ml/h |
mg/h | |||
(z.B. Behandlung postoperativer
Schmerzen)_
Die in der Tabelle angegebenen Dosierungen sind so festgelegt, dass eine wirksame Blockade erreicht wird und sollten als Richtlinien zur Anwendung bei Erwachsenen betrachtet werden. Individuelle Abweichungen hinsichtlich Einsetzen und Dauer der Blockade treten auf. Die Angaben in der Spalte "Dosis" geben die erwarteten durchschnittlichen Dosisbereiche an. Fachbücher sollten
konsultiert werden für spezifische Blocktechniken und individuelle Patientenanforderungen._
* Hinsichtlich der Plexusblockaden kann nun für die Plexus-brachialis-Blockaden eine
Dosierungsempfehlung gegeben werden. Für andere Plexusblockaden können geringere Dosen erforderlich sein. Es liegen bisher keine Erfahrungen für spezifische Dosisempfehlungen für andere Blockaden vor._
1) Zunehmende Dosen sind anzuwenden, als Anfangsdosis ca. 100 mg (97,5 mg = 13ml; 105 mg = 14 ml) innerhalb von 3 bis 5 min. Zwei zusätzliche Dosen, insgesamt 50 mg, können bei Bedarf verabreicht werden.
2) n/z = nicht zutreffend.
3) Die Dosis für eine Plexusblockade ist je nach Verabreichungsort und Patientenzustand
anzupassen. Interskalenäre und supraklavikuläre Plexus-brachialis-Blockaden können -unabhängig vom verwendeten Lokalanästhetikum - zu einer größeren Häufigkeit von_
schwerwiegenden Nebenwirkungen führen (siehe Abschnitt 4.4 „Wamhinweise und Vorsichtsmaßnahmen für die Anwendung.
Im Allgemeinen erfordert die Anästhesie für Operationen (z. B. epidurale Applikation) die höheren Konzentrationen und Dosen. Zur Epiduralanästhesie wird Ropivacain 10 mg/ml empfohlen, da hier eine ausgeprägte motorische Blockade für die Operation erforderlich ist. Zur Schmerztherapie (z B. epidurale Applikation zur Beherrschung akuter Schmerzzustände) werden die niedrigeren Konzentrationen und Dosen empfohlen.
Anwendungshinweise
Zur Vermeidung einer intravasalen Injektion wird eine wiederholte Aspiration vor und während der Injektion empfohlen. Wenn eine hohe Dosis injiziert werden soll, wird die vorherige Verabreichung einer Testdosis von 3 bis 5 ml Lidocain mit Adrenalin (Epinephrin) (Xylocain® 2 % mit Adrenalin [Epinephrin] 1:200 000) empfohlen. Eine versehentliche intravaskuläre Injektion lässt sich an einer vorübergehenden Erhöhung der Herzfrequenz und eine versehentlichen intrathekale Injektion durch Anzeichen einer Spinalblockade erkennen.
Eine Aspiration sollte vor und während der Applikation der Hauptdosis durchgeführt werden. Die Hauptdosis sollte langsam oder in steigenden Dosen mit einer Geschwindigkeit von 25 bis 50 mg/min injiziert werden, wobei die vitalen Funktionen des Patienten unter dauerndem verbalen Kontakt streng zu überwachen sind. Beim Auftreten toxischer Symptome muss die Injektion sofort gestoppt werden.
Zur Epiduralanästhesie bei chirurgischen Eingriffen wurden Einzeldosen bis zu 250 mg Ropivacain angewendet und gut vertragen.
Eine begrenzte Anzahl von Patienten erhielt zur Plexus-brachialis-Blockade eine Einzeldosis von 300 mg, die gut vertragen wurde.
Bei länger dauernden Blockaden, durch kontinuierliche epidurale Infusion oder durch wiederholte Bolusinjektion, müssen die Risiken toxischer Plasmakonzentrationen oder lokaler Nervenläsionen bedacht werden. Die bei Operationen und postoperativer Analgesie über einen Zeitraum von 24 Stunden kumulativ verabreichten Dosen von bis zu 675 mg Ropivacain wurden vom Erwachsenen gut vertragen, ebenso wie die über einen Zeitraum von 72 Stunden kontinuierlich über eine epidurale Infusion verabreichten Dosen von bis zu 28 mg/Stunde. Eine begrenzte Anzahl von Patienten erhielt höhere Dosen bis zu 800 mg pro Tag, die mit relativ wenigen unerwünschten Wirkungen verbunden waren.
Zur Behandlung postoperativer Schmerzen wird folgende Technik empfohlen:
Falls dies nicht schon präoperativ geschehen ist, wird via Epiduralkatheter mit Ropivacain-HCl Noridem 7,5 mg/ml Injektionslösung eine Epiduralanästhesie eingeleitet. Die Analgesie wird mit einer Infusion von Ropivacain-HCl Noridem 2 mg/ml Infusionslösung aufrechterhalten. Infusionsgeschwindigkeiten von 6 bis 14 ml/ Stunde (12 bis 28 mg) sichern bei mäßigen bis schweren postoperativen Schmerzen in den meisten Fällen eine ausreichende Analgesie mit nur geringer und nicht progressiver motorischer Blockade. Die maximale Anwendungsdauer der Epiduralblockade ist 3 Tage. Der analgetische Effekt sollte überprüft werden, damit bei geringem Restschmerz der Katheter baldmöglichst entfernt werden kann.
Mit dieser Technik wird eine signifikante Reduktion des Bedarfes an Opioiden erreicht.
In klinischen Prüfungen wurde Ropivacain-HCl Noridem 2 mg/ml Infusionslösung als Epiduralinfusion alleine oder gemischt mit 1 bis 4 ^g/ml Fentanyl über bis zu 72 Stunden zur Behandlung von postoperativen Schmerzen gegeben. Die Kombination von Ropivacain und Fentanyl verbesserte die Schmerzlinderung, verursachte aber opioidtypische Nebenwirkungen. Die Kombination von Ropivacain und Fentanyl wurde nur für Ropivacain-HCl Noridem 2 mg/ml Infusionslösung untersucht.
Bei kontinuierlicher peripherer Regionalanästhesie (kontinuierliche Infusion) oder wiederholten Blockaden (wiederholte Injektionen) muss das Risiko von toxischen Plasmakonzentrationen des Lokalanästhetikums bzw. von (technikbedingten) lokalen Nervenläsionen bedacht werden. In klinischen Prüfungen wurde die femorale Nervenblockade mit 300 mg Ropivacain 7,5 mg/ml und einer Interskalenusblock mit 225 mg Ropivacain 7,5 mg/ml gesetzt. Die Schmerzfreiheit wurde anschließend mit Ropivacain 2 mg/ml aufrechterhalten. Infusionsraten oder intermittierende Injektionen von 10 bis 20 mg pro Stunde über 48 Stunden führten zu ausreichender Analgesie und wurden gut vertragen.
Konzentrationen über 7,5 mg Ropivacain/ml sind für die Indikation Kaiserschnitt nicht dokumentiert.
Kinder im Alter von 0 bis einschließlich 12 Jahren:
|
Konz. |
Volumen |
Dosis | |
|
mg/ml |
ml/kg |
mg/kg | |
|
Behandlung akuter Schmerzen (intra- und postoperativ) | |||
|
Einzeitige Epiduralanästhesie Blockade unterhalb von T12, bei Kindern mit einem Körpergewicht von bis zu 25 kg |
2,0 |
1 |
2 |
|
Kontinuierliche epidurale Infusion Bei Kindern mit einem Köpergewicht von bis zu 25 kg 0 bis 6 Monate Bolusa |
2,0 |
0,5-1 |
1-2 |
|
Infusion bis zu 72 Stunden |
2,0 |
0,1 |
0,2 |
|
6 bis 12 Monate |
ml/kg/h |
mg/kg/h | |
|
Bolusa |
2,0 |
0,5-1 |
1-2 |
|
Infusion bis zu 72 Stunden |
0,2 |
0,4 | |
|
1 bis 12 Jahren |
ml/kg/h |
mg/kg/h | |
|
Bolusb |
2,0 |
1 |
2 |
|
Infusion bis zu 72 Stunden |
2,0 |
0,2 |
0,4 |
|
ml/kg/h |
mg/kg/h | ||
|
Die Dosierung in der Tabelle sollte als Richtlinie für die Anwendung bei Kindern betrachtet werden. Individuelle Schwankungen können vorkommen. Bei Kindern mit Übergewicht ist oft eine Dosisreduzierung notwendig. Die Dosierung sollte dann auf dem idealen Körpergewicht basieren. Hinsichtlich Faktoren, die spezifische Blockadetechniken und individuelle | |||
|
Patientenbedürfnisse betreffen, sollten Fachbücher konsultiert werden | |||
|
a Dosen im unteren Bereich des Dosisbereichs werden für thorakale epidurale Blockaden | |||
|
empfohlen, während Dosen im oberen Bereich für lumbale epidurale Blockaden und Kaudal- | |||
|
Blockaden empfohlen werden. | |||
|
b Empfohlen für lumbale epidurale Blockaden. Es ist sinnvoll, die Bolusgabe für eine thorakale epidurale Analgesie zu reduzieren. | |||
Anwendungshinweise
Zur Vermeidung einer intravasalen Injektion wird eine sorgfältige Aspiration vor und während der Injektion empfohlen. Die Vitalfunktionen des Patienten sollten während der Injektion eng überwacht werden. Falls toxische Symptome auftreten, muss die Injektion sofort gestoppt werden. Eine einzelne kaudale Epiduralinjektion von Ropivacain 2 mg/ml bewirkt bei der Mehrzahl der Patienten eine adäquate postoperative Analgesie unterhalb T12, wenn eine Dosis von 2 mg/kg in einem Volumen von 1 ml/kg verwendet wird. Um eine andersartige Ausbreitung der Nervenblockade zu erreichen, kann das Volumen der kaudalen Epiduralinjektion so angepasst werden, wie es in der Fachliteratur empfohlen wird. Es wurden Dosierungen bis zu 3 mg/kg bei einer Ropivacainkonzentration von 3 mg/ml untersucht. Allerdings treten bei dieser Konzentration vermehrt motorische Blockaden auf.
Die Fraktionierung der berechneten Dosis des Lokalanästhetikums wird bei jeder Anwendungsart empfohlen.
Bei Kindern ab 4 Jahre wurden Dosierungen bis zu 3 mg/kg bei einer Ropivacainkonzentration von 3 mg/ml untersucht.
Die Anwendung von Ropivacain bei Frühgeborenen wurde nicht untersucht.
4.3 Gegenanzeigen
- Überempfindlichkeit gegenüber Ropivacain oder anderen Lokalanästhetika vom Amidtyp.
- Allgemeine Gegenanzeigen in Verbindung mit einer Epiduralanästhesie sollten unabhängig vom verwendeten Lokalanästhetikum berücksichtigt werden.
- Intravenöse Regionalanästhesie.
- Parazervikalanästhesie in der Geburtshilfe.
- Hypovolämie.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für der Anwendung
Regionalanästhesien sollten ausschließlich in entsprechend eingerichteten Räumlichkeiten und durch entsprechend ausgebildetes Personal erfolgen. Equipment und Arzneimittel für das Monitoring und eine notfallmäßige Wiederbelebung sind bereitzustellen. Patienten, bei denen eine große Blockade vorgenommen wird, sollten in einem bestmöglichen klinischen Zustand sein und vor Beginn der Blockade einen intravenösen Zugang erhalten. Der verantwortliche Arzt sollte die erforderlichen Vorsichtsmaßnahmen ergreifen, um eine intravasal Injektion zu vermeiden (siehe 4.2 „Dosierung, Art und Dauer der Anwendung“). Er sollte entsprechend ausgebildet sein und über ausreichende Kenntnisse der Anzeichen und Behandlung von Nebenwirkungen, systemischer Toxizität und anderen Komplikationen wie z.B. einer unbeabsichtigten subarachnoidalen Injektion, die eine hohe Spinalanästhesie mit Apnoe und Hypotension verursachen kann, verfügen (siehe Abschnitt 4.8 „Nebenwirkungen“ und 4.9 "Überdosierung"). Nach der Plexus-brachialis-Blockade und der Epiduralanästhesie traten Krämpfe vergleichsweise am häufigsten auf. Dies resultiert wahrscheinlich aus einer akzidentellen intravasalen Injektion oder einer zu schnellen Absorption vom Injektionsort.
Plexusblockaden können implizieren, dass ein großes Volumen eines Lokalanästhetikums in stark vaskularisierten Regionen, oft in der Nähe großer Gefäße, angewendet wird. Dort besteht ein erhöhtes Risiko einer intravasalen Injektion und/oder einer schnellen systemischen Absorption, was zu hohen Plasmakonzentrationen führen kann.
Bestimmte lokalanästhetische Verfahren wie z.B. Injektionen in der Kopf- und Halsregion, können unabhängig vom verwendeten Lokalanästhetikum von einer erhöhten Häufigkeit schwerwiegender unerwünschter Wirkungen verbunden sein. Es ist dafür zu sorgen, dass Injektionen in entzündete Bereiche vermieden werden.
Die Anwendung bei Kindern unter 1 Jahr kann so lange nicht empfohlen werden, bis weitere Erfahrungen vorliegen.
Patienten in altersbedingt schlechtem Allgemeinzustand oder Patienten mit teilweisem oder vollständigem AV-Block, schwerer Leber- oder Nierenfunktionsstörung, benötigen besondere Aufmerksamkeit, auch wenn bei diesen Patienten eine Regionalanästhesie besonders häufig angezeigt ist. Patienten, die mit Antiarrhythmika der Klasse III (z.B. Amiodaron) behandelt werden, sind streng zu überwachen. Ein EKG-Monitoring sollte in Betracht gezogen werden, da sich kardiale Effekte addieren können.
In sehr seltenen Fällen wurde über das Auftreten eines Herzstillstandes während der Anwendung von Ropivacain zur Epiduralanästhesie oder zur peripheren Nervenblockade vor allem nach einer unbeabsichtigten, versehentlichen intravasalen Injektion bei älteren Patienten und bei Patienten mit begleitender Herzerkrankung berichtet. In einigen Fällen war die Weiderbelebung schwierig. Bei einem Herzstillstand können längere Wiederbelebungsversuche erforderlich sein, um die Möglichkeit eines erfolgreichen Ausgangs zu verbessern.
Ropivacain wird in der Leber metabolisiert und sollte daher bei Patienten mit schwerer Leberinsuffizienz mit besonderer Vorsicht angewendet werden. Bei wiederholter Verabreichung kann eine Verminderung der Dosierung zur Anpassung an die verzögerte Ausscheidung erforderlich werden. Bei Anwendung von Einzeldosen oder bei Kurzzeitanwendung ist bei Patienten mit eingeschränkter Nierenfunktion eine Anpassung der Dosis im Allgemeinen nicht erforderlich. Azidose oder verminderte Plasmaproteinkonzentrationen, wie sie häufig bei Patienten mit chronischem Nierenversagen beobachtet werden, erhöhen möglicherweise die systemische Toxizität.
Patienten mit Hypovolämie können während einer Epiduralanästhesie unabhängig vom verwendeten Lokalanästhetikum eine plötzliche und schwere Hypotonie entwickeln.
Eine längere Anwendung von Ropivacain sollte bei Patienten vermieden werden, die gleichzeitig mit starken CYP1A2-Hemmern wie Fluvoxamin und Enoxacin behandelt werden (siehe 4.5).
Eine mögliche Kreuzallergie auf andere Lokalanästhetika vom Amidtyp sollte in Betracht gezogen werden.
Diese Arzneimittel enthält maximal 3,7 mg Natrium pro ml. Dies ist zu berücksichtigen bei Personen unter Natrium kontrollierter (natriumarmer/-kochsalzarmer) Diät.
Kinder
Bei Neugeborenen kann besondere Vorsicht geboten sein, da die Stoffwechselfunktionnen noch nicht vollständig ausgereift sind. In klinischen Untersuchungen variierten die Plasmakonzentrationene von Ropivacain bei Neugeborenen stark. Möglicherweise ist daher das Risiko für eine systemische Toxizität in dieser Altersgruppe erhöht, besonders bei kontinuierlicher epiduraler Infusion.
Die empfohlenen Dosierungsangaben bei Neugeborenen basieren auf begrenzten klinischen Daten. Ropivacain sollte bei diesen Patienten nur unter ständiger Beobachtung bezüglich Anzeichen systemischer Toxizität (z.B. Anzeichen von ZNS-Toxicität, EKG, Blutsauerstoffsättigungswert) und lokalen neurotoxischen Ereignissen (z.B. verlängerte Erholungsphase) angewendet werden. Aufgrund einer langsamen Ausscheidung von Ropivacain bei Neugeborenen sollten diese Kontrollen auch nach der Infusion fortgeführt werden.
4.5 Wechselwirkungen mit anderen Mitteln und sonstige Wechselwirkungen
Ropivacain-HCl Noridem sollte nur mit Vorsicht angewendet werden bei Patienten, die andere Lokalanästhetika oder Arzneimittel erhalten, die strukturell mit Anästhetika vom Amidtyp verwandt sind, da sich die toxischen Wirkungen addieren. Dies trifft z.B. für bestimmte Antiarrhythmika wie Lidocain und Mexiletin zu. Die gleichzeitige Anwendung von Ropivacain-HCl Noridem und Allgemeinanästhetika oder Opioiden kann die jeweiligen (Neben-)Wirkungen verstärken. Es sind keine spezifischen Interaktionsstudien mit Ropivacain und Antiarrhythmika der Klasse III (z.B. Amiodaron) durchgeführt worden, dennoch ist Vorsicht geboten (siehe auch Abschnitt 4.4 „Warnhinweise und Vorsichtsmaßnahmen für die Anwendung“).
Das Cytochrom-P-450(CYP)1A2 ist beteiligt an der Bildung von 3-Hydroxyropivacain, dem Hauptmetaboliten. Bei gleichzeitiger Anwendung von Fluvoxamin, einem selektiven und wirksamen CYP1A2-Hemmer, war die Plasmaclearance in vivo um 77 % vermindert. Somit können starke CYP1A2-Hemmer wie Fluvoxamin und Enoxacin, wenn sie während einer längeren Anwendung von Ropivacain-HCl Noridem gleichzeitig gegeben werden, Wechselwirkungen mit Ropivacain-HCl Noridem haben. Eine längere Anwendung von Ropivacain sollte bei Patienten vermieden werden, die begleitend mit starken CYP1A2-Hemmern behandelt werden (siehe auch 4.4).
Bei gleichzeitiger Verabreichung von Ketoconazol, einem selektiven und wirksamen CYP3A4-Hemmer, wurde die Plasmaclearance von Ropivacain in vivo um 15 % vermindert. Die Hemmung dieses Isoenzyms ist jedoch wahrscheinlich nicht klinisch relevant.
In vitro ist Ropivacain ein kompetitiver Hemmer von CYP2D6, jedoch hemmt es dieses Isoenzym offensichtlich nicht bei klinisch erreichten Plasmakonzentrationen.
4.6 Schwangerschaft und Stillzeit
Schwangerschaft
Mit Ausnahme der epiduralen Anwendung in der Geburtshilfe gibt es keine ausreichenden Daten zur Anwendung von Ropivacain in der Schwangerschaft. In tierexperimentellen Studien zeigten sich keine direkten oder indirekten schädlichen Auswirkungen auf Schwangerschaft, embryonale/fötale Entwicklung, Entbindung oder postnatale. Entwicklung (siehe Abschnitt 5.3 „Präklinische Daten zur Sicherheit“).
Stillzeit
Es gibt keine Untersuchungen beim Menschen zur Frage des Übertritts von Ropivacain in die Muttermilch.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es liegen keine Daten vor. Abhängig von der Dosis kann jedoch ein geringer Einfluss auf psychische Funktionen und die Koordination erwartet werden. Auch wenn sonst keine deutlichen Zeichen einer ZNS-Toxizität vorhanden sind, können die motorische Beweglichkeit und die Reaktionsfähigkeit vorübergehend vermindert sein.
4.8 Nebenwirkungen
Allgemein
Das Nebenwirkungsprofil von Ropivacain entspricht dem anderer lang wirksamer Lokalanästhetika vom Amidtyp.
Die Nebenwirkungen müssen von den physiologischen Wirkungen der Nervenblockade selbst, z. B. einer Abnahme des Blutdrucks und einer Bradykardie während der Epiduralanästhesie, unterschieden werden.
Der zu erwartende Anteil an Patienten, die Nebenwirkungen erleiden, schwankt mit der Art der Anwendung von Ropivacain. Systemische und lokale Nebenwirkungen von Ropivacain treten gewöhnlich wegen übermäßiger Dosierung, schneller Absorption oder versehentlicher intravasaler Injektion auf. Die am häufigsten auftretenden Nebenwirkungen, Übelkeit und Hypotonie, sind während Anästhesie und Operationen im Allgemeinen sehr häufig. Es ist nicht möglich, die Reaktionen, die durch die klinische Situation verursacht werden, von solchen zu unterscheiden, die durch das Arzneimittel oder die Blockade verursacht werden.
Innerhalb jeder Organklasse sind die Nebenwirkungen nach Häufigkeit sortiert, die häufigsten Nebenwirkungen werden zuerst genannt.
Hypotonie3
Übelkeit
Sehr häufig Gefäßsystem:
(>1/10) Magen-Darm:
Häufig
(>1/100)
Nervensystem:
Herz:
Gefäßsystem:
Magen-Darm:
Nieren- und Harnwege:
Parästhesie, Schwindel
Kopfschmerzen
Bradykardie, Tachykardie
Hypertonie
Erbrechenb
Harnretention
|
Allgemein/Applikationsstelle: |
Temperaturerhöhung, Rigor, Rückenschmerzen | |
|
Gelegentlich |
Psyche: |
Angst |
|
(>1/1000) |
Nervensystem: |
ZNS- Toxizitätssymptome (Krämpfe, tonisch-klonische Krämpfe, Anfälle, leichte Benommenheit, zirkumorale Parästhesie, Taubheit der Zunge, Hyperakusis, Tinnitus, Sehstörungen, Dysarthrie, Muskelzucken, Tremor)*, Hypästhesie |
|
Gefäßsystem: |
Synkopen | |
|
Atemwege: |
Dyspnoe | |
|
Allgemein/Applikationsstelle: |
Absinken der Körpertemperatur | |
|
Selten |
Herz: |
Herzstillstand, |
|
(>1/10000) |
Herzrhythmusstörungen | |
|
Allgemein/Applikationsstelle: |
Allergische Reaktionen (anaphylaktische Reaktionen, angioneurotisches Ödem und Urtikaria) |
a Eine Hypotonie kommt bei Kindern seltener vor (>1/100). b Erbrechen tritt bei Kindern häufiger auf (>1/10).
* Diese Symptome treten normalerweise aufgrund versehentlicher intravasaler Injektion, Überdosierung oder schneller Absorption auf (siehe Abschnitt 4.9)
Die häufigsten bei Kindern beobachteten klinisch relevanten Nebenwirkungen sind Erbrechen, Übelkeit, Juckreiz und Harnstau
Klassenbezogene Nebenwirkungen:
Neurologische Komplikationen
Neuropathie und Verletzung des Rückenmarks (z. B. Arteria-spinalis-anterior-Syndrom, Arachnoiditis, Cauda equina Syndrom) wurden mit der Regionalanästhesie in Zusammenhang gebracht und können in seltenen Fällen zu bleibenden Schäden führen. Diese Komplikationen sind unabhängig vom verwendeten Lokalanästhetikum.
Totale spinale Blockade
Eine totale spinale Blockade kann auftreten, wenn versehentlich eine epidurale Dosis versehentlich intrathekal angewendet wird.
4.9 Überdosierung Symptome
Akute systemische Toxizität
Systemische toxische Reaktionen betreffen in erster Linie das zentrale Nervensystem (ZNS) und das kardiovaskuläre System. Solche Reaktionen werden durch hohe Blutkonzentrationen eines Lokalanästhetikums verursacht, die bei einer (versehentlichen) intravasalen Injektion, Überdosierung oder außergewöhnlich schneller Absorption aus stark vaskularisierten Regionen auftreten können (siehe Abschnitt 4.4). ZNS-Reaktionen sind bei allen Lokalanästhetika vom Amidtyp ähnlich, während kardiale Reaktionen stärker, sowohl quantitativ als auch qualitativ, von dem Wirkstoff abhängen.
Eine akzidentelle intravaskuläre Injektion kann unmittelbare (innerhalb von Sekunden bis zu wenigen Minuten) systemische toxische Reaktionen verursachen. Bei einer Überdosierung werden abhängig von der Injektionsstelle Spitzenplasmakonzentrationen erst nach ein bis zwei Stunden nach der Injektion erreicht. Zeichen von Toxizität können daher verzögert auftreten.
Bei Kindern können frühe Anzeichen einer lokalen Toxizität des Anästhetikums schwer erkennbar sein, wenn die Blockade während einer Allgemeinanästhesie durchgeführt wird.
Zentrales Nervensystem
Bei toxischen Wirkungen auf das ZNS können Stufen mit Symptomen ansteigenden Schweregrades unterschieden werden. Anfänglich werden Symptome wie Seh- oder Hörstörungen, periorales Taubheitsgefühl. Schwindelgefühl, leichte Benommenheit, Kribbeln und Parästhesien beobachtet. Dysarthrie, Rigor und Tremor sind schwerwiegender und können den Beginn von generalisierten Krämpfen andeuten. Solche Anzeichen dürfen nicht als Symptome einer neurologischen Grunderkrankung missverstanden werden. Bewusstlosigkeit und tonisch-klonische Krämpfe können folgen, die einige Sekunden bis mehrere Minuten dauern können. Hypoxie und Hyperkapnie treten während der Konvulsionen durch die erhöhte Muskelaktivität zusammen mit Respirationsstörungen rasch auf. In schweren Fällen kann sogar eine Apnoe auftreten. Die respiratorische und metabolische Azidose verstärkt und verlängert die toxischen Wirkungen der Lokalanästhetika.
Nach Rückverteilung des Lokalanästhetikums aus dem ZNS und anschließendem Abbau und Exkretion tritt dann wieder Erholung ein. Wenn nicht große Mengen des Wirkstoffes injiziert wurden, kann sich der Zustand des Patienten rasch normalisieren.
Kardiovaskuläre Toxizität
Die Symptome der kardiovaskulären Toxizität sind schwerwiegender. Hypotonie, Bradykardie, Arrhythmie und sogar Herzstillstand können infolge hoher systemischer Konzentrationen des Lokalanästhetikums auftreten. Die i.v. -Infusion von Ropivacain bewirkte bei freiwilligen Probanden eine Verringerung der Reizleitung und Kontraktilität.
Toxischen Wirkungen auf das kardiovaskuläre System gehen im Allgemeinen ZNS-Toxizitätssymptome voraus, es sei denn, der Patient erhält eine Allgemeinanästhesie oder ist durch Substanzen wie Benzodiazepine oder Barbiturate stark sediert.
Akuttherapie
Ausrüstung und Arzneimittel für das Monitoring sowie eine notfallmäßige Wiederbelebung sind unmittelbar zur Verfügung zu stellen. Wenn akute systemische Intoxikationserscheinungen auftreten, muss die Injektion des Lokalanästhetikums sofort gestoppt werden.
Im Fall von Krämpfen ist eine entsprechende Behandlung erforderlich. Die Behandlungsziele sind die Aufrechterhaltung der Sauerstoffversorgung, die Beseitigung der Krämpfe und die Unterstützung des Kreislaufs. Es muss Sauerstoff verabreicht werden und - wenn nötig - die Atmung mittels Beatmungsbeutel unterstützt werden. Wenn die Krämpfe nicht spontan innerhalb von 15 bis 20 Sekunden abklingen, muss ein Antikonvulsivum i.v. verabreicht werden. Thiopental Natrium, 1 bis 3 mg/kg, i v. löst die Krämpfe rasch. Alternativ dazu kann Diazepam, 0,1 mg/kg, i.v. gegeben werden, auch wenn die Wirkung langsamer eintritt. Suxamethonium (Succinylcholin) stoppt die Muskelkrämpfe rasch, aber der Patient benötigt eine kontrollierte Beatmung und tracheale Intubation.
Bei kardiovaskulärer Depression (Hypotonie. Bradykardie) soll ein Vasokonstriktor i.v. verabreicht werden, diese Behandlung ist, wenn notwendig, nach 2 bis 3 Minuten zu wiederholen. Kinder sollten Dosen entsprechend ihrem Alter und Gewicht verabreicht werden.
Sollte ein Kreislaufstillstand eintreten, müssen umgehend kardiopulmonale Wiederbelebungsmaßnahmen ergriffen werden. Eine optimale Sauerstoffzufuhr, künstliche Beatmung. Kreislaufunterstützung und die Behandlung der Azidose sind lebenswichtig.
Bei einem Herzstillstand kann ein erfolgreicher Ausgang längere Wiederbelebungsversuche voraussetzen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1. Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Lokalanästhetika, Amide ATC-Code: N01 B B09
Ropivacain ist ein langwirksames Lokalanästhetikum vom Amidtyp mit sowohl anästhetischen als auch analgetischen Wirkungen. In hohen Dosen ruft es eine für chirurgische Eingriffe geeignete Anästhesie hervor, während es in niedrigeren Dosen sensorische Blockaden (Analgesie) mit begrenzter und nichtprogressiver motorischer Blockade bewirkt.
Der Mechanismus beruht auf einer reversiblen Verminderung der Membranpermeabilität der Nervenfaser für Natriumionen. Als Folge davon vermindert sich die Depolarisationsgeschwindigkeit und die Reizschwelle wird erhöht. Dies führt schließlich zu einer lokalen Blockade der Nervenimpulse.
Besonders charakteristisch für Ropivacain ist die lange Wirkdauer. Latenzzeit und Wirkdauer der Lokalanästhesie hängen vom Applikationsort ab. Durch Zugabe eines Vasokonstriktors (z. B. Adrenalin [Epinephrin]) kann die Wirkdauer nicht verlängert werden. Weitere Informationen siehe Dosierungstabelle im Abschnitt "Dosierung, Art und Dauer der Anwendung".
Gesunde Probanden vertrugen eine i.v.-Infusion mit Ropivacain bei geringen Dosen sehr gut und bei den maximal tolerierten Dosen mit den erwarteten ZNS-Symptomen. Die klinischen Erfahrungen mit diesem Arzneimittel deuten auf eine große therapeutische Breite hin, wenn es entsprechend den empfohlenen Dosierungen verwendet wird.
5.2. Pharmakokinetische Eigenschaften
Ropivacain hat ein chirales Zentrum und ist als reines S-(-)-Enantiomer verfügbar. Es ist stark fettlöslich. Alle Metaboliten haben lokalanästhetische Wirkung, jedoch mit beträchtlich geringerer Stärke und kürzerer Dauer als Ropivacain.
Die Plasmakonzentration von Ropivacain hängt von der Dosis, der Art der Applikation und der Vaskularisierung des Gewebes der Injektionsstelle ab. Ropivacain hat eine lineare Pharmakokinetik und die maximale Plasmakonzentration ist proportional zur Dosis.
Ropivacain wird vollständig aus dem Epiduralraum resorbiert. Die Halbwertszeiten für die schnelle und die langsame Phase des biphasischen Prozesses liegen bei Erwachsenen im Bereich von 14 Minuten bzw. 4 Stunden. Die langsame Resorption ist der limitierende Faktor der Eliminierung von Ropivacain, was erklärt, warum die gemessene terminale Halbwertszeit nach epiduraler Verabreichung länger ist als nach i.v.-Verabreichung.
Bei Kindern verläuft die Resorption von Ropivacain aus dem Epiduralraum ebenfalls zweiphasig.
Ropivacain hat eine mittlere Gesamtplasmaclearance von 440 ml/min, eine renale Clearance von 1 ml/min, ein Verteilungsvolumen im Steady state von 47 l und eine terminale Halbwertszeit von 1,8 h nach i.v.-Verabreichung. Ropivacain hat ein mittleres hepatisches Extraktionsverhältnis von ca. 0,4. Es ist im Plasma hauptsächlich an alpha-1-saures Glykoprotein (AAG) gebunden, der ungebundene Anteil beträgt ca. 6 %.
Bei kontinuierlicher epiduraler und interskalenärer Infusion wurde im Zusammenhang mit einem postoperativen Anstieg des alpha-1-sauren Glykoproteins ein Anstieg der Gesamtkonzentration im Plasma beobachtet.
Schwankungen der ungebundenen, d.h. pharmakologisch aktiven Fraktion waren sehr viel geringer als die der Gesamtplasmakonzentration.
Ropivacain besitzt eine mittlere bis geringe hepatische Eliminationsrate. Daher sollte seine Eliminationsgeschwindigkeit von der ungebundenen Plasmakonzentration abhängen. Ein postoperativer Anstieg des AAG verringert die ungebundene Fraktion aufgrund der zunehmenden Proteinbindung. Wie man in Studien bei Kindern und Erwachsenen gesehen hat, wird hierdurch wiederum die Gesamtclearance herabgesetzt, was zu einem Anstieg der Gesamtplasmaclearance führt. Die Clearance der ungebundenen Anteile von Ropivacain bleibt unverändert, wie sich
während postoperativer Infusionen anhand der stabilen Konzentrationen der ungebundenen Fraktion zeigen ließ. Pharmakodynamische Effekte und Toxizität hängen demnach mit dem ungebundenen Anteil im Plasma zusammen.
Ropivacain überwindet die Plazentaschranke leicht und es stellt sich schnell ein Gleichgewicht der ungebundenen Konzentration im Plasma ein. Das Ausmaß der Plasmaproteinbindung im Fetus ist geringer als bei der Mutter, was beim Fetus zu geringeren Gesamtplasmakonzentrationen führt als bei der Mutter.
Ropivacain wird extensiv metabolisiert, vorwiegend durch aromatische Hydroxylierung. Insgesamt werden nach i.v.-Verabreichung 86 % der Dosis über den Urin ausgeschieden, jedoch nur ca. 1 % als unveränderte Substanz. Der Hauptmetabolit ist das 3-Hydroxy-Ropivacain (ca. 37 %), das hauptsächlich in konjugierter Form über den Urin ausgeschieden wird. Die Ausscheidung von 4-Hydroxy-Ropivacain, dem N-dealkylierten und dem 4-Hydroxy-dealkylierten Metaboliten beträgt ca. 1 bis 3 % der Dosis. Konjugiertes und unkonjugiertes 3-Hydroxy-Ropivacain treten nur in gerade nachweisbaren Konzentrationen im Plasma auf.
Ein ähnliches Metabolitenmuster wurde bei Kindern älter als 1 Jahr festgestellt.
Es gibt keinen Hinweis auf eine In-vivo-Razemisierung von Ropivacain.
Kinder
Die Pharmakokinetik von Ropivacain wurde ein einer gepoolten PK Patientenanalyse mit Daten von 192 Kindern zwischen 0 und 12 Jahren untersucht. Die Clearance des ungebundenen Ropivacains und des PPX sowie das Verteilungsvolumen der ungebundenen Fraktion hängen bis zur vollständigen Ausreifung der Leberfunktion von Körpergewicht und Alter ab. Danach hängt die Clearance vorwiegend vom Körpergewicht ab. Dies ist anscheinend für das ungebundenen Ropivacain mit 3 Jahren der Fall, für PPX bereits mit 1 Jahr und für das Verteilungsvolumen der ungebundenen Fraktion es Ropivacains mit 2 Jahren. Das Verteilungsvolumen des ungebundenen PPX ist nur vom Körpergewicht abhängig. PPX kann während der Epiduralinfusion kumulieren, da es eine längere Halbwertszeit und eine geringere Clearance besitzt.
Die Clearance (CIu) des ungebundenen Ropivacains erreichte bei Kindern über 6 Monaten werte die im für Erwachsenen typischen Bereich lagen. Die in der Tabelle aufgeführten Werte der totalen Clearance (CL) wurden nicht durch den postoperativen Anstieg des AAG beeinflusst.
Berechnung der pharmakokinetischen Parameter aus der gepoolten pädiatrischen PK Analyse:
|
Altersgruppe |
Körpergewicht3 kg |
Club (l/h/kg) |
Vuc (l/kg) |
CLd (l/h/kg) |
t y2 (h)e |
t y2 ppx(h)f |
|
Neugeborenen |
3,27 |
2,40 |
21,86 |
0,096 |
6,3 |
43,3 |
|
1 Monat |
4,29 |
3,60 |
25,94 |
0,143 |
5,0 |
25,7 |
|
6 Monate |
7,85 |
8,03 |
41,71 |
0,320 |
3,6 |
14,5 |
|
1 Jahr |
10,15 |
11,32 |
52,60 |
0,451 |
3,2 |
13,6 |
|
4 Jahre |
16,69 |
15,91 |
65,24 |
0,633 |
2,8 |
15,1 |
|
10 Jahre |
32,19 |
13,94 |
65,57 |
0,555 |
3,3 |
17,8 |
a Mittleres Körpergewicht der jeweiligen Altersgruppe gemäß WHO Datenbank b Clearance des ungebundenen Ropivacains c Verteilungsvolumen des ungebundenen Ropivacains d Totale Ropivacainclearance e Terminale Halbwertszeit von Ropivacain f Terminale Halbwertszeit von PPX
Die nach einer Kaudal-Blockade kalkulierten mittleren maximalen Plasmakonzentration (Cumax) waren bei Neugeborenen höher und die Zeit bis Cumax (tmax) erreicht war nahm mit zunehmenden Alter ab (Tabelle unten). Die kalkulierten mittleren ungebundenen Plasmakonzentrationen nach 72-stündiger epiduraler Infusion in den empfohlenen Dosierungen lagen bei Neugeborenen ebenfalls höher als bei Kleinkindern und Kindern (siehe Abschnitt 4.4).
Kalkulierte mittlere und beobachtete Bereiche von ungebundenem Cumax nach einzeitiger KaudalBlockade:
|
Altersgruppe |
Dose (mg/kg) |
Cu max (mg/l) |
T max |
Cu max (mg/l) |
|
0-1 Monate |
2,00 |
0,0582 |
2,00 |
0,05-0,08 (n=5) |
|
1-6 Monate |
2,00 |
0,0375 |
1,50 |
0,02-0,09 (n=18) |
|
6-12 Monate |
2,00 |
0,0283 |
1,00 |
0,01-0,05 (n=9) |
|
1-10 Jahre |
2,00 |
0,0221 |
0,50 |
0,01-0,05 (n=60) |
a Ungebundene maximale Plasmakonzentrationen b Zeit, bis die ungebundene maximale Plasmakonzentration erreicht ist. c Beobachtete und dosisangepasste ungebundene maximale Plasmakonzentrationen.
Im Alter von 6 Monaten, dem Zeitpunkt für eine Änderung der empfohlenen Dosierung zur kontinuierlichen epiduralen Infusion, erreicht die Clearance des ungebundenen Ropivacains 34% und die Clearance des ungebundenen PXX 71% des Wertes beim Erwachsenen. Im Vergleich zu älteren Kindern ist die systemische Verfügbarkeit bei Neugeborenen und Kindern zwischen 1 und 6 Monate höher, was mit der Unreife ihrer Leberfunktion zusammenhängt. Dies wird jedoch zum Teil dadurch kompensiert, dass bei Kleinkindern unter 6 Monaten für die kontinuierliche Infusion einen um 50 % reduzierte Dosierung empfohlen wird.
Eine auf den in der Patientenanalyse ermittelten PK Parametern und ihrer Varianz basierte Kalkulation für die Plasmakonzentrationen von ungebundenem Ropivacain und PPX zeigt, dass für eine einzelne Kaudal-Blockade die empfohlene Dosis in der jüngsten Altersgruppe um den Faktor 2,7 gesteigert werden muss und bei den 1- bis 10-Jährigen um den Faktor 7,4. Dies ist notwendig, damit der obere Grenzwert des 90%-Konfidenzintervalls den Grenzwert für eine systemische Toxizität erreicht. Die entsprechenden Faktoren für die kontinuierliche epidurale Infusion sind 1,8 bzw. 3,8.
5.3 Präklinische Daten zur Sicherheit
Aus den üblichen Studien zur Sicherheitspharmakologie, akuten und chronischen Toxizität, Reproduktionstoxizität, Mutagenität und lokalen Verträglichkeit ließen sich keine Risiken für die Anwendung beim Menschen erkennen, abgesehen von den Risiken, die auf Grund des Wirkmechanismus bei hohen Dosen von Ropivacain erwartet werden können (z. B. ZNS-Symptome einschließlich Konvulsionen, Kardiotoxizität)
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Natriumchlorid, Natriumhydroxid/Salzsäure (3,6 %) zur pH-Wert-Einstellung, Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Die Verträglichkeit mit anderen Lösungen als den unter Punkt 6.6 erwähnten wurde nicht untersucht. In alkalischen Lösungen können Niederschläge auftreten, da Ropivacain bei einem pH > 6 schwer löslich ist.
6.3 Dauer der Haltbarkeit
Kunststoffampullen:
3 Jahre
Infusionsbeutel:
3 Jahre
Dauer der Haltbarkeit nach dem ersten Öffnen:
Aus mikrobiologischer Sicht sollte das Produkt unmittelbar verwendet werden. Wird es nicht unmittelbar verwendet, liegen die Verwendungsdauer und Aufbewahrungsbedingungen, vor der Anwendung in der Verantwortlichkeit des Anwenders; die Verwendungsdauer des Produktes ist normalerweise nicht länger als 24 Stunden bei 2 bis 8 °C.
Zur Mischung siehe Abschnitt 6.6.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 30°C lagern.
Nicht einfrieren.
Zur Lagerung nach dem Öffnen siehe Abschnitt 6.3.
Für Kinder unzugänglich aufbewahren.
6.5 Art und Inhalt des Behältnisses
Ropivacain-HCl Noridem 2 mg/ml Injektionslösung - 10 ml Ampulle:
5 Polypropylen-Ampullen mit je 10 ml Injektionslösung steril verpackt [N 1]
50 (5 x 2 x 5) Polypropylen-Ampullen mit je 10 ml Injektionslösung steril verpackt [Klinikpackung]
Ropivacain-HCl Noridem 2 mg/ml Injektionslösung - 20 ml Ampulle:
5 Polypropylen-Ampullen mit je 20 ml Injektionslösung steril verpackt [N 1]
50 (5 x 2 x 5) Polypropylen-Ampullen mit je 20 ml Injektionslösung steril verpackt [Klinikpackung]
Ropivacain-HCl Noridem 7,5 mg/ml Injektionslösung - 10 ml Ampulle:
5 Polypropylen-Ampullen mit je 10 ml Injektionslösung steril verpackt [N 1]
50 (5 x 2 x 5) Polypropylen-Ampullen mit je 10 ml Injektionslösung steril verpackt [Klinikpackung]
Ropivacain-HCl Noridem 7,5 mg/ml Injektionslösung - 20 ml Ampulle:
5 Polypropylen-Ampullen mit je 20 ml Injektionslösung steril verpackt [N 1]
50 (5 x 2 x 5) Polypropylen-Ampullen mit je 20 ml Injektionslösung steril verpackt [Klinikpackung]
|
Ropivacain-HCl Noridem 10 mg/ml Injektionslösung - 10 ml Ampulle: | ||
|
5 Polypropylen-Ampullen mit je 10 ml Injektionslösung steril verpackt [N 1] | ||
|
50 (5 x 2 x 5) Polypropylen-Ampullen mit je 10 ml Injektionslösung steril verpackt [Klinikpackung] | ||
Ropivacain-HCl Noridem 10 mg/ml Injektionslösung - 20 ml Ampulle:
5 Polypropylen-Ampullen mit je 20 ml Injektionslösung steril verpackt [N 1]
50 (5 x 2 x 5) Polypropylen-Ampullen mit je 20 ml Injektionslösung steril verpackt [Klinikpackung]
Ropivacain-HCl Noridem 2 mg/ml Infusionslösung - 100 ml Infusionsbeutel:
5 Polypropylen-Infusionsbeutel mit je 100 ml Infusionslösung steril verpackt [N 1]
20 (4 x 5) Polypropylen-Infusionsbeutel mit je 100 ml Infusionslösung steril verpackt
[Klinikpackung]
Ropivacain-HCl Noridem 2 mg/ml Infusionslösung - 200 ml Infusionsbeutel:
5 -Polypropylen-Infusionsbeutel mit je 200 ml Infusionslösung steril verpackt [N 1]
20 (4 x 5) Polypropylen-Infusionsbeutel mit je 200 ml Infusionslösung steril verpackt
[Klinikpackung]
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Die Ropivacain-HCl Noridem Produkte enthalten keine Konservierungsstoffe und sind deshalb nur zum einmaligen Gebrauch geeignet. Nicht verbrauchte Lösungen sind zu verwerfen.
Das noch nicht geöffnete Behältnis darf nicht autoklaviert werden Wenn ein steriles Äußeres erforderlich ist, sollte ein geblistertes Behältnis benutzt werden.
Die Kompatibilität von Ropivacain-HCl Noridem 2 mg/ml Infusionslösung in
Kunststoffinfusionsbeuteln wurde chemisch und physikalisch mit den folgenden Produkten untersucht und veröffentlicht im Journal of Clinical Pharmacy and Therapeutics (2002) 27, 39-45:
|
Konzentration von Ropivacain-HC |
Noridem: 1 bis 2 mg/ml |
|
Zusatz |
Konzentration * |
|
Fentanylcitrat |
1,0 - 10,0 pg/ml |
|
Sufentanylcitrat |
0,4 - 4,0 pg/ml |
|
Morphinsulfat |
20,0 - 100,0 pg/ml |
|
Clonidinhydrochlorid |
5,0 - 50,0 pg/ml |
(*)Die in der Tabelle wiedergegebenen, Konzentrationsbereiche sind größer als die in der klinischen Praxis. Die epidurale Infusion von Ropivacain /Chlonidinhydrochlorid wurde in klinischen Studien nicht untersucht.
Die Mischungen sind bei 20 bis 30 °C über 30 Tage chemisch und physikalisch stabil. Aus mikrobiologischer Sicht sollten die Mischungen unmittelbar verwendet werden. Werden diese nicht unmittelbar verwendet, liegen die Verwendungsdauer und Aufbewahrungsbedingungen vor der Anwendung in der Verantwortlichkeit des Anwenders; die Verwendungsdauer der Mischungen ist normalerweise nicht länger als 24 Stunden bei 2 bis 8 °C.
7. INHABER DER ZULASSUNG
Noridem Enterprises Ltd.
Evagorou & Makariou, Mitsi Building 3, Suite 115,
1065 Nikosia Zypern
Mitvertrieb:
DEMO Pharmaceuticals GmbH Airport Business Center Am Söldnermoos 17 D-85399 Hallbergmoos Tel: 0811/555455-0
8. ZULASSUNGSNUMMER(N)
Ropivacain-HCl Noridem 2 mg/ml Injektionslösung: 78032.00.00 Ropivacain-HCl Noridem 7,5 mg/ml Injektionslösung: 78034.00.00 Ropivacain-HCl Noridem 10 mg/ml Injektionslösung: 78035.00.00 Ropivacain-HCl Noridem 2 mg/ml Infusionslösung: 78036.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
03.11.2009
10. STAND DER INFORMATION
Februar 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig