Ropivacain-Kk 5 Mg/Ml Injektionslösung
Fachinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Ropivacain-KK 5 mg/ml Injektionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Ropivacainhydrochlorid Monohydrat
CH o, H
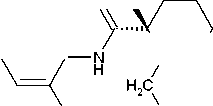
CH,
CH2
/ 2
H3C
N-' ■ HCl ■ H2O
Molekülformel: C17H26N2O HCl H2O Molekulargewicht:328,9 1 ml Injektionslösung enthält 5,29 mg Ropivacainhydrochlorid Monohydrat (entsprechend 5 mg Ropivacainhydrochlorid).
1 Ampulle mit 10 ml bzw. 20 ml Injektionslösung enthält 52,9 mg bzw. 105,8 mg Ropivacainhydrochlorid Monohydrat (entsprechend 50 mg bzw. 100 mg Ropivacainhydrochlorid).
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Injektionslösung Klare, farblose Lösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Ropivacain-KK 5 mg/ml ist indiziert bei Erwachsenen
• zur intrathekalen Anwendung zur Anästhesie bei chirurgischen Eingriffen
Bei Kleinkindern ab 1 Jahr und Kindern bis einschließlich 12 Jahren zur akuten Schmerztherapie (intra- und postoperativ):
• zur einzeitigen peripheren Nervenblockade
4.2. Dosierung, Art und Dauer der Anwendung
Art der Anwendung: Zur intrathekalen Anwendung zur Anästhesie bei chirurgischen Eingriffen
Ropivacain soll nur von oder unter der Aufsicht von Ärzten angewendet werden, die in der Regionalanästhesie erfahren sind.
Dosierung
Die folgende Tabelle dient als Leitfaden für die Dosierung bei der intrathekalen Anwendung bei Erwachsenen. Es soll die kleinste Dosis angewendet werden, die eine wirksame Blockade hervorruft. Für die Festlegung der Dosis sind die Erfahrungen des Narkosearztes sowie die Kenntnisse des Allgemeinzustandes des Patienten ausschlaggebend.
Dosierung für die intrathekale Anwendung bei Erwachsenen
|
Konzentration von Ropivacain- hydrochlorid [mg/ml] |
Volumen [ml] |
Dosis von Ropivacain- hydrochlorid [mg] |
Beginn Minuten] |
Dauer Stunden] | |
|
Anästhesie bei chirurgischen Eingriffen | |||||
|
Intrathekale Anwendung | |||||
|
Chirurgie |
5,0 |
3-5 |
15-25 |
1-5 |
2-6 |
|
Die in der Tabelle angegebenen Dosierungen sind so festgelegt, dass eine wirksame Blockade erreicht wird und sollten als Richtlinien zur Anwendung bei Erwachsenen betrachtet werden. Individuelle Abweichungen hinsichtlich Einsetzen und Dauer der Blockade können auftreten. Die Angaben in der Spalte "Dosis" geben die erwarteten durchschnittlichen Dosisbereiche an. Hinsichtlich der Faktoren, die spezielle Blocktechniken betreffen, und für individuelle Patientenanforderungen sollte Fachliteratur konsultiert werden. | |||||
Kinder
Die intrathekale Anwendung wurde weder bei Säuglingen, Kleinkindern noch bei Kindern untersucht.
Art der Anwendung
Zur Vermeidung einer intravasalen Injektion wird eine sorgfältige Aspiration vor und während der Injektion empfohlen.
Eine Aspiration sollte vor und während der Applikation der Hauptdosis durchgeführt werden. Die Hauptdosis sollte langsam mit einer Geschwindigkeit von 25-50 mg/min injiziert werden, wobei die vitalen Funktionen des Patienten unter dauerndem verbalen Kontakt streng zu überwachen sind. Beim Auftreten toxischer Symptome muss die Injektion sofort gestoppt werden.
Die intrathekale Injektion sollte erfolgen, nachdem der Subarachnoidalraum identifiziert wurde und Liquor aus der Spinalkanüle austritt oder aspiriert werden kann.
Einzeitige Injektion zur peripheren Nervenblockade Kinder
Kleinkinder ab 1 Jahr und Kinder bis einschließlich 12 Jahren
|
Konzentration von Ropivacain-hydrochlorid [mg/ml] |
Volumen [ml/kg] |
Dosis von Ropivacain-hydrochlorid [mg/kg] | |
|
Einzeitige Injektion zur peripheren Nervenblockade (z.B. Ilioinguinalnerv-Blockade, Plexus-brachialis-Blockade) bei Kindern im Alter von 1 bis 12 Jahren |
5,0 |
0,5-0,6 |
2,5-3,0 |
|
Die in der Tabelle angegebenen Dosierungen sollen als Richtlinien zur Anwendung bei Kindern betrachtet werden. Individuelle Abweichungen können auftreten. Bei übergewichtigen Kindern ist oft eine Dosisreduzierung notwendig. Die Dosierung sollte dann auf dem idealen | |||
Körpergewicht basieren. Hinsichtlich der Faktoren, die spezielle Blocktechniken betreffen, oder für individuelle Patientenanforderungen sollte Fachliteratur konsultiert werden_
Die empfohlene Dosierung für die periphere Nervenblockade bei Kleinkindern und Kindern gibt Richtgrößen für Kinder ohne schwerwiegende Erkrankung an. Bei Kindern mit schwerwiegenden Erkrankungen werden eher konservative Dosierungen und eine engmaschige Überwachung empfohlen.
Ropivacain 5 mg/ml ist für die Anwendung bei Kindern unter 1 Jahr nicht zugelassen. Die Anwendung von Ropivacain bei Frühgeborenen ist nicht belegt.
Anwendungshinweise
Zur Vermeidung einer intravasalen Injektion wird eine sorgfältige Aspiration vor und während der Injektion empfohlen. Die Vitalfunktionen des Patienten sollten während der Injektion eng überwacht werden. Falls toxische Symptome auftreten, muss die Injektion sofort gestoppt werden.
Eine Fraktionierung der berechneten Dosis des Lokalanästhetikums wird empfohlen.
Im Rahmen von Ultraschalluntersuchungen kann oftmals eine geringere Dosis erforderlich sein (siehe Abschnitt 5.2).
Nach Verabreichung von Ropivacain 5 mg/ml in Dosen von 3,5 mg/kg (0,7 ml/kg) wurden hohe Plasmakonzentrationen beobachtet, ohne dass systemische Toxizitätssymptome auftraten. Es wird die Anwendung von niedrigeren Ropivacain-Konzentrationen für Blockaden empfohlen, bei denen größere Volumina, die über die Dosis von 3 mg/ml (0,6 ml/kg) hinausgehen, benötigt werden (z.B. bei einer Blockade des Fascia-iliaca-Kompartments).
4.3 Gegenanzeigen
- Überempfindlichkeiten gegenüber Ropivacain oder anderen Lokalanästhetika vom Amidtyp oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
- Allgemeine Gegenanzeigen in Verbindung mit einer Regionalanästhesie sollten unabhängig vom verwendeten Lokalanästhetikum berücksichtigt werden.
- Intravenöse Regionalanästhesie.
- Parazervikalanästhesie in der Geburtshilfe.
- Große Nervenblockaden sind bei hypovolämischen Patienten kontraindiziert.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für der Anwendung
Regionalanästhesien sollten ausschließlich in entsprechend eingerichteten Räumlichkeiten und durch entsprechend ausgebildetes Personal erfolgen. Ausrüstung und Arzneimittel für das Monitoring und eine notfallmäßige Wiederbelebung müssen sofort verfügbar sein.
Patienten, bei denen eine große Blockade vorgenommen wird, sollten in einem optimalen Zustand sein und vor Beginn der Blockade einen intravenösen Zugang erhalten.
Der verantwortliche Arzt sollte die erforderlichen Vorsichtsmaßnahmen ergreifen, um eine intravasale Injektion zu vermeiden (siehe Abschnitt 4.2). Er sollte entsprechend ausgebildet sein und über ausreichende Kenntnisse bezüglich der Anzeichen und der Behandlung von Nebenwirkungen, systemischer Toxizität und anderen Komplikationen verfügen. Aufgrund der geringen angewendeten Dosis ist nach einer intrathekalen Anwendung keine systemische Toxizität zu erwarten. Werden zu hohe Dosen in den Spinalraum appliziert, kann dies zu einer totalen spinalen Blockade führen (siehe 4.9).
Herz-Kreislauf
Patienten, die mit Antiarrhythmika der Klasse III (z.B Amiodaron) behandelt werden, sind streng zu überwachen. Ein EKG-Monitoring sollte in Betracht gezogen werden, da sich kardiale Effekte addieren können.
Überempfindlichkeit
Eine mögliche Kreuz-Überempfindlichkeit mit anderen Lokalanästhetika vom Amidtyp sollte in Betracht gezogen werden (siehe Abschnitt 4.3).
Hypovolämie
Patienten mit Hypovolämie gleich welcher Ursache können während einer intrathekalen Anästhesie unabhängig vom verwendeten Lokalanästhetikum eine plötzliche und schwere Hypotonie entwickeln.
Patienten im schlechten Allgemeinzustand
Patienten in altersbedingt schlechtem Allgemeinzustand oder anderen beeinträchtigenden Faktoren, wie teilweisem oder vollständigem AV-Block, fortgeschrittener Lebererkrankung oder schwerer Nierenfunktionsstörung, benötigen besondere Aufmerksamkeit, auch wenn bei diesen Patienten eine Regionalanästhesie häufig angezeigt ist.
Patienten mit Funktionsstörung von Leber und Niere
Ropivacain wird in der Leber metabolisiert und sollte daher bei Patienten mit schwerer Lebererkrankung mit Vorsicht angewendet werden. Bei wiederholter Gabe kann eine Verminderung der Dosierung zur Anpassung an die verzögerte Ausscheidung erforderlich werden.
Bei Anwendung von Einzeldosen oder bei Kurzzeitanwendung ist bei Patienten mit eingeschränkter Nierenfunktion eine Anpassung der Dosis im Allgemeinen nicht erforderlich. Azidose oder verminderte Plasmaproteinkonzentration, wie sie häufig bei Patienten mit chronischem Nierenversagen beobachtet werden, erhöhen möglicherweise die systemische Toxizität.
Akute Porphyrie
Ropivacain Injektionslösung kann möglicherweise eine Porphyrie auslösen und sollte bei Patienten mit akuter Pophyrie nur angewendet werden, wenn keine sichere Alternative zur Verfügung steht. Entsprechende Vorsichtsmaßnahmen bei gefährdeten Patienten sollten gemäß der Fachliteratur und/oder in Absprache mit einem Spezialisten erfolgen.
Langzeitanwendung
Eine längere Anwendung von Ropivacain sollte bei Patienten vermieden werden, die gleichzeitig mit starken CYP1A2-Hemmern wie Fluvoxamin und Enoxacin behandelt werden (siehe 4.5).
Kinder
Die intrathekale Anwendung bei Säuglingen, Kleinkindern und Kindern ist nicht dokumentiert.
Die Sicherheit und Wirksamkeit von Ropivacain 5 mg/ml zur peripheren Nervenblockade sind für Kinder unter 1 Jahr nicht belegt.
Ropivacain 5 mg/ml ist für die Anwendung bei Kindern unter 1 Jahr nicht zugelassen. Aufgrund ihrer noch unausgereiften Stoffwechselwege würden Neugeborene eine besondere Aufmerksamkeit benötigen. Die größeren Abweichungen in Bezug auf die Plasmakonzentrationen von Ropivacain, die in klinischen Studien bei Neugeborenen beobachtet wurden, lassen vermuten, dass für diese Altersgruppe ein erhöhtes Risiko für eine systemische Toxizität besteht. Sonstige Bestandteile mit bekannter Wirkung 1 ml Injektionslösung enthält 0,14 mmol (3,2 mg) Natrium. Dies ist zu berücksichtigen bei Personen unter Natrium kontrollierter (natriumarmer/-kochsalzarmer) Diät.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Ropivacain sollte mit Vorsicht angewendet werden bei Patienten, die andere Lokalanästhetika oder Arzneimittel erhalten, die strukturell mit Anästhetika vom Amidtyp verwandt sind, da sich die systemischen toxischen Wirkungen addieren. Dies trifft auf z.B. für bestimmte Antiarrhythmika wie Lidocain und Mexiletin zu. Die gleichzeitige Anwendung von Ropivacain und Allgemeinanästhetika oder Opioiden kann die jeweiligen (Neben-)Wirkungen verstärken. Es sind keine spezifischen Interaktionsstudien mit Ropivacain und Antiarrhythmika der Klasse III (z.B. Amiodaron) durchgeführt worden, dennoch ist Vorsicht geboten (siehe auch Abschnitt 4.4).
Das Cytochrom-P-450(CYP)1A2 ist beteiligt an der Bildung von 3-Hydroxy-Ropivacain, dem Hauptmetaboliten. Bei gleichzeitiger Anwendung von Fluvoxamin, einem selektiven und wirksamen CYP1A2-Hemmer, war die Plasmaclearance in vivo um bis zu 77 % vermindert. Somit können starke CYP1A2-Hemmer wie Fluvoxamin und Enoxacin, wenn sie während einer längeren Anwendung von Ropivacain gleichzeitig gegeben werden, Wechselwirkungen mit Ropivacain haben. Eine längere Anwendung von Ropivacain sollte bei Patienten vermieden werden, die begleitend mit starken CYP1A2-Hemmern behandelt werden (siehe Abschnitt 4.4).
Bei gleichzeitiger Anwendung von Ketoconazol, einem selektiven und wirksamen CYP3A4-Hemmer, wurde die Plasmaclearance von Ropivacain in vivo um 15 % vermindert. Die Hemmung dieses Isoenzyms ist jedoch wahrscheinlich nicht klinisch relevant.
In vitro ist Ropivacain ein kompetitiver Hemmer von CYP2D6, jedoch hemmt es dieses Isoenzym offensichtlich nicht bei klinisch erreichten Plasmakonzentrationen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Mit Ausnahme der epiduralen Anwendung in der Geburtshilfe gibt es keine ausreichenden Daten zur Anwendung von Ropivacain in der Schwangerschaft beim Menschen. In tierexperimentellen Studien zeigten sich keine direkten oder indirekten schädlichen Auswirkungen auf Schwangerschaft, embryonale/fötale Entwicklung, Entbindung oder postnatale Entwicklung (siehe Abschnitt 5.3).
Stillzeit
Es gibt keine Untersuchungen bei Frauen zur Frage des Übertritts von Ropivacain in die Muttermilch.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt. Abhängig von der Dosis kann jedoch ein geringer Einfluss auf psychische Funktionen und die Koordination erwartet werden. Auch wenn sonst keine deutlichen Zeichen einer ZNS-Toxizität vorhanden sind, können die motorische Beweglichkeit und die Reaktionsfähigkeit vorübergehend vermindert sein.
4.8 Nebenwirkungen
Allgemein
Das Nebenwirkungsprofil von Ropivacain entspricht dem anderer lang wirksamer Lokalanästhetika vom Amidtyp. Die Nebenwirkungen müssen von den physiologischen Wirkungen der Nervenblockade selbst, z. B. einer Abnahme des Blutdrucks und eine Bradykardie während der intrathekalen Anästhesie, sowie von Ereignissen, die durch die Punktion verursacht
werden (z.B. spinale Hämatome, postdurale Kopfschmerzen, Meningitis und epiduraler Abszess) unterschieden werden. Viele der am häufigsten auftretenden Nebenwirkungen, wie Übelkeit, Erbrechen und Hypotonie, sind während Anästhesie und Operationen im Allgemeinen sehr häufig. Es ist nicht möglich, die Reaktionen, die durch die klinische Situation verursacht werden, von solchen zu unterscheiden, die durch das Arzneimittel oder die Blockade verursacht werden.
Eine totale spinale Blockade kann unter allen Lokalanästhetika auftreten, wenn versehentlich eine epidurale Dosis intrathekal appliziert wird oder wenn eine zu große intrathekale Dosis angewendet wird. Systemische und lokale Nebenwirkungen von Ropivacain treten gewöhnlich wegen zu hoher Dosierung, schneller Absorption oder versehentlicher intravasaler Injektion auf. Wegen der niedrigen Dosierungen, die bei Anwendung der intrathekalen Anästhesie verwendet werden, sind systemische toxische Reaktionen jedoch nicht zu erwarten.
Tabelle der Nebenwirkungen
Die verwendeten Häufigkeitsangaben in der Tabelle sind wie folgt: Sehr häufig (>1/10)
Häufig (>1/100 bis <1/10)
Gelegentlich (>1/1000 bis <1/100)
Selten (>1/10 000 bis <1/1000)
Sehr selten (<1/10 000)
|
Systemorganklasse |
Häufigkeit |
Nebenwirkung |
|
Psychiatrische Erkrankungen |
Gelegentlich |
Angst |
|
Erkrankungen des Nervensystems |
Häufig |
Parästhesie Schwindel Kopfschmerzen0 |
|
Gelegentlich |
ZNS-Toxizitätssymptome (Krämpfe, tonisch-klonische Krämpfe, Anfälle, Benommenheit, zirkumorale Parästhesie, Taubheit der Zunge, Hyperakusis, Tinnitus, Sehstörungen, Dysarthrie, Muskelzucken, Tremor)*, Hypästhesiec | |
|
Herzerkrankungen |
Häufig |
Bradykardiec Tachykardie |
|
Selten |
Herzstillstand Herzrhythmusstörungen | |
|
Gefäßerkrankungen |
Sehr häufig |
Hypotonie3 |
|
Häufig |
Hypertonie | |
|
Gelegentlich |
Synkopec | |
|
Erkrankung der Atemwege und des Brustraums und Mediastinums |
Gelegentlich |
Dyspnoec |
|
Erkrankungen des Gastrointestinaltrakts |
Sehr häufig |
Übelkeit |
|
Gelegentlich |
Erbrechenbc | |
|
Erkrankungen der Nieren und Harnwege |
Häufig |
Harnretention |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Häufig |
Temperaturerhöhung Rigor Rückenschmerzen |
|
Gelegentlich |
Absinken der Körpertemperatur3 | |
|
Selten |
allergische Reaktion (anaphylaktische Reaktionen, |
angioneurotisches Ödem und
__Urtikaria)_
a Eine Hypotonie kommt bei Kindern seltener vor (< 1/100) b Erbrechen tritt bei Kindern häufiger auf (> 1/10)
c Diese Reaktionen treten nach intrathekaler Anwendung häufiger auf als angezeigt
* Diese Symptome treten normalerweise aufgrund versehentlicher intravasaler Injektion, Überdosierung oder schneller Absorption auf (siehe Abschnitt 4.9).
Klassenbezogene Nebenwirkungen:
Neurologische Komplikationen
Neuropathie und Verletzung des Rückenmarks (z. B. Arteria-spinalis-anterior-Syndrom, Arachnoiditis, Cauda equina Syndrom) wurden mit der Regionalanästhesie in Zusammenhang gebracht und können in seltenen Fällen zu bleibenden Schäden führen. Diese Komplikationen sind unabhängig vom verwendeten Lokalanästhetikum.
Totale spinale Blockade
Eine totale spinale Blockade kann auftreten, wenn eine zu hohe intrathekale Dosis angewendet wird.
Akute systemische Toxizität
Systemische toxische Reaktionen betreffen in erster Linie das zentrale Nervensystem (ZNS) und das kardiovaskuläre System. Solche Reaktionen werden durch hohe Blutkonzentrationen eines Lokalanästhetikums verursacht, die bei einer (versehentlichen) intravasalen Injektion, Überdosierung oder außergewöhnlich schneller Absorption aus stark vaskularisierten Regionen auftreten können (siehe Abschnitt 4.4). ZNS-Reaktionen sind bei allen Lokalanästhetika vom Amidtyp ähnlich, während kardiale Reaktionen stärker, sowohl quantitativ als auch qualitativ, von dem Wirkstoff abhängen.
ZNS-Toxizität
Bei toxischen Wirkungen auf das ZNS können Stufen mit Symptomen ansteigenden Schweregrades unterschieden werden. Anfänglich werden Symptome wie Seh- oder Hörstörungen, periorales Taubheitsgefühl. Schwindelgefühl, Benommenheit, Kribbeln und Parästhesien beobachtet. Dysarthrie, Rigor und Tremor sind schwerwiegender und gehen einem Anfall von generalisierten Krämpfen voraus. Solche Anzeichen dürfen nicht als Symptome einer neurologischen Grunderkrankung fehlgedeutet werden. Bewusstlosigkeit und tonisch-klonische Krämpfe können folgen, die einige Sekunden bis mehrere Minuten dauern können. Hypoxie und Hyperkapnie treten zusammen mit Respirationsstörungen während der Konvulsionen durch die erhöhte Muskelaktivität rasch auf. In schweren Fällen kann sogar eine Apnoe auftreten. Die respiratorische und metabolische Azidose verstärkt und verlängert die toxischen Wirkungen der Lokalanästhetika.
Nach Rückverteilung des Lokalanästhetikums aus dem ZNS und anschließender Metabolisierung und Exkretion tritt die Regeneration ein. Der Zustand des Patienten kann sich rasch normalisieren, wenn keine großen Mengen des Arzneimittels injiziert wurden.
Kardiovaskuläre Toxizität
Die Symptome der kardiovaskulären Toxizität sind schwerwiegender. Hypotonie, Bradykardie, Arrhythmie und sogar Herzstillstand können infolge hoher systemischer Konzentrationen des Lokalanästhetikums auftreten. Die intravenöse Infusion von Ropivacain bewirkte bei freiwilligen Probanden eine Verringerung der Reizleitung und Kontraktilität.
Toxischen Wirkungen auf das kardiovaskuläre System gehen im Allgemeinen ZNS-Toxizitätssymptome voraus, es sei denn, der Patient erhält eine Allgemeinanästhesie oder ist durch Substanzen wie Benzodiazepine oder Barbiturate stark sediert.
Kinder
Häufigkeit, Art und Schwere der Nebenwirkungen bei Kindern sind mit denen bei Erwachsenen vergleichbar mit Ausnahme von Hypotension, die bei Kindern weniger häufig (< 1 von 10) und Erbrechen, das bei Kindern häufiger (> 1 von 10) auftritt.
Bei Kindern können frühe Anzeichen einer lokalen Toxizität des Anästhetikums schwer erkennbar sein, da sie ggf. nicht in der Lage sind, diese verbal adäquat auszudrücken (siehe auch Abschnitt 4.4).
Behandlung von akuter systemischer Toxizität Siehe Abschnitt 4.9.
Meldung des Verdachts auf Nebenwirkungen
Diese Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome
Eine unbeabsichtigte intravasale Injektion kann unmittelbare (innerhalb von Sekunden bis zu wenigen Minuten) systemische toxische Reaktionen verursachen. Bei einer Überdosierung werden abhängig von der Injektionsstelle Spitzenplasmakonzentrationen erst nach ein bis zwei Stunden nach der Injektion erreicht. Zeichen von Toxizität können daher verzögert auftreten (siehe Abschnitt 4.8).Akuttherapie
Ausrüstung und Arzneimittel, die für das Monitoring sowie eine notfallmäßige Wiederbelebung notwendig sind, müssen sofort zur Verfügung stehen.
Wenn Anzeichen einer akuten systemischen Intoxikation oder einer totalen spinalen Blockade auftreten, muss die Injektion des Lokalanästhetikums sofort gestoppt werden. Symptome, die das ZNS betreffen (Krämpfe, Depression des ZNS), müssen umgehend durch entsprechende Unterstützung der Atemwege/des Atmens und durch Verabreichung eines Antikonvulsivums behandelt werden.
Wenn die Krämpfe nicht spontan innerhalb von 15-20 Sekunden abklingen, muss ein Antikonvulsivum intravenös verabreicht werden. Thiopental Natrium, 1-3 mg/kg, intravenös löst die Krämpfe rasch. Alternativ kann Diazepam, 0,1 mg/kg, intravenös gegeben werden, auch wenn die Wirkung langsamer eintritt. Suxamethonium (Succinylcholin) stoppt die Muskelkrämpfe rasch, aber der Patient benötigt eine kontrollierte Beatmung und tracheale Intubation.
Bei kardiovaskulärer Depression (Hypotonie. Bradykardie) soll ein Vasokonstriktor intravenös verabreicht werden, diese Behandlung ist, wenn notwendig, nach 2-3 Minuten zu wiederholen. Kindern sollten Dosen entsprechend ihrem Alter und Gewicht verabreicht werden.
Sollte ein Kreislaufstillstand eintreten, müssen umgehend kardiopulmonale Wiederbelebungsmaßnahmen ergriffen werden. Eine optimale Sauerstoffzufuhr, künstliche Beatmung, Kreislaufunterstützung und die Behandlung der Azidose sind lebenswichtig.
Bei kardiovaskulärer Depression (Hypotonie. Bradykardie) sollte eine angemessene Behandlung mit intravenösen Flüssigkeiten, vasopressorischen, chronotropen und/oder inotropen Arzneimitteln in Betracht gezogen werden.
Bei einem Herzstillstand kann ein erfolgreicher Ausgang längere Wiederbelebungsversuche voraussetzen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1. Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Lokalanästhetika, Amide ATC-Code: N01B B09
Ropivacain ist ein langwirksames Lokalanästhetikum vom Amidtyp mit sowohl anästhetischen als auch analgetischen Wirkungen. In hohen Dosen ruft es eine für chirurgische Eingriffe geeignete Anästhesie hervor, während es in niedrigeren Dosen sensorische Blockaden (Analgesie) mit begrenzter und nichtprogressiver motorischer Blockade bewirkt.
Der Wirkmechanismus beruht auf einer reversiblen Verminderung der Membranpermeabilität der Nervenfaser für Natriumionen. Als Folge davon vermindert sich die Depolarisationsgeschwindigkeit und die Reizschwelle wird erhöht. Dies führt schließlich zu einer lokalen Blockade der Nervenimpulse.
Besonders charakteristisch für Ropivacain ist die lange Wirkdauer. Wirkungseintritt und Wirkdauer der Lokalanästhesie hängen vom Applikationsort und Dosis ab. Durch Zugabe eines Vasokonstriktors (z. B. Adrenalin [Epinephrin]) kann die Wirkdauer nicht verlängert werden. Weitere Informationen siehe Dosierungstabelle unter Abschnitt 4.2.
Gesunde Probanden vertrugen eine intravenöse Infusion mit Ropivacain bei geringen Dosen sehr gut und bei den maximal tolerierten Dosen mit den erwarteten ZNS-Symptomen. Die klinischen Erfahrungen mit diesem Arzneimittel deuten auf eine große therapeutische Breite hin, wenn es entsprechend den empfohlenen Dosierungen verwendet wird.
5.2. Pharmakokinetische Eigenschaften
Ropivacain hat ein chirales Zentrum und ist als reines S-(-)-Enantiomer verfügbar. Es ist stark fettlöslich. Alle Metaboliten haben lokalanästhetische Wirkung, jedoch mit beträchtlich geringerer Stärke und kürzerer Dauer als Ropivacain.
Die Plasmakonzentration von Ropivacain hängt von der Dosis, der Art der Applikation und der Vaskularisierung des Gewebes der Injektionsstelle ab. Ropivacain hat eine lineare Pharmakokinetik und die maximale Plasmakonzentration (cmax) ist proportional zur Dosis.
Ropivacain wird vollständig in zwei Phasen aus dem Epiduralraum resorbiert. Die Halbwertszeiten für die schnelle und die langsame Phase liegen bei Erwachsenen im Bereich von 14 Minuten bzw. 4 Stunden. Die langsame Resorption ist der limitierende Faktor der Elimination von Ropivacain, was erklärt, warum die gemessene terminale Halbwertszeit nach epiduraler Verabreichung länger ist als nach intravenöser Anwendung.
Ropivacain hat eine mittlere Gesamtplasma-Clearance von 440 ml/min, eine renale Clearance von 1 ml/min, ein Verteilungsvolumen im Steady state von 47 l und eine terminale Halbwertszeit von 1,8 h nach intravenöser Verabreichung. Ropivacain hat ein mittleres hepatisches Extraktionsverhältnis von ca. 0,4. Es ist im Plasma hauptsächlich an alpha-1-saures Glykoprotein (AAG) gebunden, der ungebundene Anteil beträgt ca. 6 %.
Bei kontinuierlicher epiduraler Infusion wurde im Zusammenhang mit einem postoperativen Anstieg des alpha-1-sauren Glykoproteins (AAG) ein Anstieg der Gesamtkonzentration im Plasma beobachtet.
Schwankungen der ungebundenen, d.h. pharmakologisch aktiven Fraktion waren sehr viel geringer als die der Gesamtplasmakonzentration.
Die Pharmakokinetik von Ropivacain nach regionaler Anästhesie wurde bei Kindern zwischen 1 und 12 Jahren nicht vom Alter beeinflusst. In dieser Altersgruppe hat Ropivacain eine Gesamtplasma-Clearance in der Größenordnung von 7,5 ml/min kg, eine Plasma-Clearance des freien Anteils von 0,15 l/min kg, ein Verteilungsvolumen im Steady state von 2,4 l/kg, einen
ungebundenen Anteil von 5 % und eine terminale Halbwertszeit von 3 Stunden. Ropivacain zeigt eine zweiphasige Resorption aus dem Kaudalraum. Die Clearance im Verhältnis zum Körpergewicht ist in dieser Altergruppe annährend gleich zu der bei Erwachsenen.
Ropivacain überwindet die Plazentaschranke leicht und es stellt sich schnell ein Gleichgewicht der ungebundenen Konzentration im Plasma ein. Das Ausmaß der Plasmaproteinbindung im Fetus ist geringer als bei der Mutter, was beim Fetus zu geringeren Gesamtplasmakonzentrationen führt als bei der Mutter.
Ropivacain wird extensiv metabolisiert, vorwiegend durch aromatische Hydroxylierung. Insgesamt werden nach intravenöser Verabreichung 86 % der Dosis über den Urin ausgeschieden, jedoch nur ca. 1 % als unverändertes Ropivacain. Der Hauptmetabolit ist das 3-Hydroxy-Ropivacain (ca. 37 %), das hauptsächlich in konjugierter Form über den Urin ausgeschieden wird. Die Ausscheidung über den Urin von 4-Hydroxy-Ropivacain, dem N-dealkylierten und dem 4-Hydroxy-dealkylierten Metaboliten beträgt ca. 1-3 % der Dosis. Konjugiertes und unkonjugiertes 3-Hydroxy-Ropivacain treten nur in gerade noch nachweisbaren Konzentrationen im Plasma auf.
Eine eingeschränkte Nierenfunktion hat wenig bis gar keinen Einfluss auf die Pharmakokinetik von Ropivacain. Die renale PPX-Clearance korreliert significant mit der Kreatinin-Clearance. Das Fehlen der Korrelation zwischen der Gesamt-Exposition, die als AUC dargestellt wird, und der Kreatinin-Clearance deutet darauf hin, dass für die vollständige Elimination von PPX zusätzlich zur renalen Ausscheidung ein nicht renaler Eliminationsweg von Bedeutung ist. Einige Patienten mit eingeschränkter Nierenfunktion können eine erhöhte PPX-Exposition aufweisen, die auf eine reduzierte nicht renale Elimination zurückzuführen ist. Aufgrund der reduzierten ZNS-Toxizität von PPX im Vergleich zu Ropivacain werden die klinischen Auswirkungen bei einer Kurzbehandlung als geringfügig angesehen. Patienten mit terminaler Niereninsuffizienz, die eine regelmäßige Dialysebehandlung bekommen, wurden nicht untersucht.
Es gibt keinen Hinweis auf eine In-vivo-Razemisierung von Ropivacain.
Kinder
Die Pharmakokinetik von Ropivacain wurde in einer gepoolten PK-Patientenanalyse mit Daten von 192 Kindern zwischen 0 un d12 Jahren untersucht. Die Clearance des ungebundenen Ropivacains und des PPX sowie das Verteilungsvolumen der ungebundenen Fraktion hängen bis zur vollständigen Ausreifung der Leberfunktion von Körpergewicht und Alter ab. Danach hängt die Clearance vorwiegend vom Körpergewicht ab. Der Reifungsprozess für die Clearance des ungebundenen Ropivacain ist offenbar mit 3 Jahren abgeschlossen, für die Clearance von PPX bereits mit einem Jahr und für das Verteilungsvolumen des ungebundenen PPX ist nur vom Körpergewicht abhängig. PPX kann während der Epiduralinfusion kumulieren, da es eine längere Halbswertzeit und eine geringere Clearance besitzt.
Die Clearance (CLu) des ungebundenen Ropivacains erreichte bei Kindern über 6 Monaten Werte, die im für Erwachsene typischen Bereiche lagen. Die in der Tabelle aufgeführten Werte der totalen Clearance (CL) wurden nicht durch den postoperativen Anstieg des alpha-1-sauren Glykoproteins (AAG) beeinflusst.
Berechnung der pharmakokinetischen Parameter aus der gepoolten pädiatrischen PK Analyse:
|
Altersgruppe |
Körpergewicht3 kg |
Club (l/h/kg) |
Vuc (l/kg) |
CLd (l/h/kg) |
t v2e (h) |
t V ppxf (h) |
|
Neugeborene |
3,27 |
2,40 |
21,86 |
0,096 |
6,3 |
43,3 |
|
1 Monat |
4,29 |
3,60 |
25,94 |
0,143 |
5,0 |
25,7 |
|
6 Monate |
7,85 |
8,03 |
41,71 |
0,320 |
3,6 |
14,5 |
|
1 Jahr |
10,15 |
11,32 |
52,60 |
0,451 |
3,2 |
13,6 |
|
4 Jahre |
16,69 |
15,91 |
65,24 |
0,633 |
2,8 |
15,1 |
|
10 Jahre |
32,19 |
13,94 |
65,57 |
0,555 |
3,3 |
17,8 |
a Mittleres Körpergewicht der jeweiligen Altersgruppe gemäß WHO Datenbank
b Clearance des ungebundenen Ropivacains c Verteilungsvolumen des ungebundenen Ropivacains d Totale Ropivacainclearance e Terminale Halbwertszeit von Ropivacain f Terminale Halbwertszeit von PPX
Die nach einer einzeitigen Kaudal-Blockade kalkulierten mittleren maximalen Plasmakonzentrationen (Cumax) waren bei Neugeborenen höher und die Zeit bis Cumax (tmax) erreicht war, nahm mit zunehmenden Alter ab (siehe Tabelle unten). Die kalkulierten mittleren ungebundenen Plasmakonzentrationen lagen nach 72-stündiger epiduraler Infusion in den empfohlenen Dosierungen bei Neugeborenen ebenfalls höher als bei Kleinkindern und Kindern (siehe Abschnitt 4.4).
Kalkulierte mittlere und beobachtete Bereiche von ungebundenem Cumax nach einzeitiger KaudalBlockade:
|
Altersgruppe |
Dosis (mg/kg) |
Cu max (mg/l) |
rp b T max |
Cu max (mg/l) |
|
0-1 Monate |
2,00 |
0,0582 |
2,00 |
0,05-0,08 (n=5) |
|
1-6 Monate |
2,00 |
0,0375 |
1,50 |
0,02-0,09 (n= 18) |
|
6-12 Monate |
2,00 |
0,0283 |
1,00 |
0,01-0,05 (n=9) |
|
1-10 Jahre |
2,00 |
0,0221 |
0,50 |
0,01-0,05 (n=60) |
a Ungebundene maximale Plasmakonzentrationen b Zeit, bis die ungebundene maximale Plasmakonzentration erreicht ist. c Beobachtete und dosisangepasste ungebundene maximale Plasmakonzentrationen.
Im Alter von 6 Monaten, dem Zeitpunkt für eine Änderung der empfohlenen Dosierung zur kontinuierlichen epiduralen Infusion, erreicht die Clearance des ungebundenen Ropivacains 34% und die Clearance des ungebundenen PPX 71% des Wertes beim Erwachsenen. Im Vergleich zu älteren Kindern ist die systemische Verfügbarkeit bei Neugeborenen und Kindern zwischen 1 und 6 Monate höher, was mit der Unreife ihrer Leberfunktion zusammenhängt. Dies wird jedoch zum Teil dadurch kompensiert, dass bei Kleinkindern unter 6 Monaten für die kontinuierliche Infusion einen um 50 % reduzierte Dosierung empfohlen wird.
Eine auf den in der Patientenanalyse ermittelten PK-Parametern und ihrer Varianz basierte Kalkulation für die Summe der Plasmakonzentrationen von ungebundenem Ropivacain und PPX zeigt, dass für eine einzelne Kaudal-Blockade die empfohlene Dosis in der jüngsten Altersgruppe um den Faktor 2,7 gesteigert werden muss und bei den 1- bis 10-Jährigen um den Faktor 7,4. Dies ist notwendig, damit der obere Grenzwert des 90%-Konfidenzintervalls den Grenzwert für eine systemische Toxizität erreicht. Die entsprechenden Faktoren für die kontinuierliche epidurale Infusion sind 1,8 bzw. 3,8.
In einer Studie mit Kindern im Alter von 1-12 Jahren (n=22), die im Rahmen einer eizeitigen Ilioinguinalis-Iliohypogastricus-Blockade 3 mg/kg Ropivacain 5 mg/l erhielten, wurde Ropivacain schnell resorbiert mit Spitzenplasmakonzentrationen, die 15-64 Minuten nach Injektionsbeginn erreicht wurden. Der mittlere Cmax-Wert für das gesamte Ropivacain betrug 1,5 ± 0,9 mg/l (mit einem Höchstwert von 4,8 mg/l) bei einer mittleren Eliminationshalbwertszeit von 2,0 ± 1,7 Stunden. Die kalkulierte ungebundene Plasmakonzentration nach 30 Minuten betrug 0,05 ± 0,03 mg/l und der Cmax-Bereich beträgt 0,02-0,136 mg/l.
Eine auf den in der Patientenanalyse ermittelten PK-Parametern und ihrer Varianz basierte Kalkulation für die Summe der Plasmakonzentrationen von ungebundenem Ropivacain und PPX zeigt, dass bei den 1- bis 12-Jährigen, die 3 mg/kg für eine einzeitige periphere (ilioinguinale) Nervenblockade erhalten, die mittlere ungebundene Spitzenkonzentration nach 0,8 Std. 0,0347 mg/l beträgt. Dies entspricht einem Zehntel der Toxizitätsgrenze (0,34 mg/l). Das obere 90%-Konfidenzintervall für die maximale ungebundene Plasmakonzentration beträgt 0,074 mg/l. Dies entspricht einem Fünftel der Toxizitätsgrenze.
In einer veröffentlichten Studie, die die Pharmakokinetik einer Einzelinjektion von Ropivacain 5 mg/l zur ilioinguinalis-iliohypogastricus-Blockade mittels Ultraschall-geführter Technik mit der mittels landmark-geführter Technik verglich, führte die Ultraschall-geführte Technik zu einem Anstieg der Cmax- bzw. AUC-Werte von 45-56 % sowie zu einer um 19 % kürzeren Zeit bis zum Erreichen der maximalen Plasmakonzentration. Daher können im Rahmen von UltraschallTechniken niedrigere Dosen verabreicht werden (siehe Abschnitt 4.2).
5.3 Präklinische Daten zur Sicherheit
Aus den üblichen Studien zur Sicherheitspharmakologie, Toxizität bei einmaliger und wiederholter Gabe, Reproduktionstoxizität, Mutagenität und lokalen Verträglichkeit ließen sich keine Risiken für die Anwendung beim Menschen erkennen, abgesehen von den Risiken, die auf Grund des Wirkmechanismus bei hohen Dosen von Ropivacain erwartet werden können (z. B. ZNS-Symptome einschließlich Konvulsionen, Kardiotoxizität)
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Natriumchlorid, Natriumhydroxidlösung 4% / Salzsäure 3,6% zur pH-Wert-Einstellung, Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln verdünnt oder gemischt werden. In alkalischen Lösungen können Niederschläge auftreten, da Ropivacain bei einem pH > 6 schwer löslich ist.
6.3 Dauer der Haltbarkeit
3 Jahre
Dauer der Haltbarkeit nach dem ersten Öffnen:
Aus mikrobiologischer Sicht sollte das Produkt unmittelbar verwendet werden. Wird es nicht unmittelbar verwendet, liegen die Verwendungsdauer und Aufbewahrungsbedingungen, vor der Anwendung in der Verantwortlichkeit des Anwenders; die Verwendungsdauer des Produktes ist normalerweise nicht länger als 24 Stunden bei 2 bis 8 °C.
Zur Mischung siehe Abschnitt 6.6
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 30 °C lagern.
Nicht einfrieren.
Zur Lagerung nach dem Öffnen siehe Abschnitt 6.3.
Für Kinder unzugänglich aufbewahren.
6.5 Art und Inhalt des Behältnisses und Packungsgrößen
5 Polypropylen Ampullen mit je 10 ml Injektionslösung steril verpackt
50 (5 x 2 x 5) Polypropylen Ampullen mit je 10 ml Injektionslösung steril verpackt [Klinikpackung] 5 Polypropylen Ampullen mit je 20 ml Injektionslösung steril verpackt
50 (5 x 2 x 5) Polypropylen Ampullen mit je 20 ml Injektionslösung steril verpackt [Klinikpackung]
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Die Ropivacain-KK Produkte enthalten keine Konservierungsstoffe und sind deshalb nur zum einmaligen Gebrauch geeignet. Nicht verbrauchte Lösungen sind zu verwerfen.
Das Arzneimittel muss vor dem Gebrauch visuell geprüft werden. Die Lösung soll nur kann verwendet werden, wenn sie klar und praktisch partikelfrei ist und wenn das Behältnis unbeschädigt ist.
Das noch nicht geöffnete Behältnis darf nicht autoklaviert werden
7. INHABER DER ZULASSUNG
Pharma Resources GmbH Domeierstraße 29/31 31785 Hameln Germany
Telefon : +49 5151 609 96-0 Telefax: +49 5151 609 96-30 E-Mail: info@pha-res.com
8. ZULASSUNGSNUMMER(N)
Ropivacain-KK 5 mg/ml Injektionslösung: 70367.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
27.10.2008
10. STAND DER INFORMATION
06/2015
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig