Rytmonorm Sr 225 Mg Hartkapseln, Retardiert
Fachinformation
1. BEZEICHNUNG DER ARZNEIMITTEL
Rytmonorm® SR 225 mg Hartkapseln, retardiert
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Rytmonorm SR 225 mg Hartkapseln, retardiert
Jede Hartkapsel, retardiert, enthält 225 mg Propafenonhydrochlorid.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Hartkapsel, retardiert
Rytmonorm SR 225 mg Hartkapseln, retardiert
Weiße bis nahezu weiß-opake Kapsel, das Kapseloberteil ist mit „225" bedruckt.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Rytmonorm SR Hartkapseln, retardiert, ist indiziert zur Verlängerung der Zeit bis zum Wiederauftreten von symptomatischen Vorhofarrhythmien bei Patienten mit symptomatischem Vorhofflimmern in der Anamnese ohne signifikante strukturelle Herzerkrankung.
4.2 Dosierung, Art und Dauer der Anwendung
Die Dosierung von Rytmonorm SR erfolgt individuell anhand des Therapieerfolges und der Verträglichkeit. Die Titration bis zur individuellen Erhaltungsdosis sollte durch einen Kardiologen überwacht werden (wiederholte EKG- und Blutdruckmessungen).
Es wird empfohlen, die Therapie mit 225 mg Propafenonhydrochlorid (als Hartkapsel, retardiert) zu beginnen, und zwar alle 12 Stunden. Die Dosierung darf erst nach einem minimalen zeitlichen Abstand von 5 Tagen auf 325 mg Propafenonhydrochlorid (als Hartkapsel, retardiert) alle 12 Stunden gesteigert werden. Ist eine zusätzliche therapeutische Wirkung notwendig, darf die Dosis auf 425 mg Propafenonhydrochlorid (als Hartkapsel, retardiert) alle 12 Stunden nach einem minimalen zeitlichen Abstand von weiteren 5 Tagen gesteigert werden. Um die Dosistitration zu erleichtern, sind verschiedene Stärken von Rytmonorm SR verfügbar. Ein direkter Vergleich zwischen Propafenon in Hartkapseln, retardiert, und Propafenon in Tabletten mit sofortiger Freisetzung wurde in klinischen Studien nicht untersucht.
Bei Patienten, die eine signifikante Verbreiterung des QRS-Komplexes oder einen AV-Block II. oder III. Grades aufweisen, ist eine Dosisreduktion in Betracht zu ziehen.
Kinder und Jugendliche
Rytmonorm SR wurde an Kindern und Jugendlichen nicht geprüft.
Ältere Patienten
In dieser Patientengruppe wurden keine generellen Unterschiede bezüglich Sicherheit und Wirksamkeit beobachtet, allerdings kann bei einigen älteren Patienten eine größere Sensitivität nicht ausgeschlossen werden. Daher sollen diese Patienten sorgfältig beobachtet werden. Bei diesen Patienten sollte die Dosis-Titration mit besonderer Vorsicht erfolgen.
Dosierung bei eingeschränkter Nierenfunktion
Die Elimination des Hauptmetaboliten von Propafenon wird durch eingeschränkte Nierenfunktion beeinflusst. Rytmonorm SR soll daher mit Vorsicht angewendet werden.
Dosierung bei eingeschränkter Leberfunktion
Propafenon wird vorwiegend über einen sich sättigenden hepatischen Oxidase-Schritt metabolisiert. Im Hinblick auf die erhöhte Bioverfügbarkeit und die erhöhte Eliminationshalbwertszeit von Propafenon kann eine Reduktion der verordneten Dosis notwendig sein.
Art der Anwendung
Rytmonorm SR Hartkapseln, retardiert, sollen mit Flüssigkeit entweder zu den oder außerhalb der Mahlzeiten eingenommen werden.
Die Kapsel darf nicht zerstoßen oder ihr Inhalt weiter geteilt werden.
4.3 Gegenanzeigen
• Überempfindlichkeit gegenüber dem Wirkstoff oder einem der in Abschnitt 6.1 genannten sonstigen Bestandteile (siehe Abschnitt 6.1)
• bekanntes Brugada-Syndrom (siehe Abschnitt 4.4)
• Signifikante strukturelle Herzerkrankung, wie z.B.
- Myokardinfarkt innerhalb der letzten 3 Monate
- unkontrollierte kongestive Herzinsuffizienz mit linksventrikulärem Output unter 35 %
- kardiogener Schock, außer hervorgerufen durch Arrhythmie
- schwere symptomatische Bradykardie
- vorliegende Sinusknotendysfunktion, Vorhofleitungsstörungen, AV-Block II. Grades oder höhergradig, Schenkelblock oder distaler Block ohne Schrittmacher
- schwere Hypotonie
• manifeste Elektrolytstörungen (z.B. Störungen im Kaliummetabolismus)
• schwere obstruktive Lungenerkrankung
• Myasthenia gravis
• gleichzeitige Einnahme von Ritonavir
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Es ist notwendig, dass jeder Patient, der Rytmonorm SR einnimmt, vor und während der Behandlung elektrokardiographisch und klinisch untersucht wird, um zu bestimmen, ob die Wirkung von Rytmonorm SR die Fortsetzung der Behandlung rechtfertigt.
Die Einnahme von Propafenon kann bei zuvor asymptomatischen Trägern des Brugada-Syndromes zu einer Manifestation des Syndromes führen oder Brugada-artige Veränderungen des Elektrokardiogrammes (EKGs) provozieren. Nach Beginn der Behandlung mit Propafenon sollte ein EKG gemacht werden, um Veränderungen, welche ein Brugada-Syndrom nahelegen, auszuschließen.
Propafenonhydrochlorid kann die Pacing- und Sensingschwelle von Herzschrittmachern verändern. Die Funktion des Herzschrittmachers sollte während der Therapie überprüft und, falls erforderlich, neu programmiert werden.
Bei der Behandlung des paroxysmalen Vorhofflimmerns ist ein Übergang vom Vorhofflimmern zum Vorhofflattern mit Entstehung einer 2:1- bzw. 1:1-Überleitung auf den Ventrikel möglich (siehe Abschnitt 4.8).
Wie bei einigen anderen Klasse-IC-Antiarrhythmika können Patienten mit signifikanter struktureller Herzerkrankung schweren unerwünschten Ereignissen ausgesetzt sein. Daher ist Rytmonorm SR bei diesen Patienten kontraindiziert (siehe Abschnitt 4.3).
Aufgrund der Betablocker-Effekte sollten Patienten mit Asthma mit Vorsicht behandelt werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Arzneimittel, die CYP2D6, CYP1A2 und CYP3A4 hemmen, wie z.B. Ketoconazol, Cimetidin, Chinidin und Erythromycin, sowie Grapefruitsaft können die Plasmaspiegel von Propafenon erhöhen. Bei Anwendung von Propafenon und Inhibitoren dieser Enzyme sollten die Patienten engmaschig überwacht und sollte gegebenenfalls die Dosis angepasst werden.
Bei gleichzeitiger Anwendung von Propafenon und Lidocain wurden keine signifikanten Änderungen der Pharmakokinetik von Propafenon und Lidocain beobachtet. Dennoch wurde bei gleichzeitiger Anwendung von Propafenon und Lidocain über ein erhöhtes Risiko zentralnervöser Nebenwirkungen von Lidocain berichtet.
Eine Kombinationstherapie mit Amiodaron und Propafenonhydrochlorid kann die Erregungsleitung und Repolarisation im Herzen beeinflussen und zu Störungen mit der Gefahr von Proarrhythmien führen. Eine Dosisanpassung beider Arzneimittel anhand des therapeutischen Effektes kann erforderlich sein.
Wird Propafenon gleichzeitig mit selektiven Serotonin-Wiederaufnahmehemmern (SSRI) wie Fluoxetin oder Paroxetin eingenommen, können erhöhte PropafenonPlasmaspiegel auftreten. Bei gleichzeitiger Anwendung von Propafenon und Fluoxetin bei Patienten mit extensiver Metabolisierung sind für S-Propafenon cmax um 39 % und AUC um 50 % sowie für R-Propafenon cmax um 71 % und AUC um 50 % erhöht. Niedrigere Dosen von Propafenon können ausreichen, um die gewünschte therapeutische Wirkung zu erreichen.
Es besteht die Gefahr erhöhter Nebenwirkungen, wenn Propafenon in Verbindung mit Lokalanästhetika (wie z.B. bei Schrittmacherimplantation, operativen oder dentalen Eingriffen) und anderen Arzneimitteln eingenommen wird, die die Herzfrequenz und/oder die myokardiale Kontraktilität hemmen (wie z.B. Beta-Blocker, trizyklische Antidepressiva).
Die gleichzeitige Anwendung von Propafenonhydrochlorid und Arzneimitteln, die über CYP2D6 verstoffwechselt werden (z.B. Venlafaxin), kann zu erhöhten Plasmakonzentrationen dieser Arzneimittel führen.
Während der Therapie mit Propafenon wurde über erhöhte Plasma- und/oder Blutspiegel von Propranolol, Metoprolol, Desipramin, Ciclosporin, Theophyllin und Digoxin berichtet. Werden Anzeichen einer Überdosierung beobachtet, ist die Dosis dieser Arzneimittel entsprechend zu reduzieren.
Bei gleichzeitiger Anwendung von Propafenon und Phenobarbital und/oder Rifampicin (CYP3A4-Induktoren) kann die antiarrhythmische Wirkung von Propafenon aufgrund einer Reduktion der Propafenon-Plasmaspiegel vermindert sein. Daher sollte bei einer gleichzeitigen Behandlung mit Phenobarbital und/oder Rifampicin das Ansprechen auf die Propafenontherapie beobachtet werden.
Eine engmaschige Kontrolle des Gerinnungsstatus wird bei Patienten, die gleichzeitig orale Antikoagulantien (wie z.B. Phenprocoumon, Warfarin) einnehmen, empfohlen, da Propafenon die Plasmaspiegel dieser Arzneimittel erhöhen und damit die ProthrombinZeit verlängern kann. Die Dosis dieser Arzneimittel sollte falls nötig angepasst werden.
4.6 Schwangerschaft und Stillzeit Schwangerschaft:
Es liegen keine ausreichenden und gut kontrollierten Untersuchungen an Schwangeren vor. Propafenon darf während der Schwangerschaft nur dann angewendet werden, wenn der potentielle Nutzen die möglichen Risiken für den Fetus rechtfertigt.
Es ist bekannt, dass Propafenon die humane Placentaschranke passiert. Es wurde berichtet, dass die Propafenon-Konzentration im Nabelschnurblut ca. 30 % der Plasmakonzentration des mütterlichen Blutes beträgt.
Stillzeit:
Die Ausscheidung von Propafenon in die humane Muttermilch wurde nicht untersucht. Begrenzt verfügbare Daten besagen, dass Propafenon in die Muttermilch übergehen kann. Propafenon darf bei stillenden Müttern nur mit Vorsicht angewendet werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Verschwommensehen, Schwindel, Müdigkeit und haltungsbedingte Hypotonie können die Reaktionsschnelligkeit des Patienten beeinträchtigen und die individuelle Fähigkeit zum Bedienen von Maschinen und Führen von Kraftfahrzeugen einschränken.
4.8 Nebenwirkungen
a. Zusammenfassung des Sicherheitsprofils
Die am häufigsten und insgesamt sehr häufig auftretenden Nebenwirkungen im Zusammenhang mit Rytmonorm SR sind Schwindel-/Benommenheitsgefühl, Erregungsleitungsstörungen am Herzen und Palpitationen.
b. Tabellarische Übersicht der Nebenwirkungen
In der folgenden Tabelle sind die Nebenwirkungen aus klinischen Studien und Beobachtungen nach Markteinführung von Rytmonorm SR Hartkapseln, retardiert, aufgeführt.
Die Ereignisse, bei denen ein kausaler Zusammenhang mit Rytmonorm SR zumindest für möglich gehalten wird, werden nach Organsystemklasse und nach Häufigkeit geordnet wiedergegeben, wobei die folgende Konvention gilt: sehr häufig (> 1/10), häufig (> 1/100 bis < 1/10), gelegentlich (> 1/1000 bis < 1/100) und nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar). Innerhalb jeder Häufigkeitsgruppe wurden die Nebenwirkungen nach absteigender Bedeutung sortiert, sofern diese eingeschätzt werden konnte.
|
Organsystem klasse |
sehr häufig (> 1/10) |
häufig (> 1/100 bis < 1/10) |
gelegentlich (> 1/1000 bis < 1/100) |
nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) |
|
Erkrankungen des Blutes und des Lymphsystems |
Thrombozytopenie |
Agranulocytose Leukopenie Granulozytopenie | ||
|
Erkrankungen des Immunsystems |
Überempfindlichkeit1 | |||
|
Stoffwechsel- und Ernährungsstörungen |
verminderter Appetit | |||
|
Psychiatrische Erkrankungen |
Ängstlichkeit Schlafstörungen |
Alpträume |
Verwirrung | |
|
Erkrankungen des Nervensystems |
Schwindel- und Benommenheits- gefühl2 |
Kopfschmerzen Geschmacks störungen |
Synkope Ataxie Parästhesie |
Konvulsionen extrapyramidale Symptome Unruhe |
|
Augenerkrankungen |
verschwommenes Sehen | |||
|
Erkrankungen des Ohrs und des Labyrinths |
Vertigo | |||
|
Herzerkrankungen |
Störungen der Erregungsleitung im Herzen3 Palpitationen |
Sinusbradykardie Bradykardie Tachykardie Vorhofflattern |
ventrikuläre Tachykardie Arrhythmie4 |
ventrikuläre Fibrillation Herzversagen5 verlangsamter Herzschlag |
|
Gefäßerkrankungen |
Hypotonie |
orthostatische Hypotonie | ||
|
Erkrankungen der Atemwege, des brustraumes und Mediastinums |
Dyspnoe | |||
|
Gastrointestinale Erkrankungen |
Bauchschmerzen Erbrechen Übelkeit Durchfall Verstopfung Mundtrockenheit |
Bauchblähung Flatulenz |
Würgereiz gastrointestinale Störungen | |
|
Leber- und Gallenerkrankungen |
Störungen der Leberfunktion6 |
Leberzellschäden Cholestase Hepatitis Gelbsucht | ||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Urtikaria Pruritus Ausschlag Erythem | |||
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
lupusähnliches Syndrom | |||
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
erektile Dysfunktion |
Spermienzahl vermindert7 | ||
|
Allgemeine Erkrankungen und |
Brustschmerzen Asthenie |
|
Organsystem klasse |
sehr häufig (> 1/10) |
häufig (> 1/100 bis < 1/10) |
gelegentlich (> 1/1000 bis < 1/100) |
nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) |
|
Beschwerden am Verabreichungsort |
Müdigkeit Fieber |
1 Kann sich durch Cholestase, Dyskrasien des Blutes und Hautausschlag manifestieren.
2 Ohne Schwindel.
3 Einschließlich sinuatrialem Block, AV-Block und intraventrikulärem Block.
4 Propafenon kann mit proarrhythmogenen Effekten, die sich als Erhöhung der Herzfrequenz (Tachykardie) manifestieren, in Verbindung gebracht werden. Einige dieser Arrhythmien können lebensbedrohlich sein, und es kann eine Wiederbelebung erforderlich sein, um einen tödlichen Ausgang zu verhindern.
5 Eine vorbestehende Herzinsuffizienz kann sich verschlimmern.
6 Dieser Begriff deckt anomale Ergebnisse von Leberfunktionstests ab, etwa einen Anstieg der Aspartat-Aminotransferase, der Alanin-Aminotransferase, der Gamma-Glutamyltransferase oder der alkalischen Phosphatase im Blut.
7 Die Verminderung der Spermienzahl ist nach Absetzen von Propafenon reversibel.
c. Beschreibung ausgewählter Nebenwirkungen
Erregungsleitungsstörungen
Die am häufigsten auftretende Form ist ein AV-Block I. Grades, der normalerweise asymptomatisch verläuft, aber trotzdem der Beobachtung und einer Dosisreduktion bedarf, um einer höhergradigen Überleitungsstörung vorzubeugen.
Dosisabhängige Nebenwirkungen
Geschmacksstörungen und Übelkeit können dosisabhängig auftreten.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger Allee 3
D-53175 Bonn
Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome einer Überdosierung:
Myokardiale Symptome: Die Wirkungen einer Propafenon-Überdosierung manifestieren sich im Myokard in Form von Schrittmacher- und Leitungsstörungen wie
PQ-Verlängerung, QRS-Verbreiterung, Unterdrückung der Sinusknoten-Automatie, AV-Block, ventrikuläre Tachykardie und Kammerflimmern. Die Verminderung der Kontraktilität (negativ inotroper Effekt) kann eine Hypotonie hervorrufen, in gravierenden Fällen kann dies zu einem kardiovaskulären Schock führen.
Nicht-kardiale Symptome: Kopfschmerzen, Schwindel, Verschwommensehen, Parästhesien, Tremor, Übelkeit, Verstopfung und trockener Mund treten häufig auf. In sehr seltenen Fällen wurde bei Überdosierung über Krampfanfälle berichtet.
Todesfälle wurden ebenfalls berichtet.
Bei schweren Vergiftungsfällen können klonisch-tonische Krämpfe, Parästhesien, Somnolenz, Koma und Atemstillstand auftreten.
Behandlung:
Zusätzlich zu den allgemeinen Notfallmaßnahmen sollen die Vitalfunktionen des Patienten auf der Intensivstation überwacht und entsprechend korrigiert werden.
Sowohl Defibrillation als auch Infusion von Dopamin und Isoprenalin haben sich zur Kontrolle des Herzrhythmus und des Blutdrucks als wirksam gezeigt. Krampfanfälle ließen sich mit intravenös appliziertem Diazepam abschwächen. Mechanische Beatmung und externe Herzmassage können als generelle unterstützende Maßnahmen notwendig sein.
Versuche zur Elimination mittels Hämoperfusion sind von eingeschränkter Wirksamkeit. Aufgrund der hohen Eiweißbindung (> 95 %) und des großen Verteilungsvolumens ist eine Hämodialyse ineffektiv.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antiarrhythmika, Klasse IC ATC-Code: C01BC03
Wirkmechanismus und Pharmakodynamische Wirkung
Propafenon ist ein Antiarrhythmikum mit Membran-stabilisierenden sowie Natriumkanal-blockierenden Eigenschaften (Vaughan Williams: Klasse I C) und besitzt auch eine schwache betablockierende Wirkung (Klasse II nach Vaughan Williams). Propafenon mindert die Anstiegsgeschwindigkeit des Aktionspotentials und führt so zu einer Verlangsamung der Impulsleitung (negativ dromotroper Effekt): Die Refraktärperioden im Vorhof, im AV-Knoten und in den Ventrikeln werden verlängert. Propafenon verlängert die Refraktärperioden in akzessorischen Leitungsbahnen bei Patienten mit Wolff-Parkinson-White-Syndrom (WPW-Syndrom).
Klinische Wirksamkeit und Sicherheit
In 2 doppelblinden Phase-III-Studien wurde Rytmonorm SR bei Patienten mit wiederholt auftretenden Episoden von symptomatischem Vorhofflimmern untersucht.
In einer multizentrischen US-Studie (RAFT) wurden 3 Dosierungen von Rytmonorm SR (225 mg 2-mal täglich, 325 mg 2-mal täglich und 425 mg 2-mal täglich) und Placebo an 523 Patienten verglichen. Im Mittel hatten die Patienten eine Vorhofflimmern-Anamnese von 13 Monaten und dokumentiertes, symptomatisches Vorhofflimmern innerhalb von 12 Monaten vor Studienbeginn. Über 90 % der Patienten befanden sich in NYHA Klasse I und bei 21 % der Patienten bestand ein Zustand nach elektrischer Kardioversion. Alle drei Dosierungen von Rytmonorm SR, die über 39 Wochen eingenommen wurden, erwiesen sich bezogen auf die Zeit bis zum ersten Wiederauftreten von symptomatischem Vorhofflimmern gemessen nach
Tag 1 der Randomisierung gegenüber Placebo als überlegen (p < 0,014 für 225 mg 2-mal täglich und < 0,001 für 325 mg und 425 mg 2-mal täglich).

Abbildung 1: Tachykardie-freie Zeit (Fehlen von symptomatischem Vorhofflimmern (AF), Vorhofflattern oder paroxysmaler supraventrikulärer Tachykardie (PSVT)) nach Tag 1 der Randomisierung (vollständige Darstellung); RAFT-Studie (Log-Rank Test).
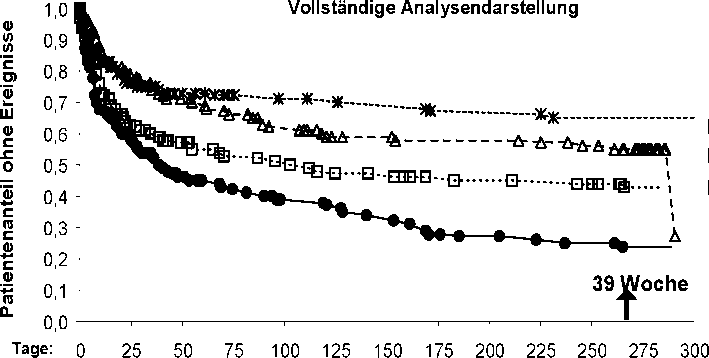
< 0,001 < 0,001 = 0,014
Risiko-Patienten: 523 270 229
191 83
Placebo
—^—Propafenone SR 325 mg Hartkapseln, retardiert 2-mal täglich
Propafenone SR 22!5 mg Hartkapseln, retardiert Propafenone SR 425 mg Hartkapseln, retardiert
2-mal täglich * 2-rnal täglich g p ’
Für folgende Untersuchungsparameter zeigte sich eine deutliche Dosisabhängigkeit: Zeit bis zum Wiederauftreten von symptomatischer Vorhofarrhythmie ab Tag 1 der Randomisierung und Zeit bis zum Wiederauftreten von symptomatischer Vorhofarrhythmie ab Tag 5 der Randomisierung. Es wurde eine klare Dosisabhängigkeit bezüglich der Tachykardie-freien Zeit festgestellt, wobei die Patientengruppe mit der Dosis von 425 mg 2-mal täglich die längste Zeit bis zum Wiederauftreten zeigte. Dennoch scheint Rytmonorm SR 425 mg bezogen auf die Sicherheitsparameter ein weniger günstiges Sicherheitsprofil aufzuweisen als Rytmonorm SR 325 mg und Rytmonorm SR 225 mg 2-mal täglich gegeben.
In der europäischen, multizentrischen Studie (ERAFT) wurden 2 Dosierungen von Rytmonorm SR (325 mg 2-mal täglich und 425 mg 2-mal täglich) und Placebo an 293 Patienten verglichen. Im Mittel hatten die Patienten Vorhofflimmern über 3,3 Jahre, 37 % der Patienten hatten eine leichte, strukturelle Herzerkrankung in der Anamnese und 61 % der Patienten nahmen Arzneimittel ein, die die Herzfrequenz reduzierten. Innerhalb der 28-tägigen Einschlussperiode musste bei den Patienten 1 Ereignis von symptomatischem Vorhofflimmern dokumentiert sein. Die doppelblinde Behandlungsphase bestand in einer 4-tägigen Aufsättigungsperiode gefolgt von einer 91-tägigen Wirksamkeitsperiode. Symptomatische Arrhythmien wurden mittels Elektrokardiogramm-Monitoring dokumentiert. Rytmonorm SR zeigte dosisabhängig eine Verlängerung der Zeit bis zum ersten Wiederauftreten von symptomatischer Vorhofarrhythmie (primärer Wirksamkeitsparameter) ab Tag 5 nach Randomisierung: 9 Tage in der Placebogruppe, 35 Tage in der Gruppe Propafenon SR 325 mg 2-mal täglich (p = 0,004)und 44 Tage in der Gruppe Propafenon SR 425 mg 2-mal täglich (p = 0,003) Die Ergebnisse stimmen mit RAFT überein.
Propafenon ist ein racemisches Gemisch von S- und R- Propafenon.
Resoption
Maximale Propafenon-Plasmaspiegel werden innerhalb von 3-8 Stunden nach der Einnahme von Rytmonorm SR erreicht. Für Propafenon ist bekannt, dass die Substanz einer ausgeprägten und sättigbaren, präsystemischen Biotransformation (CYP2D6, hepatischer First-pass-Effekt) unterliegt, die in einer von der Dosis und der Darreichungsform abhängigen absoluten Bioverfügbarkeit resultiert. Obwohl Nahrungsaufnahme den maximalen Plasmaspiegel und die Bioverfügbarkeit in einer Einzeldosis-Studie erhöhte, konnte während mehrfacher Einnahme von Propafenon an gesunden Probanden gezeigt werden, dass die Nahrungsaufnahme keinen bedeutenden Einfluss auf die Bioverfügbarkeitvon Propafenon hat.
Daten zur relativen Bioverfügbarkeit, die in einer vergleichenden pharmakokinetischen Studie mit retardierten und sofort freisetzenden Darreichungsformen von Propafenon unterschiedlicher Dosierungen durchgeführt wurden, zeigten vergleichbare Plasmakonzentrationen (AUC) von Propafenon sowohl mit 150 mg Propafenon sofort freisetzenden Tabletten 3-mal täglich und Rytmonorm SR 325 mg Hartkapseln, retardiert 2-mal täglich als auch mit 300 mg Propafenon sofort freisetzenden Tabletten 2-mal täglich und Rytmonorm SR 425 mg Hartkapseln, retardiert 2-mal täglich. Allerdings ist ein Wechsel auf Rytmonorm SR Hartkapseln, retardiert an Patienten, die mit Propafenon sofort freisetzenden Tabletten behandelt wurden, in einer klinischen Studie nicht ausdrücklich untersucht worden.
Verteilung
Propafenon hat eine hohe Verteilungsrate. Das Verteilungsvolumen im Steady State beträgt 1,9 bis 3,0 l/kg. Die Plasma-Eiweißbindung von Propafenon ist konzentrationsabhängig (dosisabhängig) und sinkt von 97,3 % bei 0,25 ng/ml auf 91,3 % bei 100 ng/ml.
Biotransformation und Elimination
Es gibt zwei genetisch bestimmte Metabolisierungsmuster für Propafenon. Bei über 90 % der Patienten wird das Arzneimittel schnell und extensiv mit einer Eliminationshalbwertszeit von 2 bis 10 Stunden metabolisiert, (d.h.extensive Metabolisierer). Diese Patienten verstoffwechseln Propafenon zu zwei wirksamen Metaboliten: 5-Hydroxypropafenon, das über CYP2D6 gebildet wird, und N-Depropylpropafenon (Norpropafenon), das über CYP3A4 und CYP1A2 gebildet wird. Bei weniger als 10 % der Patienten ist die Metabolisierung von Propafenon langsamer, da der 5-Hydroxy-Metabolit nicht oder nur minimal gebildet wird (d.h. langsame Metabolisierer).
Die geschätzte Eliminationshalbwertszeit von Propafenon beträgt 10 - 32 Stunden für langsame Metabolisierer. Die Clearance für Propafenon ist 0,67 bis 0,81 l/h/kg.
Basierend auf dem erhöhten First-pass-Effekt sind im Verhältnis zur sofort freisetzenden Darreichungsform bei der retardierten Darreichungsform höhere tägliche Dosen von Propafenon erforderlich, um ähnliche Plasmakonzentrationen von Propafenon zu erreichen.
Da der Steady State in beiden Gruppen nach drei bis vier Tagen bei der Propafenonhydrochlorid IR und nach vier bis fünf Tagen bei Propafenonhydrochlorid SR erreicht wird, ist das empfohlene Dosierungsschema für Rytmonorm , unabhängig
vom Metabolisierungsmuster (schnelle oder langsame Metabolisierung) für alle Patienten gleich.
Linearität/Nicht-Linearität
Bei extensiven Metabolisierern führt der sättigbare Hydroxylierungs-Abbauschritt (CYP2D6) zu einer nicht-linearen Pharmakokinetik. Bei langsamen Metabolisierern verläuft die Pharmakokinetik für Propafenon linear.
Inter-/intraindividuelle Variabilität
Unter Propafenon gibt es ein erhebliches Ausmaß an interindividueller pharmakokinetischer Variabilität, die weitestgehend abhängig vom hepatischen FirstPass-Effekt und von der nicht-linearen Pharmakokinetik bei extensiven Metabolisierern ist. Die große interindividuelle Variabilität in den Blutspiegeln erfordert bei den Patienten eine sorgfältige Dosistitration des Arzneimittels mit einer engmaschigen Kontrolle der klinischen und EKG-Anzeichen für eine Intoxikation.
Ältere Patienten
Bei älteren Patienten mit normaler Nierenfunktion war die Propafenon-Exposition sehr variabel und unterschied sich nicht signifikant von derjenigen bei gesunden jungen Probanden. Die 5-Hydroxypropafenon-Exposition war ähnlich, diejenige von glucuronidiertem Propafenon dagegen verdoppelt.
Beeinträchtigte Nierenfunktion
Bei Patienten mit beeinträchtigter Nierenfunktion ähnelte die Exposition von Propafenon und 5-Hydroxypropafenon derjenigen bei Gesunden, es wurde allerdings eine Akkumulation glucuronidierter Metaboliten beobachtet. Bei Patienten mit einer Nierenerkrankung sollte Propafenon SR mit Vorsicht angewendet werden.(Siehe Abschnitt 4.2)
Beeinträchtigte Leberfunktion
Bei Patienten mit beeinträchtigter Leberfunktion sind die Bioverfügbarkeit von Propafenon nach oraler Einnahme sowie die Halbwertzeit erhöht. Bei Patienten mit Lebererkrankungen muss daher die Dosis angepasst werden.
Kinder und Jugendliche
Die (scheinbare) Clearance von Propafenon bei 13 Säuglingen und Kindern im Alter von 3 Tagen bis 7,5 Jahren reichte nach intravenöser bzw. oraler Verabreichung von 0,13 bis 2,98 l/h/kg; es gab keinen klaren Zusammenhang mit dem Alter.
Bei einer Untersuchung an 47 Kindern im Alter von 1 Tag bis 10,3 Jahren (Median
2,2 Monate) waren die Dosis-normalisierten Steady-State-Konzentrationen von Propafenon nach oraler Einnahme bei Kindern, die älter als 1 Jahr waren, 45 % höher als bei denen, die jünger als 1 Jahr waren. Trotz der großen interindividuellen Schwankungen scheint eine EKG Überwachung für die Dosiseinstellung besser geeignet zu sein als die Propafenon-Plasmakonzentration.
5.3 Präklinische Daten zur Sicherheit
Präklinische Daten anhand üblicher Untersuchungen zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Genotoxizität, Kanzerogenität oder ReproduktionsToxizität haben für Menschen keine spezielle Gefährdung gezeigt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Bestandteile des Kapselinhalts
Hypromellose
Magnesiumstearat (Ph. Eur.)
Kapselhülle
Gelatine
Titandioxid (E 171) Natriumdodecylsulfat
Drucktinte
Eisen(III)-oxid (E 172)
Schellack
Propylenglycol
Kaliumhydroxid
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 30 °C lagern.
6.5 Art und Inhalt des Behältnisses
PVC/PVDC/Aluminium oder Polypropylen/Aluminium-Blisterpackungen. Packungsgrößen: 20, 50, 100 Hartkapseln, retardiert.
Es werden eventuell nicht alle Packungsgrößen vermarktet.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
Mylan Healthcare GmbH
Freundallee 9A
30173 Hannover
Telefon: 0511 / 6750-2400
Telefax: 0511 / 6750-3120
E-Mail: mylan.healthcare@mylan.com
8. Zulassungsnummern
Rytmonorm SR 225 mg Hartkapseln, retardiert
61919.00.00
9. Datum der Erteilung der Zulassung/Verlängerung der Zulassung
23. November 2005/28. Oktober 2009
10. Stand der Information
August 2016
11. Verkaufsabgrenzung Verschreibungspflichtig.
12/12