Salbutamol Al N 0,1 Mg/Sprühstoß Druckgasinhalation, Suspension
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SPC)
1. Bezeichung des Arzneimittels
Salbutamol STADA® N 0,1mg / Sprühstoß Druckgasinhalation, Suspension
2. Qualitative und quantitative Zusammensetzung
1 Sprühstoß a 30 mg Aerosol enthält 0,1 mg Salbutamol als Salbutamolsulfat. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1
3. Darreichungsform
Druckgasinhalation, Suspension
Homogene, cremeweiße bis gräulichweiße Suspension.
4. Klinische Angaben
4.1 Anwendungsgebiete
• Symptomatische Behandlung von Erkrankungen mit reversibler Atemwegsobstruktion wie z.B. Asthma bronchiale oder chronisch obstruktive bronchiale Erkrankung (COPD) mit reversibler Komponente.
• Verhütung von durch Anstrengung oder Allergenkontakt verursachten Asthmaanfällen.
Hinweise
Eine längerfristige Behandlung soll symptomorientiert und nur in Verbindung mit einer entzündungshemmenden Dauertherapie erfolgen.
Salbutamol STADA® N ist zur Akutbehandlung plötzlich auftretender Bronchialkrämpfe und anfallsweise auftretender Atemnot geeignet.
4.2 Dosierung und Art der Anwendung
Die Dosierung richtet sich nach Art und Schwere der Erkrankung.
Soweit vom Arzt nicht anders verordnet, gelten für Erwachsene und Kinder ab 4 Jahren folgende Dosierungsempfehlungen:
Erwachsene (einschließlich ältere Personen und Jugendliche)
1 Einzeldosis = 1-2 Sprühstöße = 0,1-0,2 mg Salbutamol
Kinder 4-12 Jahren
1 Einzeldosis = 1 Sprühstoß = 0,1 mg Salbutamol
Zur Akutbehandlung plötzlich auftretender Bronchialkrämpfe und anfallsweise auftretender Atemnot wird eine Einzeldosis inhaliert. Sollte sich die Atemnot 510 Minuten nach Inhalation der ersten Einzeldosis nicht spürbar gebessert haben, kann eine weitere Einzeldosis genommen werden. Kann ein schwerer Anfall von Luftnot auch durch eine zweite Einzeldosis nicht behoben werden, können weitere Einzeldosen erforderlich werden. In diesen Fällen muss unverzüglich ärztliche Hilfe in Anspruch genommen werden.
Zur gezielten Vorbeugung bei Anstrengungsasthma oder vorhersehbarem Allergenkontakt wird eine Einzeldosis, wenn möglich etwa 10-15 Minuten vorher, inhaliert. Die Tagesgesamtdosis für Erwachsene soll 0,8 mg Salbutamol nicht überschreiten. Für Kinder soll die Tagesgesamtdosis 0,4 mg Salbutamol nicht überschreiten. Eine höhere Dosierung lässt im Allgemeinen keinen zusätzlichen therapeutischen Nutzen erwarten, die Wahrscheinlichkeit des Auftretens auch schwerwiegender Nebenwirkungen kann aber erhöht werden.
Dieses Arzneimittel ist ausschließlich zum Inhalieren bestimmt.
Ältere Personen
Siehe Erwachsene und Schulkinder.
Art und Dauer der Anwendung
Vor dem ersten Gebrauch und wenn das Salbutamol STADA® N zwei Wochen oder länger nicht benutzt wurde, werden zunächst 4 Sprühstöße in die Luft abgegeben.
Gemäß Bedienungsanleitung inhalieren
1. Schutzkappe abnehmen.
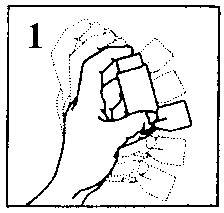
2. Gut schütteln (vgl. Abb. 1).
3. Tief ausatmen. Das offene Ende des Mundstückes in den Mund einführen. Der Boden des Wirkstoffbehältnisses muss dabei nach oben zeigen, unabhängig von der Körperposition, in der inhaliert wird. Nach Möglichkeit sollte die Anwendung im Sitzen oder Stehen erfolgen. Die Lippen müssen das
Mundstück fest umschließen (vgl. Abb. 2).
4. Langsam und gleichmäßig tief durch den Mund einatmen und dabei durch Druck auf den Boden des Wirkstoffbehältnisses eine Dosis freigeben. Der Wirkstoff muss unbedingt mit dem Einatmungsstrom möglichst tief in den Bronchialbereich gebracht werden.
5. Den Atem für mindestens 10 Sekunden anhalten, bevor langsam ausgeatmet wird.
Sind mehrere aufeinander folgende Inhalationen erforderlich, werden die Schritte 2 bis 5 wiederholt.
Nach abschließender Benutzung wird die Schutzkappe wieder aufgesetzt. Reinigungsanleitung
Das Salbutamol STADA® N ist wöchentlich zu reinigen. Diese Reinigung ist sehr wichtig! Nur so lässt sich eine mögliche Verstopfung der kleinen Öffnung im Innern des Mundstücks vermeiden, durch die der Wirkstoff freigesetzt wird.
Das Wirkstoffbehältnis aus dem Kunststoffgehäuse des Salbutamol STADA® N nehmen. Das Wirkstoffbehältnis wird nicht gereinigt und sollte nicht unter Wasser gehalten werden.
Die Schutzkappe vom Mundstück entfernen.
Das Mundstück und die Schutzkappe unter fließendem warmem Wasser für mindestens 30 Sekunden spülen. Wasser durch das Mundstück laufen lassen (vgl. Abb. A).

Das Mundstück umdrehen und das Wasser durch die andere Öffnung des Mundstücks laufen lassen (vgl. Abb. B).
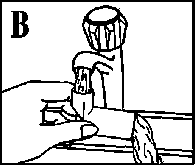
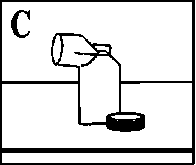
Das Wasser abschütteln und die Kunststoffteile vollständig an der Luft trocknen lassen (vgl. Abb. C), falls möglich über Nacht.
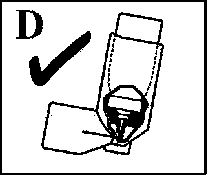
Das Wirkstoffbehältnis erst wieder einsetzen, wenn das Mundstück trocken ist (vgl. Abb. D).
Die trockene Schutzkappe aufsetzen.
Falls das Salbutamol STADA® N benutzt wird, bevor das Mundstück vollständig getrocknet ist, das Restwasser vom Mundstück abschütteln und das Wirkstoffbehältnis - wie in Abb. D dargestellt - einsetzen.
Zweimal in die Luft sprühen, bevor die übliche Dosis inhaliert wird. Anschließend das Mundstück erneut spülen und es vollständig trocknen lassen, wie in Abb. A, B und C dargestellt.
Hinweis
Bitte beachten, dass das Mundstück leicht durch Ablagerung des Wirkstoffs verstopfen kann, wenn das Mundstück nach der Reinigung nicht sorgfältig getrocknet wurde.
Abb. D zeigt das Innere des Salbutamol STADA® N mit richtig eingesetztem Wirkstoffbehältnis. Bitte beachten, dass die Metalldüse (Ventilstift) in die vorgesehene kleine Öffnung eingesetzt werden muss.

Abb. E zeigt das Innere des Salbutamol STADA® N mit falsch eingesetztem Wirkstoffbehältnis. In diesem Fall wird durch Druck auf den Boden des Wirkstoffbehältnisses keine Dosis freigegeben, da die Metalldüse (Ventilstift) nicht in die vorgesehene kleine Öffnung eingesetzt wurde.
Für den Fall, dass das Salbutamol STADA® N nicht richtig funktioniert, bitte
Folgendes beachten
Wird durch Druck auf den Boden des Wirkstoffbehältnisses keine oder nur eine geringe Dosis freigegeben (vgl. Abb. F), kann dies folgende Gründe haben:
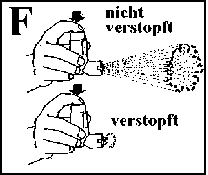
Das Mundstück ist nicht sauber oder ist verstopft. Das Mundstück spülen und trocknen wie in Abb. A, B und C beschrieben.
Das Salbutamol STADA® N könnte leer sein. Den Füllungszustand durch Entnahme und Schütteln des Wirkstoffbehältnisses prüfen. Das WirkstoffTreibmittel-Gemisch liegt im Wirkstoffbehältnis in flüssiger Form vor. Enthält das Wirkstoffbehältnis noch Flüssigkeit, ist dies durch Schütteln wahrzunehmen.
Das Salbutamol STADA® N könnte falsch zusammengebaut sein (vgl. Abb. E).
Die Dauer der Behandlung richtet sich nach Art, Schwere und Verlauf der Erkrankung und ist vom Arzt individuell zu entscheiden.
Hinweise
Um eine falsche Anwendung zu vermeiden, ist eine gründliche Einweisung des Patienten in den korrekten Gebrauch vorzunehmen. Kinder sollten dieses Arzneimittel nur unter Aufsicht eines Erwachsenen und nach Vorschrift des Arztes anwenden.
Übermäßiger Gebrauch von ß2-Sympathomimetika-Inhalaten, wie Salbutamol, kann gesundheitsschädigend sein (siehe Warnhinweis unter Dosierung).
4.3 Gegenanzeigen
• Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Salbutamol STADA® N sollte nur bei strenger Indikationsstellung und mit Vorsicht angewendet werden bei
• schweren Herzerkrankungen, insbesondere frischem Herzinfarkt, koronarer Herzkrankheit, hypertropher obstruktiver Kardiomyopathie und tachykarden Arrhythmien
• Einnahme von Herzglykosiden
• schwerer und unbehandelter Hypertonie
• Aneurysmen
• Hyperthyreose
• schwer kontrollierbarem Diabetes mellitus
• Phäochromozytom.
Salbutamol sollte nicht als einzige Therapie bei Patienten mit persistierendem Asthma eingesetzt werden.
Ein ansteigender Bedarf von ß2-Sympathomimetika wie Salbutamol STADA® N ist ein Anzeichen für eine Verschlechterung der Erkrankung.
Kommt es trotz Therapie zu keiner befriedigenden Besserung oder gar zu einer Verschlechterung des Leidens, muss der Therapieplan durch den Arzt überdacht und ggf. durch eine Kombination mit entzündungshemmenden Arzneimitteln, eine Dosisanpassung einer bereits bestehenden entzündungshemmenden Therapie oder die zusätzliche Gabe weiterer Arzneimittel neu festgesetzt werden. Bei akuter oder sich rasch verschlimmernder Atemnot muss unverzüglich ärztliche Hilfe in Anspruch genommen werden.
Eine erhebliche Überschreitung, insbesondere der vorgegebenen Einzeldosen beim akuten Anfall, aber auch der Tagesdosis kann gefährlich sein wegen der kardialen Nebenwirkungen, insbesondere in Verbindung mit ElektrolytVerschiebungen (Hypokaliämie) und muss deshalb vermieden werden.
Bei der Anwendung von Sympathomimetika, einschließlich Salbutamol, können kardiovaskuläre Effekte auftreten. Aufgrund von Daten aus der Marktbeobachtung nach Zulassung sowie aus publizierter Literatur gibt es Hinweise auf das seltene Auftreten von myokardialer Ischämie im Zusammenhang mit Salbutamol. Patienten mit einer zugrunde liegenden schweren Herzerkrankung (z.B. ischämischer Herzerkrankung, Arrhythmie oder schwerer Herzinsuffizienz), die Salbutamol erhalten, sollten dringend darauf hingewiesen werden ärztlichen Rat zu suchen, wenn sie Schmerzen in der Brust oder Symptome einer sich verschlimmernden Herzerkrankung feststellen. Bei der Beurteilung von Symptomen wie Atemnot und Brustschmerzen ist besondere Sorgfalt erforderlich, da diese entweder respiratorischer oder kardialer Herkunft sein können.
Es ist wiederholt über ein erhöhtes Risiko für schwere Komplikationen und Todesfälle bei der Behandlung des Asthma bronchiale mit ß-Sympathomimetika zur Inhalation berichtet worden, ohne dass die ursächlichen Zusammenhänge bisher hinreichend geklärt werden konnten.
Bei der Inhalation von Salbutamol STADA® N in hohen Dosen kann der Blutzuckerspiegel ansteigen. Bei Diabetikern sollten engmaschige Blutzuckerkontrollen durchgeführt werden.
Sehr selten ist über eine Laktatazidose in Verbindung mit hohen therapeutischen Dosen von kurzwirksamen Beta-Sympathomimetika berichtet worden, die intravenös oder über einen Vernebler inhaliert wurden, hauptsächlich bei Patienten, die wegen einer akuten Asthmaexazerbation behandelt wurden (siehe Abschnitt 4.8 Nebenwirkungen). Ein Anstieg des Serumlaktatspiegels kann zu Dyspnoe und kompensatorischer Hyperventilation führen, die fälschlicherweise als ein Hinweis auf ein Versagen der Asthmatherapie missinterpretiert und zu unangemessener Intensivierung der Therapie mit kurzwirksamen Beta- Sympathomimetika führen kann. Deshalb wird empfohlen, die Patienten auf die Entwicklung von erhöhten Serumlaktatspiegeln und nachfolgender metabolischer Azidose zu überwachen.
Zur Beurteilung von Krankheitsverlauf und Therapieerfolg ist eine tägliche Selbstkontrolle nach ärztlicher Anleitung wichtig. Dies erfolgt z.B. durch regelmäßige Messung der max. Atemstoßstärke mittels Peak-flow-Meter.
Es ist in einzelnen Fällen über die Auslösung von Glaukomanfällen bei Patienten mit Engwinkelglaukom berichtet worden, die mit einer Kombination von Salbutamol und Ipratropiumbromid bzw. Oxitropiumbromid behandelt wurden. Bei Vorliegen eines Engwinkelglaukoms sollte daher bei einer kombinierten Behandlung von Salbutamol mit Anticholinergika besonders darauf geachtet werden, dass das Inhalat nicht mit den Augen in Berührung kommt.
Die Anwendung von Salbutamol STADA® N kann bei Dopingkontrollen zu positiven Ergebnissen führen. Die gesundheitlichen Folgen der Anwendung von Salbutamol STADA® N als Dopingmittel können nicht abgesehen werden, schwerwiegende Gesundheitsgefährdungen sind nicht auszuschließen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die gleichzeitige Anwendung von Salbutamol STADA® N und ß-Rezeptorenblockern führt zu einer gegenseitigen Wirkungsabschwächung, wobei die Gabe von ß-Rezeptorenblockern bei Patienten mit Asthma bronchiale das Risiko der Auslösung schwerer Bronchospasmen birgt.
Weiterhin kann die Blutzucker senkende Wirkung von Antidiabetika bei Behandlung mit Salbutamol STADA® N vermindert werden. Hiermit ist jedoch im Allgemeinen erst bei höheren Dosen zu rechnen, wie sie bei systemischer Gabe (als Tabletten oder Injektion/Infusion) üblich sind.
Eine wechselseitige Wirkungsverstärkung und ein erhöhtes Risiko für unerwünschte Wirkungen sind möglich bei gleichzeitiger Gabe von Salbutamol STADA® N und Methylxanthinen (wie z.B. Theophyllin) oder anderen Sympathomimetika.
Ein erhöhtes Risiko für unerwünschte Wirkungen ist möglich bei gleichzeitiger Gabe von Salbutamol STADA® N und Digitalisglykosiden.
Bei der Anwendung halogenierter Anästhetika, wie z.B. Halothan,
Methoxyfluran oder Enfluran, muss bei Patienten, die mit Salbutamol STADA®
N behandelt werden, mit einem erhöhten Risiko für schwere Herzrhythmusstörungen und Blutdrucksenkung gerechnet werden (siehe Hinweise).
Hinweise
Wenn eine Narkose unter Verwendung von halogenierten Anästhetika geplant ist, sollte darauf geachtet werden, dass Salbutamol innerhalb von mindestens 6 Stunden vor Narkosebeginn möglichst nicht mehr angewendet wird.
Bei hoch dosierter Therapie mit Salbutamol STADA® N kann eine Hypokaliämie auftreten.
Diese kann bei gleichzeitiger Anwendung anderer Arzneimittel, insbesondere Methylxanthinen (z.B. Theophyllin), Kortikoiden, Diuretika oder Digitalisglykosiden, oder bei gleichzeitig bestehender Hypoxämie noch verstärkt werden. Eine Kontrolle der Blutsalze ist angezeigt, damit ggf. Kalium zugeführt werden kann.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Salbutamol passiert die Plazentaschranke. Obwohl bisher keine teratogenen Wirkungen beim Menschen bekannt sind, sollte Salbutamol in der Schwangerschaft, insbesondere während des ersten Schwangerschaftsdrittels nur nach besonders kritischer Indikationsstellung angewandt werden. Das Gleiche gilt wegen der Wehen hemmenden Wirkung für die Anwendung am Ende der Schwangerschaft.
Stillzeit
Es ist unbekannt, ob Salbutamol unerwünschte Wirkungen auf das Neugeborene hat. Da Salbutamol in die Muttermilch übergeht, wird die Anwendung in der Stillzeit nur nach sorgfältiger Nutzen-Risikoabwägung empfohlen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Durch individuell auftretende unterschiedliche Reaktionen, insbesondere bei höherer Dosierung, kann die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt werden. Dies gilt in verstärktem Maße bei Behandlungsbeginn sowie beim Zusammenwirken mit Alkohol oder Beruhigungs- und Schlafmitteln.
4.8 Nebenwirkungen
Die am häufigsten auftretenden Nebenwirkungen sind:
Tremor, Übelkeit, Kopfschmerzen, Schwindel und Palpitationen. Diese Nebenwirkungen können sich bei Fortführung der Behandlung im Verlaufe von 1-2 Wochen zurückbilden.
Untersuchungen
Anstieg des Blutspiegels von Insulin und Beeinflussung des Blutdrucks (Senkung oder Steigerung).
Herzerkrankungen
Palpitationen, Tachykardie, Arrhythmien (einschließlich atrialer Fibrillationen) und Extrasystolen, myokardiale Ischämie.
Erkrankungen des Nervensystems Tremor, Kopfschmerzen und Schwindel.
Erkrankungen der Atemwege, des Brustraums und Mediastinums Husten und paradoxe Bronchospasmen.
Erkrankungen des Gastrointestinaltrakts
Übelkeit und Missempfindungen im Mund-, Rachenbereich.
Erkrankungen der Haut und des Unterzellgewebes Schwitzen
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen Myalgien und Muskelkrämpfe.
Stoffwechsel- und Ernährungsstörungen Hypokaliämie und Hyperglykämie.
Es ist sehr selten über eine Laktatazidose bei Patienten berichtet worden, die zur Behandlung einer akuten Asthmaexazerbation Salbutamol intravenös oder vernebelt erhielten.
Erkrankungen des Immunsystems
Überempfindlichkeitsreaktionen (u.a. Juckreiz, Urtikaria, Exanthem, Hypotonie, Angioödem).
Psychiatrische Erkrankungen
Nervosität, Hyperaktivität, Schlafstörungen, Halluzinationen (insbesondere bei Kindern bis 12 Jahren).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn
Website: http:lllwww.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome einer Intoxikation
Im Falle einer Überdosierung treten die bereits benannten Nebenwirkungen sehr schnell und ggf. in verstärktem Umfang in Erscheinung. Typische Symptome sind: Tachykardie, Palpitationen, Arrhythmien, Ruhelosigkeit, Schlafstörungen, Brustschmerzen und heftiger Tremor insbesondere an den Händen, aber auch am ganzen Körper. Gelegentlich sind nach exzessiven Salbutamol-Dosen psychotische Reaktionen beobachtet worden. Bei Überdosierung von Salbutamol kann es verstärkt zu Verschiebungen von Kalium in den Intrazellularraum mit der Folge einer Hypokaliämie sowie zu Hyperglykämie, Hyperlipidämie und Hyperketonämie kommen.
Therapie einer Intoxikation
Die Behandlung nach ß-sympathomimetischer Überdosierung erfolgt hauptsächlich symptomatisch. Nachfolgend sind eine Reihe zu empfehlender Maßnahmen angeführt:
• Für den Fall, dass große Mengen des Arzneimittels geschluckt wurden, sollte eine Magenspülung erwogen werden. Aktivkohle und Abführmittel können die unerwünschte Resorption des ß-Sympathomimetikums günstig beeinflussen.
• Die kardialen Symptome können mit einem kardioselektiven ß-Rezeptorenblocker behandelt werden, hierbei ist jedoch ein erhöhtes Risiko für die Auslösung einer Bronchospastik bei Patienten mit Asthma bronchiale zu beachten.
• Zur kardialen Überwachung ist EKG-Monitoring angezeigt.
• Im Falle von ausgeprägteren Blutdrucksenkungen ist eine Volumensubstitution (z.B. Plasmaersatzmittel) zu empfehlen.
Es muss mit der Entwicklung einer Hypokaliämie gerechnet werden, so dass entsprechende Kontrollen des Elektrolythaushaltes und ggf. Substitutionen zu empfehlen sind. Zu beachten ist dabei auch eine eventuell vorausgehende Behandlung mit anderen Pharmaka, die eine Hypokaliämie verursachen können.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Broncholytikum/Antiasthmatikum/ ß2-Sympathomimetikum
ATC-Code: R 03A C02.
Salbutamol ist ein direkt wirkendes Sympathomimetikum. Es ist ein überwiegend selektiver ß2-Adrenozeptor-Agonist, der sowohl die glatte als auch die quergestreifte Muskulatur beeinflusst. Die muskulären Wirkungen bestehen u. a. in Relaxation der Bronchial- und Gefäßmuskulatur, des Uterus sowie Tremor der Skelettmuskulatur. Die Relaxation der glatten Muskulatur ist dosisabhängig und soll über Effekte auf das Adenylatcyclase-cAMP-System in der Weise ausgelöst werden, dass sich das Pharmakon über den ß-adrenergen Rezeptor an die Zellmembran bindet und hierdurch eine Umwandlung von ATP in cAMP und, vermittelt über Guanosin-bindendes Nukleotid-Protein, eine Aktivierung der Proteinkinase-A bewirkt. Dies wiederum hat eine Vermehrung des Anteils an gebundenem intrazellulärem Calcium durch erhöhte Proteinphosphorylierung zur Folge, so dass das intrazellulär ionisierte Calcium nur vermindert verfügbar ist. Dies inhibiert die Aktin-Mysosin-Bindung, so dass ein verminderter Spannungszustand der kontraktilen Elemente zu einer muskulären Relaxation führt.
ß2-Agonisten, wie Salbutamol, haben außerdem einen antiallergischen Effekt über eine Hemmung der Freisetzung bronchokonstriktorischer Mediatoren aus Mastzellen wie Histamin, neutrophile chemotactive factor (NCF) und Prostaglandin D2 (PGD-2). Diese Effekte sind sowohl durch In-vitro-Studien mit humanen Mastzellen als auch durch In-vivo-Untersuchungen mit Mediatorbestimmungen in Antigen-Provokations-Tests nachgewiesen worden. Ebenso wie bei der ß-Adrenozeptor-Wirkung auf die Bronchialmuskulatur wird es bei der Regulierung der Mastzell-Funktion als wahrscheinlich angesehen, dass das cAMP-System als second messenger in Erscheinung tritt.
Als weitere Wirkung auf das Bronchialsystem konnte eine Steigerung der mukoziliären Clearance nachgewiesen werden, wobei Wirkungsmechanismus und klinische Relevanz noch nicht eindeutig geklärt sind.
Eine Stimulation von ß2-Rezeptoren der Gefäßwände durch Salbutamol führt zu einer Vasodilatation vor allem in der Peripherie und infolgedessen zur reflektorischen Steigerung der Herzfrequenz, das Herzschlagvolumen wird hingegen nur wenig beeinflusst. Die Chronotropie von Salbutamol ist erheblich geringer im Vergleich zu ß^Rezeptor stimulierenden Substanzen, wie etwa Isoprenalin. Verschiedene Untersuchungen haben nach Vernebler-Inhalations-sowie parenteraler Anwendung von Salbutamol eine Senkung des diastolischen Blutdrucks gezeigt, während hinsichtlich des systolischen Blutdrucks uneinheitlich Anstiege bzw. Senkungen beobachtet wurden.
Darüber hinaus sind weit gefächerte metabolische Wirkungen von Salbutamol durch eine Erregung von ß2-Rezeptoren nachgewiesen worden. Hierzu zählen Anstiege der Blutkonzentrationen von freien Fettsäuren, Glycerol, Insulin, Laktat und Glukose sowie ein Absinken der Kaliumionenkonzentration. Der hypokaliämische Effekt ist nicht direkt mit dem Anstieg des Insulinspiegels korreliert und soll Folge einer direkten ß2-Rezeptorstimulation sein, deren Wirkung über eine membrangebundene Na+-K+-ATPase vermittelt werden soll.
Nach Inhalation von Salbutamol tritt die bronchodilatorische Wirkung nach 5-15 Minuten ein, was auf eine lokale Wirkung hindeutet, während zum Zeitpunkt der maximalen Plasmakonzentration ein vergleichsweise geringer therapeutischer Effekt festzustellen ist. Eine maximale Verbesserung der Lungenfunktion wurde in verschiedenen Untersuchungen 1-2 Stunden nach der Inhalation gemessen, die Wirkungsdauer wurde mit 3-4 Stunden festgestellt.
Therapeutische Äquivalenzprüfung
Eine im Jahr 1993 durchgeführte Untersuchung zur therapeutischen Aquivalenz an 24 Probanden ergab im Vergleich zum Referenzpräparat:
|
Lungenfunktionsparameter (Einheit) |
Testpräparat |
Referenzpräparat |
|
FEV1 [1]* 45 Minuten vor Dosierungsbeginn |
2,60 (±0,65) |
2,64 (±0,71) |
|
FEV1-Anstieg [1]* nach Inhalation von16 kumulativen Dosen (entsprechend 1,6 mg Salbutamol) |
1,09 (±0,51) |
0,99 (±0,51) |
*Angabe der Werte als Mittelwerte und Streubreite
1.2 0.6-
S = T cstpräparat
V = Referenzpräparat
0.3J 0.2 0.1 0.0
Kumulative Inhalationen im Abstand von 30 Minuten
Bei Neugeborenen und Kleinkindern bis zu einem Alter von 20 Monaten kann die Wirkung von Salbutamol verringert sein oder fehlen.
Untersuchungen hinsichtlich der Möglichkeit eines Wirksamkeitsverlustes (Tachyphylaxie) bei Langzeitanwendung von Salbutamol kamen zu keinem übereinstimmenden Ergebnis. Im Falle eines Wirksamkeitsverlustes bei längerfristiger Anwendung kann die kombinierte Anwendung mit Glukokortikoiden die verminderte Ansprechbarkeit der ß2-Rezeptoren wieder erhöhen.
5.2 Pharmakokinetische Eigenschaften
Resorption und Metabolisierung von Salbutamol verlaufen in Lunge und
Gastrointestinaltrakt unterschiedlich.
Nach der Inhalation gelangen etwa 10-20% des Wirkstoffes in die tieferen Bronchialwege, während sich der Rest im Mund und oberen Abschnitt des Atemtraktes absetzt und sukzessive verschluckt wird. In verschiedenen Untersuchungen wurde nach inhalativer Anwendung von Salbutamol ein im Vergleich zur peroralen Applikation ähnlicher, jedoch zeitlich verzögerter Plasmaspiegelverlauf sowie ein ähnliches Konzentrations-Verhältnis von Salbutamol zu seinen Metaboliten gefunden. Der maximale Plasmaspiegel wird demzufolge nach 3-5 Stunden erreicht, und das Verhältnis von freiem Wirkstoff zu Metaboliten beträgt etwa 1:4, womit es als sehr wahrscheinlich anzusehen ist, dass die gemessenen Plasmakonzentrationen dem nach Verschlucken resorbierten Wirkstoffanteil entsprechen. Nach Inhalation von Salbutamol mit Hilfe eines Verneblers in drei Dosisstufen von 1,5 mg, 3 mg und 7,5 mg wurden mittlere maximale Plasmaspiegel von jeweils 0,2 ng/ml, 1,1 ng/ml und 2,5 ng/ml gemessen. Der Wirkungseintritt sowie der maximale therapeutische Effekt erscheinen nach inhalativer Anwendung im Vergleich zur peroralen Gabe erheblich rascher (Wirkungseintritt 5-15 Minuten nach der Inhalation), dabei zeigt der Plasmaspiegel keine Korrelation mit der pharmakodynamischen Zeitwirkungskurve.
Salbutamol wird nach oraler Verabreichung gut (zu ca. 85%) resorbiert, zwischen 58 und 78% der Substanz werden innerhalb von 24 Stunden und 65-84% innerhalb von 72 Stunden mit dem Urin ausgeschieden. Die Substanz wird zu einem erheblichen Teil präsystemisch in der Darmwand sowie der Leber metabolisiert. Im Gegensatz z.B. zu Isoprenalin ist Salbutamol kein Substrat für die Catechol-O-Methyltransferase und Monoamin-Oxidase. Die Metabolisierung erfolgt hingegen im Wesentlichen über eine Sulfat-Konjugation, als Hauptmetabolit wurde ein 4'-O-Sulfatester identifiziert, der wahrscheinlich in der Darmmukosa gebildet wird und pharmakologisch inaktiv ist.
Nach Verabreichung von Salbutamol-Tabletten bei Erwachsenen konnte Salbutamol bereits nach 30 Minuten im Serum nachgewiesen werden, die maximale Plasmakonzentration wurde nach 2-3 Stunden festgestellt. Dabei betrug die Ratio von freiem Salbutamol zu Metabolit 1 : 5. Es wurde über maximale Plasmakonzentrationen nach einer oralen Einzeldosis von 4 mg Salbutamol von 10-16,9 ng/ml berichtet, die Plasmahalbwertszeit wurde zwischen 2,7 und 5 Stunden bestimmt.
Die Proteinbindung beträgt etwa 10%, das spezifische scheinbare Verteilungsvolumen 3,4+0,6 l/kg. In einer späteren Studie wurde ein mittleres scheinbares Verteilungsvolumen von 156 l ermittelt. Dieses hohe Verteilungsvolumen ist durch eine extensive Verteilung in die Gewebe zu erklären, die durch tierexperimentelle Untersuchungen erhärtet wurde.
Die totale Plasmaclearance nach i.v. Infusion wurde mit 6,6-7,7 ml/min/kg bestimmt. Die Ausscheidung erfolgt zum größten Teil über die Nieren, wobei das Verhältnis von freiem Salbutamol zu Metaboliten von der Art der Anwendung abhängig ist. Nach oraler Gabe finden sich dabei vorwiegend die metabolisierte (55% als Sulfatester), nach i.v. Gabe die nicht-metabolisierte Form. Nach einer Pulver-Inhalation im empfohlenen Dosisbereich folgt das Exkretionsmuster dem nach oraler Gabe, während nach Inhalation höherer Dosen die Ausscheidung eines relativ höheren Anteils der unveränderten Substanz eine größere pulmonale Resorption widerspiegelt.
Die Plazentagängigkeit von Salbutamol wurde in vitro ebenso wie in vivo nachgewiesen.
5.3 Präklinische Daten zur Sicherheit
Untersuchungen zur Mutagenität ergaben keine Hinweise auf ein gentoxisches Potential von Salbutamol. Unter Langzeitgabe von sehr hohen Dosen von Salbutamol an Ratten kommt es, wie auch bei anderen BetaSympathomimetika, zur Ausbildung von gutartigen Leiomyomen des Mesovariums. Nach vorherrschender Meinung ist eine Übertragbarkeit auf den Menschen jedoch nicht gegeben. Reproduktionstoxikologische Studien an drei Tierspezies (Ratte, Maus, Kaninchen) haben keine Hinweise auf ein teratogenes Potential von Salbutamol ergeben. Embryo- bzw. fetotoxische Effekte (verringertes Geburtsgewicht, gesteigerte Mortalitätsrate) wurden bei der Ratte nach oraler Gabe von 50 mg/kg/Tag beobachtet. Fertilitätsstörungen bei männlichen und weiblichen Ratten traten bis zu einer Dosis von 50 mg/kg/Tag nicht auf.
Für den Menschen liegen über die Anwendung während der Schwangerschaft unzureichende Erfahrungen vor. Tachykardie und Hypoglykämie des Neugeborenen sind bei der Anwendung von Salbutamol als Tokolytikum beschrieben worden.
Zur Anwendung beim Menschen während Schwangerschaft und Stillzeit siehe Abschnitt 4.6.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Ethanol, Norfluran, Ölsäure.
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
2 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über +25°C lagern.
Behälter steht unter Druck!
Vor Hitze, direkter Sonnenbestrahlung und Frost schützen!
Nicht gegen Flammen oder auf glühende Gegenstände sprühen!
Nicht gewaltsam öffnen oder verbrennen!
6.5 Art und Inhalt des Behältnisses
Aluminiumkännchen, verschlossen mit einem Dosierventil und verbunden mit einem Adapter.
Packung mit 200 Einzeldosen Doppelpackung mit 2 x 200 Einzeldosen Dreierpackung mit 3 x 200 Einzeldosen
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. Inhaber der Zulassung
Pharmazeutischer Unternehmer STADApharm GmbH Stadastraße 2-18 61118 Bad Vilbel Telefon: 06101 603-0 Telefax: 06101 603-259 Internet: www.stada.de
Zulassungsinhaber
3M Health Care Limited,1 Morley Street, Loughborough Leicestershire, LE11 1EP, Großbritannien
8. Zulassungsnummer
41203.00.00
9. Datum der Erteilung der Zulassung/Verlängerung der Zulassung
11.06.1998/ 24.11.2005
10. Stand der Information
März 2014
11. Verkaufsabgrenzung
Verschreibungspflichtig
17