Salbutamol Orion Easyhaler 0,1 Mg/Dosis
Fachinformation
1. BEZEICHNUNG DER ARZNEIMITTEL
Salbutamol Orion Easyhaler 0,1 mg/Dosis, Pulver zur Inhalation Salbutamol Orion Easyhaler 0,2 mg/Dosis, Pulver zur Inhalation
Wirkstoff: Salbutamolsulfat
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Salbutamol Orion Easyhaler 0,1 mg/Dosis
Eine Einzeldosis Salbutamol Orion Easyhaler 0,1 mg/Dosis enthält 0,12 mg Salbutamolsulfat. Dies entspricht einer (aus dem Mundstück) abgegebenen Dosis von 0,108 mg Salbutamolsulfat, entsprechend 0,09 mg Salbutamol.
Salbutamol Orion Easyhaler 0,2 mg/Dosis
Eine Einzeldosis Salbutamol Orion Easyhaler 0,2 mg/Dosis enthält 0,24 mg Salbutamolsulfat. Dies entspricht einer (aus dem Mundstück) abgegebenen Dosis von 0,216 mg Salbutamolsulfat, entsprechend 0,18 mg Salbutamol.
Sonstiger Bestandteil: Lactose-Monohydrat (enthält geringe Mengen Milchprotein).
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver zur Inhalation
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Erwachsene und Kinder über 6 Jahren
- Symptomatische Behandlung von Erkrankungen mit reversibler Atemwegsobstruktion wie z. B.Asthma bronchiale.
- Verhütung von durch Anstrengung oder Allergenkontakt verursachten Asthmaanfällen. Erwachsene
- Behandlung chronisch obstruktiver bronchialer Erkrankung (COPD) mit reversibler Komponente.
Hinweise
Eine längerfristige Behandlung soll symptomorientiert und nur in Verbindung mit einer entzündungshemmenden Dauertherapie erfolgen.
Salbutamol Orion Easyhaler 0,2 mg/Dosis ist nur angezeigt, wenn sich niedriger dosierte ß2-Sympathomimetika-haltige Arzneimittel zur Inhalation bei der Behandlung der Atemnot als nicht ausreichend erwiesen haben.
4.2 Dosierung, Art und Dauer der Anwendung
Salbutamol Orion Easyhaler 0,1 mg/Dosis
Die Dosierung richtet sich nach Art und Schwere der Erkrankung.
Für Erwachsene und Kinder über 6 Jahre gelten folgende Dosierungsempfehlungen:
1 Einzeldosis entspricht 0,1 mg Salbutamol.
- Zur Akutbehandlung plötzlich auftretender Bronchialkrämpfe und anfallsweise auftretender Atemnot wird eine Einzeldosis inhaliert. Sollte sich die Atemnot 5-10 Minuten nach Inhalation der ersten Einzeldosis nicht spürbar gebessert haben, kann eine weitere Einzeldosis genommen werden. Kann ein schwerer Anfall von Luftnot auch durch eine zweite Einzeldosis nicht behoben werden, können weitere Einzeldosen erforderlich werden. In diesen Fällen muss unverzüglich ärztliche Hilfe in Anspruch genommen werden.
- Im Zusammenhang mit einer Dauerbehandlung sollte vorzugsweise die jeweilige Einzelanwendung hinsichtlich Zeitpunkt und Dosis entsprechend Auftreten und Schwere der Atemnot (symptomorientiert) unter Berücksichtigung der folgenden Dosierungsempfehlungen und in Ergänzung zu einer entzündungshemmenden Dauertherapie mit Kortikoiden zur Inhalation oder anderen entzündungshemmend wirkenden Substanzen erfolgen. Bei Auftreten von Atemnot wird eine Einzeldosis (0,1 mg Salbutamol) inhaliert.
- Zur gezielten Vorbeugung bei Anstrengungsasthma oder vorhersehbarem Allergenkontakt wird eine Einzeldosis, wenn möglich etwa 10-15 Minuten vorher, inhaliert.
- Falls eine Dauerbehandlung mit ß2-Sympathomimetika für notwendig befunden wird, beträgt die Dosierung 1 Einzeldosis 3-4-mal pro Tag. Sie sollte von einer entzündungshemmenden Dauertherapie begleitet werden. Der Abstand der einzelnen Inhalationen soll mindestens 4 Stunden betragen.
Die Tagesgesamtdosis für Erwachsene soll 1,0 mg Salbutamol (entsprechend 10 Einzeldosen) nicht überschreiten. Für Kinder soll die Tagesgesamtdosis 0,4 mg Salbutamol (entsprechend 4 Einzeldosen) nicht überschreiten. Eine höhere Dosierung lässt im Allgemeinen keinen zusätzlichen therapeutischen Nutzen erwarten, die Wahrscheinlichkeit des Auftretens auch schwerwiegender Nebenwirkungen kann aber erhöht werden.
Dieses Arzneimittel ist ausschließlich zum Inhalieren bestimmt.
Es ist wichtig, sicherzustellen, dass die Patienten detaillierte Anweisungen zum korrekten Gebrauch erhalten und Kinder sich unter der Aufsicht eines Erwachsenen befinden, wenn sie den Inhalator verwenden.
Salbutamol Orion Easyhaler 0,2 mg/Dosis
Die Dosierung richtet sich nach Art und Schwere der Erkrankung.
Für Erwachsene (einschließlich ältere Personen und Jugendliche) gelten folgende Dosierungsempfehlungen:
1 Einzeldosis entspricht 0,2 mg Salbutamol.
- Zur Akutbehandlung plötzlich auftretender Bronchialkrämpfe und anfallsweise auftretender Atemnot wird eine Einzeldosis inhaliert. Sollte sich die Atemnot 5-10 Minuten nach Inhalation der ersten Einzeldosis nicht spürbar gebessert haben, kann eine weitere Einzeldosis genommen werden. Kann ein schwerer Anfall von Luftnot auch durch eine zweite Einzeldosis nicht behoben werden, können weitere Einzeldosen erforderlich werden. In diesen Fällen muss unverzüglich ärztliche Hilfe in Anspruch genommen werden.
- Im Zusammenhang mit einer Dauerbehandlung sollte vorzugsweise die jeweilige Einzelanwendung hinsichtlich Zeitpunkt und Dosis entsprechend Auftreten und Schwere der Atemnot (symptomorientiert) unter Berücksichtigung der folgenden Dosierungsempfehlungen und in Ergänzung zu einer entzündungshemmenden Dauertherapie mit Kortikoiden zur
Inhalation oder anderen entzündungshemmend wirkenden Substanzen erfolgen. Bei Auftreten von Atemnot wird eine Einzeldosis (0,2 mg Salbutamol) inhaliert.
- Zur gezielten Vorbeugung bei Anstrengungsasthma oder vorhersehbarem Allergenkontakt wird eine Einzeldosis, wenn möglich etwa 10-15 Minuten vorher, inhaliert.
- Falls eine Dauerbehandlung mit ß2-Sympathomimetika für notwendig befunden wird, beträgt die Dosierung 1 Einzeldosis 3-4-mal pro Tag. Sie sollte von einer entzündungshemmenden Dauertherapie begleitet werden. Der Abstand der einzelnen Inhalationen soll mindestens 4 Stunden betragen.
Die Tagesgesamtdosis für Erwachsene soll 1,0 mg Salbutamol (entsprechend 5 Einzeldosen) nicht
überschreiten, da eine höhere Dosierung im Allgemeinen keinen zusätzlichen therapeutischen
Nutzen erwarten lässt, aber die Wahrscheinlichkeit des Auftretens auch schwerwiegender
Nebenwirkungen erhöht werden kann.
Dieses Arzneimittel ist ausschließlich zum Inhalieren bestimmt.
Es ist wichtig, sicherzustellen, dass die Patienten detaillierte Anweisungen zum korrekten Gebrauch
erhalten, wenn sie den Inhalator verwenden.
Für Kinder stehen entsprechende Arzneimittel mit niedriger Einzeldosis zur Verfügung.
Art und Dauer der Anwendung
Die Anwendung sollte möglichst im Sitzen oder Stehen erfolgen.
Bedienungsanleitung
Lesen Sie die folgenden Hinweise sorgfältig, bevor Sie Salbutamol Orion Easyhaler anwenden.
Befolgen Sie bitte unbedingt die hier gemachten Angaben.
A. Einsetzen des Easyhaler in die Schutzbox
1. Entnehmen Sie den Easyhaler aus der Folienverpackung.
2. Öffnen Sie die Schutzbox (Abb. 2).
3. Stecken Sie den Easyhaler in die Schutzbox (Abb. 2). Die Schutzkappe auf dem Mundstück des Easyhaler (Abb. 1) blockiert diesen und verhindert eine versehentliche Betätigung des Easyhaler beim Einsetzen in die Schutzbox.
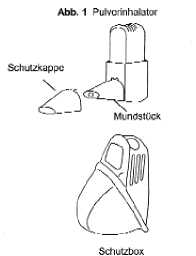
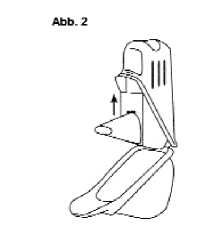
4. Verschließen Sie die Schutzbox bis zum Anschlag.
Hinweis
Das aufklappbare und wiederverschließbare Etikett an der Rückseite Ihres Easyhaler enthält wichtige Informationen über das Arzneimittel. Vermeiden Sie bitte Beschädigungen dieses Etiketts und achten Sie darauf, dass dieses beim Einsetzen des Easyhaler in die Schutzbox verschlossen ist.
B. Bedienung des Easyhaler
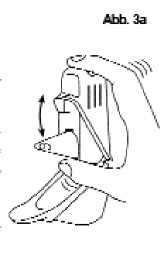
1. Öffnen Sie die Schutzbox. Entfernen Sie die Schutzkappe vom Mundstück.
2. Schütteln Sie den Easyhaler kräftig (Abb. 3a). Halten Sie den Easyhaler dabei senkrecht.
3. Zur Freisetzung einer Einzeldosis drücken Sie den Easyhaler zwischen Daumen und Zeigefinger 1-mal herunter bis Sie ein Klickgeräusch hören (Abb. 4a). Anschließend lassen Sie den Easyhaler in seine Ausgangsposition zurückgleiten. Halten Sie den Easyhaler dabei weiter senkrecht.
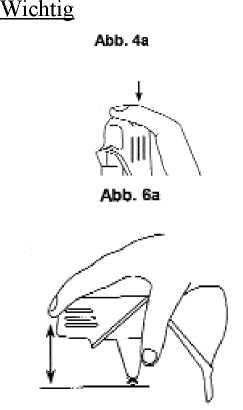
Eine Einzeldosis sollte nur freigesetzt werden, wenn diese anschließend inhaliert wird. Bei versehentlichem Freisetzen einer Einzeldosis kann diese durch Ausklopfen auf einer festen Unterlage aus dem Mundstück des Easyhaler entfernt werden (Abb. 6a). Wiederholen Sie dann die Bedienung des Easyhaler ab Punkt B.2.
4. Inhalieren Sie den Arzneistoff entsprechend der folgenden Anweisung:
Atmen Sie normal aus, bevor Sie das Mundstück in den Mund nehmen. Atmen Sie nie in den Easyhaler hinein. Nehmen Sie nun das Mundstück in den Mund und atmen Sie tief und kräftig ein (Abb. 5a). Nehmen Sie dann das Mundstück aus dem Mund und halten Sie für 5-10 Sekunden den Atem an.
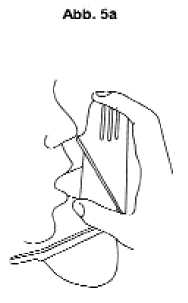
Sollten Sie mehr als eine Einzeldosis benötigen, beginnen Sie wieder bei Punkt B.2.
5. Setzen Sie die Schutzkappe wieder auf das Mundstück. Dadurch wird der Easyhaler blockiert, d. h., auch bei versehentlicher Betätigung des Easyhaler wird keine Dosis freigesetzt. Schließen Sie die Schutzbox.
6. Spülen Sie Ihren Mund nach der Inhalation mit Wasser aus und spucken Sie das Wasser danach aus.
Reinigung
Das Mundstück kann mit einem trockenen Tuch gereinigt werden. Verwenden Sie zur Reinigung niemals Wasser!
Aufbewahrung
Bewahren Sie den Easyhaler bei Raumtemperatur an einem trockenen Ort auf.
Verbrauch des Inhalationspulvers
Der Easyhaler hat ein Zählwerk, das die Anzahl der verbleibenden Dosen anzeigt (Abb. 7a). Nach jeder
5. Anwendung bewegt sich das Zählwerk weiter. Erscheint eine rote Markierung im Sichtfenster, stehen noch 20 Einzeldosen zur Verfügung. Sie sollten sich zu diesem Zeitpunkt um einen neuen Easyhaler bemühen.
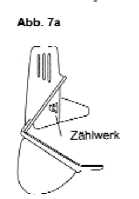
Zeigt das Zählwerk 0 an, wurden 200 Einzeldosen abgegeben. Wenden Sie Salbutamol Orion Easyhaler, danach nicht weiter an, da die korrekte Dosierung nicht mehr gewährleistet ist. Die vorhandenen Pulverrestmengen sind produktionstechnisch bedingt.
Beim Ersatz des Salbutamol Orion Easyhaler durch einen Neuen können Sie die alte Schutzbox wieder verwenden.
Die Dauer der Behandlung richtet sich nach Art, Schwere und Verlauf der Erkrankung und ist vom Arzt individuell zu entscheiden.
Hinweise
Um eine falsche Anwendung zu vermeiden, ist eine gründliche Einweisung des Patienten in den korrekten Gebrauch vorzunehmen. Kinder sollten dieses Arzneimittel nur unter Aufsicht eines Erwachsenen und nach Vorschrift des Arztes anwenden.
Übermäßiger Gebrauch von ^-Sympathomimetika zur Inhalation wie Salbutamol kann gesundheitsschädigend sein (siehe Warnhinweis unter Dosierung).
4.3 Gegenanzeigen
Salbutamol Orion Easyhaler darf nicht angewendet werden bei Überempfindlichkeit gegenüber Salbutamol, Milchprotein oder einen der sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Salbutamol Orion Easyhaler sollte nur bei strenger Indikationsstellung und mit Vorsicht angewendet werden bei:
- schweren Herzerkrankungen, insbesondere frischem Herzinfarkt, koronarer Herzkrankheit, hypertropher obstruktiver Kardiomyopathie und tachykarden Arrhythmien
- Einnahme von Herzglykosiden
- schwerer und unbehandelter Hypertonie
- Aneurysmen
- Hyperthyreose
- schwer kontrollierbarem Diabetes mellitus
- Phäochromozytom
Salbutamol sollte nicht als einzige Therapie bei Patienten mit persistierendem Asthma eingesetzt werden.
Ein ansteigender Bedarf von ß2-Sympathomimetika wie Salbutamol Orion Easyhaler ist ein Anzeichen für eine Verschlechterung der Erkrankung.
Kommt es trotz Therapie zu keiner befriedigenden Besserung oder gar zu einer Verschlechterung des Leidens, muss der Therapieplan durch den Arzt überdacht und gegebenenfalls durch eine Kombination mit entzündungshemmenden Arzneimitteln, eine Dosisanpassung einer bereits bestehenden entzündungshemmenden Therapie oder die zusätzliche Gabe weiterer Arzneimittel neu festgesetzt werden. Bei akuter oder sich rasch verschlimmernder Atemnot muss unverzüglich ärztliche Hilfe in Anspruch genommen werden.
Eine erhebliche Überschreitung, insbesondere der vorgegebenen Einzeldosen beim akuten Anfall, aber auch der Tagesdosis kann gefährlich sein wegen der kardialen Nebenwirkungen, insbesondere in Verbindung mit Elektrolyt-Verschiebungen (Hypokaliämie) und muss deshalb vermieden werden.
Es ist wiederholt über ein erhöhtes Risiko für schwere Komplikationen und Todesfälle bei der Behandlung des Asthma bronchiale mit ß-Sympathomimetika zur Inhalation berichtet worden, ohne dass die ursächlichen Zusammenhänge bisher hinreichend geklärt werden konnten.
Bei der Inhalation von Salbutamol Orion Easyhaler in hohen Dosen kann der Blutzuckerspiegel ansteigen. Bei Diabetikern sollten engmaschige Blutzuckerkontrollen durchgeführt werden.
Zur Beurteilung von Krankheitsverlauf und Therapieerfolg ist eine tägliche Selbstkontrolle nach ärztlicher Anleitung wichtig. Dies erfolgt z. B. durch regelmäßige Messung der max.
Atemstoßstärke mittels Peak-flow-Meter.
Die Anwendung von Salbutamol Orion Easyhaler kann bei Dopingkontrollen zu positiven Ergebnissen führen. Eine missbräuchliche Anwendung des Arzneimittels Salbutamol Orion Easyhaler zu Dopingzwecken kann die Gesundheit gefährden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die gleichzeitige Anwendung von Salbutamol Orion Easyhaler und ß-Rezeptorenblockem führt zu einer gegenseitigen Wirkungsabschwächung, wobei die Gabe von ß-Rezeptorenblockern bei Patienten mit Asthma bronchiale das Risiko der Auslösung schwerer Bronchospasmen birgt.
Weiterhin kann die blutzuckersenkende Wirkung von Antidiabetika bei Behandlung mit Salbutamol Orion Easyhaler vermindert werden. Hiermit ist jedoch im Allgemeinen erst bei höheren Dosen zu rechnen, wie sie bei systemischer Gabe (als Tabletten oder Injektion/Infusion) üblich sind.
Eine wechselseitige Wirkungsverstärkung und ein erhöhtes Risiko für unerwünschte Wirkungen sind möglich bei gleichzeitiger Gabe von Salbutamol Orion Easyhaler und Methylxanthinen (wie z. B. Theophyllin) oder anderen Sympathomimetika.
Ein erhöhtes Risiko für unerwünschte Wirkungen ist möglich bei gleichzeitiger Gabe von Salbutamol Orion Easyhaler und Digitalisglykosiden.
Bei der Anwendung halogenierter Anästhetika, wie z. B. Halothan, Methoxyfluran oder Enfluran, muss bei Patienten, die mit Salbutamol Orion Easyhaler behandelt werden, mit einem erhöhten Risiko für schwere Herzrhythmusstörungen und Blutdrucksenkung gerechnet werden (siehe Hinweise).
Hinweise
Wenn eine Narkose unter Verwendung von halogenierten Anästhetika geplant ist, sollte darauf geachtet werden, dass Salbutamol innerhalb von mindestens 6 Stunden vor Narkosebeginn möglichst nicht mehr angewendet wird.
Bei hochdosierter Therapie mit Salbutamol Orion Easyhaler kann eine Hypokaliämie auftreten. Diese kann bei gleichzeitiger Anwendung anderer Arzneimittel, insbesondere Methylxanthinen (z. B. Theophyllin), Kortikoiden, Diuretika oder Digitalisglykosiden, oder bei gleichzeitig bestehender Hypoxämie noch verstärkt werden. Eine Kontrolle der Blutsalze ist angezeigt, damit ggf. Kalium zugeführt werden kann.
4.6 Schwangerschaft und Stillzeit
Salbutamol passiert die Plazentaschranke. Für den Menschen liegen über eine Anwendung während der Schwangerschaft unzureichende Erfahrungen vor.Tachykardie und Hypoglykämie des Neugeborenen sind bei der Anwendung von Salbutamol als Tokolytikum beschrieben worden. Tierexperimentelle Studien haben bei der Ratte in sehr hoher Dosierung Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3 „Präklinische Daten zur Sicherheit“). Das potentielle Risiko für den Menschen ist nicht bekannt.
Salbutamol Orion Easyhaler sollte in der Schwangerschaft, insbesondere während der ersten 3 Monate, nur nach besonders kritischer Indikationsstellung angewendet werden. Das Gleiche gilt wegen der wehenhemmenden Wirkung für die Anwendung am Ende der Schwangerschaft.
Da Salbutamol wahrscheinlich in die Muttermilch übergeht, wird die Anwendung in der Stillzeit nur nach sorgfältiger Nutzen-Risiko-Abwägung empfohlen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Durch individuell auftretende unterschiedliche Reaktionen, insbesondere bei höherer Dosierung, kann die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt werden. Dies gilt in verstärktem Maße bei Behandlungsbeginn sowie bei Zusammenwirken mit Alkohol oder Beruhigungs- und Schlafmitteln.
4.8
Nebenwirkungen
Die am häufigsten auftretenden Nebenwirkungen sind:
Tremor, Übelkeit, Kopfschmerzen, Schwindel und Palpitationen. Diese Nebenwirkungen können sich bei Fortführung der Behandlung im Verlauf von 1-2 Wochen zurückbilden.
Generalisierte Störungen
Kopfschmerzen, Schwindel, Schwitzen, Überempfindlichkeitsreaktionen (u. a. Juckreiz, Urtikaria, Exanthem, Hypotonie, Angioödem)
Herz-Kreislauf-System
Palpitationen, Tachykardie, Arrhythmien (einschließlich atrialer Fibrillationen), Extrasystolen, Beeinflussung des Blutdrucks (Senkung oder Steigerung), myokardiale Ischämie
Stoffwechsel/Elektrolyte
Hypokaliämie, Hyperglykämie, Anstieg des Blutspiegels von Insulin Nervensvstem/Psvche
Nervosität, Tremor, Hyperaktivität, Schlafstörungen, Halluzinationen (insbesondere bei Kindern bis 12 Jahre)
Muskel- und Skelettsvstem Myalgien, Muskelkrämpfe
Respirationstrakt
Missempfindungen im Mund- und Rachenbereich, Husten, paradoxe Bronchospasmen
Lactose enthält geringe Mengen Milchprotein und kann deshalb allergische Reaktionen hervorrufen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger Allee 3
D-53175 Bonn
Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Symptome einer Überdosierung
Im Falle einer Überdosierung treten die bereits benannten Nebenwirkungen sehr schnell und gegebenenfalls in verstärktem Umfang in Erscheinung.
Typische Symptome sind:
Tachykardie, Palpitationen, Arrhythmien, Ruhelosigkeit, Schlafstörungen, Brustschmerzen, Laktatazidose und heftiger Tremor insbesondere an den Händen, aber auch am ganzen Körper. Gelegentlich sind nach exzessiven Salbutamol-Dosen psychotische Reaktionen beobachtet worden.
Bei Überdosierung von Salbutamol kann es verstärkt zu Verschiebungen von Kalium in den Intrazellularraum mit der Folge einer Hypokaliämie sowie zu Hyperglykämie, Hyperlipidämie und Hyperketonämie kommen.
Therapiemaßnahmen bei Überdosierung
Die Behandlung nach ß-sympathomimetischer Überdosierung erfolgt hauptsächlich symptomatisch.
Nachfolgend sind eine Reihe zu empfehlender Maßnahmen angeführt:
- Für den Fall, dass große Mengen des Arzneimittels geschluckt wurden, sollte eine Magenspülung erwogen werden. Aktivkohle und Abführmittel können die unerwünschte Resorption des ß-Sympathomimetikums günstig beeinflussen.
- Die kardialen Symptome können mit einem kardioselektiven ß-Rezeptorenblocker behandelt werden, hierbei ist jedoch ein erhöhtes Risiko für die Auslösung einer Bronchospastik bei Patienten mit Asthma bronchiale zu beachten.
- Zur kardialen Überwachung ist EKG-Monitoring angezeigt.
- Im Falle von ausgeprägteren Blutdrucksenkungen ist eine Volumensubstitution (z. B. Plasmaersatzmittel) zu empfehlen.
Es muss mit der Entwicklung einer Hypokaliämie gerechnet werden, so dass entsprechende
Kontrollen des Elektrolythaushaltes und gegebenenfalls Substitutionen zu empfehlen sind. Zu
beachten ist dabei auch eine eventuell vorausgehende Behandlung mit anderen Pharmaka, die eine
Hypokaliämie verursachen können.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Broncholytikum / Antiasthmatikum / ß2-Sympathomimetikum ATC-Code: R03A C02
Salbutamol ist ein direkt wirkendes Sympathomimetikum. Es ist ein überwiegend selektiver ß2-Adrenozeptor-Agonist, der sowohl die glatte als auch die quergestreifte Muskulatur beeinflusst. Die muskulären Wirkungen bestehen u. a. in Relaxation der Bronchial- und Gefäßmuskulatur, des Uterus sowie Tremor der Skelettmuskulatur. Die Relaxation der glatten Muskulatur ist dosisabhängig und soll über Effekte auf das Adenylatcyclase-cAMP-System in der Weise ausgelöst werden, dass sich das Pharmakon über den ß-adrenergen Rezeptor an die Zellmembran bindet und hierdurch eine Umwandlung von AMP in cAMP und, vermittelt über Guanosin-bindendes Nukleotid-Protein, eine Aktivierung der Proteinkinase-A bewirkt. Dies wiederum hat eine Vermehrung des Anteils an gebundenem intrazellulärem Kalzium durch erhöhte Proteinphosphorylierung zur Folge, so dass das intrazellulär ionisierte Kalzium nur vermindert verfügbar ist. Dies inhibiert die Aktin-Myosin-Bindung, so dass ein verminderter Spannungszustand der kontraktilen Elemente zu einer muskulären Relaxation führt.
ß2-Agonisten, wie Salbutamol, haben außerdem einen antiallergischen Effekt über eine Hemmung der Freisetzung bronchokonstriktorischer Mediatoren aus Mastzellen wie Histamin, neutrophile chemotactive factor (NCF) und Prostaglandin D2 (PGD-2). Diese Effekte sind sowohl durch In-vitro-Studien mit humanen Mastzellen als auch durch In-vivo-Untersuchungen mit Mediatorbestimmungen in Antigen-Provokations-Tests nachgewiesen worden. Ebenso wie bei der ß-Adrenozeptor-Wirkung auf die Bronchialmuskulatur wird es bei der Regulierung der MastzellFunktion als wahrscheinlich angesehen, dass das cAMP-System als second messenger in Erscheinung tritt.
Als weitere Wirkung auf das Bronchialsystem konnte eine Steigerung der mukoziliären Clearance nachgewiesen werden, wobei Wirkungsmechanismus und klinische Relevanz noch nicht eindeutig geklärt sind.
Eine Stimulation von ß2-Rezeptoren der Gefäßwände durch Salbutamol führt zu einer Vasodilatation vor allem in der Peripherie und infolgedessen zur reflektorischen Steigerung der Herzfrequenz, das Herzschlagvolumen wird hingegen nur wenig beeinflusst. Die Chronotropie von Salbutamol ist erheblich geringer im Vergleich zu ß1-Rezeptor stimulierenden Substanzen, wie etwa Isoprenalin. Verschiedene Untersuchungen haben nach Vernebler-Inhalations- sowie parenteraler Anwendung von Salbutamol eine Senkung des diastolischen Blutdrucks gezeigt, während hinsichtlich des systolischen Blutdrucks uneinheitlich Anstiege bzw. Senkungen beobachtet wurden.
Darüber hinaus sind weitgefächerte metabolische Wirkungen von Salbutamol durch eine Erregung von ß2-Rezeptoren nachgewiesen worden. Hierzu zählen Anstiege der Blutkonzentrationen von freien Fettsäuren, Glycerol, Insulin, Laktat und Glukose sowie ein Absinken der Kaliumionenkonzentration. Der hypokaliämische Effekt ist nicht direkt mit dem Anstieg des Insulinspiegels korreliert und soll Folge einer direkten ß2-Rezeptorstimulation sein, deren Wirkung über eine Membran gebundene Na+-K+-ATPase vermittelt werden soll.
Nach Inhalation von Salbutamol tritt die bronchodilatorische Wirkung nach 5-15 Minuten ein, was auf eine lokale Wirkung hindeutet, während zum Zeitpunkt der maximalen Plasmakonzentration ein vergleichsweise geringer therapeutischer Effekt festzustellen ist. Eine maximale Verbesserung der Lungenfunktion wurde in verschiedenen Untersuchungen 1-2 Stunden nach der Inhalation gemessen, die Wirkungsdauer wurde mit 3-4 Stunden festgestellt.
Therapeutische Äquivalenzprüfung
Salbutamol Orion Easyhaler 0,1 mg/Dosis
Eine im Jahr 1993 durchgeführte Untersuchung zur therapeutischen Äquivalenz an 40 Probanden ergab im Vergleich zum Referenzpräparat:
|
Lungenfunktionsparameter (Einheit) |
Testpräparat |
Referenzpräparat |
|
Forciertes Exspirationsvolumen in einer Sekun de FEV1,max (l) |
2,49 (0,99) |
2,47 (0,92) |
|
Maximale exspiratorische Flussrate PEFRmax (l/s) |
5,61 (1,88) |
5,67 (1,87) |
|
Forcierte Vitalkapazität FVCmax (l) |
3,59 (1,23) |
3,56 (1,16) |
Angabe der Werte als Mittelwert und Streubreite (Standardabweichung)
Salbutamol Orion Easyhaler 0,2 mg/Dosis
Eine im Jahr 1992 durchgeführte Untersuchung zur therapeutischen Äquivalenz an 21 Probanden ergab im Vergleich zum Referenzpräparat:
Lungenfunktions- Testpräparat Referenzpräparat
parameter (Einheit)
Forciertes Exspirationsvolumen 2,44 (0,96) 2,45 (0,93)
in einer Sekunde FEVi,max (l)
Maximale exspiratorische 454,12 (134,90) 453,76 (137,38)
Flussrate PEFRmax (l/min)
Forcierte Vitalkapazität 3,60 (1,38) 3,57 (1,33)
FVCmax (l)
Angabe der Werte als Mittelwert und Streubreite (Standardabweichung)
Bei Neugeborenen und Kleinkindern bis zu einem Alter von 20 Monaten kann die Wirkung von Salbutamol verringert sein oder fehlen.
Untersuchungen hinsichtlich der Möglichkeit eines Wirksamkeitsverlustes (Tachyphylaxie) bei Langzeitanwendung von Salbutamol kamen zu keinem übereinstimmenden Ergebnis.
Im Falle eines Wirksamkeitsverlustes bei längerfristiger Anwendung kann die kombinierte Anwendung mit Glukokortikoiden die verminderte Ansprechbarkeit der ß2-Rezeptoren wieder erhöhen.
5.2 Pharmakokinetische Eigenschaften
Resorption und Metabolisierung von Salbutamol verlaufen in Lunge und Gastrointestinaltrakt unterschiedlich.
Nach der Inhalation gelangen etwa 10-20 % des Wirkstoffes in die tieferen Bronchialwege, während sich der Rest im Mund und oberen Abschnitt des Atemtraktes absetzt und sukzessive verschluckt wird. In verschiedenen Untersuchungen wurden nach inhalativer Anwendung von Salbutamol ein im Vergleich zur peroralen Applikation ähnlicher, jedoch zeitlich verzögerter Plasmaspiegelverlauf sowie ein ähnliches Konzentrations-Verhältnis von Salbutamol zu seinen Metaboliten gefunden. Der maximale Plasmaspiegel wird demzufolge nach 3-5 Stunden erreicht, und das Verhältnis von freiem Wirkstoff zu Metaboliten beträgt etwa 1:4, womit es als sehr wahrscheinlich anzusehen ist, dass die gemessenen Plasmakonzentrationen dem nach Verschlucken resorbierten Wirkstoffanteil entsprechen. Nach Inhalation von Salbutamol mit Hilfe eines Verneblers in drei Dosisstufen von 1,5 mg, 3 mg und 7,5 mg wurden mittlere maximale Plasmaspiegel von jeweils 0,2 ng/ml, 1,1 ng/ml und 2,5 ng/ml gemessen. Der Wirkungseintritt sowie der maximale therapeutische Effekt erscheinen nach inhalativer Anwendung im Vergleich zur peroralen Gabe erheblich rascher (Wirkungseintritt 515 Minuten nach der Inhalation), dabei zeigt der Plasmaspiegel keine Korrelation mit der pharmakodynamischen Zeit-Wirkungs-Kurve.
Salbutamol wird nach oraler Verabreichung gut (zu ca. 85 %) resorbiert, zwischen 58 und 78 % der Substanz werden innerhalb von 24 Stunden und 65-84 % innerhalb von 72 Stunden mit dem Urin ausgeschieden. Die Substanz wird zu einem erheblichen Teil präsystemisch in der Darmwand sowie der Leber metabolisiert. Im Gegensatz z. B. zu Isoprenalin ist Salbutamol kein Substrat für die Catechol-O-Methyltransferase und Monoamin-Oxidase. Die Metabolisierung erfolgt hingegen im Wesentlichen über eine Sulfat-Konjugation, als Hauptmetabolit wurde ein 4'-O-Sulfatester identifiziert, der wahrscheinlich in der Darmmukosa gebildet wird und pharmakologisch inaktiv ist.
Nach Verabreichung von Salbutamol-Tabletten bei Erwachsenen konnte Salbutamol bereits nach 30 Minuten im Serum nachgewiesen werden, die maximale Plasmakonzentration wurde nach 2-3 Stunden festgestellt. Dabei betrug die Ratio von freiem Salbutamol zu Metabolit 1:5. Es wurde über maximale Plasmakonzentrationen nach einer oralen Einzeldosis von 4 mg Salbutamol von 10-16,9 ng/ml berichtet, die Plasmahalbwertszeit wurde zwischen 2,7 und 5 Stunden bestimmt.
Die Proteinbindung beträgt etwa 10 %, das spezifische scheinbare Verteilungsvolumen 3,4 ± 0,6 l/kg. In einer späteren Studie wurde ein mittleres scheinbares Verteilungsvolumen von 156 l ermittelt. Dieses hohe Verteilungsvolumen ist durch eine extensive Verteilung in die Gewebe zu erklären, die durch tierexperimentelle Untersuchungen erhärtet wurde.
Die totale Plasmaclearance nach i.v.-Infusion wurde mit 6,6-7,7 ml/min/kg bestimmt. Die Ausscheidung erfolgt zum größten Teil über die Nieren, wobei das Verhältnis von freiem Salbutamol zu Metaboliten von der Art der Anwendung abhängig ist. Nach oraler Gabe finden sich dabei vorwiegend die metabolisierte (55 % als Sulfatester), nach i.v.-Gabe die nicht-metabolisierte Form. Nach einer Pulverinhalation im empfohlenen Dosisbereich folgt das Exkretionsmuster dem nach oraler Gabe, während nach Inhalation höherer Dosen die Ausscheidung eines relativ höheren Anteils der unveränderten Substanz eine größere pulmonale Resorption widerspiegelt.
Die Plazentagängigkeit von Salbutamol wurde in vitro ebenso wie in vivo nachgewiesen.
5.3 Präklinische Daten zur Sicherheit
Untersuchungen zur Mutagenität ergaben keine Hinweise auf ein gentoxisches Potential von Salbutamol. Unter Langzeitgabe von sehr hohen Dosen von Salbutamol an Ratten kommt es, wie auch bei anderen Beta-Sympathomimetika, zur Ausbildung von gutartigen Leiomyomen des Mesovariums. Nach vorherrschender Meinung ist eine Übertragbarkeit auf den Menschen jedoch nicht gegeben.
Reproduktionstoxikologische Studien an drei Tierspezies (Ratte, Maus, Kaninchen) haben keine Hinweise auf ein teratogenes Potential von Salbutamol ergeben. Embryo- bzw. fetotoxische Effekte (verringertes Geburtsgewicht, gesteigerte Mortalitätsrate) wurden bei der Ratte nach oraler Gabe von 50 mg/kg/Tag beobachtet. Fertilitätsstörungen bei männlichen und weiblichen Ratten traten bis zu einer Dosis von 50 mg/kg/Tag nicht auf.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Lactose-Monohydrat (enthält geringe Mengen Milchprotein).
6.2 Inkompatibilitäten
Nicht zutreffend
6.3 Dauer der Haltbarkeit
3 Jahre
Hinweis auf Haltbarkeit nach Anbruch
Nach dem Öffnen der Folienverpackung ist der Salbutamol Orion Easyhaler 6 Monate verwendbar.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Salbutamol Orion Easyhaler ist vor Licht und Feuchtigkeit geschützt aufzubewahren. Nach Anwendung muss die Schutzbox sofort wieder geschlossen werden.
6.5 Art und Inhalt des Behältnisses
Der Multidosis-Pulverinhalator besteht aus sieben Plastikteilen und einer rostfreien Stahlfeder. Die Plastikmaterialien des Pulverinhalators sind: Polyester, LDPE, Polycarbonat, Acetal, StyrolButadien-Copolymer, Polypropylen. Der Inhalator ist in einer Laminatfolie versiegelt und, gegebenenfalls zusammen mit der Schutzbox, in einer Faltschachtel aus Karton verpackt.
Packungsgrößen
Salbutamol Orion Easyhaler 0,1 mg/Dosis
1 Inhalator zu 2,4 g Pulver zur Inhalation (entsprechend mind. 200 Einzeldosen)
1 Inhalator zu 2,4 g Pulver zur Inhalation (entsprechend mind. 200 Einzeldosen) + Schutzbox
2 Inhalatoren zu je 2,4 g Pulver zur Inhalation (entsprechend 2-mal mind. 200 Einzeldosen)
3 Inhalatoren zu je 2,4 g Pulver zur Inhalation (entsprechend 3-mal mind. 200 Einzeldosen)
Salbutamol Orion Easyhaler 0,2 mg/Dosis
1 Inhalator zu 2,3 g Pulver zur Inhalation (entsprechend mind. 200 Einzeldosen)
1 Inhalator zu 2,3 g Pulver zur Inhalation (entsprechend mind. 200 Einzeldosen) + Schutzbox
2 Inhalatoren zu je 2,3 g Pulver zur Inhalation (entsprechend 2-mal mind. 200 Einzeldosen)
3 Inhalatoren zu je 2,3 g Pulver zur Inhalation (entsprechend 3-mal mind. 200 Einzeldosen)
Die Schutzbox ist auch einzeln erhältlich.
Die Schutzbox kann unter der Hotline 0800-6746674 angefordert werden.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen
7. INHABER DER ZULASSUNGEN
Orion Corporation Orionintie 1 FI-02200 Espoo Finnland
8. ZULASSUNGSNUMMERN
Salbutamol Orion Easyhaler 0,1 mg/Dosis 37374.00.00
Salbutamol Orion Easyhaler 0,2 mg/Dosis 37374.01.00
9. DATUM DER ERTEILUNG DER ZULASSUNGEN / VERLÄNGERUNG DER
ZULASSUNGEN
04.09.1996 / 06.09.2004
10. STAND DER INFORMATION
Januar 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig