Salbutamol Sandoz 100 Mikrogramm Dosieraerosol Druckgasinhalation, Suspension
1.
1.
2.
3.
4. 4.1
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels)
Bezeichnung des Arzneimittels
Salbutamol Sandoz 100 Mikrogramm Dosieraerosol Druckgasinhalation, Suspension
Qualitative und quantitative Zusammensetzung
Ein Sprühstoß enthält 100 Mikrogramm Salbutamol (als Sulfat).
Die durch das Mundstück abgegebene Dosis beträgt 90 Mikrogramm Salbutamol (als Sulfat).
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
Darreichungsform
Druckgasinhalation, Suspension Weiße Suspension
Klinische Angaben
Anwendungsgebiete
Symptomatische Behandlung einer reversiblen Bronchokonstriktion infolge von Bronchialasthma und chronisch obstruktiver Lungenerkrankung (COPD), einschließlich chronischer Bronchitis und Lungenemphysem.
Prophylaxe des belastungs- und allergeninduzierten Asthmas
Salbutamol Sandoz ist vor allem zur Linderung von Asthmasymptomen geeignet, vorausgesetzt, es verzögert nicht die Einleitung und regelmäßige Anwendung einer Inhalationstherapie mit Kortikosteroiden.
Salbutamol Sandoz ist angezeigt bei Erwachsenen, Jugendlichen und Kindern von 4-11 Jahren.
Salbutamol Sandoz ist nur zur Inhalation bestimmt.
Dosierung
Die Dosierung sollte individuell erfolgen.
Erwachsene und Jugendliche ab 12 Jahre
Zur Linderung von Anfällen: je nach Bedarf 1-2 Sprühstöße
Maximale Dosierung: 8 Sprühstöße pro Tag
Zur Vorbeugung allergen- oder belastungsinduzierter Symptome sollten 10-15 Minuten vor dem auslösenden Ereignis 2 Sprühstöße angewendet werden.
Kinder und Jugendliche
Die Wirkung von Salbutamol Sandoz ist für Kinder unter 4 Jahren noch nicht nachgewiesen worden. Verfügbare Daten sind in Abschnitt 5.1 beschrieben. Dosierungsempfehlungen können nicht gegeben werden.
Kinder unter 12 Jahren
Zur Linderung von Anfällen: bei Bedarf 1 Sprühstoß Die Dosis kann bei Bedarf auf 2 Sprühstöße erhöht werden.
Maximale Dosierung: Die Bedarfsanwendung von Salbutamol Sandoz sollte 2 Sprühstöße 4-mal täglich nicht überschreiten. Die Notwendigkeit von häufigem, zusätzlichem Gebrauch oder ein plötzlicher Anstieg der Dosierung deutet auf eine schlechte Asthmakontrolle bzw. auf ein sich verschlechterndes Asthma hin (siehe Abschnitt 4.4).
Zur Vorbeugung allergen- oder belastungsinduzierter Symptome sollten 10-15 Minuten vor dem auslösenden Ereignis 1 oder, falls erforderlich, 2 Sprühstöße angewendet werden. Die maximale Dosis beträgt bis zu 2 Sprühstöße 4-mal täglich.
Art der Anwendung
Handhabung
Bei Druckgasinhalatoren wird sehr häufig eine falsche Inhalationstechnik verwendet. Deshalb ist es wichtig, die Patienten in die richtige Inhalationstechnik einzuweisen und diese bei den Arztbesuchen zu überprüfen.
Salbutamol Sandoz kann von Kindern und Patienten, die es schwierig finden, gleichzeitig den Sprühstoß zu aktivieren und einzuatmen, mit einem Vortex®- oder AeroChamber® Plus-Spacer verwendet werden.
Wenden Sie dieses Arzneimittel, bei Kindern unter 1 Jahr, immer mit einem dieser Spacer an.
Für Hinweise zur Anwendung des Vortex®- oder AeroChamber® Plus-Spacers beachten Sie bitte die entsprechende Gebrauchsanleitung des betreffenden Spacers.
Vorbereitung/erneute Vorbereitung des Gerätes
Bevor Salbutamol Sandoz zum ersten Mal angewendet wird oder nachdem es für 7 Tage oder länger nicht mehr angewendet wurde, ist es wichtig, die Funktion des Gerätes zu prüfen. Dazu werden die Schutzkappe entfernt, der Inhalator geschüttelt und 2 Sprühstöße in die Luft abgegeben.
Gebrauchsanleitung
Die Inhalation sollte nach Möglichkeit im Sitzen oder Stehen erfolgen.
1. Schutzkappe entfernen. Das Innere und Äußere sorgfältig prüfen um sicherzugehen, dass das Mundstück sauber ist.
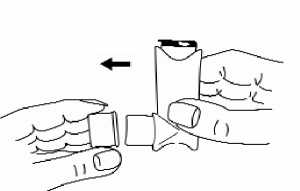
t
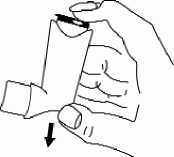
3. Den Inhalator senkrecht mit dem Boden des Behältnisses nach oben halten. Dabei befindet sich der Daumen unterhalb des Mundstücks. Jetzt muss der Patient so lange wie möglich ausatmen, ohne dabei in das Mundstück zu atmen.
4. Das Mundstück zwischen den Zähnen in den Mund nehmen und fest mit den Lippen umschließen, ohne darauf zu beißen.
5. Direkt nach Beginn der Einatmung durch den Mund, das Behältnis mit dem Zeigefinger nach unten drücken um einen Sprühstoß freizugeben und gleichzeitig weiter gleichmäßig und tief einatmen.
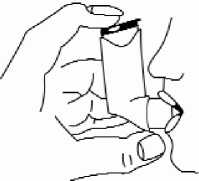
6. Den Atem anhalten, den Inhalator aus dem Mund nehmen und den Zeigefinger von dem Inhalator lösen. Den Atem noch für einige Sekunden bzw. so lange wie möglich anhalten.
7. Falls ein weiterer Sprühstoß erforderlich ist, den Inhalator weiter senkrecht halten und etwa eine halbe Minute warten bis die Schritte 2. bis 6. wiederholt werden.
8. Nach der Anwendung das Mundstück immer mit der Schutzkappe verschließen um Staub und Fussel fernzuhalten. Die Schutzkappe wieder fest aufsetzen bis sie in der richtigen Stellung einrastet.
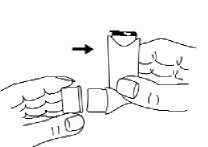
Für Anweisungen zur Reinigung des Inhalators siehe Abschnitt 6.6.
Überprüfung des Inhalatorinhalts
Den Inhalator schütteln, um festzustellen, ob noch Arzneimittel darin enthalten ist. Salbutamol Sandoz nicht anwenden, wenn beim Schütteln des Inhalators keine Flüssigkeit in dem Inhalator wahrgenommen wird.
Anwendung bei kalter Temperatur
Falls der Inhalator unter 0 °C aufbewahrt wurde, muss er in den Händen des Patienten für 2 Minuten gewärmt und dann geschüttelt und vor der Anwendung 2 Sprühstöße in die Luft abgegeben werden.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die Behandlung des Asthmas besteht normalerweise aus einem schrittweise angepassten Programm und das Ansprechen des Patienten auf die Therapie muss klinisch und mit Lungenfunktionstests überwacht werden. Eine ständig steigende Anwendung des Beta-2-Agonisten weist auf eine Verschlechterung des Asthmas und auf die Notwendigkeit des Überdenkens der Behandlung hin.
Bronchodilatatoren sollten bei Patienten mit persistierendem Asthma nicht als einzige oder hauptsächliche Therapie eingesetzt werden.
In folgenden Fällen sollte Salbutamol Sandoz nur mit Vorsicht und bei strenger Indikationsstellung angewendet werden:
• schwere Herzerkrankungen, insbesondere frischer Myokardinfarkt
• koronare Herzkrankheit, hypertrophe obstruktive Kardiomyopathie und Tachyarrhythmie
• schwere und unbehandelte Hypertonie
• Aneurysma
• schwer kontrollierbarer Diabetes mellitus
• Phäochromozytom
• unkontrollierte Hyperthyreose
• unbehandelte Hypokaliämie
Bei der Anwendung von Sympathomimetika, einschließlich Salbutamol Sandoz, können kardiovaskuläre Effekte auftreten.
Aus Daten nach der Markteinführung und aus der veröffentlichten Literatur ergeben sich in Zusammenhang mit Beta-Agonisten gewisse Hinweise auf das seltene Auftreten einer Myokardischämie. Patienten mit zugrunde liegender schwerer Herzerkrankung (z.B. ischämische Herzkrankheit, Arrhythmie oder schwere Herzinsuffizienz), die Salbutamol Sandoz erhalten, sollten darauf hingewiesen werden, ärztliche Hilfe in Anspruch zu nehmen, wenn bei ihnen Brustschmerz oder andere Symptome einer Verschlechterung ihrer Herzkrankheit auftreten.
Bei der Beurteilung von Symptomen wie Atemnot und Brustschmerzen ist besondere Sorgfalt erforderlich, da diese entweder respiratorischer oder kardialer Herkunft sein können.
Eine Hypokaliämie kann bei gleichzeitiger Therapie mit Xanthinderivaten,
Steroiden oder Diuretika oder bei gleichzeitig bestehender Hypoxie verstärkt werden. Daher sollten bei Risikopatienten und insbesondere bei der
Behandlung eines akuten schweren Asthmas mit hohen Dosen von Salbutamol Sandoz die Serumkaliumspiegel überwacht werden.
Wird bei Diabetikern eine Behandlung mit Salbutamol Sandoz eingeleitet, werden zusätzliche Blutzuckerkontrollen empfohlen, da Beta-2-Agonisten das Risiko einer Hyperglykämie erhöhen.
Nicht-selektive Betarezeptorenblocker können die Wirkung von Salbutamol vollständig hemmen. Bei Asthmapatienten ist die Gabe von Betarezeptorenblockern mit dem Risiko einer schweren Bronchokonstriktion verbunden. Deshalb sollten Salbutamol und nicht-selektive Betarezeptorenblocker im Allgemeinen nicht zusammen verordnet werden (siehe Abschnitt 4.5).
Eine plötzliche und progressive Verschlechterung der Asthmakontrolle ist potenziell lebensbedrohlich. Die Patienten sollten darauf hingewiesen werden einen Arzt zu Rate zu ziehen, falls die Wirkung von Salbutamol Sandoz nachlässt, da wiederholte Inhalationen nicht die Einleitung einer anderen wichtigen Therapie verzögern dürfen. In diesen Fällen ist eine Behandlung mit erhöhten Kortikosteroid-Dosen zu erwägen.
Wie bei anderen Inhalationstherapien können direkt nach der Gabe von Salbutamol Sandoz paradoxe Bronchospasmen mit verstärkter keuchender Atmung auftreten. Sollte dies der Fall sein, muss das Präparat sofort abgesetzt und durch eine andere Therapie ersetzt werden.
Die Anwendung von Salbutamol Sandoz kann bei Dopingkontrollen zu positiven Ergebnissen führen. Die Anwendung von Salbutamol Sandoz als Dopingmittel kann zu einer Gefährdung der Gesundheit führen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige
Wechselwirkungen
Bei gleichzeitiger Behandlung mit Xanthinderivaten, Steroiden oder Diuretika kann eine Hypokaliämie verstärkt werden (siehe Abschnitt 4.4).
Salbutamol und nicht-selektive Betarezeptorenblocker sollten im Allgemeinen nicht zusammen verordnet werden. Bei Asthmapatienten ist die Gabe von Betarezeptorenblockern mit dem Risiko einer schweren Bronchokonstriktion verbunden.
Werden Patienten, die Salbutamol erhalten halogenierte Anästhetika, wie Halothan, Methoxyfluran oder Enfluran verabreicht muss mit einem erhöhten Risiko für schwere Herzrhythmusstörungen und Hypotonie gerechnet werden. Ist eine Narkose mit halogenierten Anästhetika vorgesehen, ist darauf zu achten, dass Salbutamol für mindestens 6 Stunden vor Einleitung der Anästhesie nicht mehr angewendet wird.
Monoaminooxidasehemmer und trizyklische Antidepressiva können das Risiko kardiovaskulärer Nebenwirkungen erhöhen.
Eine durch Salbutamol ausgelöste Hypokaliämie kann die Anfälligkeit für digoxininduzierte Arrhythmien erhöhen.
Schwangerschaft
Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt. Die Sicherheit bei Schwangeren ist nicht bekannt. Salbutamol sollte während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich.
Stillzeit
Da Salbutamol wahrscheinlich in die Muttermilch übergeht, muss seine Anwendung bei stillenden Müttern sorgfältig abgewogen werden. Ein Risiko für den Säugling kann nicht ausgeschlossen werden. Eine Entscheidung über Fortführung/Abbruch des Stillens oder Fortführung/Abbruch der Therapie mit Salbutamol Sandoz sollte getroffen werden, unter Berücksichtigung des Nutzens des Stillens für das Kind und des Nutzens der Salbutamol-Therapie für die Frau.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum
Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
4.8 Nebenwirkungen
Die Nebenwirkungen sind nach Systemorganklassen und der Häufigkeit des Auftretens eingeteilt. Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt:
Sehr häufig (>1/10)
Häufig (>1/100, <1/10)
Gelegentlich (>1/1 000, <1/100)
Selten (>1/10 000, <1/1 000)
Sehr selten (<1/10 000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Die sehr häufigen, häufigen und gelegentlichen Nebenwirkungen stammen aus klinischen Studien und die seltenen, sehr seltenen und nicht bekannten Nebenwirkungen von spontanen Berichten nach der Markteinführung.
Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
|
Organsystem |
Nebenwirkungen |
Häufigkeit |
|
Erkrankungen des Immunsystems |
Überempfindlichkeitsreaktionen, einschließlich Angioödem, Kollaps, Bronchospasmen, Hypotonie, Urtikaria |
sehr selten |
|
Stoffwechsel- und Ernährungsstörungen |
Hypokaliämie |
selten |
|
Erkrankungen des Nervensystems |
Tremor, Kopfschmerzen Hyperaktivität, Schlafstörungen, Überreizbarkeit, Halluzinationen |
häufig sehr selten |
|
Herzerkrankungen |
Tachykardie |
häufig |
|
Palpitationen |
gelegentlich | |
|
Herzrhythmusstörungen (z.B. Vorhofflimmern, supraventrikuläre Tachykardie und Extrasystolen) |
sehr selten | |
|
myokardiale Ischämie* (siehe Abschnitt 4.4) |
nicht bekannt | |
|
Gefäßerkrankungen |
periphere Vasodilatation |
selten |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
paradoxe Bronchospasmen |
sehr selten |
|
Erkrankungen des Gastrointestinaltrakts |
Reizungen in Mund und Rachen |
gelegentlich |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Muskelkrämpfe |
häufig |
*spontan berichtet nach Markteinführung, daher wird die Häufigkeit als nicht bekannt angegeben/eingestuft.
Die für Beta-2-Agonisten typischen Nebenwirkungen wie Muskeltremor und Palpitationen können vor allem zu Beginn der Behandlung auftreten und sind häufig dosisabhängig.
Wie bei anderen Inhalationstherapien können nach der Anwendung von Salbutamol Sandoz paradoxe Bronchospasmen mit einer plötzlichen Verstärkung der keuchenden Atmung auftreten. Diese sollten umgehend mit einer anderen Darreichungsform oder einem anderen schnell wirkenden inhalativen Bronchodilatator behandelt werden. Salbutamol Sandoz muss sofort abgesetzt, der Patient beurteilt und bei Bedarf eine alternative Behandlung eingeleitet werden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Symptome einer Überdosierung
Bei einer Überdosierung können die bereits genannten Nebenwirkungen sehr rasch und möglicherweise in verstärktem Ausmaß in Erscheinung treten.
Typische Symptome sind: Tachykardie, Palpitationen, Herzrhythmusstörungen, Agitation, Schlafstörungen, Brustschmerzen und starker Tremor insbesondere an den Händen, aber auch am ganzen Körper.
Vor allem nach oraler Intoxikation können gastrointestinale Beschwerden einschließlich Übelkeit auftreten.
Nach exzessiven Salbutamol-Dosen wurden gelegentlich psychotische Reaktionen beobachtet.
Im Zusammenhang mit einer Überdosierung von Salbutamol kann es zu Verschiebungen des Kaliums in den Intrazellularraum mit der Folge einer Hypokaliämie und einer Hyperglykämie kommen.
Therapiemaßnahmen bei Überdosierung
Die Behandlung von Überdosierungen mit Beta-Sympathomimetika ist hauptsächlich symptomatisch. Die folgenden Maßnahmen sind zu empfehlen:
• Falls versehentlich große Mengen des Arzneimittels geschluckt wurden, ist eine Magenspülung zu erwägen. Aktivkohle und Laxanzien können die unerwünschte Resorption günstig beeinflussen.
• Kardiale Symptome können mit einem kardioselektiven Betarezeptorenblocker behandelt werden. Dabei ist allerdings das erhöhte Risiko, bei Patienten mit Bronchialasthma eine Bronchospastik auszulösen, zu beachten.
• Zur kardialen Überwachung ist ein EKG-Monitoring angezeigt.
• Bei einer ausgeprägten Hypotonie ist eine Volumensubstitution (z.B. Plasmaexpander) zu empfehlen.
Mit der Entwicklung einer Hypokaliämie muss gerechnet werden. Deshalb sind entsprechende Kontrollen des Elektrolythaushaltes und bei Bedarf entsprechende Substitutionen zu empfehlen. Dabei ist auch eine mögliche vorausgegangene Behandlung mit anderen Arzneimitteln zu beachten, die eine Hypokaliämie, Hyperlipidämie oder Ketonämie induzieren können.
5.
5.1
Pharmakologische Eigenschaften
Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: selektive Beta-2-Adrenorezeptoragonisten. ATC-Code: R03AC02
Salbutamol ist ein adrenerger Betarezeptoragonist mit einer selektiven Wirkung auf die Beta-2-Rezeptoren der Bronchien, die eine Bronchodilatation hervorruft. Die bronchodilatierende Wirkung tritt innerhalb weniger Minuten nach der Inhalation auf und erreicht ihr Maximum nach 30-60 Minuten. Sie hält im Allgemeinen mindestens 4 Stunden an. Bei der Inhalation steht die bronchodilatierende Wirkung nicht in Beziehung zur Plasmakonzentration.
Für adrenerge Beta-2-Rezeptoragonisten konnte außerdem eine Steigerung der bei der obstruktiven Lungenerkrankung verminderten mukoziliären Clearance nachgewiesen werden, wodurch das Abhusten des zähen Sekrets erleichtert wird.
Der Wirkstoff in Salbutamol Sandoz ist mikronisiertes Salbutamolsulfat, das in einem flüssigen, nicht auf Freon basierenden Treibmittel (Norfluran) suspendiert ist.
Besondere Patientengruppen
Kinder unter 4 Jahren
Pädiatrische klinische Studien die bei Patienten unter 4 Jahren mit Bronchospasmus und reversiblen obstruktiven Atemwegserkrankungen durchgeführt wurden, ergaben, dass Salbutamol Druckgasinhalation, Suspension gut verträglich ist und dass ein vergleichbares Sicherheitsprofil zu dem bei Kindern ab 4 Jahren, Jugendlichen und Erwachsenen besteht.
5.2 Pharmakokinetische Eigenschaften
Intravenös verabreichtes Salbutamol hat eine Halbwertszeit von 4 bis 6 Stunden und wird teilweise über die Niere und zum Teil nach Metabolisierung zu dem inaktiven 4'-O-Sulfat (phenolisches Sulfat) primär mit dem Urin ausgeschieden. Die Fäzes sind nur ein unbedeutender Ausscheidungsweg.
Nach inhalativer Anwendung gelangen zwischen 10 und 20 % in die unteren Atemwege. Der Rest wird in dem Freisetzungssystem zurückgehalten oder setzt sich im Mund- und Rachenraum ab, von wo er verschluckt wird. Der in die Atemwege gelangte Anteil wird von Lungengewebe und Kreislauf aufgenommen, aber nicht in der Lunge metabolisiert. Nach Erreichen des systemischen Kreislaufs wird er dem hepatischen Metabolismus zugängig und wird hauptsächlich mit dem Urin als unverändertes Salbutamol und als phenolisches Sulfat ausgeschieden.
Der geschluckte Anteil einer inhalierten Dosis wird aus dem Gastrointestinaltrakt resorbiert und unterliegt einem erheblichen First-pass-Metabolismus zu phenolischem Sulfat. Sowohl der unveränderte Wirkstoff als auch das Konjugat werden primär mit dem Urin ausgeschieden. Der größte Teil einer intravenös, oral oder per Inhalation verabreichten Dosis von Salbutamol wird innerhalb von 72 Stunden ausgeschieden. Salbutamol ist zu etwa 10 % an Plasmaproteine gebunden.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Sicherheit, Pharmakologie,
Toxizität bei wiederholter Gabe, Reproduktionstoxizität, Gentoxizität, und zum kanzerogenen Potenzial lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen. Die in den präklinischen Studien beobachteten Wirkungen standen mit der beta-adrenergen Aktivität von Salbutamol in Zusammenhang.
Wie für andere potente, selektive Beta-2-Rezeptoragonisten wurde auch für Salbutamol bei Mäusen nach subkutaner Gabe eine teratogene Wirkung nachgewiesen. In einer Reproduktionsstudie hatten 9,3 % der Feten nach Gabe von 2,5 mg/kg, was der 4-fachen oralen Maximaldosis beim Menschen entspricht, Gaumenspalten. Bei Ratten führte die Behandlung mit oralen Dosen von 0,5, 2,32, 10,75 und 50 mg/kg/Tag während der Trächtigkeit nicht zu signifikanten fetalen Fehlbildungen. Die einzige toxische Wirkung war eine Zunahme der neonatalen Mortalität bei der höchsten Dosierung als Folge mangelnder maternaler Versorgung. In Reproduktionsstudien an Kaninchen kam es nach oralen Dosen von 50 mg/kg/Tag (d.h. der 78-fachen oralen Maximaldosis beim Menschen) bei den Feten zu behandlungsbedingten Veränderungen; zu diesen zählten fehlende Augenlider (Ablepharie), sekundäre
Gaumenspalten (Palatoschisis), Veränderungen der Ossifikation der vorderen Schädelknochen (Kranioschisis) und Extremitätenverkrümmung.
Für das nicht Fluorchlorkohlenwasserstoff-haltige Treibmittel HFA 134a wurden bei verschiedensten Tierspezies, die über einen Zeitraum von 2 Jahren täglich Dampfkonzentrationen ausgesetzt waren, die weit über jenen lagen, mit denen Patienten in Kontakt kommen, keine toxischen Wirkungen nachgewiesen.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Norfluran (HFA 134a)
Ethanol
Ölsäure
6.2 Inkompatibilitäten
Nicht zutreffend
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 30 °C lagern.
Den Inhalator flach liegend oder mit dem Mundstück nach unten aufbewahren.
Das Behältnis enthält eine unter Druck stehende Flüssigkeit und darf selbst für eine kurze Zeit nicht Temperaturen von mehr als 50 °C ausgesetzt werden.
Vor Hitze, direkter Sonneneinstrahlung und Frost schützen!
Das Behältnis nicht durchstechen, selbst wenn es leer ist.
6.5 Art und Inhalt des Behältnisses
Aluminiumbehälter mit Dosierventil und Polypropylengehäuse Die Packungen enthalten:
• 200 Sprühstöße (entsprechend 8,5 g Druckgasinhalation, Suspension)
• 2 x 200 Sprühstöße (entsprechend 2 x 8,5 g Druckgasinhalation, Suspension)
• 3 x 200 Sprühstöße (entsprechend 3 x 8,5 g Druckgasinhalation, Suspension)
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige
Hinweise zur Handhabung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den
nationalen Anforderungen zu beseitigen.
Um ein Verstopfen des Inhalators zu vermeiden, ist es wichtig, ihn mindestens 1-
mal pro Woche gemäß den folgenden Anweisungen zu reinigen. Sollte der
Inhalator verstopft sein, sind ebenfalls diese Reinigungsanweisungen zu befolgen.
Um den Inhalator zu reinigen:
1 Das Metallbehältnis aus dem Kunststoffgehäuse des Inhalators nehmen und die Schutzkappe vom Mundstück entfernen.
2 Das Kunststoffgehäuse und die Schutzkappe in warmem Wasser spülen. Falls sich an dem Mundstück Arzneimittel abgelagert hat, darf der Patient nicht versuchen, es mit einem scharfen Gegenstand, wie z. B. einer Nadel, zu entfernen. Dem Wasser kann ein mildes Spülmittel zugegeben werden. Danach müssen die Schutzkappe und das Kunststoffgehäuse vor dem Trocknen gründlich mit klarem Wasser abgespült werden. Das Metallbehältnis darf nicht mit Wasser in Berührung kommen.
3 Das Kunststoffgehäuse und die Schutzkappe an einem warmen Ort an der Luft trocknen lassen. Starke Hitze vermeiden.
4 Nach dem Trocknen das Metallbehältnis wieder einsetzen und die Schutzkappe wieder aufsetzen.
7. Inhaber der Zulassung
Hexal AG Industriestraße 25 83607 Holzkirchen Telefon: (08024) 908-0 Telefax: (08024) 908-1290 E-Mail: medwiss@hexal.com
8. Zulassungsnummer
67797.00.00
9. Datum der Erteilung der Zulassung/Verlängerung der Zulassung
Datum der Erteilung der Zulassung: 03. August 2009 Datum der letzten Verlängerung der 19. November 2015
10. Stand der Information
September 2015
11. Verkaufsabgrenzung
Verschreibungspflichtig