Sanasthmax 250 Mikrogramm Druckgasinhalation, Lösung
S. 1
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Sanasthmax® 250 Mikrogramm Druckgasinhalation, Lösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Ein Aerosolstoß zu 59,2 mg enthält 250 Mikrogramm Beclometason-17,21-dipropionat. Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Druckgasinhalation, Lösung. Klare, farblose Lösung.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur Behandlung von Atemwegserkrankungen, wenn die Anwendung von Glukokortikoiden erforderlich ist, wie z. B. bei
- Asthma bronchiale
- chronisch-obstruktiver Bronchitis
Hinweis
Sanasthmax® 250 Mikrogramm ist nicht zur Behandlung von plötzlich auftretenden Atemnotanfällen (akuter Asthmaanfall oder Status asthmaticus) geeignet.
4.2 Dosierung und Art der Anwendung
Dosierung
Die Dosierung sollte sich an den Erfordernissen des Einzelfalls und dem klinischen Ansprechen des Patienten orientieren. Dabei sollte nach Stabilisierung der Krankheitssymptome die niedrigst mögliche Erhaltungsdosis ermittelt werden. Die Tagesdosis sollte in 2 Gaben (morgens und abends) aufgeteilt werden, in besonderen Fällen (mangelnde Wirksamkeit im Intervall) kann sie auf 3 - 4 Einzelgaben aufgeteilt werden.
In der Regel sollte die Tageshöchstdosis bei Kindern 500 Mikrogramm und bei Jugendlichen und Erwachsenen 2000 Mikrogramm Beclometason-17,21-dipropionat nicht überschreiten.
Die folgenden Dosierungsangaben können als Richtlinie gelten.
Erwachsene und Jugendliche über 12 Jahre
2 x täglich 1 - 2 Aerosolstöße (entspr. 500 - 1000 Mikrogramm Beclometason-17,21-dipropionat)
Kinder unter 12 Jahren
2 x täglich 1 Aerosolstoß (entspr. 500 Mikrogramm Beclometason-17,21-dipropionat)
Es sollte auf die niedrigste Dosis, mit der eine effektive Kontrolle des Asthmas aufrechterhalten werden kann, eingestellt werden.
Für die Anwendung von Sanasthmax® 250 Mikrogramm bei Patienten mit Leber- oder Nierenfunktionsstörungen liegen keine Daten vor.
Sanasthmax® 250 Mikrogramm sollte regelmäßig in den empfohlenen Zeitabständen eingesetzt werden. Bei Stabilisierung der Krankheitssymptome sollte die tägliche Dosis von Sanasthmax® 250 Mikrogramm bis zur niedrigst möglichen Erhaltungsdosis reduziert werden. Grundsätzlich ist Sanasthmax® 250 Mikrogramm ein Arzneimittel zur
Langzeitbehandlung des Asthma bronchiale. Die Patienten sollten angewiesen werden, Sanasthmax® 250 Mikrogramm jeden Tag anzuwenden, auch wenn sie keine Symptome aufweisen.
Hinweis
Sanasthmax® 250 Mikrogramm soll angewendet werden, wenn sich niedriger dosierte Beclometason-17,21-dipropionat-haltige Arzneimittel als nicht ausreichend oder praktikabel erwiesen haben.
Art der Anwendung
Sanasthmax® 250 Mikrogramm ist ausschließlich zur inhalativen Anwendung bestimmt.
Um die korrekte Anwendung des Arzneimittels sicherzustellen, sollte ein Arzt oder eine andere medizinische Fachkraft dem Patienten zeigen, wie der Inhalator benutzt wird. Damit das Arzneimittel die Zielregion in der Lunge erreicht und erfolgreich behandelt werden kann, ist die korrekte Anwendung des Inhalators notwendig. Kinder sollten dieses Arzneimittel nur unter Aufsicht eines Erwachsenen anwenden.
Die Patienten sollten nach der Inhalation den Mund mit Wasser ausspülen oder die Zähne putzen und/oder einen Spacer verwenden (siehe Abschnitt 4.4).
Anleitung zur Anwendung von Sanasthmax® 250 Mikrogramm
Sanasthmax® 250 Mikrogramm wird als Druckbehältnis mit Mundstück oder als Druckbehältnis mit der Inhalierhilfe Jetspacer geliefert.
In Packungen mit der Inhalierhilfe Jetspacer befindet sich das Druckbehältnis bereits anwendungsbereit im Jetspacer. Für jedes Druckbehältnis ist ein neuer Jetspacer zu verwenden.
Bei neuen oder gebrauchten Druckbehältnissen, die 3 oder mehr Tage nicht verwendet wurden, sollte vor dem Gebrauch ein Sprühstoß in die Luft abgegeben werden, um eine einwandfreie Funktion zu gewährleisten.
Die Anwendung sollte möglichst im Sitzen oder Stehen erfolgen. Die Inhalation nicht überhastet vornehmen.
Anwendung mit Mundstück
1. Die Schutzkappe vom Mundstück entfernen.
2. Langsam und so tief wie möglich ausatmen.
3. Das Druckbehältnis, unabhängig von der Körperposition, in der inhaliert wird, mit dem Behälterboden nach oben halten. Das Mundstück vorsichtig zwischen den Zähnen platzieren und mit den Lippen umschließen. Den Kopf leicht zurückneigen.
4. Langsam und tief durch den Mund einatmen und gleichzeitig auf den oberen Teil des Inhalators drücken, um einen Aerosolstoß freizusetzen.
5. Den Atem so lange wie ohne Anstrengung möglich anhalten und den Inhalator aus dem Mund nehmen.
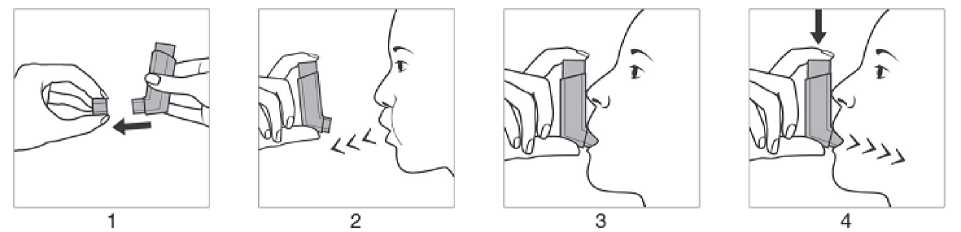
Falls ein weiterer Aerosolstoß inhaliert werden soll, den Inhalator etwa eine halbe Minute in
aufrechter Position halten und anschließend die Schritte 2 bis 5 wiederholen.
Falls unbeabsichtigt ein Teil des Aerosols aus dem oberen Teil des Inhalators oder seitlich
aus dem Mund entweicht, sollte ein weiterer Aerosolstoß inhaliert werden.
Nach Gebrauch die Schutzkappe wieder aufsetzen.
Für Patienten mit schwächerem Händedruck kann es leichter sein, den Inhalator mit beiden
Händen zu halten. Dazu wird der Inhalator mit beiden Zeigefingern von oben und beiden
Daumen von unten fixiert.
Anwendung mit Jetspacer
1. Es ist sicherzustellen, dass die Schutzkappe aufgesetzt ist. Das Druckbehältnis mit dem Jetspacer, unabhängig von der Körperposition, in der inhaliert wird, mit dem Behälterboden nach oben halten und das Druckbehältnis nach unten drücken, um einen Aerosolstoß freizusetzen.
2. Langsam und so tief wie möglich ausatmen.
3. Schutzkappe abnehmen.
4. Das Mundstück des Jetspacers sofort vorsichtig zwischen den Zähnen platzieren und mit den Lippen umschließen. Den Kopf leicht zurückneigen.
5. Langsam und tief durch den Mund einatmen. Den Atem so lange wie ohne Anstrengung möglich anhalten und den Jetspacer aus dem Mund nehmen.
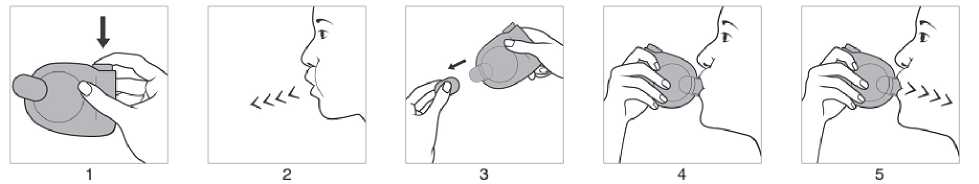
Nach Gebrauch die Schutzkappe wieder aufsetzen. Falls ein weiterer Aerosolstoß inhaliert werden soll, das Druckbehältnis mit Jetspacer etwa eine halbe Minute in aufrechter Position halten und anschließend die Schritte 1 bis 5 wiederholen.
Reinigung des Mundstücks und des Jetspacers
Um eine störungsfreie Funktion von Sanasthmax® 250 Mikrogramm zu gewährleisten, sollte das Mundstück oder der Jetspacer regelmäßig (mindestens 1-mal pro Woche, bei Bedarf auch öfter) gereinigt werden.
Ablagerungen können mit lauwarmem Wasser entfernt werden, nachdem das Druckbehältnis abgezogen wurde.
Anschließend das Mundstück gut abtrocknen bzw. den Jetspacer so aufstellen, dass er gut trocknen kann. Das Druckbehältnis erst wieder einsetzen und die Schutzkappe aufstecken, wenn das Mundstück bzw. der Jetspacer vollständig getrocknet ist.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die Behandlung mit Sanasthmax® 250 Mikrogramm sollte nicht abrupt beendet werden.
Verschlimmert sich die Atemnot nach der Inhalation akut (paradoxer Bronchospasmus), so sollte die Behandlung sofort abgesetzt und der Behandlungsplan überprüft werden (siehe Abschnitt 4.8).
Inhalativ anzuwendende Glukokortikoide können systemische Nebenwirkungen verursachen, insbesondere wenn hohe Dosen über lange Zeiträume gegeben werden. Solche Reaktionen treten deutlich seltener auf als bei oraler Glukokortikoidgabe. Mögliche systemische Nebenwirkungen sind: Cushing-Syndrom, cushingoide Erscheinungen, Nebennierenrindensuppression, verringerte Knochenmineraldichte, Wachstumsverzögerungen bei Kindern und Jugendlichen, Katarakt und Glaukom, sowie auch eine Reihe von Auswirkungen auf die Psyche oder das Verhalten, einschließlich psychomotorische Hyperaktivität, Schlafstörungen, Angstzustände, Depression oder Aggression (vor allem bei Kindern). Deshalb ist es wichtig, dass die niedrigste Dosis, mit der eine effektive Kontrolle des Asthmas aufrechterhalten werden kann, verabreicht wird.
Bei der Behandlung mit hohen Dosen, insbesondere bei Überschreitung der empfohlenen Dosierung, kann eine klinisch relevante Funktionsminderung der Nebennierenrinde mit einer verminderten Produktion bzw. einer bei gesteigertem Bedarf (Stresssituationen) nicht mehr ausreichend steigerbaren Produktion körpereigener Glukokortikoide auftreten. In solchen Fällen sollte in Stresssituationen (z. B. vor Operationen) eine vorübergehende zusätzliche Glukokortikoidgabe zum Ausgleich der verminderten natürlichen Glukokortikoidproduktion erwogen werden.
Hinweise für nicht mit Kortikoiden vorbehandelte Patienten
Bei Patienten, die zuvor keine oder nur gelegentlich eine kurzdauernde Kortikoidbehandlung erhalten haben, sollte die vorschriftsmäßige, regelmäßige Anwendung von Sanasthmax® 250 Mikrogramm nach ca. 1 Woche zu einer Verbesserung der Atmung führen. Starke Verschleimung und entzündliche Veränderungen können allerdings die Bronchien soweit verstopfen, dass Beclometason-17,21-dipropionat lokal nicht voll wirksam werden kann. In diesen Fällen sollte die Einleitung der Therapie mit systemischen Kortikoiden (beginnend mit 40 - 60 mg Prednisonäquivalent pro Tag) ergänzt werden. Die Inhalationen werden auch nach schrittweisem Abbau der systemischen Kortikoidgabe fortgesetzt.
Hinweise für die Umstellung kortikoidabhängiger Patienten auf die Inhalationsbehandlung Patienten, die systemisch mit Kortikoiden behandelt werden, sollten zu einem Zeitpunkt auf Sanasthmax® 250 Mikrogramm umgestellt werden, an dem ihre Beschwerden unter Kontrolle sind. Bei diesen Patienten, deren Nebennierenrindenfunktion gewöhnlich eingeschränkt ist, muss die systemische Kortikoidgabe allmählich abgesetzt und darf nicht plötzlich unterbrochen werden. Zu Beginn der Umstellung sollte Sanasthmax® 250 Mikrogramm für etwa 1 Woche zusätzlich verabreicht werden. Dann wird die systemische KortikoidTagesdosis entsprechend dem jeweiligen Ansprechen im Abstand von 1 - 2 Wochen stufenweise herabgesetzt: um 1 mg Prednisonäquivalent bei einer Tagesdosis von bis zu 10 mg und um 2,5 mg Prednisonäquivalent bei höheren Tagesdosen.
Kommt es innerhalb der ersten Monate nach Umstellung von der systemischen Kortikoidgabe auf die Inhalationsbehandlung zu besonderen Stresssituationen oder Notfällen (z. B. schwere Infektionen, Verletzungen, Operationen), kann eine erneute systemische Gabe von Kortikoiden notwendig werden.
Bei Umstellung von Kortikoidtabletten oder -injektionen auf die Inhalationsbehandlung mit Sanasthmax® 250 Mikrogramm können Allergien auftreten, die durch die bisherige Behandlung unterdrückt waren, wie z. B. allergische Rhinitis, allergische Ekzeme, rheumatoide Beschwerden. Diese Symptome sollten, falls erforderlich, mit Antihistaminika und/oder topischer Therapie, einschließlich topischer Kortikoide behandelt werden.
Exazerbation der Krankheitssymptome durch akute Atemwegsinfektionen Bei Verschlimmerung der Krankheitssymptome durch akute Atemwegsinfektionen ist die Gabe entsprechender Antibiotika zu erwägen. Die Dosis von Sanasthmax® 250 Mikrogramm kann ggf. angepasst werden, u. U. ist die systemische Gabe von Glukokortikoiden indiziert.
Die Behandlung mit Kortikosteroiden kann einige Symptome der Lungentuberkulose und anderer bakterieller Atemwegserkrankungen wie auch fungaler und viraler Atemwegsinfektionen maskieren. Lungentuberkulose kann außerdem durch die (erneute) Gabe von inhalativen Kortikosteroiden reaktiviert werden. Dies sollte beachtet werden, wenn Patienten mit Atemwegsinfektionen behandelt werden, wobei sowohl das Asthma als auch die Atemwegsinfektion angemessen therapiert werden müssen.
Bei der Behandlung von Patienten mit Anomalien der Lunge wie z. B. Bronchiektasen und Pneumokoniose sollte im Zusammenhang mit der Möglichkeit fungaler Infektionen zurückhaltend umgegangen werden.
Um das Risiko einer oropharyngealen Candida-Infektion zu verringern, sollten nach der Inhalation der Mund ausgespült oder die Zähne geputzt und/oder ein Spacer verwendet werden.
Kinder und Jugendliche
Es wird empfohlen, das Wachstum von Kindern, die eine Langzeittherapie mit inhalativ anzuwendenden Glukokortikoiden erhalten, regelmäßig zu kontrollieren. Bei Wachstumsverzögerungen sollte die Therapie überdacht werden mit dem Ziel, die Dosis des inhalativ anzuwendenden Glukokortikoids auf die niedrigste Dosis zu verringern, mit der eine effektive Kontrolle des Asthmas aufrechterhalten werden kann. Außerdem sollte in Betracht gezogen werden, Kinder an einen Lungenspezialisten für Kinder zu überweisen.
Pneumonie bei COPD-Patienten
Eine Zunahme der Inzidenz von Pneumonien, einschließlich Pneumonien, die eine Krankenhauseinweisung erfordern, wurde bei COPD-Patienten beobachtet, die inhalative Kortikosteroide erhalten. Es gibt einige Hinweise darauf, dass ein erhöhtes Risiko für Pneumonien mit einer erhöhten Steroid-Dosierung einhergeht. Dies konnte jedoch nicht eindeutig in allen Studien gezeigt werden.
Es gibt keinen eindeutigen klinischen Nachweis für Unterschiede im Ausmaß des Pneumonierisikos innerhalb der Klasse der inhalativen Kortikosteroide.
Ärzte sollten bei COPD-Patienten auf eine mögliche Entwicklung einer Pneumonie achten, da sich die klinischen Merkmale einer solchen Entzündung mit den Symptomen von COPD Exazerbationen überschneiden.
Risikofaktoren für eine Pneumonie bei COPD-Patienten umfassen derzeitiges Rauchen, höheres Alter, niedrigen Body Mass Index (BMI) und schwere COPD-Ausprägungen.
Der Patient sollte darauf hingewiesen werden, dass Sanasthmax® 250 Mikrogramm geringe Mengen Ethanol (ungefähr 9 mg pro Aerosolstoß) enthält. Bei empfohlenen Dosierungen sind diese Mengen an Ethanol normalerweise vernachlässigbar und stellen kein Risiko für den Patienten dar (siehe Abschnitt 4.5).
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Sanasthmax® 250 Mikrogramm kann die Wirksamkeit von ß2-Sympathomimetika zur Inhalation verstärken.
Sanasthmax® 250 Mikrogramm enthält eine geringe Menge Ethanol. Daraus ergibt sich ein theoretisches Risiko für Interaktionen bei besonders empfindlichen Patienten, die Disulfiram oder Metronidazol nehmen.
Bei gleichzeitiger Anwendung mit systemischen oder nasalen Steroiden addiert sich der supprimierende Effekt auf die Nebennierenrindenfunktion.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Die Notwendigkeit einer Anwendung während der Schwangerschaft ist besonders sorgfältig abzuwägen. Obwohl nach den bisherigen Erfahrungen bei Schwangeren keine Anhaltspunkte dafür vorliegen, dass die im Tierversuch aufgetretenen teratogenen Wirkungen von Beclometason für den Menschen von Bedeutung sind, können andere Formen der Schädigung (z. B. intrauterine Wachstumsstörungen, Atrophie der Nebennierenrinde) und Spätfolgen bei Langzeittherapien nicht sicher ausgeschlossen werden. Insbesondere synthetische Glukokortikoide, die von der Plazenta nur unzureichend inaktiviert werden können, stehen in Verdacht, durch eine In-utero-Programmierung beim Feten zu späteren kardiovaskulären Erkrankungen beizutragen.
Stillzeit
Es liegen keine Daten zum Übergang von Beclometason in die Muttermilch vor. Andere Glukokortikoide gehen in geringen Mengen in die Muttermilch über. Die Belastung des Säuglings wird dabei in der Regel weniger als 1/100 der systemisch bei der stillenden Mutter zur Verfügung stehenden Dosis betragen. Sollten Substanzwirkungen beim Säugling beobachtet werden, ist abzustillen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Sanasthmax® 250 Mikrogramm hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Die Nebenwirkungen sind im Folgenden nach Systemorganklassen und Häufigkeit sortiert. Die Häufigkeiten der Nebenwirkungen sind wie folgt definiert:
Sehr häufig Häufig Gelegentlich Selten Sehr selten Nicht bekannt
(> 1/10)
(> 1/100 bis < 1/10)
(> 1/1.000 bis < 1/100)
(> 1/10.000 bis < 1/1.000)
(< 1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Systemorganklasse |
Nebenwirkung |
Häufigkeit |
|
Infektionen und parasitäre Erkrankungen |
Pneumonie (bei COPD-Patienten) |
Häufig |
|
Orale Candidose (Mund und Rachen) |
Gelegentlich | |
|
Laryngitis, Pharyngitis |
Nicht bekannt | |
|
Erkrankungen des Immunsystems |
Überempfindlichkeitsreaktionen mit den folgenden Erscheinungsformen: | |
|
Ausschlag, Urtikaria, Pruritus, Erythem, Angioödem Ödem der Augen, des Gesichts, der Lippen und des Rachens |
Nicht bekannt | |
|
Erkrankungen des Nervensystems |
Kopfschmerz |
Nicht bekannt |
|
Augenerkrankungen |
Augenödem |
Nicht bekannt |
|
Erkrankungen der Atemwege, des Brustraums und des Mediastinums |
Heiserkeit |
Häufig |
|
Rachenreizung |
Gelegentlich | |
|
paradoxer Bronchospasmus, Husten |
Sehr selten | |
|
Dyspnoe, Pharynxödem, Dysphonie, Giemen |
Nicht bekannt | |
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit |
Nicht bekannt |
|
Systemorganklasse |
Nebenwirkung |
Häufigkeit |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Osteoporose |
Selten |
Systemische Effekte können vor allem dann auftreten, wenn inhalativ anzuwendende Glukokortikoide (z. B. Beclometason-17,21-dipropionat) in hohen Dosen über lange Zeit angewendet werden. Dazu können zählen: Nebennierenrindensuppression (nicht bekannt), verringerte Knochenmineraldichte (nicht bekannt), Wachstumsverzögerungen bei Kindern und Jugendlichen (nicht bekannt), Glaukom (selten) und Katarakt (selten). Auch Auswirkungen auf die Psyche, einschließlich psychomotorischer Hyperaktivität, Schlafstörungen, Angstzuständen, Depression, Aggression und Verhaltensänderungen (besonders bei Kindern) sind berichtet worden (die Häufigkeiten dieser Nebenwirkungen sind nicht bekannt). Siehe Abschnitt 4.4.
Bei Gabe von Sanasthmax® 250 Mikrogramm kann die Hypothalamus-Hypophysen-vorderlappen-Nebennierenrinden-Achse supprimiert werden und es können weitere glukokortikoidübliche Wirkungen, wie z. B. eine erhöhte Infektanfälligkeit, auftreten. Die Stressanpassung kann behindert sein. Bei Erwachsenen konnte bei Dosen von 400 - 800 Mikrogramm Beclometason-17,21-dipropionat pro Tag bei der Mehrzahl der Patienten keine Suppression der Nebennierenrinde gefunden werden. Bei Dosen von 1600 - 2000 Mikrogramm pro Tag ist ein relevanter Effekt nicht auszuschließen.
Beschreibung ausgewählter Nebenwirkungen
Wie bei anderen Inhalationstherapien kann ein paradoxer Bronchospasmus auftreten, der sich unmittelbar nach der Inhalation durch verstärkte pfeifende Atemgeräusche, Kurzatmigkeit und Husten äußert. Dies sollte sofort mit einem schnellwirksamen inhalativen Bronchodilatator behandelt werden und Sanasthmax® 250 Mikrogramm sollte umgehend abgesetzt werden.
Die Inzidenz von Candidiasis in Mund und Rachen steigt mit Dosierungen von mehr als 400 Mikrogramm Beclometason-17,21-dipropionat pro Tag. Bei Patienten mit hohen Konzentrationen von Antikörpern gegen Candida im Blut, die auf eine frühere Infektion hinweisen, ist die Wahrscheinlichkeit am höchsten, eine solche Komplikation zu entwickeln. Es kann nützlich sein, wenn Patienten ihren Mund nach der Inhalation gründlich mit Wasser ausspülen (siehe Abschnitt 4.4). Die symptomatische Candidiasis im Mund kann mit einer topischen antifungalen Therapie behandelt werden, während die Behandlung mit Sanasthmax® 250 Mikrogramm weitergeführt wird.
Die Heiserkeit ist reversibel und verschwindet nach Beendigung der Behandlung und/oder Schonen der Stimme. Betroffene Patienten müssen dazu angehalten werden, ihren Mund sofort nach der Inhalation mit Wasser auszuspülen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3
D-53175 Bonn
Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome einer Überdosierung
Bei kurzfristiger Überdosierung kann eine Suppression der Hypothalamus-Hypophysenvorderlappen-Nebennierenrinden-Funktion eintreten. Bei längerfristiger Überdosierung kann es zusätzlich zur Nebennierenrindenatrophie kommen.
Es können glukokortikoidübliche Wirkungen, wie eine erhöhte Anfälligkeit für Infektionen, auftreten. Die Stressanpassung kann beeinträchtigt sein.
Therapiemaßnahmen bei Überdosierung
Bei kurzfristiger Überdosierung ist grundsätzlich keine spezielle Notfallbehandlung erforderlich. Bei fortgesetzter Inhalationsbehandlung in vorgeschriebener Dosierung sollte sich die Funktion der Hypothalamus-Hypophysenvorderlappen-Nebennierenrinden-Achse nach ca. 1 - 2 Tagen normalisieren.
In Stresssituationen kann eine Kortikoidschutzbehandlung (z. B. hochdosierte Gabe von Hydrokortison) erforderlich sein.
Bei Nebennierenrindenatrophie gilt der Patient als steroidabhängig und ist auf die entsprechende Erhaltungsdosis eines systemischen Steroids einzustellen, bis sich der Zustand stabilisiert hat.
Kommt es bei sehr hohen Dosierungen von Beclometason-17,21-dipropionat zu systemischen Kortikoidwirkungen (wie Hyperkortizismus und
Nebennierenrindensuppression), muss die Dosis verringert werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Andere inhalative Mittel bei obstruktiven Atemwegserkrankungen, Glukokortikoide ATC-Code: R03B A01
Pharmakodynamische Wirkungen
Beclometason-17,21-dipropionat ist ein synthetisches Glukokortikoid. Nach oraler Inhalation hat es einen lokalen entzündungshemmenden Effekt auf die Bronchialschleimhaut.
Klinische Wirksamkeit und Sicherheit
Klinisch macht sich dieser Effekt zum Beispiel durch eine Reduktion krankheitsbezogener Symptome, wie Atemnot, bemerkbar. Die Hyperreagibilität des Bronchialsystems auf exogene Reize wird reduziert.
5.2 Pharmakokinetische Eigenschaften
Resorption
Nach Inhalation wird Beclometason-17,21-dipropionat zu Beclometason-17-monopropionat hydrolysiert, welches zu Beclometason-21-monopropionat umgeestert und nachfolgend zu Beclometason hydrolysiert wird. Beclometason-17,21-dipropionat stellt mithin ein pharmakologisch aktives Prodrug dar, aus dem in der Lunge selbst in kurzer Zeit das noch aktivere Beclometason-17-monopropionat gebildet wird.
Die systemische Absorption von Beclometason-17-monopropionat erfolgt über die Lunge (36 %) und oral (26 %).
Die absolute Bioverfügbarkeit nach Inhalation beträgt ca. 2 % (Beclometason-17,21-dipropionat) bzw. 62 % (Beclometason-17-monopropionat).
Beclometason-17,21-dipropionat wird rasch resorbiert und zeigt cmax nach 0,3 Stunden. Beclometason-17-monopropionat hingegen wird langsamer resorbiert und weist cmax nach 1 Stunde auf.
Erhöhungen der inhalierten Dosis führen zu einem annähernd linearen Anstieg der systemischen Exposition. Die Bioverfügbarkeit von Beclometason-17,21-dipropionat ist bei oraler Verabreichung vernachlässigbar, aber die präsystemische Umwandlung in Beclometason-17-monopropionat führt dazu, dass 41 % der Dosis als Beclometason-17-monopropionat resorbiert werden.
Verteilung
Die Verteilung im Gewebe ist für Beclometason-17,21-dipropionat im steady-state mäßig (20 l), aber für Beclometason-17-monopropionat ausgeprägt (424 l).
Die Plasmaproteinbindung beträgt 87 % für Beclometason-17-monopropionat.
Biotransformation
Ca. 90 % des geschluckten Beclometason-17,21-dipropionat werden hauptsächlich als Beclometason-17-monopropionat, Dipropionat und freier Alkohol aus dem Gastrointestinaltrakt resorbiert. In der Leber werden sie mittels First-Pass-Effekt in pharmakologisch inaktive Metaboliten umgewandelt. Damit sind systemische Bioverfügbarkeit und Toxizität begrenzt.
Elimination
Die Elimination von Beclometason-17,21-dipropionat und Beclometason-17-monopropionat ist durch eine hohe Plasma-Clearance (150 und 120 l/h) mit entsprechenden terminalen Eliminationshalbwertszeiten von 0,5 und 2,7 Stunden charakterisiert. Etwa 60 % der Dosis werden; vorwiegend als freie und konjugierte Metaboliten über die Faeces innerhalb von 96 Stunden nach oraler Verabreichung von Beclometason-17,21-dipropionat ausgeschieden. Etwa 12 % der Dosis werden als freie und konjugierte polare Metaboliten im Urin ausgeschieden. Die renale Clearance von Beclometason-17,21-dipropionat und seinen Metaboliten ist vernachlässigbar.
5.3 Präklinische Daten zur Sicherheit
Präklinische Sicherheitsstudien haben keine Auswirkungen außer den bereits bekannten Effekten bei übermäßiger Anwendung von Kortikosteroiden gezeigt, einschließlich Veränderungen im Lymphgewebe, wie Gewichtsabnahme des Thymus, der Milz und der Nebenniere.
Akute T oxizität Siehe Abschnitt 4.9.
Chronische Toxizität
Untersuchungen zur chronischen Toxizität an verschiedenen Tierspezies bei unterschiedlicher Applikationsart zeigten dosisabhängig Symptome der Glukokortikoidüberdosierung.
Mutagenes und tumorerzeugendes Potential
Mutagenitätsuntersuchungen mit Beclometason-17,21-dipropionat in Kombination mit Salbutamol verliefen im Ames-Test und im Mikrokerntest an der Maus negativ. Langzeituntersuchungen an der Ratte bei kombinierter inhalativer und oraler Applikation ergaben keine Hinweise auf ein tumorerzeugendes Potential.
Reproduktionstoxizität
Beclometason-17,21-dipropionat verursachte bei Mäusen und Kaninchen Gaumenspalten und Embryoletalität. Bei Rhesusaffen sind eine erhöhte Abortrate und intrauterine Wachstumsretardierungen beobachtet worden.
In-vitro- und In-vivo-Studien einschließlich Langzeitinhalationsstudien an Nagern haben keine Hinweise auf die mutagene, klastogene und kanzerogene Wirkung des Treibmittels Norfluran (HFA-134 a) ergeben.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Norfluran, Ethanol, Glycerol
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
Behälter steht unter Druck.
Vor Hitze, direkter Sonnenbestrahlung und Frost schützen.
Nicht gegen Flammen oder auf glühende Gegenstände sprühen.
Nicht gewaltsam öffnen oder verbrennen, selbst wenn das Behältnis leer zu sein scheint.
6.5 Art und Inhalt des Behältnisses
Druckbehältnis aus Aluminium mit Kunststoffgehäuse/Auslöser und Schutzkappe.
1 Druckbehältnis mit 200 Aerosolstößen (Druckgasinhalation, Lösung)
2 Druckbehältnisse mit je 200 Aerosolstößen (Druckgasinhalation, Lösung) (Doppelpackung)
3 Druckbehältnisse mit je 200 Aerosolstößen (Druckgasinhalation, Lösung) (Dreierpackung)
1 Druckbehältnis mit 200 Aerosolstößen (Druckgasinhalation, Lösung) mit Inhalierhilfe Jetspacer
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
Chiesi GmbH Gasstr. 6 22761 Hamburg Telefon: 040 89724-0 Telefax: 040 89724-212 E-Mail: info.de@chiesi.com
8. ZULASSUNGSNUMMER
45368.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 22.06.1999
Datum der letzten Verlängerung der Zulassung: 27.07.2004
10. STAND DER INFORMATION
Juli 2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Stand: 07/2016