Sanasthmax Junior 50 Mikrogramm Druckgasinhalation, Lösung
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Sanasthmax® Junior 50 Mikrogramm Druckgasinhalation, Lösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: Beclometason-17,21-dipropionat
Ein Aerosolstoß zu 59,0 mg enthält 50 Mikrogramm Beclometason-17,21-dipropionat. Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Druckgasinhalation, Lösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur Behandlung von Atemwegserkrankungen, wenn die Anwendung von Glukokortikoiden erforderlich ist, wie z. B. bei
- Asthma bronchiale
- chronisch-obstruktiver Bronchitis
Hinweis:
Sanasthmax® Junior ist nicht zur Behandlung von plötzlich auftretenden Atemnotanfällen (akuter Asthmaanfall oder Status asthmaticus) geeignet.
4.2 Dosierung, Art und Dauer der Anwendung
Die Dosierung sollte sich an den Erfordernissen des Einzelfalles und dem klinischen Ansprechen des Patienten orientieren. Dabei sollte nach Stabilisierung der Krankheitssymptome die möglichst niedrigste Erhaltungsdosis ermittelt werden. Die Tagesdosis sollte in 2 Gaben (morgens und abends) aufgeteilt werden, in besonderen Fällen (mangelnde Wirksamkeit im Intervall) kann sie auf 3 - 4 Einzelgaben aufgeteilt werden.
In der Regel sollte die Tageshöchstdosis bei Kindern 500 Mikrogramm und bei Jugendlichen und Erwachsenen 2000 Mikrogramm Beclometason-17,21-dipropionat nicht überschreiten.
Die folgenden Dosierungsangaben können als Richtlinie gelten.
Erwachsene und Jugendliche über 12 Jahre:
2 x täglich 4 - 6 Aerosolstöße (entspr. 400 - 600 Mikrogramm Beclometason-17,21-dipropionat)
Kinder unter 12 Jahren:
2 x täglich 2 - 4 Aerosolstöße (entspr. 200 - 400 Mikrogramm Beclometason-17,21-dipropionat)
Es sollte auf die niedrigste Dosis, mit der eine effektive Kontrolle des Asthmas aufrechterhalten werden kann, eingestellt werden.
Sanasthmax® Junior sollte regelmäßig in den empfohlenen Zeitabständen eingesetzt werden. Bei Stabilisierung der Krankheitssymptome sollte die tägliche Dosis von Sanasthmax® Junior bis zur niedrigst möglichen Erhaltungsdosis reduziert werden. Grundsätzlich ist Sanasthmax® Junior ein Arzneimittel zur Langzeitbehandlung des Asthma bronchiale.
Sanasthmax® Junior sollte vor einer Mahlzeit angewendet werden, wenn dieses nicht möglich ist, sollte nach der Inhalation der Mund ausgespült werden.
Anleitung zur Anwendung von Sanasthmax® Junior:
Sanasthmax® Junior wird als Druckbehältnis mit Mundrohr oder als Druckbehältnis mit Inhalierhilfe Jetspacer geliefert.
In Packungen mit der Inhalierhilfe Jetspacer befindet sich das Druckbehältnis bereits anwendungsbereit im Jetspacer. Für jedes Druckbehältnis ist ein neuer Jetspacer zu verwenden.
Bei neuen oder gebrauchten Druckbehältnissen, die 3 oder mehr Tage nicht verwendet wurden, sollte vor dem Gebrauch ein Sprühstoß in die Luft abgegeben werden, um eine einwandfreie Funktion zu gewährleisten.
Die Anwendung sollte möglichst im Sitzen oder Stehen erfolgen. Die Inhalation nicht überhastet vornehmen.
Anwendung mit Mundrohr:
1. Die Schutzkappe vom Mundrohr entfernen.
2. Langsam und so tief wie möglich ausatmen.
3. Das Druckbehältnis, unabhängig von der Körperposition, in der inhaliert wird, mit dem Behälterboden nach oben halten. Das Mundrohr vorsichtig zwischen den Zähnen platzieren und mit den Lippen umschließen. Den Kopf leicht zurückneigen.
4. Langsam und tief durch den Mund einatmen und gleichzeitig auf den oberen Teil des Inhalators drücken, um einen Aerosolstoß freizusetzen.
5. Den Atem so lange wie ohne Anstrengung möglich anhalten und anschließend den Inhalator aus dem Mund nehmen.
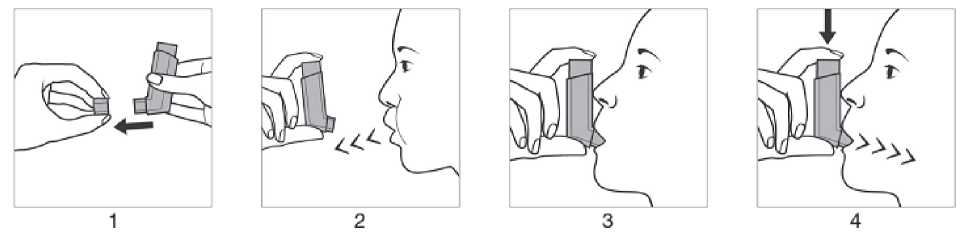
Falls ein weiterer Aerosolstoß inhaliert werden soll, den Inhalator etwa eine halbe Minute in aufrechter Position halten und anschließend die Schritte 2 bis 4 wiederholen.
Falls unbeabsichtigt ein Teil des Gases vom oberen Teil des Inhalators oder seitlich aus dem Mund entweicht, sollte ein weiterer Aerosolstoß inhaliert werden.
Nach Gebrauch die Schutzkappe wieder aufsetzen.
Für Patienten mit schwächerem Händedruck kann es leichter sein, den Inhalator mit beiden Händen zu halten. Dazu wird der Inhalator mit beiden Zeigefingern von oben und beiden Daumen von unten fixiert.
Anwendung mit Jetspacer:
1. Es ist sicherzustellen, dass die Schutzkappe aufgesetzt ist. Das Druckbehältnis mit dem Jetspacer, unabhängig von der Körperposition, in der inhaliert wird, mit dem Behälterboden
nach oben halten und das Druckbehältnis nach unten drücken, um einen Aerosolstoß freizusetzen.
2. Langsam und so tief wie möglich ausatmen.
3. Schutzkappe abnehmen.
4. Das Mundstück des Jetspacers unmittelbar und vorsichtig zwischen den Zähnen platzieren und mit den Lippen umschließen. Den Kopf leicht zurückneigen.
5. Langsam und tief durch den Mund einatmen. Den Atem so lange wie ohne Anstrengung möglich anhalten und anschließend den Jetspacer aus dem Mund nehmen.
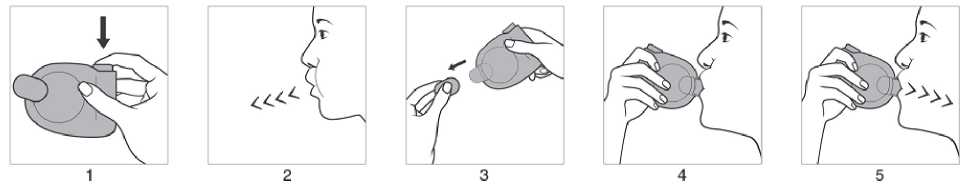
Nach Gebrauch die Schutzkappe wieder aufsetzen. Falls ein weiterer Aerosolstoß inhaliert werden soll, das Druckbehältnis mit Jetspacer etwa eine halbe Minute in aufrechter Position halten und anschließend die Schritte 1 bis 5 wiederholen.
Reinigung des Mundrohres und des Jetspacers:
Um eine störungsfreie Funktion von Sanasthmax® Junior zu gewährleisten, sollte das Mundrohr oder der Jetspacer regelmäßig (mindestens 1-mal pro Woche, bei Bedarf auch öfter) gereinigt werden.
Ablagerungen können mit lauwarmem Wasser entfernt werden, nachdem das Druckbehältnis abgezogen wurde.
Anschließend das Mundrohr gut abtrocknen bzw. den Jetspacer so aufstellen, dass er gut trocknen kann. Das Druckbehältnis erst wieder einsetzen und die Schutzkappe aufstecken, wenn das Mundrohr bzw. der Jetspacer vollständig trocken ist.
Hinweis:
Um eine falsche Anwendung zu vermeiden, ist eine gründliche Einweisung des Patienten in den korrekten Gebrauch vorzunehmen. Kinder sollten dieses Arzneimittel nur unter Aufsicht eines Erwachsenen anwenden.
4.3 Gegenanzeigen
Überempfindlichkeit gegen Beclometason-17,21-dipropionat oder einen der anderen Bestandteile.
Bei Lungentuberkulose soll Sanasthmax® Junior nur angewendet werden, wenn gleichzeitig eine wirksame tuberkulostatische Therapie durchgeführt wird.
Bei Mykosen oder anderen Infektionen im Bereich der Atemwege soll Sanasthmax® Junior nur eingesetzt werden, wenn diese angemessen behandelt werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Innerhalb der ersten Monate nach Umstellung von der systemischen Kortikoidgabe auf die Inhalationsbehandlung ist u. U. in Stresssituationen oder Notfällen (z. B. schwere Infektionen, Verletzungen, Operationen) eine erneute systemische Gabe von Kortikoiden notwendig, weil wegen einer möglicherweise noch bestehenden Nebennierenrindeninsuffizienz eine adäquate Kortisolausschüttung nicht gewährleistet ist.
Verschlimmert sich die Atemnot nach der Inhalation akut (paradoxe Bronchospastik), so sollte die Behandlung sofort abgesetzt und der Behandlungsplan überprüft werden.
Inhalativ anzuwendende Glukokortikoide können systemische Nebenwirkungen verursachen, insbesondere wenn hohe Dosen über lange Zeiträume gegeben werden. Solche Reaktionen treten deutlich seltener auf als bei oraler Glukokortikoidgabe. Mögliche systemische Effekte schließen die adrenale Suppression, die Verminderung der Knochendichte, Wachstumsverzögerungen bei Kindern und Jugendlichen, Katarakt und Glaukom ein, sowie seltener auch eine Reihe von Auswirkungen auf die Psyche oder das Verhalten, einschließlich psychomotorische Hyperaktivität, Schlafstörungen, Angstzustände, Depression oder Aggression (vor allem bei Kindern). Deshalb ist es wichtig, dass die niedrigste Dosis, mit der eine effektive Kontrolle des Asthmas aufrechterhalten werden kann, verabreicht wird.
Es wird empfohlen, das Wachstum von Kindern, die eine Langzeittherapie mit inhalativ anzuwendenden Glukokortikoiden erhalten, regelmäßig zu kontrollieren. Bei Wachstumsverzögerungen sollte die Therapie überdacht werden mit dem Ziel, die Dosis des inhalativ anzuwendenden Glukokortikoids auf die niedrigste Dosis zu verringern, mit der eine effektive Kontrolle des Asthmas aufrechterhalten werden kann.
Bei der Behandlung mit hohen Dosen, insbesondere bei Überschreitung der empfohlenen Dosierung, kann eine klinisch relevante Funktionsminderung der Nebennierenrinde mit einer verminderten Produktion bzw. einer bei gesteigertem Bedarf (Stresssituationen) nicht mehr ausreichend steigerbaren Produktion körpereigener Glukokortikoide auftreten. In solchen Fällen sollte in Stresssituationen (z. B. vor Operationen) eine vorübergehende zusätzliche Glukokortikoidgabe zum Ausgleich der verminderten natürlichen Glukokortikoidproduktion erwogen werden.
Hinweise für nicht mit Kortikoiden vorbehandelte Patienten:
Bei Patienten, die zuvor keine oder nur gelegentlich eine kurzdauernde Kortikoidbehandlung erhalten haben, sollte die vorschriftsmäßige, regelmäßige Anwendung von Sanasthmax® Junior nach ca. 1 Woche zu einer Verbesserung der Atmung führen. Starke Verschleimung und entzündliche Veränderungen können allerdings die Bronchien soweit verstopfen, dass Beclometason-17,21-dipropionat lokal nicht voll wirksam werden kann. In diesen Fällen sollte die Einleitung der Therapie mit systemischen Kortikoiden (beginnend mit 40 - 60 mg Prednisonäquivalent pro Tag) ergänzt werden. Die Inhalationen werden auch nach schrittweisem Abbau der systemischen Kortikoidgabe fortgesetzt.
Hinweise für die Umstellung kortikoidabhängiger Patienten auf die Inhalationsbehandlung: Patienten, die systemisch mit Kortikoiden behandelt werden, sollten zu einem Zeitpunkt auf Sanasthmax® Junior umgestellt werden, an dem ihre Beschwerden unter Kontrolle sind. Bei diesen Patienten, deren Nebennierenrindenfunktion gewöhnlich eingeschränkt ist, muss die systemische Kortikoidgabe allmählich abgesetzt und darf nicht plötzlich unterbrochen werden. Zu Beginn der Umstellung sollte Sanasthmax® Junior für etwa 1 Woche zusätzlich verabreicht werden. Dann wird die systemische Kortikoid-Tagesdosis entsprechend dem jeweiligen Ansprechen im Abstand von 1 - 2 Wochen um 2,5 mg Prednisonäquivalent herabgesetzt.
Kommt es innerhalb der ersten Monate nach Umstellung von der systemischen Kortikoidgabe auf die Inhalationsbehandlung zu besonderen Stresssituationen oder Notfällen (z. B. schwere Infektionen, Verletzungen, Operationen), kann eine erneute systemische Gabe von Kortikoiden notwendig werden.
Exazerbation der Krankheitssymptome durch akute Atemwegsinfektionen:
Bei Verschlimmerung der Krankheitssymptome durch akute Atemwegsinfektionen ist die Gabe entsprechender Antibiotika zu erwägen. Die Dosis von Sanasthmax® Junior kann ggf. angepasst werden, u. U. ist die systemische Gabe von Glukokortikoiden indiziert.
Die Anwendung von Sanasthmax® Junior 50 Mikrogramm kann bei Dopingkontrollen zu positiven Ergebnissen führen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Sanasthmax® Junior kann die Wirksamkeit von ß2-Sympathomimetika zur Inhalation verstärken.
4.6 Schwangerschaft und Stillzeit
Die Notwendigkeit einer Anwendung während der Schwangerschaft ist besonders sorgfältig abzuwägen. Obwohl nach den bisherigen Erfahrungen bei Schwangeren keine Anhaltspunkte dafür vorliegen, dass die im Tierversuch aufgetretenen teratogenen Wirkungen von Beclometason für den Menschen von Bedeutung sind, können andere Formen der Schädigung (z. B. intrauterine Wachstumsstörungen, Atrophie der Nebennierenrinde) und Spätfolgen bei Langzeittherapien nicht sicher ausgeschlossen werden. Insbesondere synthetische Glukokortikoide, die von der Plazenta nur unzureichend inaktiviert werden können, stehen in Verdacht, durch eine In-utero-Programmierung beim Feten zu späteren kardiovaskulären Erkrankungen beizutragen.
Es liegen keine Daten zum Übergang von Beclometason in die Muttermilch vor. Andere Glukokortikoide gehen in geringen Mengen in die Muttermilch über. Die Belastung des Säuglings wird dabei in der Regel weniger als 1/100 der systemisch bei der stillenden Mutter zur Verfügung stehenden Dosis betragen. Sollten Substanzwirkungen beim Säugling beobachtet werden, ist abzustillen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen
Keine
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig:
Häufig:
Gelegentlich:
Selten:
Sehr selten: Nicht bekannt:
(>1/10)
(>1/100 - < 1/10)
(>1/1.000 - < 1/100)
(>1/10.000 - < 1/1.000)
(< 1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Augenerkrankungen Selten: Glaukom, Katarakt
Erkrankungen der Atemwege, des Brustraums und des Mediastinums Häufig: Heiserkeit
Gelegentlich: Reizwirkungen im Rachenraum Sehr selten: paradoxe Bronchospasmen, Husten
Erkrankungen des Gastrointestinaltrakts Gelegentlich: lokale Pilzinfektionen
Das Risiko kann vermindert werden, wenn Sanasthmax® Junior vor einer Mahlzeit angewendet wird, nach der Inhalation der Mund ausgespült wird und/oder ein Spacer verwendet wird.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen Selten: Osteoporose
Psychiatrische Erkrankungen
Häufigkeit nicht bekannt: Psychomotorische Hyperaktivität, Schlafstörungen, Angstzustände, Depression, Aggression, Verhaltensauffälligkeiten (eher bei Kindern)
Erkrankungen des Nervensystems Häufigkeit nicht bekannt: Kopfschmerz
Erkrankungen des Gastrointestinaltrakts Häufigkeit nicht bekannt: Übelkeit
Überempfindlichkeitsreaktionen einschließlich Hautausschlag, Urtikaria, Juckreiz, Erythem und Ödeme von Augen, Gesicht, Lippen und Rachen sind berichtet worden.
Bei Umstellung von Kortikoidtabletten oder -injektionen auf die Inhalationsbehandlung mit Sanasthmax® Junior können Allergien auftreten, die durch die bisherige Behandlung unterdrückt waren, wie z. B. allergische Rhinitis, allergische Ekzeme, rheumatoide Beschwerden. Diese Symptome sollten mit geeigneten Arzneimitteln zusätzlich behandelt werden.
Bei Gabe von Sanasthmax® Junior kann die Hypothalamus-Hypophysenvorderlappen-Nebennierenrinden-Achse supprimiert werden und es können weitere glukokortikoidübliche Wirkungen, wie z. B. eine erhöhte Infektanfälligkeit, auftreten. Die Stressanpassung kann behindert sein. Bei Erwachsenen konnte bei Dosen von 400 - 800 Mikrogramm Beclo-metason-17,21-dipropionat pro Tag bei der Mehrzahl der Patienten keine Suppression der Nebennierenrinde gefunden werden. Bei Dosen von 1600 - 2000 Mikrogramm pro Tag ist ein relevanter Effekt nicht auszuschließen.
Inhalativ anzuwendende Glukokortikoide können systemische Nebenwirkungen verursachen, insbesondere wenn hohe Dosen über lange Zeiträume gegeben werden. Mögliche Nebenwirkungen schließen die adrenale Suppression, die Verminderung der Knochendichte, Wachstumsverzögerungen bei Kindern und Jugendlichen sowie Katarakt und Glaukom ein.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn
Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome einer Überdosierung:
Bei kurzfristiger Überdosierung kann eine Suppression der Hypothalamus-Hypophysenvorder-lappen-Nebennierenrinden-Funktion eintreten. Bei längerfristiger Überdosierung kann es zusätzlich zur Nebennierenrindenatrophie kommen.
Es können glukokortikoidübliche Wirkungen, wie eine erhöhte Anfälligkeit für Infektionen, auftreten. Die Stressanpassung kann behindert sein.
Therapiemaßnahmen bei Überdosierung:
Bei kurzfristiger Überdosierung ist grundsätzlich keine spezielle Notfallbehandlung erforderlich. Bei fortgesetzter Inhalationsbehandlung in vorgeschriebener Dosierung sollte sich die Funktion der Hypothalamus-Hypophysenvorderlappen-Nebennierenrinden-Achse nach ca. 1 - 2 Tagen normalisieren.
In Stresssituationen kann eine Kortikoidschutzbehandlung (z. B. hochdosierte Gabe von Hydrocortison) erforderlich sein.
Bei Nebennierenrindenatrophie gilt der Patient als steroidabhängig und ist auf die entsprechende Erhaltungsdosis eines systemischen Steroids einzustellen, bis sich der Zustand stabilisiert hat.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Glukokortikoid zur Inhalation/Antiasthmatikum ATC-Klassifizierung: R03B A01
Beclometason-17,21-dipropionat ist ein synthetisches Glukokortikoid. Nach oraler Inhalation hat es einen lokalen entzündungshemmenden Effekt auf die Bronchialschleimhaut. Klinisch macht sich dieser Effekt zum Beispiel durch eine Reduktion krankheitsbezogener Symptome, wie Atemnot, bemerkbar. Die Hyperreagibilität des Bronchialsystems auf exogene Reize wird reduziert.
5.2 Pharmakokinetische Eigenschaften
Nach Inhalation wird Beclometason-17,21-dipropionat zu Beclometason-17-propionat hydrolysiert, welches zu Beclometason-21-propionat umgeestert und nachfolgend zu Beclometason hydrolysiert wird. Beclometason-17,21-dipropionat stellt mithin ein pharmakologisch aktives Prodrug dar, aus dem in der Lunge selbst in kurzer Zeit das noch aktivere Beclometason-17-propionat gebildet wird.
Die systemische Absorption von Beclometason-17-propionat erfolgt über die Lunge (36 %) und oral (26 %).
Die absolute Bioverfügbarkeit nach Inhalation beträgt ca. 2 % (Beclometason-17,21-dipropionat) bzw. 62 % (Beclometason-17-propionat).
Beclometason-17,21-dipropionat wird rasch absorbiert und zeigt Cmax nach 0,3 Stunden. Beclometason-17-propionat hingegen wird langsamer resorbiert und weist Cmax nach 1 Stunde auf. Die Plasmaproteinbindung beträgt 87 %.
Ca. 90 % des geschluckten Beclometason-17,21-dipropionat werden hauptsächlich als Beclo-metason-17-propionat, Dipropionat und freier Alkohol aus dem Gastrointestinaltrakt resorbiert. In der Leber werden sie mittels First-Pass-Effekt in pharmakologisch inaktive Metaboliten umgewandelt. Damit sind systemische Bioverfügbarkeit und Toxizität begrenzt. Die Metaboliten werden zum größeren Teil über den Faeces und zu ca. 15 % über den Urin ausgeschieden.
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität
Siehe 4.9 „Überdosierung“.
Chronische Toxizität
Untersuchungen zur chronischen Toxizität an verschiedenen Tierspezies bei unterschiedlicher Applikationsart zeigten dosisabhängig Symptome der Glukokortikoidüberdosierung.
Mutagenes und tumorerzeugendes Potential
Mutagenitätsuntersuchungen mit Beclometasondipropionat in Kombination mit Salbutamol verliefen im Ames-Test und im Mikrokerntest an der Maus negativ.
Langzeituntersuchungen an der Ratte bei kombinierter inhalativer und oraler Applikation ergaben keine Hinweise auf ein tumorerzeugendes Potential.
Reproduktionstoxizität
Beclometason-17,21-dipropionat verursachte bei Mäusen und Kaninchen Gaumenspalten und Embryoletalität. Bei Rhesusaffen sind eine erhöhte Abortrate und intrauterine Wachstumsretardierungen beobachtet worden.
In-vitro- und In-vivo-Studien einschließlich Langzeitinhalationsstudien an Nagern haben keine Hinweise auf die mutagene, klastogene und kanzerogene Wirkung des Treibmittels Norfluran (HFA-134 a) ergeben.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Norfluran, Ethanol, Glycerol
6.2 Inkompatibilitäten
Keine bekannt.
6.3 Dauer der Haltbarkeit
Die Dauer der Haltbarkeit beträgt 3 Jahre.
Dieses Arzneimittel soll nach Ablauf des Verfalldatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
Behälter steht unter Druck!
Vor Hitze, direkter Sonnenbestrahlung und Frost schützen!
Nicht gegen Flammen oder auf glühende Gegenstände sprühen! Nicht gewaltsam öffnen oder verbrennen!
6.5 Art und Inhalt des Behältnisses
1 Sanasthmax® Junior 50 Mikrogramm Druckbehältnis mit 200 Aerosolstößen (Druckgasinhalation, Lösung)
2 Sanasthmax® Junior 50 Mikrogramm Druckbehältnisse mit je 200 Aerosolstößen (Druckgasinhalation, Lösung) (Doppelpackung)
3 Sanasthmax® Junior 50 Mikrogramm Druckbehältnisse mit je 200 Aerosolstößen (Druckgasinhalation, Lösung) (Dreierpackung)
1 Sanasthmax® Junior 50 Mikrogramm Druckbehältnis mit 200 Aerosolstößen (Druckgasinhalation, Lösung) mit Inhalierhilfe Jetspacer
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
Chiesi GmbH 22761 Hamburg Telefon: 040 89724-0 Telefax: 040 89724-212 E-Mail: info.de@chiesi.com
8. ZULASSUNGSNUMMER
5794.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
26.09.1985/27.07.2004
10. STAND DER INFORMATION
April 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig