Sayana 104 Mg/0,65 Ml Injektionssuspension
SAYANA®
PFIZER ((Logo))
FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels)
1. BEZEICHNUNG DES ARZNEIMITTELS
SAYANA® 104 mg/0,65 ml Injektionssuspension
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Eine Fertigspritze enthält eine Einzeldosis mit 104 mg Medroxyprogesteronacetat (MPA) in 0,65 ml Injektionssuspension.
Sonstige Bestandteile mit bekannter Wirkung:
Methyl-4-hydroxybenzoat: 1,04 mg in 0,65 ml Propyl-4-hydroxybenzoat: 0,0975 mg in 0,65 ml Natrium: 2,47 mg in 0,65 ml
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Injektionssuspension
Weiße bis weißliche homogene Suspension
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
SAYANA wird zur Langzeit-Empfängnisverhütung bei Frauen eingesetzt. Die subkutane Injektion verhindert die Ovulation. Dadurch kann für mindestens 13 Wochen (+/-1 Woche) verhütet werden. Es sollte jedoch beachtet werden, dass sich das Wiedereintreten der Fruchtbarkeit (Ovulation) bis zu 1 Jahr nach Absetzen von SAYANA verzögern kann (siehe Abschnitt 4.4).
Unter Anwendung von SAYANA über einen längeren Zeitraum (siehe Abschnitt 4.4) kann es bei Frauen aller Altersstufen zu einer Abnahme der Knochendichte kommen. Aus diesem Grund muss eine Nutzen-Risiko-Bewertung, welche auch den Abbau an Knochendichte während Schwangerschaft und Stillzeit berücksichtigt, erfolgen.
Anwendung bei jugendlichen Frauen (12 bis 18 Jahre)
Bei jugendlichen Frauen ist die Anwendung von SAYANA nur dann angezeigt, wenn andere Verhütungsmethoden als ungeeignet oder inakzeptabel erachtet werden, aufgrund der unbekannten Langzeiteffekte von SAYANA auf die Knochendichte während der kritischen Zeit des Knochenwachstums (siehe Abschnitt 4.4).
Es wurden keine Studien über die Anwendung von SAYANA bei Frauen unter 18 Jahren durchgeführt, jedoch sind Daten über die Anwendung von intramuskulär (i.m.) verabreichtem Medroxyprogesteronacetat in dieser Patientengruppe verfügbar.
4.2 Dosierung und Art der Anwendung
Unmittelbar vor Gebrauch ist die SAYANA-Fertigspritze kräftig zu schütteln, um eine gleichmäßige Verteilung der Suspension bei Applikation zu gewährleisten. Der Beginn der Behandlung sollte durch einen Arzt bzw. medizinisches Fachpersonal erfolgen. SAYANA wird subkutan in die Vorderseite des Oberschenkels oder in den Bauch injiziert. Das Arzneimittel muss langsam bis zur vollständigen Entleerung der Spritze injiziert werden. Dieser Vorgang soll ca. 5 bis 7 Sekunden in Anspruch nehmen. Anweisungen zur Vorbereitung von SAYANA vor der Verabreichung siehe Abschnitt 6.6.
Schritt 1: Auswahl und Vorbereitung der Injektionsstelle
Wählen Sie die Injektionsstelle entweder am vorderen Oberschenkel oder am Bauch (siehe schattierte Flächen in Abbildung 1). Vermeiden Sie knochige Bereiche und den Bauchnabel.
Abbildung 1
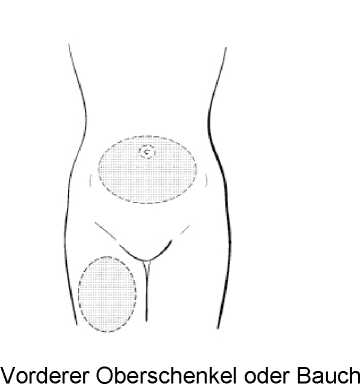
Reinigen Sie die Haut der ausgewählten Injektionsstelle mit einem Alkoholtupfer und lassen Sie sie anschließend trocknen.
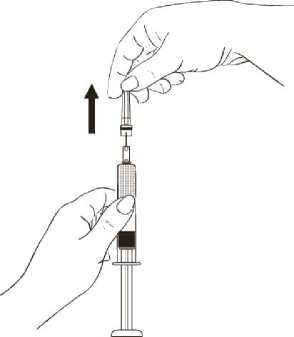
Halten Sie die Spritze am Spritzenkörper fest und entfernen Sie die Plastikschutzkappe von der Nadel, ohne zu drehen. Stellen Sie dabei sicher, dass die Nadel weiterhin fest auf der Spritze aufsitzt (Abbildung 2).
Abbildung 2
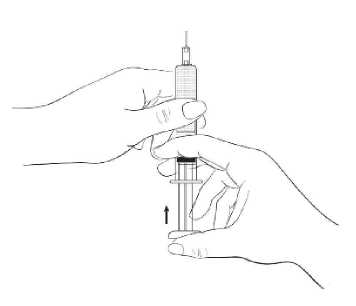
Halten Sie die Spritze mit der Nadel nach oben zeigend und drücken Sie den Kolben vorsichtig so weit in den Spritzenkörper, bis dieser bis oben hin mit der Suspension gefüllt ist. Im Spritzenkörper darf sich keine Luft befinden (Abbildung 3).
Abbildung 3
Schritt 2: Injektion der Dosis
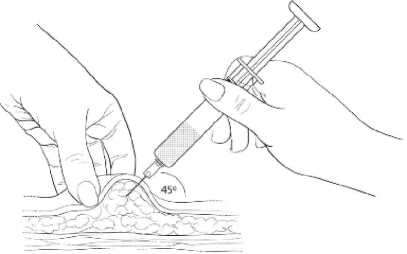
Ergreifen Sie vorsichtig eine große Fläche Haut an der gewählten Injektionsstelle und bilden Sie zwischen Daumen und Zeigefinger eine Hautfalte, die Sie weit weg vom Körper ziehen. Führen Sie die Nadel in einem 45-Grad-Winkel so ein, dass sie fast vollständig im Fettgewebe der Hautfalte verschwindet. Der Spritzenhals aus Plastik soll dabei wenn möglich die Haut berühren (Abbildung 4).
Abbildung 4
Injizieren Sie die Suspension langsam, bis sich keine Flüssigkeit mehr in der Spritze befindet (Abbildung 5).
• Dieser Vorgang soll ungefähr 5 bis 7 Sekunden in Anspruch nehmen.
• Es ist wichtig, dass die SAYANA-Dosis vollständig injiziert wird.
Abbildung 5
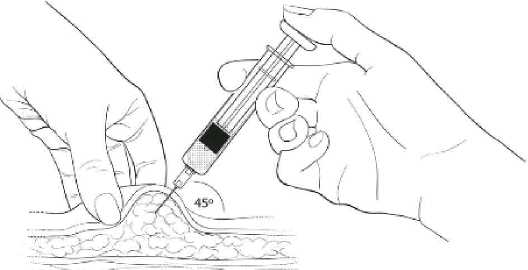
Langsam injizieren! (5 bis 7 Sekunden)
Nachdem die Gesamtdosis vollständig injiziert ist, ziehen Sie die Nadel vorsichtig aus der Haut.
Drücken Sie mit einem sauberen Mulltupfer für ein paar Sekunden auf die Einstichstelle. Reiben Sie die Einstichstelle NICHT.
Erwachsene 1. Injektion: Für einen sicheren Empfängnisschutz im 1. Behandlungszyklus muss die subkutane Injektion von 104 mg Medroxyprogesteronacetat während der ersten 5 Tage eines normalen Monatszyklus erfolgen. Wenn die Injektion vorschriftsmäßig durchgeführt wurde, ist kein zusätzlicher Empfängnisschutz erforderlich.
Weitere Injektionen: Die 2. und die darauf folgenden Injektionen haben in einem Abstand von jeweils 13 Wochen zu erfolgen. Sofern die Injektion nicht später als 7 Tage nach diesem Zeitpunkt erfolgt, sind keine weiteren zusätzlichen empfängnisverhütenden Maßnahmen (z. B. Kondome) erforderlich. Beträgt das Intervall seit der letzten Injektion aus irgendwelchen Gründen mehr als 14 Wochen (13 Wochen plus 7 Tage), ist vor der nächsten Injektion eine Schwangerschaft auszuschließen. Die Wirksamkeit von SAYANA ist von der Einhaltung des empfohlenen Dosierungsschemas abhängig.
Post partum: Sofern nicht gestillt wird, muss die Injektion während der ersten 5 Tage post partum erfolgen, um eine Schwangerschaft auszuschließen. Muss die Injektion zu einem anderen Zeitpunkt gegeben werden, ist zuvor das Vorliegen einer Schwangerschaft auszuschließen.
Stillenden Frauen darf die Injektion erst nach Ablauf von 6 Wochen nach der Entbindung verabreicht werden, wenn das Enzymsystem des Säuglings weiterentwickelt ist (siehe Abschnitt 4.6).
Es gibt Hinweise darauf, dass es bei Frauen, denen SAYANA unmittelbar im Wochenbett verordnet wurde, zu anhaltenden und starken Blutungen kommen kann. Daher sollte dieses Arzneimittel im Wochenbett mit Vorsicht eingesetzt werden. Frauen, die erwägen, dieses Arzneimittel unmittelbar nach der Geburt oder einem Schwangerschaftsabbruch einzusetzen, sollten auf das erhöhte Risiko für ein Auftreten starker oder anhaltender Blutungen hingewiesen werden. Ärzte seien daran erinnert, dass die Ovulation bei einer nicht stillenden Frau bereits 4 Wochen nach der Geburt einsetzen kann.
Wechsel von anderen empfängnisverhütenden Methoden: Beim Wechsel von anderen Verhütungsmethoden auf SAYANA ist darauf zu achten, dass zum Zeitpunkt der 1. Injektion ein kontinuierlicher Empfängnisschutz besteht, wobei der Wirkmechanismus von beiden Verhütungsmethoden zu berücksichtigen ist (z. B. hat die 1. Injektion bei Patientinnen, die von oralen Kontrazeptiva zu SAYANA wechseln, innerhalb von 7 Tagen nach der letzten Pilleneinnahme zu erfolgen).
Eingeschränkte Leberfunktion: Die Auswirkungen von Lebererkrankungen auf die Pharmakokinetik von SAYANA sind nicht bekannt. Da SAYANA überwiegend hepatisch eliminiert wird, kann es möglicherweise von Patientinnen mit schweren Leberfunktionsstörungen nur unzureichend metabolisiert werden (siehe Abschnitt 4.3).
Eingeschränkte Nierenfunktion: Die Auswirkungen von Nierenerkrankungen auf die Pharmakokinetik von SAYANA sind nicht bekannt. Da SAYANA jedoch fast ausschließlich über die Leber eliminiert wird, sollte eine Dosisanpassung bei Patientinnen mit eingeschränkter Nierenfunktion nicht erforderlich sein.
Kinder und Jugendliche
Eine Anwendung von SAYANA vor der Menarche ist nicht angezeigt (siehe Abschnitt 4.1). Daten über die Anwendung bei jugendlichen Frauen (12 bis 18 Jahre) sind für i.m. verabreichtes Medroxyprogesteronacetat verfügbar (siehe Abschnitte 4.4 und 5.1). Im Vergleich zu erwachsenen Frauen sind, abgesehen von Bedenken bezüglich der Abnahme der Knochendichte, bei jugendlichen Frauen nach der Menarche keine abweichenden Auswirkungen in Bezug auf Unbedenklichkeit und Wirksamkeit von SAYANA zu erwarten.
4.3 Gegenanzeigen
SAYANA ist kontraindiziert
• bei Patientinnen mit bekannter Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile,
• während der Schwangerschaft oder bei Verdacht darauf,
• bei Patientinnen mit bekannten oder vermuteten bösartigen Erkrankungen der Brust oder Geschlechtsorgane,
• bei Patientinnen mit Vaginalblutungen ungeklärter Ursache,
• bei Patientinnen mit schweren Funktionsstörungen der Leber,
• bei Patientinnen mit Knochenerkrankungen aufgrund von Stoffwechselstörungen,
• bei Patientinnen mit aktiven thromboembolischen Erkrankungen sowie bei Patientinnen mit akuten oder in der Vergangenheit aufgetretenen zerebrovaskulären Erkrankungen.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Besondere Warnhinweise
Abnahme der Knochendichte
Die Anwendung von SAYANA führt zu erniedrigten Östrogenspiegeln im Blut und wird mit einer signifikanten Abnahme der Knochendichte in Verbindung gebracht, basierend auf den bekannten Auswirkungen von Östrogenmangel im Wiederaufbausystem der Knochen. Die Abnahme der Knochendichte steigt mit zunehmender Anwendungsdauer, scheint sich jedoch nach Absetzen von SAYANA wieder zu bessern, wenn die ovarielle Östrogenproduktion wieder ansteigt.
Der Verlust der Knochendichte ist während des Heranwachsens und im frühen Erwachsenenalter von besonderer Bedeutung, zumal diese Zeitspanne als kritisch für das Knochenwachstum anzusehen ist. Es ist nicht bekannt, ob die Anwendung von SAYANA bei jüngeren Frauen zu einer Verringerung des Knochendichtehöchstwertes und zu einem Risikoanstieg für Frakturen im späteren Leben führt.
Eine klinische Studie zur Beurteilung der Wirkung von i.m. verabreichtem Medroxyprogesteronacetat auf die Knochendichte jugendlicher Frauen hat gezeigt, dass die Anwendung mit einem signifikanten Rückgang der Knochendichte im Vergleich zu den Ausgangswerten verbunden war. Eine kleine Gruppe Frauen wurde nachbeobachtet; bei ihnen erreichte die durchschnittliche Knochendichte 1 bis 3 Jahre nach Therapieende wieder den Bereich der Ausgangswerte. Eine Anwendung von SAYANA bei jugendlichen Frauen ist möglich, jedoch nur, nachdem andere Verhütungsmethoden mit der Patientin besprochen und als ungeeignet oder inakzeptabel bewertet wurden.
Eine sorgfältige erneute Abwägung des Nutzen-Risiko-Verhältnisses der Behandlung ist bei Frauen aller Altersstufen durchzuführen, die SAYANA für einen über 2 Jahre hinausgehenden Zeitraum anwenden möchten. Speziell bei Frauen, die aufgrund ihrer Lebensweise und/ oder medizinischer Risikofaktoren ein erhöhtes Osteoporoserisiko aufweisen, sollten vorrangig andere Verhütungsmethoden als SAYANA in Betracht gezogen werden.
Bedeutende Risikofaktoren für Osteoporose sind u. a.
• Alkoholmissbrauch und/ oder Rauchen,
• Dauertherapie mit Arzneimitteln, die die Knochendichte vermindern können, z. B. Antikonvulsiva oder Kortikosteroide,
• niedriger Body-Mass-Index oder Essstörungen, z. B. Anorexia nervosa oder Bulimie,
• Fraktur nach leichtem Trauma in der Anamnese,
• Osteoporose bei Familienmitgliedern.
Eine retrospektive Kohortenstudie, die auf den Daten der „General Practice Research Database" basierte, ergab, dass Frauen, die MPA-Injektionen (DMPA) angewendet hatten, ein höheres Frakturrisiko aufweisen als Anwenderinnen von Kontrazeptiva, die nachweislich kein DMPA angewendet hatten (relatives Risiko für die 5-jährige Nachbeobachtungsdauer: 1,41; 95 %-KI: 1,35 - 1,47). Es ist nicht klar, ob dies auf DMPA zurückzuführen ist oder auf andere Lebensumstände, die einen Einfluss auf die Frakturrate haben. Im Gegensatz dazu war das Frakturrisiko bei Frauen, die DMPA anwenden, vor und nach Beginn der Anwendung von DMPA nicht erhöht (relatives Risiko 1,08; 95 %-KI: 0,92 - 1,26). Wichtig ist, dass diese Studie nicht klären konnte, ob DMPA die Frakturrate im späteren Leben beeinflusst.
Weitere Informationen zu Veränderungen der Knochendichte bei erwachsenen und jugendlichen Frauen, wie in klinischen Studien kürzlich berichtet, werden in Abschnitt 5.1 angeführt. Die Zufuhr von ausreichend Calcium und Vitamin D über die Nahrung oder mittels Ersatzpräparaten ist für die Gesundheit der Knochen bei Frauen jeglichen Alters wichtig.
Unregelmäßiger Zyklus
Bei den meisten Frauen kam es unter der Anwendung von SAYANA zu abweichenden Blutungszyklen. Die Patientinnen sind über die Möglichkeit von Menstruationsstörungen und über eine eventuell verzögerte Ovulation nach Absetzen des Arzneimittels in ausreichendem Maße aufzuklären. Bei fortgesetzter Anwendung wurde vermehrt über ein vollständiges Ausbleiben der Monatsblutung berichtet und weniger über unregelmäßige Blutungen. In einer Studie über 12 Monate mit 4 Verabreichungen von SAYANA berichteten 39 % der Patientinnen über das Ausbleiben der Monatsblutung im 6. Monat, im 12. Anwendungsmonat waren es 56,5 %. Die Veränderungen der Menstruationszyklen aus drei durchgeführten Kontrazeptionsstudien werden in den Abbildungen 1 und 2 dargestellt. Abbildung 1 zeigt die prozentuale Zunahme von Amenorrhoe in der 12-Monats-Studie. Abbildung 2 gibt Aufschluss über den Anteil der Patientinnen, die während dieser Zeitspanne entweder Schmierblutungen oder normale Blutungen oder beides hatten. Zusätzlich zu Amenorrhoen kam es zu veränderten Blutungsmustern wie Zwischenblutungen, Menorrhagien und Metrorrhagien. Wenn die Blutungsstörungen im Zusammenhang mit SAYANA andauern oder schwerwiegend sind, sollte eine geeignete Untersuchung und Behandlung durchgeführt werden.
Abbildung 1: Prozentuales Auftreten von Amenorrhoe bei mit SAYANA behandelten Patientinnen
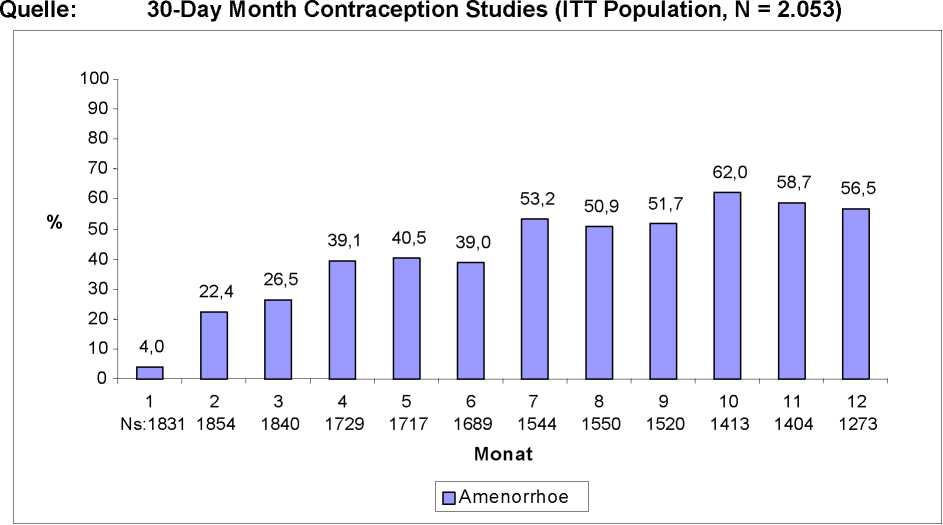
Abbildung 2: Auftreten von Monats- bzw. Schmierblutungen bei mit SAYANA behandelten Patientinnen
Quelle: 30-Day Month Contraception Studies (ITT Population, N = 2.053)
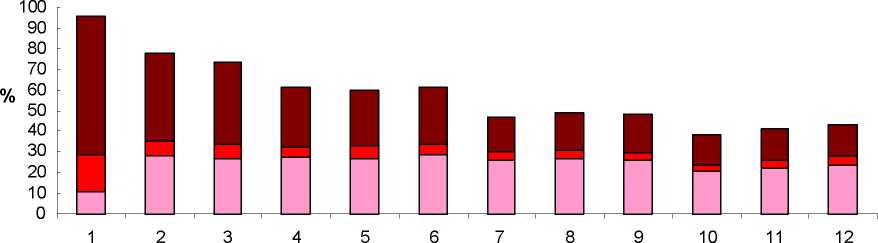
Ns:1831 1854 1840 1729 1717 1689 1544 1550 1520 1413 1404 1273
Monat
^ Nur Schmierblutugen ^ Nur Monatsblutungen
^ Monats- und Schmierblutungen
Krebsrisiko
Die langfristige, einzelfallkontrollierte Überwachung von Patientinnen, die 150 mg Depot-Medroxyprogesteronacetat (DMPA) i.m. anwendeten, ergab keine Hinweise auf ein erhöhtes Allgemeinrisiko für Krebserkrankungen an Ovarien, Leber oder Zervix. Das Risiko, an einem Endometriumkarzinom zu erkranken, sank bei den Anwenderinnen langfristig.
Brustkrebs tritt bei Frauen unter 40 Jahren selten auf, unabhängig davon, ob sie hormonelle Verhütungsmittel anwenden oder nicht.
Ergebnisse epidemiologischer Studien verweisen hinsichtlich des Brustkrebsrisikos auf einen geringen Unterschied zwischen aktiven und ehemaligen Anwenderinnen von hormonellen Kontrazeptiva und Frauen, die nie hormonelle Verhütungsmittel angewendet haben. Das höhere Risiko bei aktiven und ehemaligen DMPA-Anwenderinnen ist insbesondere bei jungen Frauen (siehe unten) im Verhältnis zum Gesamtrisiko für Brustkrebs gering und besteht 10 Jahre nach der letzten Anwendung nicht mehr. Die Dauer der Anwendung scheint keine Rolle zu spielen.
Mögliche Anzahl zusätzlicher Fälle von Brustkrebs, diagnostiziert bis zu 10 Jahre nach Absetzen von Gestagen-Injektionen*
|
Alter bei der letzten DMPA-Anwendung |
Anzahl der Fälle pro 10.000 Nichtanwenderinnen |
Mögliche zusätzliche Fälle pro 10.000 DMPA-Anwenderinnen |
|
20 |
weniger als 1 |
deutlich weniger als 1 |
|
30 |
44 |
2-3 |
|
40 |
160 |
10 |
* basierend auf einer 5-jährigen Anwendungsdauer
Thmmboembolische Erkrankungen
Obwohl kein kausaler Zusammenhang für das Auftreten thrombotischer oder thromboembolischer Erkrankungen durch Medroxyprogesteronacetat (MPA) nachgewiesen werden konnte, dürfen Patientinnen, bei denen thromboembolische Ereignisse wie Lungenembolie, zerebrovaskuläre Erkrankungen, Netzhautthrombose oder tiefe Venenthrombose während der Therapie auftraten, nicht wieder mit SAYANA behandelt werden. Es gibt keine klinischen Untersuchungen von Frauen mit thromboembolischen Erkrankungen in der Anamnese. Ebenso sind keine Informationen verfügbar, welche die Unbedenklichkeit der Anwendung von SAYANA bei dieser Patientengruppe belegen.
Anaphylaxie und anaphylaktische Reaktionen
Bei Auftreten einer anaphylaktischen Reaktion ist die entsprechende Therapie umgehend einzuleiten. Schwerwiegende anaphylaktische Reaktionen erfordern eine sofortige Notfallbehandlung.
Erkrankungen des Auges
Bei einem plötzlich auftretenden Teil- oder Vollverlust des Sehvermögens oder bei raschem Einsetzen von Proptosis, Diplopie oder Migräne ist von einer weiteren Behandlung umgehend abzusehen. Sollte bei der Untersuchung ein Papillenödem oder eine Gefäßverletzung der Retina diagnostiziert werden, darf die Behandlung mit SAYANA keinesfalls wieder aufgenommen werden.
Vorsichtsmaßnahmen
Änderung des Körpergewichts
Gewichtsveränderungen sind häufig, aber nicht vorhersehbar. In den Phase-III-Studien wurde das Körpergewicht über 12 Monate beobachtet. Die Hälfte (50 %) der Frauen blieb innerhalb von 2,2 kg ihres Anfangskörpergewichts. 12 % der Frauen nahmen mehr als 2,2 kg ab und 38 % der Frauen nahmen mehr als 2,3 kg zu.
Flüssigkeitsretention
Progesteron kann nachweislich zur Flüssigkeitsretention führen. Daher ist bei der Behandlung von Patientinnen mit bestehenden Erkrankungen, die den Flüssigkeitshaushalt ungünstig beeinflussen, besondere Vorsicht geboten.
Rückkehr der Ovulation
Nach einer einmaligen Gabe von SAYANA betrug die kumulative Rückkehrrate zur Ovulation nach 1 Jahr 97,4 % (38 von 39 Patientinnen), wie Plasma-Progesteron-Messungen ergaben. Nach dem therapeutischen Fenster von 14 Wochen war die früheste Ovulation 1 Woche danach festzustellen. Die durchschnittliche Zeitspanne bis zum Eintritt der Ovulation betrug 30 Wochen. Die Patientinnen sollten darauf hingewiesen werden, dass eine verzögerte Ovulation nach Anwendung von SAYANA möglich ist, unabhängig von der
Anwendungsdauer. Eine Amenorrhoe bzw. unregelmäßige Menstruation nach dem Absetzen der hormonellen Kontrazeption kann allerdings auf eine Grunderkrankung mit unregelmäßiger Menstruation, insbesondere auf ein polyzystisches ovarielles Syndrom zurückzuführen sein.
Psychiatrische Erkrankungen
Patientinnen mit behandelten Depressionen in der Anamnese sind unter Anwendung von SAYANA sorgfältig zu überwachen.
Schutz vor sexuell übertragbaren Erkrankungen
Patientinnen sind darauf hinzuweisen, dass SAYANA nicht vor HIV-Infektionen (Aids) oder anderen sexuell übertragbaren Erkrankungen schützt.
Kohlehydrate/ Stoffwechsel
Bei einigen Patientinnen kam es unter der Behandlung mit Gestagenen zu einer reduzierten Glucosetoleranz. Patientinnen, die an Diabetes leiden, sind daher besonders zu überwachen.
Leberfunktion
Bei Auftreten eines Ikterus während der Behandlung mit SAYANA sollte in Erwägung gezogen werden, SAYANA künftig nicht mehr zu verabreichen (siehe Abschnitt 4.3).
Bluthochdruck und Erkrankungen des Fettstoffwechsels
Limitierte Belege deuten darauf hin, dass Frauen mit Hypertonie oder mit einem gestörten Fettstoffwechsel ein leicht erhöhtes Risiko für kardiovaskuläre Ereignisse haben, wenn sie Injektionspräparate anwenden, die nur Gestagene enthalten. Wenn der Bluthochdruck unter der Behandlung mit SAYANA auftritt und/ oder die Steigerung des Bluthochdrucks nicht adäquat mit blutdrucksenkenden Medikamenten behandelt werden kann, ist die Behandlung mit SAYANA zu beenden. Zusätzliche Risikofaktoren für arteriell-thrombotische Erkrankungen sind: Hypertonie, Rauchen, das Alter, Erkrankungen des Fettstoffwechsels, Migräne, Adipositas, positive familiäre Vorgeschichte, Herzklappenerkrankungen, Vorhofflimmern.
SAYANA sollte bei Patientinnen mit einem oder mehreren dieser Risikofaktoren nur unter besonderer Vorsicht angewendet werden.
Weitere Erkrankungen
Die folgenden Erkrankungen wurden während einer Schwangerschaft und während der Behandlung mit Sexualhormonen berichtet, die Verbindung mit der Anwendung von Gestagenen ist jedoch nicht gesichert: Gelbsucht und/ oder Juckreiz in Verbindung mit Cholestase, Bildung von Gallensteinen, Porphyrie, systemischer Lupus erythematodes, hämolytisch-urämisches Syndrom, Chorea Sydenham, Herpes gestationis, Otosklerose-bedingter Hörverlust.
Laboruntersuchungen
Der Laborarzt ist über eine Behandlung mit Gestagenen in Kenntnis zu setzen, sofern relevante Proben eingereicht werden. Der Arzt muss darüber informiert werden, dass es durch eine derartige Behandlung bei gewissen Hormon- und Leberfunktionstests sowie einzelnen Blutbestandteilen zu Abweichungen kommen kann:
a) Die Plasma-/ Harnsteroide sind herabgesetzt (z. B. Progesteron, Estradiol,
Pregnandiol, Testosteron, Kortisol).
b) Die Plasma- und Harn-Gonadotropin-Spiegel sind herabgesetzt (z. B. LH, FSH).
c) Die Konzentrationen von Sexualhormon-bindendem Globulin (SHBG) sind herabgesetzt.
Sonstige Bestandteile
Da dieses Arzneimittel Methyl-4-hydroxybenzoat und Propyl-4-hydroxybenzoat enthält, sind allergische Reaktionen, insbesondere Bronchospasmen (auch zu einem späteren Zeitpunkt) möglich. SAYANA enthält Natrium, aber weniger als 1 mmol (23 mg) Natrium pro 104 mg/0,65 ml.
Wenn solche Symptome/ Risikofaktoren auftreten, muss der Nutzen von SAYANA gegen mögliche Risiken bei jeder einzelnen Frau abgewogen und mit der Frau diskutiert werden, bevor sie sich für die Anwendung entscheidet. Bei einer Verschlechterung, Exazerbation bzw. dem ersten Auftreten eines derartigen Symptoms bzw. Risikofaktors muss die Frau ihren Arzt aufsuchen. Der Arzt muss dann entscheiden, ob SAYANA abgesetzt werden soll.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden keine Wechselwirkungsstudien mit SAYANA durchgeführt.
Von Wechselwirkungen mit anderen Arzneimitteln einschließlich oraler Antikoagulanzien wurde selten berichtet, ein kausaler Zusammenhang wurde jedoch nicht nachgewiesen. Bei Patientinnen, die zusätzliche Arzneimittel anwenden, ist auf das mögliche Auftreten von Wechselwirkungen zu achten.
MPA wird in vitro vornehmlich durch Hydroxylierung über CYP3A4 metabolisiert. Spezifische Studien zur Erfassung von Arzneimittelwechselwirkungen in Hinblick auf die klinischen Wirkungen von Induktoren oder Inhibitoren des CYP3A4 auf die Behandlung mit MPA wurden nicht durchgeführt, sodass die klinischen Wirkungen von CYP3A4-Induktoren oder -Inhibitoren nicht bekannt sind.
4.6 Fertilität, Schwangerschaft und Stillzeit
Fertilität
SAYANA ist zur Schwangerschaftsverhütung angezeigt.
Nach Absetzen von SAYANA kann sich bei Frauen die Rückkehr zur Fertilität (Konzeption) verzögern (siehe Abschnitt 4.4).
Schwangerschaft
SAYANA ist bei schwangeren Frauen kontraindiziert. Einige Berichte deuten auf einen Zusammenhang zwischen einer Gestagenexposition im 1. Trimenon der Schwangerschaft und Missbildungen der Genitalien männlicher und weiblicher Föten hin. Bei Anwendung von SAYANA während der Schwangerschaft oder im Falle, dass die Patientin während der Anwendung schwanger wird, muss sie umgehend über das Gefahrenpotenzial für den Fötus aufgeklärt werden.
Eine Studie ergab, dass Kinder aus unbeabsichtigten Schwangerschaften, die 1 bis 2 Monate nach Injektion von 150 mg MPA i.m. auftraten, ein erhöhtes Risiko für ein reduziertes Geburtsgewicht haben, was seinerseits wiederum mit einem erhöhten Risiko für neonatalen Tod assoziiert ist. Das Gesamtrisiko hierfür ist jedoch gering, da Schwangerschaften unter Anwendung von 150 mg MPA i.m. ungewöhnlich sind.
Untersuchungen an Kindern, die einer MPA-Exposition in utero ausgesetzt waren und bis ins Jugendlichenalter nachverfolgt wurden, ergaben keine Hinweise auf Beeinträchtigungen ihrer Gesundheit, einschließlich ihrer physischen, intellektuellen, sexuellen oder sozialen Entwicklung.
Stillzeit
Geringe Mengen des Wirkstoffs wurden in der Muttermilch nachgewiesen. Bei stillenden Müttern, die mit 150 mg MPA i.m. behandelt wurden, waren die Zusammensetzung, Qualität und Menge der Milch nicht negativ beeinflusst. Neugeborene und Kinder, die MPA über die Muttermilch ausgesetzt waren, wurden bezüglich Entwicklung und Verhalten bis zur Pubertät untersucht. Es wurden keine negativen Effekte festgestellt. Da jedoch nur begrenzt Daten zur Wirkung von MPA auf unter 6 Wochen alte gestillte Säuglinge vorliegen, sollte SAYANA erst nach Ablauf von 6 Wochen nach der Entbindung verabreicht werden, wenn das Enzymsystem des Säuglings weiterentwickelt ist.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
SAYANA hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Nebenwirkungen aus klinischen Studien:
Die folgende Tabelle enthält eine Liste der Nebenwirkungen nach Häufigkeit und auf der Grundlage nicht kausalitätsbasierter Daten klinischer Studien, in denen 2.053 Frauen DMPA-SC als Empfängnisverhütung erhielten. Die am häufigsten berichteten Nebenwirkungen (> 5 %) waren Kopfschmerzen (8,9 %), Metrorrhagie (7,1 %), Gewichtszunahme (6,9 %), Amenorrhoe (6,3 %) und Reaktionen an der Injektionsstelle (6,1 %).
Sehr häufig (>1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Häufigkeit nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht
abschätzbar)
Nebenwirkungen aus der Beobachtung nach Markteinführung:
Des Weiteren sind in der untenstehenden Liste medizinisch bedeutsame Nebenwirkungen aus nach der Markteinführung gewonnenen Daten mit injizierbarem DMPA (i.m. oder s.c.) ebenfalls aufgelistet.
|
Systemorganklas se |
Sehr häufig |
Häufig |
Gelegentlich |
Selten |
Nicht bekannt |
|
Gutartige, bösartige und unspezifische Neubildungen (einschließlich Zysten und Polypen) |
Brustkrebs (siehe Abschnitt 4. 4) | ||||
|
Erkrankungen des Immunsystems |
Arzneimittelüber empfindlichkeit (siehe Abschnitt 4.4) |
Anaphylaktische und anaphylaktoide Reaktionen, Angioödem (siehe Abschnitt 4.4) |
|
Stoffwechsel- und Ernährungsstöru ngen |
Flüssigkeitsrete ntion (siehe Abschnitt 4.4), gesteigerter Appetit, verminderter Appetit | ||||
|
Psychiatrische Erkrankungen |
Depression, Schlaflosigkeit, Angst, affektive Störungen, Reizbarkeit, abgeschwächte Libido |
Nervosität, emotionale Störungen, Anorgasmie | |||
|
Erkrankungen des Nervensystems |
Schwindelgefühl, Kopfschmerzen |
Migräne, Schläfrigkeit |
Anfälle | ||
|
Erkrankungen des Ohrs und des Labyrinths |
Schwindel | ||||
|
Herzerkrankung en |
Tachykardie | ||||
|
Gefäßerkrankun gen |
Hypertonie (siehe Abschnitt 4.4), Varizen, Hitzewallungen |
Lungenembolie, Embolie und Thrombose (siehe Abschnitt 4.4), Thrombophlebitis | |||
|
Erkrankungen des Gastrointestinaltr akts |
Abdominalschme rz, Übelkeit |
Blähungen | |||
|
Leber- und Gallenerkrankun gen |
Gelbsucht, anomale Leberfunktion (siehe Abschnitt 4.4) | ||||
|
Erkrankungen der Haut und des Unterhautzellge webes |
Akne |
Alopezie, Hirsutismus, Dermatitis, Ekchymosen, Chloasmen, Ausschlag, Pruritus, Urtikaria |
Erworbene Lipodistroph ie |
Hautdehnungsstreifen | |
|
Skelettmuskulat ur-, Bindegewebs- und Knochenerkrank ungen |
Rückenschmerze n, Schmerzen in den Extremitäten |
Arthralgie, Muskelkrämpfe |
Osteoporose, osteoporotische Frakturen |
|
Erkrankungen der Geschlechtsorga ne und der Brustdrüse |
Menometrorrhagi e, Metrorrhagie, Menorrhagie (siehe Abschnitt 4.4), Dysmenorrhoe, Amenorrhoe, Vaginalinfektion, Brustschmerz |
Ovarialzysten, uterine Blutungen (unregelmäßig, verstärkt, verringert), vaginaler Ausfluss, Dyspareunie, Galaktorrhoe, Beckenschmerz en, vulvovaginale Trockenheit, prämenstruelles Syndrom, schmerzempfind liche Brust, Brustvergrößeru ng | |||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungso rt |
Müdigkeit, Reaktionen an der Injektionsstelle, persistierende Atrophie/ Einbuchtung/ Kräuselung an der Injektionsstelle, Knötchenbildung/ Schwellung an der Injektionsstelle, Schmerzen/ Druc kschmerz an der Injektionsstelle |
Pyrexie |
Asthenie | ||
|
Untersuchungen |
Gewichtszunahm e (siehe Abschnitt 4.4), anomaler Zervixabstrich |
Verringerung der Knochendichte (siehe Abschnitt 4.4), verminderte Glucosetoleranz (siehe Abschnitt 4.4), anomale Leberenzyme |
Gewichtsab nahme (siehe Abschnitt 4. 4) |
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
Zusätzliche Maßnahmen außer dem Abbruch der Behandlung sind nicht erforderlich.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
ATC-Code: G03AC06
MPA ist ein Analogon von 17a-Hydroxyprogesteron mit antiöstrogener, antiandrogener und antigonadotropher Wirkung.
SAYANA Injektionssuspension unterdrückt die Sekretion von Gonadotropinen und verhindert in der Folge die Follikelreifung und die Ovulation. Der primäre Mechanismus der Ovulationsunterdrückung zeigt sich wiederum in einer Verdünnung des Endometriums. Das Zusammenwirken dieser Faktoren resultiert in einer kontrazeptiven Wirkung des Arzneimittels.
Änderungen der Knochendichte bei erwachsenen Frauen
Eine Vergleichsstudie über die Änderungen der Knochendichte innerhalb zweier Untersuchungsgruppen (SAYANA versus 150 mg MPA i.m.) ergab nach einer Behandlungsdauer von 2 Jahren keine signifikanten Unterschiede zwischen den Gruppen. Die Durchschnittswerte der Knochendichteänderung in der SAYANA-Gruppe werden in Tabelle 1 prozentual dargestellt.
Tabelle 1: Prozentuale Durchschnittswerte der Änderungen an Knochendichte,
bezogen auf den Ausgangswert bei erwachsenen Frauen unter Anwendung von SAYANA
|
Behandlun gsdauer |
Lendenwirbelsäule |
Hüfte |
Oberschenkelhals | |||
|
n |
0 - Änderung in % (95%-KI) |
n |
0 - Änderung in % (95%-KI) |
n |
0 - Änderung in % (95%-KI) | |
|
1 Jahr |
166 |
-2,7 (-3,1 bis -2,3) |
166 |
-1,7 (-2,1 bis -1,3) |
166 |
-1,9 (-2,5 bis-1,4) |
|
2 Jahre |
106 |
-4,1 (-4,6 bis -3,5) |
106 |
-3,5 (-4,2 bis -2,7) |
106 |
-3,5 (-4,3 bis -2,6) |
n = Anzahl der Frauen
In einer weiteren kontrollierten klinischen Studie an erwachsenen Frauen, die 150 mg MPA i.m. bis zu 5 Jahre lang angewendet hatten, wurde eine Abnahme der Knochendichte in der Wirbelsäule und im Hüftknochen von durchschnittlich 5 bis 6 % beobachtet und keine signifikanten Änderungen in der Kontrollgruppe. Die Abnahme an Knochendichte war in den ersten 2 Jahren der Anwendung stärker ausgeprägt als in den folgenden Jahren. Die beobachteten durchschnittlichen Änderungen der Knochendichte in der Lendenwirbelsäule betrugen jeweils -2,86 %, -4,11 %, -4,89 %, -4,93 % und -5,38 % nach 1,2, 3, 4 bzw.
5 Jahren. Die durchschnittliche Abnahme der Knochendichte in den Hüft- und Schenkelhalsknochen hatte ähnliche Ausmaße. Für zusätzliche Informationen siehe Tabelle 2.
Während der Nachbeobachtungphase nach Absetzen von 150 mg MPA i.m. konnte eine Erhöhung der Knochendichte festgestellt werden, die annähernd den Ausgangswerten entsprach. Nach längerer Behandlungsdauer war die Wiederherstellungsrate der Knochendichte verlangsamt.
Tabelle 2: Prozentuale Durchschnittswerte der Änderungen an Knochendichte,
bezogen auf den Ausgangswert bei einer Gruppe von Frauen nach 5-jähriger Behandlung mit 150 mg MPA i.m. und anschließendem 2-jährigen Nachbeobachtungszeitraum bzw. bei der Kontrollgruppe nach einem 7-jährigen Beobachtungszeitraum
|
Zeitraum |
Wirbelsäule |
Hüfte |
Oberschenkelhals | |||
|
MPA |
Kontrollgru ppe |
MPA |
Kontrollgru ppe |
MPA |
Kontrollgru ppe | |
|
5 Jahre* |
n = 33 -5,38 % |
n = 105 0,43 % |
n = 21 -5,16 % |
n = 65 0,19 % |
n = 34 -6,12 % |
n = 106 -0,27 % |
|
7 Jahre** |
n = 12 -3,13 % |
n = 60 0,53 % |
n = 7 -1,34 % |
n = 39 0,94 % |
n = 13 -5,38 % |
n = 63 -0,11 % |
n = Anzahl der Frauen
* Die Behandlungsgruppe bestand aus Frauen, die über einen Zeitraum von 5 Jahren mit MPA 150 mg i.m. behandelt wurden. Die Kontrollgruppe bestand aus Frauen, die über diese Zeitspanne keine hormonellen Verhütungsmethoden angewendet haben.
** Die Behandlungsgruppe bestand aus Frauen, die über einen Zeitraum von 5 Jahren mit MPA 150 mg i.m. behandelt wurden und über einen weiteren Zeitraum von 2 Jahren beobachtet wurden, in dem keine hormonellen Verhütungsmethoden angewendet wurden. Die Kontrollgruppe bestand aus Frauen, die über den gesamten Zeitraum von 7 Jahren keine hormonellen Verhütungsmethoden angewendet haben.
Änderungen der Knochendichte bei jugendlichen Frauen im Alter von 12 bis 18 Jahren
Ergebnisse einer offenen, nicht randomisierten klinischen Studie mit 150 mg MPA i.m. alle 12 Wochen über einen Zeitraum von bis zu 240 Wochen (4,6 Jahre) mit einer Nachbeobachtungsphase bei weiblichen Jugendlichen zwischen 12 und 18 Jahren zeigten ebenfalls, dass die i.m.-Anwendung von MPA mit einer signifikanten Abnahme der Knochendichte gegenüber den Ausgangswerten assoziiert ist. Bei Frauen, die über einen Zeitraum von 60 Wochen 4 oder mehr Injektionen erhielten, betrug die durchschnittliche Abnahme der Knochendichte in der Lendenwirbelsäule nach 240 Wochen (4,6 Jahren)
-2,1 %; die durchschnittliche Abnahme der Knochendichte in der Hüfte und im Oberschenkelhalsknochen betrug -6,4 % bzw. -5,4 %. Im Nachbeobachtungszeitraum nach Abschluss der Behandlung wurden im Durchschnitt innerhalb etwa 1 Jahres für die Knochendichte in der Lendenwirbelsäule wieder die Ausgangswerte erreicht und für die Knochendichte in der Hüfte nach etwa 3 Jahren. Hier muss jedoch darauf hingewiesen werden, dass eine große Anzahl der Teilnehmerinnen die Studie nicht zu Ende geführt hat und die Ergebnisse nur auf einer geringen Teilnehmerzahl (71 Frauen 60 Wochen und 25 Frauen 240 Wochen nach Therapieende) basieren. Im Gegensatz dazu ergab sich bei einer nicht vergleichbaren Gruppe unbehandelter Personen, die andere Ausgangswerte der Knochendichte als die DMPA-Anwenderinnen aufwiesen, nach 240 Wochen ein durchschnittlicher Anstieg der Knochendichte von Lendenwirbelsäule, Hüfte und Oberschenkelhals um 6,4 %, 1,7 % und 1,9 %.
5.2 Pharmakokinetische Eigenschaften
Die pharmakokinetischen Parameter von Medroxyprogesteronacetat (MPA) im Anschluss an eine einmalig subkutan verabreichte SAYANA-Injektion sind in Tabelle 3 dargestellt.
Tabelle 3: Pharmakokinetische Parameter von Medroxyprogesteronacetat (MPA)
nach einer einmaligen subkutanen SAYANA-Injektion bei gesunden Frauen (n = 42)
|
Cmax |
Tmax |
C91 (min) |
AUCo-91 |
AUCo«d |
t% | |
|
(ng/ml) |
(Tag) |
(ng/ml) |
(ngTag/ml) |
(ngTag/ml) |
(Tag) | |
|
0 |
1,56 |
8,8 |
0,402 |
66,98 |
92,84 |
43 |
|
Min. |
0,53 |
2,0 |
0,133 |
20,63 |
31,36 |
16 |
|
Max. |
3,08 |
80,0 |
0,733 |
139,79 |
162,29 |
114 |
|
Cmax |
= Serumspitzenkonzentration |
|
T max |
= Zeitpunkt, an dem Cmax beobachtet wird |
|
AUC0-91 |
= Fläche unter der Konzentrations-Zeit-Kurve über 91 Tage |
|
t/ |
= terminale Halbwertszeit |
|
1 Nanogramm |
= 103 Pikogramm |
Allgemeine Charakteristika
Resorption
Die Zeitspanne von der subkutanen Verabreichung von MPA bis zum Erreichen eines therapeutischen Niveaus ist verhältnismäßig kurz. Die mittlere Tmax wird ungefähr 1 Woche nach der Injektion erreicht. Spitzenkonzentrationen von MPA (Cmax) reichen im Allgemeinen von 0,5 bis 3,0 ng/ml mit einer mittleren Cmax von 1,5 ng/ml nach einer einmaligen subkutanen Injektion.
Auswirkungen aufgrund unterschiedlicher Einstichstellen
SAYANA wurde zwecks Erstellung eines Zeitprofils der MPA-Konzentration sowohl in den vorderen Oberschenkel als auch in den Bauch injiziert. MPA-Tiefstkonzentrationen (Cmin;
Tag 91) ergaben ähnliche Werte für die beiden möglichen Einstichstellen. Daraus konnte der Schluss gezogen werden, dass weder die eine noch die andere Einstichstelle die kontrazeptive Wirkung von SAYANA negativ beeinflusst.
Verteilung
Die Plasmaproteinbindung von MPA beträgt durchschnittlich 86 %. Vorwiegend bindet sich MPA an Serumalbumin, während keine Bindung an SHBG stattfindet.
Biotransformation
MPA wird in der Leber durch P450-Enzyme weitgehend metabolisiert. Der MPA-Metabolismus betrifft hauptsächlich Ring A und/ oder eine Seitenkettenreduktion, wie Abspaltung der Acetylgruppe, Hydroxylierung der Positionen 2, 6 und 21 oder eine Kombination dieser Reaktionen und resultiert so in der Bildung von mehr als 10 Metaboliten.
Elimination
Die Restkonzentrationen von MPA am Ende des Dosierungsintervalls (3 Monate) von SAYANA betragen weniger als 0,5 ng/ml und stehen im Einklang mit der scheinbaren terminalen Halbwertszeit von rund 40 Tagen nach subkutaner Injektion. Die meisten MPA-Metaboliten werden als Glukuronidkonjugate und nur ein geringer Anteil als Sulfate mit dem Urin ausgeschieden.
Linearität/ Nicht-Linearität
Daten nach Einzeldosen ergaben keinen Hinweis auf Nicht-Linearität nach subkutaner Verabreichung im Dosierungsbereich von 50 bis 150 mg MPA. Das Verhältnis zwischen AUC oder der Cmin und der subkutanen Dosis von MPA war linear. Es kam zu keiner wesentlichen Änderung der durchschnittlichen Cmax mit steigenden Dosen.
Spezielle Populationen
Ethnische Zugehörigkeit
Studien an Frauen unterschiedlicher ethnischer Zugehörigkeit ergaben sowohl in der Pharmakokinetik als auch -dynamik von MPA nach subkutaner Verabreichung keine Unterschiede, wobei eine Studie über Pharmakokinetik und -dynamik von MPA an asiatischen Frauen separat durchgeführt wurde.
Auswirkungen auf das Körpergewicht
Eine Dosisanpassung von SAYANA, basierend auf dem jeweiligen Körpergewicht, ist nicht erforderlich. Die Auswirkung des Körpergewichts auf die Pharmakokinetik von MPA wurde in einer Gruppe von 42 Frauen, deren Body-Mass-Index (BMI) von 18,2 bis 46,0 kg/m2 reichte, ausgewertet. Die AUC0-91-Werte für MPA betrugen jeweils 68,5, 74,8 und 61,8 ng x Tag/ml bei Frauen in den entsprechenden BMI-Kategorien von < 25 kg/m2, > 25 bis < 30 kg/m2 und > 30 kg/m2. Die durchschnittliche MPA-Cmax betrug 1,65 ng/ml bei Frauen mit einem BMI von < 25 kg/m2, 1,76 ng/ml bei Frauen mit einem BMI von > 25 bis < 30 kg/m2 und 1,40 ng/ml bei Frauen mit einem BMI > 30 kg/m2. Die Bandbreite der Tiefstkonzentrationen (Cmin) und der Halbwertszeit von MPA war innerhalb der drei BMI-Gruppen vergleichbar.
Pharmakokinetische/ pharmakodynamische Zusammenhänge
Aus pharmakodynamischer Sicht hängt die Dauer der Ovulationsunterdrückung vom Beibehalten therapeutischer MPA-Konzentrationen über das 13-wöchige Dosierungsintervall hinweg ab.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Genotoxizität und zum karzinogenen Potenzial lassen die präklinischen Daten keine besondere Gefahr für den Menschen erkennen. Medroxyprogesteronacetat hat bei Tieren zu unerwünschten Wirkungen auf die Reproduktion geführt und ist daher während der Schwangerschaft kontraindiziert.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Macrogol 3350
Methyl-4-hydroxybenzoat (Ph. Eur.) (E 218) Propyl-4-hydroxybenzoat (Ph. Eur.) (E 216)
Natriumchlorid Polysorbat 80
Natriumdihydrogenphosphat 1 H2O Natriummonohydrogenphosphat-Dodecahydrat (Ph. Eur.)
Methionin
Povidon
Salzsäure und/ oder Natriumhydroxid zur Einstellung des pH-Werts Wasser für Injektionszwecke
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Ungeöffnet: 3 Jahre
Nach Anbruch: Zur sofortigen Verwendung. Nicht verbrauchter Inhalt ist zu verwerfen.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht im Kühlschrank aufbewahren. Nicht einfrieren.
6.5 Art und Inhalt des Behältnisses
SAYANA 104 mg/0,65 ml Injektionssuspension ist als Einweg-Fertigspritze aus Glas (Typ-1-Glas [Ph. Eur.]) mit einer Inhaltsmenge von 0,65 ml, verschlossen mit einem Gummistopfen (Bromobutylgummi) und einer Schutzkappe erhältlich. Eine 26G-3/8"-Injektionsnadel ist separat dazugepackt.
Packungsgrößen
Originalpackung mit 1 Fertigspritze zu 0,65 ml (N3)
Originalpackung mit 6 Fertigspritzen zu 0,65 ml
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Nur zur einmaligen Anwendung bestimmt.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Anweisungen zum Gebrauch und zur Handhabung
Vorbereitung
Frieren Sie das Arzneimittel nicht ein. Stellen Sie sicher, dass es vor der Injektion Raumtemperatur aufweist (um eine geeignete Viskosität der Suspension zu gewährleisten). Die folgenden Bestandteile müssen verfügbar sein (Abbildungen 6 und 7).
Abbildung 6
Fertig
spritze
Abbildung 7
Plastik
kappe
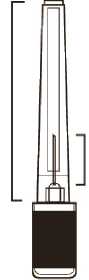
Nadel
Bevor Sie die Injektion vornehmen, überprüfen Sie SAYANA, wie alle anderen parenteral zu verabreichenden Arzneimittel, bitte visuell auf eventuelle Verunreinigungen oder eine Verfärbung des Inhalts.
Vorbereitung der Spritze
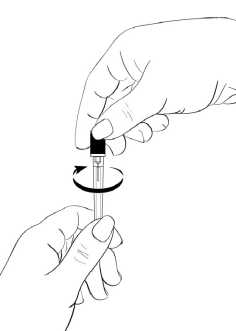
Drehen Sie das Ende der Schutzkappe vorsichtig von der Nadel, um die Versiegelung zu brechen (Abbildung 8). Legen Sie sie beiseite.
Abbildung 8
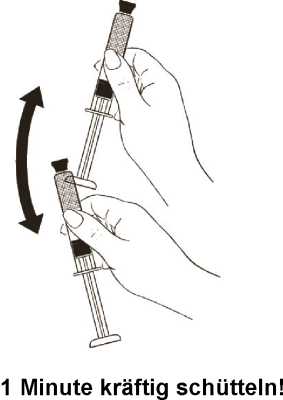
Halten Sie die Spritze nach oben gerichtet fest und schütteln Sie sie kräftig mindestens 1 Minute lang, damit die Suspension gut gemischt ist (Abbildung 9).
Abbildung 9
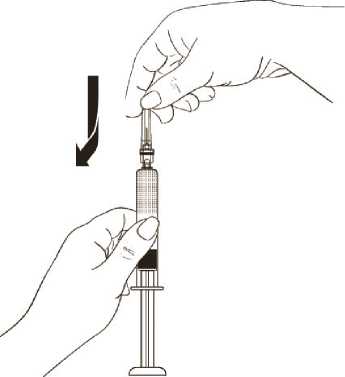
Entfernen Sie dann die Schutzkappe von der Spitze des Spritzenkörpers.
Halten Sie den Spritzenkörper und drücken Sie zur sicheren Befestigung der Nadel die Plastik-Nadelkappe mit einer leichten Drehbewegung vollständig herunter (Abbildung 10).
Abbildung 10
7. INHABER DER ZULASSUNG
PFIZER PHARMA PFE GmbH
Linkstr. 10
10785 Berlin
Tel.: 0800 8535555
Fax: 0800 8545555
8. ZULASSUNGSNUMMER
69347.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/ VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 30. November 2007 Datum der letzten Verlängerung der Zulassung: 06. Mai 2011
10. STAND DER INFORMATION
Juni 2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig spcde-6v17say-sui-104
spcde-6v17say-sui-104 20 29.03.2016