Sehcat
GE Healthcare


Radioaktives Arzneimittel
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
SeHCAT™
370 kBq Hartkapsel
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Der Wirkstoff ist: Tauroselcholsäure (75Se)
1 Kapsel enthält am Kalibriertermin:
370 kBq Tauroselcholsäure (75Se).
Spezifische Aktivität: 12,5 - 31,1 kBq/pg Tauroselcholsäure
Physikalische Eigenschaften des Radionuklids Selen-75:
Selen-75 wird unter Neutronenbeschuss von stabilem Selen-74 im Kernreaktor erzeugt und zerfällt unter Emission von Gammaquanten u. a. mit Energien von 265 keV, 136 keV, 280 keV und 121 keV mit einer Zerfallswahrscheinlichkeit von 59 %, 56 %, 25 % bzw. 16 % und einer Halbwertszeit von ca. 120 Tagen zu stabilem Arsen-75.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Hartkapsel
Orange-gelbe Gelatinekapsel
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Dieses Arzneimittel ist nur für diagnositische Zwecke bestimmt.
Tauroselcholsäure (75Se) wird zur Untersuchung der Gallensäurenresorption bzw. des Gallensäurenverlusts sowie zur Beurteilung der Ileumfunktion angewendet
• zur Differentialdiagnose chronischer Diarrhoen als Folge vermehrter Gallensäurenausscheidung, z. B. bei chronisch entzündlichen Erkrankungen des terminalen Ileums wie Morbus Crohn.
• zur Ermittlung der Ileumfunktion nach Operation im intestinalen Bereich und nach Strahlentherapie im Bereich des Abdomens.
• als zusätzlicher diagnostischer Test bei Patienten mit chronischer Diarrhoe, wenn Störungen der Gallensäurenresorption in Betracht zu ziehen sind.
4.2 Dosierung und Art der Anwendung
Dosierung
Erwachsene und ältere Patienten
Bei Erwachsenen und älteren Patienten (70 kg) wird im Normalfall eine Kapsel oral verabreicht.
Leberfunktionsstörung
Die anzuwendende Aktivität ist sorgfältig abzuwägen, da es bei diesen Patienten möglicherweise zu einer erhöhten Strahlenbelastung kommen kann.
Art der Anwendung Hartkapsel zum Einnehmen.
Vorbereitung des Patienten, siehe Abschnitt 4.4.
Bildgebung
1. Messung des Gallensäurenverlustes
Der Verlust von Gallensäuren aus dem endogenen Pool kann unter Verwendung von SeHCAT™ durch Bestimmung der Aktivitätsretention im Körper über einen Zeitraum von mehreren Tagen oder durch Bestimmung der Aktivitätsausscheidung mit den Faezes erfolgen. Die Ergebnisse können z.B. als „Ausscheidung je Zeitintervall" ausgedrückt werden, wenn mehrere Messungen vorgenommen werden. Einfacher ist es, sie als Prozentsatz der im Körper nach einer bestimmten Zeit (z.B. nach 7 Tagen) verbliebenen Radioaktivität anzugeben. Ein Ganzkörperzähler oder andere Zähltechniken können angewendet werden.
1.1. Messung der Tauroselcholsäure (75Se)-Retention im Ganzkörperzähler
Die Messung erfolgt wie bei Ganzkörperzählmethoden üblich. Nach Untergrundsubtraktion stellt der initiale Messwert des Patienten den 100-%-Wert (Wert zum Zeitpunkt to) dar. Nach 7 Tagen erfolgt die zweite Messung. Die Retentionsaktivität wird als Prozentsatz der Ausgangsaktivität ausgedrückt.
1.2. Messung der Tauroselcholsäure (75Se)-Retention mit einer unkollimierten
Großfeldkamera
Messgeometrie: Der Detektor ist symmetrisch zum Körperstamm des Patienten parallel zum Untersuchungstisch in der maximal möglichen Entfernung zum Patienten einzustellen (Abb. 1). Dadurch können Änderungen der Impulsraten bei kleinen Lageveränderungen in der Horizontalen oder Vertikalen vermieden werden.
Eine gleichbleibende Messanordnung muss gewährleistet sein (konstanter Abstand des Detektors zur Oberfläche der Patientenliege, Orientierung an markanten anatomischen Punkten, z.B. Jugulum).
Abb. 1: Messanordnung zu Retentionsstudien mit der unkollimierten Gammakamera
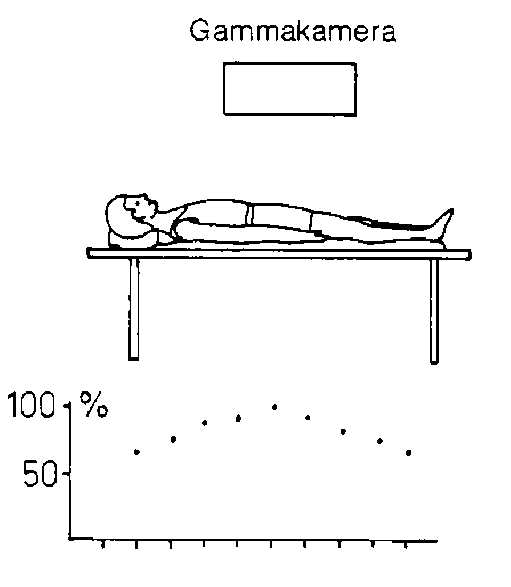
Um Störungen durch Untergrundaktivität aufgrund von Technetium-99m-Quellen zu vermeiden, sollten die Messungen im Photopeak der Gammaenergie von 280 keV bei einer Fensterbreite von 20 % erfolgen. Bei Patienten, bei denen gleichzeitig noch andere Untersuchungen mit Radionukliden durchgeführt werden, müssen Störungen durch andere Photopeaks verhindert oder bei der Berechnung berücksichtigt werden.
Die erste Ganzkörpermessung sollte 3 - 6 Stunden, jedoch in jedem Falle vor dem ersten Stuhlgang des Patienten nach Einnahme der Kapsel erfolgen (Verteilung der Aktivität im Darmbereich). Nach zweimaliger Messung der Untergrundaktivität sind die Messungen jeweils über ein vorgegebenes Zeitintervall (beispielsweise 300 Sekunden) in ventraler und dorsaler Sicht durchzuführen. Danach sollte die Untergrundaktivität nochmals gemessen werden.
Als Messwert (m) dient das geometrische Mittel der Nettoimpulsraten aus ventraler (mv) und dorsaler (md) Sicht:
m = yj(mv )• (md )
Nach 7 Tagen erfolgt die zweite Messung. Für die Zerfalls ko rrektur kann der am Tag 7 ermittelte Messwert mit 1,04 multipliziert werden. Die Retentionsaktivität wird als Prozentsatz der Ausgangsaktivität ausgedrückt.
Ergebnisse: Bei Verabreichung einer Aktivität von 370 kBq sind zum Zeitpunkt der ersten Messung Nettoimpulsraten von etwa 6000 Impulsen/Sekunde zu erwarten.
Bei normaler enteraler Resorption von SeHCAT™ ergibt sich ein monoexponentieller Abfall der Retention mit einer Halbwertszeit von > 2,5 Tagen bzw. ein Retentionswert nach 7 Tagen von >19 %.
1.3. Messung der Tauroselcholsäure (75Se)-Retention an einem Messplatz zur Bestimmung der Nierenclearance mit zwei unkollimierten Obertischsonden Messgeometrie: Positionierung der 3"-Sonden siehe Abb. 2. Ansonsten gilt die Beschreibung unter 1.2.
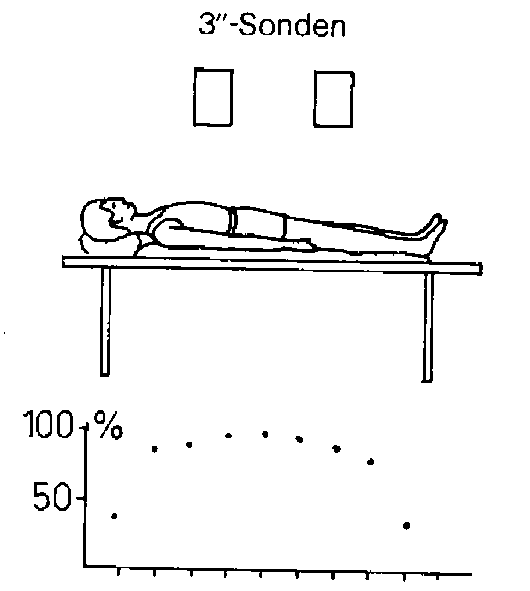
Durchführung der Messung wie 1.2. Als Messwert dient das geometrische Mittel der Nettoimpulsraten beider Sonden aus ventraler und dorsaler Sicht.
Ergebnisse: Bei Verabreichung einer Aktivität von 370 kBq sind zum Zeitpunkt der ersten Messung Nettoimpulsraten von etwa 250 Impulsen/Sekunde zu erwarten. Ansonsten gilt 1.2.
1.4. Quantitative Bestimmung der Sekretion von Tauroselcholsäure (75Se) in die Gallenblase mit Hilfe der kollimierten Gammakamera
Die durch die Leber sezernierten Gallensäuren werden im terminalen Ileum rückresorbiert. Im enterohepatischen Kreislauf der Gallensäuren steht die Gallenblase bei intakter Funktion als Depot zur Verfügung. Lässt sich in diesem Depot unter Bedingungen der Nahrungskarenz vorübergehend mehr als 80 % der an Gallensäuren fixierten Aktivität wiederfinden, ist eine Resorptionsstörung im terminalen Ileum ausgeschlossen. Durch diese Voruntersuchung kann ein Großteil von Patienten mit normaler Ileumfunktion maximal 6 Stunden nach Kapselgabe von weiteren Messungen ausgeschlossen werden.
Durchführung der Untersuchung:Nach oraler Gabe der Kapsel werden statische Szintigramme über dem Bereich des Magens in ventraler und dorsaler Sicht aufgezeichnet. (Kollimation der Gammakamera für die Gammaenergie von 280 keV). Bei vorgegebenen Impulsraten werden anschließend Leerbilder mit gleicher Laufzeit gespeichert. Innerhalb der „Region of Interest" (ROI), welche die im Magen befindliche Kapsel umschließt, werden die Nettoimpulsraten ermittelt und das geometrische Mittel gebildet.
m = sj(m\ - mv) • (m2 - md)
m1 = Bruttoimpulsrate ventral (innerhalb der ROI) mv = Nulleffekt ventral (innerhalb der ROI) m2 = Bruttoimpulsrate dorsal (innerhalb der ROI) md = Nulleffekt dorsal (innerhalb der ROI)
Im Abstand von etwa 30 Minuten während maximal 6 Stunden werden weitere Szintigramme über dem Bereich der Gallenblase ebenfalls in ventraler und dorsaler Sicht
aufgezeichnet und das geometrische Mittel der Nettoimpulsraten über der Gallenblase bestimmt. Es muss darauf geachtet werden, dass keine Überlagerungen von Darmaktivität innerhalb der ROI miterfasst werden.
g = J(gl - gv) -(g2 - gd)
Messergebnisse: Erreicht g einen Wert > 80 % von m, liegt keine Störung der Gallensäurenresorption vor.
Erreicht g keinen Wert > 80 %, ist dies nicht beweisend für eine Resorptionsstörung des terminalen Ileums.
Fehlermöglichkeiten: Dysfunktion der Gallenblase, Leberfunktionsstörung. Hierfür ist die Untersuchung nach Verfahren 1.2 bzw. 1.3 fortzusetzen.
Nach Abschluss der Untersuchung kann zur weiteren Reduzierung der an sich geringen Strahlenexposition die Ausscheidung der Aktivität mittels Cholestyramin beschleunigt werden.
2. Messung der ausgeschiedenen Aktivität
Nach Gabe der Kapsel muss eine komplette Stuhlsammlung über einen Zeitraum von 7 Tagen erfolgen. Auf Kooperativität des Patienten ist zu achten. Die Messung der Stuhlproben wird in einem Gamma-Counter durchgeführt. Eine gleichbleibende Messanordnung muss sichergestellt sein.
Stuhlproben von Patienten, bei denen gleichzeitig andere Untersuchungen mit Radionukliden durchgeführt werden, sollten nicht gemessen werden, es sei denn, die Ausscheidung des anderen Radionuklids ist vernachlässigbar gering oder die Messvorrichtung kann so eingestellt werden, dass selektiv 75Se-Photonenemissionen erfasst werden.
4.3 Gegenanzeigen
• Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
• Schwangerschaft.
Kinder und Jugendliche
Die Anwendung von SeHCAT™ ist bei Kindern kontraindiziert. Über die Anwendung von Tauroselcholsäure (75Se) bei Kindern liegen keine Daten vor.
Patienten mit schweren Leberfunktionsstörungen oder Cholestase
Die Anwendung von SeHCAT™ ist bei diesen Patienten wegen der erhöhten Strahlenexposition der Leber kontraindiziert.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen bei der Anwendung
Schwangerschaft, siehe Abschnitt 4.6.
Möglichkeit von Überempfindlichkiets- und anaphylaktischen Reaktionen Bei Auftreten von Überempfindlichkeitsreaktionen, einschließlich anaphylaktischer Reaktionen, darf keine weitere Zufuhr des Arzneimittels erfolgen. Falls notwendig, sind entsprechende Gegenmaßnahmen einzuleiten. Um im Notfall unverzüglich reagieren zu können, sollten entsprechende Instrumente (u. a. Trachealtubus und Beatmungsgerät) und Medikamente griffbereit sein.
Individuelle Nutzen/Risiko Abwägung
Bei jedem Patienten ist sorgfältig zwischen dem zu erwartenden Nutzen und dem mit der Strahlenexposition verbundenen Risiko abzuwägen. Um die benötigte diagnostische
Information zu erhalten, darf die anzuwendende Aktivität nicht höher als erforderlich bemessen werden.
Leberfunktionsstörung
Bei diesen Patienten ist eine sorgfältige Abwägung des Nutzen/Risiko-Verhältnisses erforderlich, da es zu einer erhöhten Strahlenbelastung kommen kann.
Vorbereitung des Patienten
a. Der Patient muss mindestens 6 Stunden vor dem Einnehmen der Kapsel nüchtern bleiben.
b. Während der Einnahme der Kapsel sollte der Patient sitzen oder stehen.
c. Vor dem Einnehmen der Kapsel muss der Patient ca. ^ Tasse (mindestens 15 ml) Wasser trinken.
d. Die Kapsel wird zusammen mit einer weiteren ^ Tasse (mindestens 15 ml) Wasser ohne Zerbeißen heruntergeschluckt.
e. Danach muss der Patient nochmals ^ bis 1 Tasse Wasser trinken.
f. Die nächste Mahlzeit sollte erst nach Messung des ersten Retentionswertes, bei Messung der Gallenblasenretention erst nach Ende dieser Untersuchung (ca. 3 - 4 Stunden nach Gabe der Kapsel) eingenommen werden.
Besondere Warnhinweise
Dieses Arzneimittel enthält 3,01 mmol/Kapsel (71,04 mg/Kapsel) Natrium. Bei Patienten, die eine kochsalzarme Diät einhalten müssen, ist dies zu berücksichtigen.
Hinweise zur Vermeidung von Gefahren für die Umwelt, siehe Abschnitt 6.6.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bei gleichzeitiger Gabe von Cholestyramin-haltigen Arzneimitteln wird die Ausscheidung von Tauroselcholsäure (75Se) beschleunigt. Eine Cholestyramintherapie ist daher mindestens 1 -2 Tage vor Anwendung von Tauroselcholsäure (75Se) bis zum Ende der Untersuchung abzusetzen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Frauen im gebärfähigen Alter
Falls es erforderlich ist, an einer Frau im gebärfähigen Alter ein radioaktives Arzneimittel anzuwenden, so ist festzustellen, ob eine Schwangerschaft vorliegt. Grundsätzlich muss von einer Schwangerschaft ausgegangen werden, wenn die Menstruation ausgeblieben ist. Im Zweifelsfall einer möglichen Schwangerschaft (wenn eine Menstruation ausgeblieben ist, die Periode sehr unregelmäßig ist, etc.) sollten alternative Untersuchungsmethoden ohne ionisierende Strahlung (falls vorhanden) angeboten werden.
Schwangerschaft
Die Anwendung von SeHCAT™ ist während der Schwangerschaft und Stillzeit kontraindiziert.
Nuklearmedizinische Untersuchungen bei Schwangeren beinhalten auch eine Strahlenexposition des Feten. Die Verabreichung von 370 kBq ergibt eine im Uterus absorbierte Dosis von 0,28 mGy. Strahlendosen über 0,5 mGy werden für die Fetus als potentielles Risiko betrachtet.
Über die Anwendung von Tauroselcholsäure (75Se) während der Schwangerschaft liegen keine Daten vor. Reproduktionsstudien an Tieren wurden nicht durchgeführt.
Stillzeit
Vor Anwendung eines Radiopharmazeutikums an einer stillenden Mutter ist zu prüfen, ob die Anwendung des Radionuklids auf einen Zeitpunkt nach dem Abstillen verschoben werden kann und welches Radiopharmazeutikum im Hinblick auf eine möglichst geringe Ausscheidung von Radioaktivität in die Muttermilch am besten geeignet ist. Falls eine Anwendung von Tauroselcholsäure (75Se) während der Stillzeit erforderlich ist, muss abgestillt werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Studien über die Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen wurden nicht durchgeführt.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt:
|
Sehr häufig: |
mehr als 1 von 10 Behandelten |
|
Häufig: |
weniger als 1 von 10, aber mehr als 1 von 100 Behandelten |
|
Gelegentlich: |
weniger als 1 von 100, aber mehr als 1 von 1000 Behandelten |
|
Selten: |
weniger als 1 von 1000, aber mehr als 1 von 10 000 Behandelten |
|
Sehr selten: |
weniger als 1 von 10 000 Behandelten |
|
Nicht bekannt: |
Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar |
Erkrankung des Immunsystems
Nicht bekannt: Überempfindlichkeit
Sehr selten wurde über Überempfindlichkeitsreaktionen nach Verabreichung von Tauroselcholsäure (75Se) berichtet; ein Kausalzusammenhang konnte jedoch nicht eindeutig nachgewiesen werden.
Ionisierende Strahlen können Krebs und Erbgutveränderungen verursachen. Da die effektive Strahlendosis bei Gabe einer Kapsel mit 370 kBq bei 0,26 mSv liegt, sind diese Nebenwirkungen mit geringer Wahrscheinlichkeit zu erwarten.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Überdosierungen sind unwahrscheinlich, da das Arzneimittel ausschließlich in klinischen Einrichtungen in Form einer Kapsel zum Einnehmen verabreicht wird. Im Falle einer Überdosierung mit SeHCAT kann durch Cholestyramingabe die Ausscheidung der Aktivität aus dem Körper beschleunigt werden. Eine Schätzung der effektiven angewendeten Dosis kann hilfreich sein.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe:
Andere Radiodiagnostika für das Leber- und Retikuloendothelialsystem,
ATC Code: V09D X01
Bei den in diagnostischen Verfahren zur Anwendung kommenden Substanzmengen sind nach bisherigen Erkenntnissen keine pharmakodynamischen Wirkungen durch Tauroselcholsäure zu erwarten.
5.2 Pharmakokinetische Eigenschaften
Verteilung, Aufnahme in die Organe, Halbwertszeit und Elimination
Tauroselcholsäure ist ein Gallensäureanalogon, das sich physiologisch identisch zu natürlich vorkommenden Gallensäurekonjugaten verhält.
Bei Gesunden werden nach oraler Gabe ungefähr 95 % der radioaktiv markierten Gallensäure während eines enterohepatischen Kreislaufs resorbiert, hauptsächlich im terminalen Ileum. Die Aktivität verteilt sich fast ausschließlich im Lumen der Gallengänge, des Darmes und der Leber.
SeHCAT™ erscheint in der Gallenblase zum ersten Mal etwa 73 Minuten nach oraler Verabreichung; die Substanz rezirkuliert anschließend etwa 5 Mal täglich.
Daten zur Ganzkörperretention in normalen Probanden zeigen, dass 97 bis 100 % der Tauroselcholsäure (75Se) mit einer biologischen Halbwertszeit von 2,6 Tagen und bis zu 3 % mit einer mittleren Halbwertszeit von 62 Tagen ausgeschieden werden.
5.3 Präklinische Daten zur Sicherheit
Im Tierversuch (Ratten) betrug der Sicherheitsabstand zwischen toxischen Dosen und der maximalen oralen Humandosis bei einmaliger Anwendung 10 000 : 1. Das Arzneimittel ist nicht für mehrmalige Anwendung bestimmt.
Untersuchungen zur Toxizität bei wiederholter Anwendung, zur Reproduktionstoxizität und zur Mutagenität sowie Langzeit-Karzinogenitätsstudien wurden nicht durchgeführt.
Sonstige Hinweise
Tauroselcholsäure (75Se) ist ein Analogon des natürlich vorkommenden
Gallensäurekonjugates Taurocholsäure. Untersuchungen haben gezeigt, dass das physiologische Verhalten der beiden Substanzen identisch ist.
Endogene Gallensäuren werden in der Leber gebildet, in die Gallenblase sezerniert und zum größten Teil mit Hilfe eines aktiven Transportmechanismus durch die Mucosa des Ileums resorbiert. Sie werden außerdem durch passive Diffusion im proximalen Dünndarm und Colon resorbiert. Die Konjugation mit Glycin oder mit Taurin ist vollzogen, wenn die Gallensäuren die Hepatozyten verlassen. Ein Teil der Gallensäurekonjugate wird durch intestinale Mikroorganismen dekonjugiert.
Das Taurinkonjugat ist gegenüber der Dekonjugierung resistenter als das Glycinäquivalent. Konjugierte Gallensäuren werden durch den passiven Mechanismus wesentlich langsamer resorbiert; daher erfolgt ihre Resorption hauptsächlich aktiv im terminalen Ileum.
Im Vergleich mit (14C) Taurocholsäure konnte gezeigt werden, dass SeHCAT™ wesentlich resistenter gegenüber der bakteriellen Dehydroxylierung und Dekonjugierung durch fäkale anaerobe Organismen ist als das natürlich vorkommende Analogon. Entfernung oder Bypass des terminalen Ileums verhindern die Resorption von SeHCAT™. Hieraus ist ersichtlich, dass SeHCAT™ ausschließlich durch den aktiven Mechanismus des terminalen Ileums resorbiert wird. Nach Einnahme einer Kapsel verteilt sich SeHCAT™ im endogenen Gallensäurenpool.
SeHCAT™ ermöglicht die Erfassung des Gallensäureverlustes aus dem endogenen Pool. Dies kann sowohl durch die klassische Messung der fäkalen Ausscheidung, als auch durch die unproblematische Bestimmung der Retention der Radioaktivität im Körper über einen Zeitraum von mehreren Stunden bis Tagen erfolgen. Die Resultate können z.B. als „Ausscheidung pro Zeitintervall" oder einfacher als Prozentsatz der im Körper verbliebenen Radioaktivität nach einer bestimmten Zeit (z. B. nach 7 Tagen) ausgedrückt werden. Die Angabe der biologischen Halbwertszeit von SeHCAT™ hat sich ebenfalls als leicht zugänglicher Parameter erwiesen, zumal die Ausscheidung des Gallensäureanalogons im klinisch relevanten Messzeitraum in guter Näherung als monoexponentiell angesehen werden kann.
Die biologische Halbwertszeit der Taurocholsäure wurde durch die Bestimmung der fäkalen Exkretionsrate der (14C) Taurocholsäure ermittelt. Die Resultate, die mit SeHCAT™ erzielt wurden, stimmen mit diesen Werten gut überein. Die untere Normbereichsgrenze für die Retention nach 7 Tagen beträgt 19 % verglichen mit einem Wert von 20 % bei (14C) Taurocholsäure. Entsprechend liegt die untere Normbereichsgrenze der biologischen Halbwertszeit bei 2,5 Tagen. Regional unterschiedliche Ernährungsgewohnheiten können leicht abweichende Resultate zur Folge haben.
Da SeHCAT™ spezifisch im Ileum resorbiert wird, kann eine krankhafte Veränderung dieses Darmabschnittes, die sich in einer eingeschränkten Gallensäurenresorption des terminalen Ileums äußert (z. B. Morbus Crohn) erfasst und quantifiziert werden.
Das Hauptsymptom der Gallensäurenmalabsorption ist die chronische chologene Diarrhöe, die auf den inhibitorischen Effekt der Gallensäuren auf die Wasserrückresorption im Colon zurückzuführen ist. Durch orale Applikation von Cholestyramin, eines unlöslichen gallensäurebindenden Ionenaustauschers, kann die unmittelbare Ursache dieser Diarrhö beseitigt werden. Da chronische Diarrhöen auch durch andere Ursachen wie z. B. durch die ulcerative Colitis oder durch Infektionen des Dünndarms bedingt sein können, eignet sich SeHCAT™ zur Abklärung der Ätiologie und somit für die Differentialdiagnose chronischer Diarrhöen.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Tauroselcholsäure, Natriummonohydrogenphosphat-Dihydrat (Ph.Eur.), Wasser für Injektionszwecke, Gelatine, Titandioxid (E171), Chinolingelb (E104), Erythrosin (E 127), Natriumdodecylsulfat, Essigsäure.
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Die Haltbarkeit beträgt 12 Wochen nach dem auf dem Etikett angegebenen Kalibriertermin (18 Wochen nach Herstellung).
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Das Arzneimittel nicht über 25 °C im Dunkeln aufbewahren. Nicht einfrieren.
Die Lagerung darf nur im Originalbleitopf oder einer entsprechenden anderen Abschirmung erfolgen. Die nationalen Bestimmungen für die Lagerung radioaktiven Materials sind einzuhalten.
6.5 Art und Inhalt des Behältnisses
SeHCAT ist eine Hartkapsel in einem Polystyrolbehälter, verschlossen mit einer Kappe aus Polyethylen, gehalten von Schaumstoffpads aus Polyether.
Eine Packung enthält 1 Hartkapsel mit 370 kBq am Kalibriertermin.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Allgemeine Warnhinweise
Radioaktive Arzneimittel dürfen nur von dazu berechtigten Personen in speziell dafür bestimmten klinischen Bereichen in Empfang genommen, gehandhabt und angewendet werden. Ihr Empfang, Lagerung, Anwendung, Transport und Entsorgung unterliegen den Bestimmungen der örtlich zuständigen Aufsichtsbehörde und/oder entsprechenden Genehmigungen.
Radioaktive Arzneimittel dürfen nur unter Vorkehrungen zum Schutz vor ionisierenden Strahlen und unter Beachtung pharmazeutischer Qualitätsanforderungen zubereitet und angewendet werden. Angemessene aseptische Vorsichtsmaßnahmen müssen eingehalten werden.
Die Anwendung sollte so erfolgen, dass das Risiko einer Kontamination durch das Arzneimittel sowie einer Strahlenbelastung der Anwender auf ein Minimum reduziert werden. Geeignete Abschirmungsmaßnahmen sind zwingend erforderlich.
Die Anwendung radioaktiver Arzneimittel setzt andere Personen Risiken durch externe Strahlung oder durch Kontamination durch Verschütten von Urin, Erbrochenem usw. aus. Daher sind Strahlenschutzmaßnahmen entsprechend der nationalen
Strahlenschutzverordnung zu treffen.
Nach Gebrauch sind sämtliche Materialien (fest und flüssig), die in Zusammenhang mit der Zubereitung und Anwendung von radioaktiven Arzneimitteln verwendet wurden, zu dekontaminieren oder als radioaktiver Abfall zu behandeln. Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
GE Healthcare Buchler GmbH & Co. KG Gieselweg 1 38110 Braunschweig Telefon 05307/930-0
Durchwahl Auftragsannahme
gebührenfrei: 0800/100 70 87 gebührenfrei: 0800/100 70 86
Telefon 05307/930-71 Telefax 05307/930-276
8. ZULASSUNGSNUMMER
28644.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Zulassung: 08. Juni 2006 Datum der Verlängerung: 05. September 2012
10. STAND DER INFORMATION
März 2015
11. DOSIMETRIE
Dem biokinetischen Modell für die orale Verabreichung von SeHCAT™ (gemäß ICRP 57) liegt zugrunde, dass 97 % der verabreichten Aktivität im enterohepatischen System zirkulieren und dass 95 % davon bei jedem Zyklus im terminalen Ileum absorbiert werden. Die mittlere Transitzeit durch den Dünndarm vor der Absorption wird mit 3 Stunden und die Transitzeiten durch die Leber und die Gallenblase werden mit 0,4 bzw. 1,4 Stunden angenommen. Diese Annahmen führen zu einer Halbwertszeit der Ganzkörperretention von 2,7 Tagen. Bei den meisten klinischen Fragestellungen, für die SeHCAT™ benutzt wird (z. B. Morbus Crohn), führen die gestörte Absorption im Ileum und kürzere gastrointestinale Transitzeiten zu geringeren Dosen als im Normalfall. Bei Patienten mit fortgeschrittener Cholestase kann die Dosis der Leber jedoch bis zum 100fachen des Normalwerts betragen (bei 370 kBq Tauroselcholsäure [75Se]), somit bis zu 25 mSv. Aus diesem Grunde ist SeHCAT™ bei Cholestase kontraindiziert.
Gemäß dem biokinetischen Modell der ICRP-Publikation 57 und der aktualisierten Daten aus der ICRP-Publikation 80 ergeben sich folgende Strahlendosen:
Absorbierte Dosis je Einheit der angewendeten Aktivität (mGy/MBq)
|
Organ |
Erwachsene |
|
Nebennieren |
0,32 |
|
Blasenwand |
0,33 |
|
Knochenoberfläche |
0,23 |
|
Gehirn |
0,048 |
|
Brust |
0,077 |
|
Gallenblasenwand |
6,4 |
|
Magen |
0,42 |
|
Dünndarm |
1,9 |
|
Dickdarm |
2,0 |
|
oberer Dickdarm |
1,9 |
|
unterer Dickdarm |
2,1 |
|
Herz |
0,33 |
|
Nieren |
0,50 |
|
Leber |
0,69 |
|
Lunge |
0,24 |
|
Muskulatur |
0,20 |
|
Oesophagus |
0,11 |
|
Ovarien |
1,0 |
|
Bauchspeicheldrüse |
0,45 |
|
Rotes Knochenmark |
0,29 |
|
Haut |
0,075 |
|
Milz |
0,30 |
|
Testes |
0,092 |
|
Thymus |
0,11 |
|
Schilddrüse |
0,069 |
|
Uterus |
0,75 |
|
übrige Organe |
0,26 |
|
Effektive Dosis (mSv/MBq) |
0,69 |
Die effektive Dosis beträgt 0,26 mSv nach Gabe einer Kapsel mit 370 kBq Tauroselcholsäure (75Se) beim Erwachsenen (mit einem Gewicht von 70 kg). Die absorbierte Dosis in den höchst exponierten Organen (Gallenblase, Dünndarm und Dickdarm) beträgt dabei 2,4 mGy, 0,70 mGy bzw. 0,74 mGy.
Bei den meisten klinischen Untersuchungen, für die diese Substanz angewendet wird (z.B. bei Morbus Crohn) ist infolge einer beeinträchtigten Ileumresorption und einer kürzeren Magen-Darm-Passage die Strahlenexposition im Vergleich zum Normalfall reduziert.
12. ANWEISUNGEN ZUR ZUBEREITUNG VON RADIOAKTIVEN ARZNEIMITTELN
Nicht zutreffend.
13. WEITERE INFORMATIONEN
Hersteller
GE Healthcare Limited Amersham Place Little Chalfont Buckinghamshire HP79NA Großbritannien
14. VERKAUFSABGRENZUNG
Verschreibungspflichtig
SeHCAT ist eine Marke der GE Healthcare
GE und GE Monogram sind Marken der General Electric Company
12