Septopal-10Er-Kette
7875XX1000DEF_01
Fachinformation BIOMET
Septopal®-10er-Kette Septopal®- 30er-Kette Septopal®- 60er-Kette Septopal®-10er-Minikette Septopal®- 20er-Minikette
1. Bezeichnung der Arzneimittel
Handelsname:
Septopal®-10er-Kette Septopal®- 30er-Kette Septopal®- 60er-Kette Septopal®-10er-Minikette Septopal®- 20er-Minikette
Dosierungsstärke:
Septopal®-Kette mit 10, 30 und 60 Kugeln Septopal®-Minikette mit 10 und 20 ovalen Körpern
Darreichungsform:
Kette zur Implantation
2. Qualitative und quantitative Zusammensetzung
Septopal®-Kette:
Arzneilich wirksame Bestandteile:
1 Kugel (0 7mm) enthält 7,5 mg Gentamicinsulfat (entspr. 4,5 mg Gentamicinbase).
Andere Bestandteile:
1 Kugel (0 7 mm) besteht aus Methylmethacrylat-Polymer, Methylmethacrylat-ethylacrylat-Copolymer sowie Glycin und enthält 20 mg Zirconium(IV)-oxid (monoklin) als Röntgenkontrastmittel.
1 Kugelkette besteht aus 10, 30, oder 60 Kugeln von 7 mm Durchmesser, aufgereiht auf einem ca. 9 bzw. 28 bzw. 56 cm langen, polyfilen chirurgischen Draht. Dieser Draht enthält Eisen, Chrom, Nickel, Molybdän und Mangan.
Septopal®-Minikette:
Arzneilich wirksame Bestandteile:
1 ovaler Körper (ca. 3 x 5 mm) enthält 2,8 mg Gentamicinsulfat (entspr. 1,7 mg Gentamicinbase).
Andere Bestandteile:
1 ovaler Körper (ca. 3 x 5 mm) besteht aus Methylmethacrylat-Polymer, Methylmethacrylat-ethylacrylat-Copolymer sowie Glycin und enthält 3,9 mg Zirconium(IV)-oxid (monoklin) als Röntgenkontrastmittel.
Eine Septopal®-Minikette besteht aus 10 oder 20 ovalen Körpern, die auf einem ca. 10 bzw. 20 cm langen, polyfilen chirurgischen Draht aufgereiht sind. Dieser Draht enthält Eisen, Chrom, Nickel, Molybdän und Mangan.
Sonstige Bestandteile: siehe Ziff. 6.1
3. Darreichungsform
Kette zur Implantation
4. Klinische Angaben
4.1 Anwendungsgebiete
Zum temporären Einbringen in mit Gentamicin-empfindlichen Erregern infizierte Knochen und Weichteile im Rahmen der üblichen Operationsverfahren:
Knocheninfektionen:
z.B.: Posttraumatische Osteomyelitis, infizierte Osteosynthese, infizierte Pseudarthrose, infizierte Endoprothese, chronische hämatogene Osteomyelitis.
Weichteilinfektionen:
z.B.: Postoperative Wundinfektion und primäre Weichteilinfektionen (Infektionen nach orthopädischen Operationen, Gelenkinfektion nach korrigierender Knochenoperation, Gelenkempyem, infizierter Amputationsstumpf, arteriosklerotische und diabetische Gangrän, Weichteilabszess, Steißbeinfistel, subphrenischer Abszess, Pleuraempyem, septische Bursa, infizierte Sakralhöhle nach Rektumamputation, Infektion nach urologischer Operation, Dekubitalgeschwür, Gefäßchirurgie), sowie Weichteilinfektionen mit gleichzeitiger Osteomyelitis.
Präventive Anwendung bei Knochen- und Weichteilinfektionen:
z.B.: Perforierte und phlegmonöse Appendizitis, Rektumamputation, drittgradig offene Fraktur, Replantation.
Septopal®-Miniketten werden dort eingesetzt, wo die Septopal®-Ketten für die anatomischen Verhältnisse zu groß sind, z.B. in der Hand-, Kinder- und Kieferchirurgie.
Die allgemein anerkannten Richtlinien für den angemessenen Gebrauch von antibakteriellen Wirkstoffen sind bei der Anwendung von Septopal®-Ketten und Septopal®-Miniketten zu berücksichtigen.
4.2 Dosierung, Art und Dauer der Anwendung
Septopal®-Ketten und Septopal®-Miniketten sind verschreibungspflichtig.
Dosierung mit Einzel- und Tagesangaben Septopal®-Ketten
Der nach sorgfältiger operativer Revision des infizierten Knochen- bzw. Weichteilgewebes resultierende Defekt ist vollständig mit Septopal®-Ketten auszufüllen. Dazu sind im Allgemeinen Ketten mit 10-90 Kugeln erforderlich.
Septopal®-Miniketten
Der nach sorgfältiger operativer Revision des infizierten Knochen- bzw. Weichteilgewebes resultierende Defekt ist vollständig mit Septopal®-Miniketten auszufüllen.
Im Allgemeinen sind bis zu 20 ovale Körper als Septopal®-Minikette nötig, erforderlichenfalls können auch mehr Septopal®-Miniketten implantiert werden.
Art und Dauer der Anwendung
Septopal®-Ketten und Septopal®-Miniketten sind ausschließlich für die temporäre Applikation vorgesehen. Sie können folgendermaßen für die kurz- oder langfristige Applikation verwendet werden:
Knocheninfektionen - Kurzfristige Applikation:
Die Septopal®-Ketten/-Miniketten sollten intraoperativ unter Berücksichtigung der für die spätere Entfernung erforderlichen Zugrichtung eingelegt werden; die letzte Kugel / der letzte ovale Körper überragt das Hautniveau, so dass die Kette durch vorsichtiges, beständiges Ziehen entfernt werden kann.
Die Entfernung der Septopal®-Kette erfolgt im Allgemeinen nach 7 bis 10 Tagen, keinesfalls später als 2 Wochen nach der Operation. Eine schrittweise Entfernung der Septopal®-Kette über einige Tage ist ebenfalls möglich; d.h. Verkürzung der liegenden Kette ab dem 3. postoperativen Tag um jeweils 1-2, gegebenenfalls auch um mehrere Kugeln.
Die Enfernung der Septopal®-Minikette erfolgt im Allgemeinen nach 5 bis 7 Tagen. Eine schrittweise Entfernung der Septopal®-Minikette über einige Tage ist ebenfalls möglich; d.h. Verkürzung der liegenden Kette ab dem 2. postoperativen Tag um jeweils 1-2, gegebenenfalls auch mehrere ovale Körper.
Je weniger die Septopal®-Ketten/-Miniketten durch das sich postoperativ ausbildende Bindegewebe fixiert sind, desto leichter und schmerzärmer ist ihre Entfernung. Ist die Bindegewebsfixierung der Septopal®-Ketten/-Miniketten jedoch
bereits fortgeschritten, oder werden bei der Extraktion der Septopal®-Ketten/-Miniketten die bestehenden Gewebs-bedingungen nicht berücksichtigt, können sich ausnahmsweise ein(e) oder mehrere Kugeln/ovale(r) Körper vom Draht lösen; im Extremfall kann hierbei der Draht der Septopal®-Kette/-Minikette reißen. Dann sollte grundsätzl ich der Versuch gemacht werden, die im Körper verbliebenen einzelnen Kugeln/ovalen Körper mit dem Drahtrest zu entfernen. Sollten dazu jedoch ausgedehnte chirurgische Maßnahmen erforderlich werden, so können diese einzelnen Kugeln / ovalen Körper unter Berücksichtigung des Prinzips der Verhältnismäßigkeit ausnahmsweise auch belassen werden.
Knocheninfektionen - Längerfristige Applikation:
Bei der operativen Implantation wird die Septopal®-Kette/-Minikette vollständig unter das Hautniveau versenkt und nach ca. 1 bis 3 Monaten operativ komplett entfernt. Bei sanierten lokalen Verhältnissen wird gegebenenfalls eine Eigenspongiosaplastik angeschlossen.
Weichteilinfektionen - Kurzfristige Applikation:
Die Applikation der Septopal®-Ketten/-Miniketten geschieht wie unter „Knocheninfektionen, kurzfristige Applikation” angegeben; ihre Entfernung erfolgt bei dieser Indikation zweckmäßigerweise:
- zwischen dem 7. und spätestens 10. Tag nach der Operation im Falle der Septopal®-Ketten. Eine schrittweise Entfernung der Septopal®-Kette über einige Tage ist ebenfalls möglich; d.h. Verkürzung der liegenden Kette ab dem 3. postoperativen Tag um jeweils 1-2 Kugeln, gegebenfalls auch um mehrere Kugeln.
- zwischen dem 5. und spätestens 7. Tag nach der Operation im Falle der Septopal®-Miniketten. Eine schrittweise Entfernung der Septopal®-Minikette über einige Tage ist ebenfalls möglich; d.h. Verkürzung der liegenden Kette ab dem 2. postoperativen Tag um jeweils 1-2 ovale Körper, gegebenfalls auch um mehrere ovale Körper.
Es sollte stets ein Wundverschluss mit Überlaufdrain ohne Sog angestrebt werden, wodurch ein übermäßiger Sekretabfluss und damit ein Abfall der für die antibakterielle Wirkung erforderlichen Gentamicin-Konzentrationen am Ort des Infektionsgeschehens verhindert wird.
Auf keinen Fall dürfen Septopal®-Ketten/-Miniketten zusammen mit einer Spül-Saug-Drainage angewendet werden, da dies infolge des Gentamicin-Verlustes und der hygienischen Probleme zu einer Entwicklung von Gentamicinresistenten Erregerstämmen führen kann.
Anwendung bei Kindern
Zur Anwendung von Septopal®-Ketten/-Miniketten bei Kindern liegen keine Daten vor.
Anwendung von SeptopaP-Ketten/-Miniketten bei Patienten mit eingeschränkter Nierenfunktion
Bei der Anwendung der Septopal®-Ketten/-Miniketten gehen nur extrem geringe Mengen des Wirkstoffs Gentamicin ins Blut über, so dass eine spezielle Dosisanpassung für Patienten mit eingeschränkter Nierenfunktion nicht erforderlich ist. Bei Nierenfunktionsstörungen, die ein Nierenersatzverfahren (z.B. Hämodialyse) erforderlich machen, wird Gentamicin durch dieses Ersatzverfahren aus dem Serum entfernt.
4.3 Gegenanzeigen
Septopal®-Ketten/-Miniketten dürfen bei erwiesener Unverträglichkeit gegen Gentamicin oder einen der Bestandteile des Trägermaterials oder des chirurgischen Drahtes nicht angewendet werden.
4.4. Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Lokale Überempfindlichkeitsreaktionen sind im Einzelfall nicht auszuschließen. Je nach Schwere der Reaktion muss die Behandlung mit Septopal®-Ketten/-Miniketten abgebrochen werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Da bei der Anwendung der Septopal®-Ketten/-Miniketten nur extrem geringe Mengen des Wirkstoffs Gentamicin ins Blut übertreten, sind Wechselwirkungen mit anderen Arzneimitteln sehr unwahrscheinlich, sollten aber dennoch in Betracht gezogen werden.
Gentamicin / Muskeireiaxantien und Ether
Die neuromuskulär-blockierenden Eigenschaften der Aminoglykoside werden durch Ether und Muskelrelaxantien verstärkt. Dies ist in Erwägung zu ziehen, wenn Gentamicin gleichzeitig mit Muskelrelaxantien (Succinylcholin, Tubocurarin, Decamethonium), Anästhetika oder Zitratblut verabreicht wird. Durch Injektion von Calciumchlorid kann die Aminoglykosid-bedingte neuromuskuläre Blockade aufgehoben werden.
Gentamicin / Methoxyfluran-Anästhesie
Aminoglykoside können die nierenschädigende Wirkung von Methoxyfluran verstärken. Bei gleichzeitiger Anwendung sind schwerste Nephropathien möglich.
Gentamicin / andere potentiell nephro-oder ototoxische Arzneimittel
Wegen des erhöhten Nebenwirkungsrisikos sollten Patienten besonders überwacht werden, die gleichzeitig oder anschließend mit potentiell oto- oder nephrotoxischen Medikamenten behandelt werden wie z.B. Amphotericin B,
Colistin, Ciclosporin, Cisplatin, Vancomycin, Schleifendiuretika wie Etacrynsäure und Furosemid.
Bei Cisplatin enthaltenden Arzneimitteln ist zu beachten, dass noch 3 bis 4 Wochen nach Gabe dieser Substanzen die Nephrotoxizität von Gentamicin verstärkt sein kann.
Gentamicin / andere Antibiotika
Die gleichzeitige lokale Anwendung von ß-Laktamase-Antibiotika kann zu einer signifikanten gegenseitigen Inaktivierung führen. Anwendung bei Kindern
Zur Anwendung von Septopal®-Ketten/-Miniketten bei Kindern liegen keine Daten vor.
Anwendung von Septopa®-Ketten/-Miniketten bei Patienten mit eingeschränkter Nierenfunktion
Das Risiko von Wechselwirkungen wird auch für Patienten mit eingeschränkter Nierenfunktion als gering eingeschätzt, da nur extrem geringe systemische Belastungen nach Implantation von Septopal®-Ketten/-Miniketten auftreten.
Bei Nierenfunktionsstörungen, die ein Nierenersatzverfahren (z.B. Hämodialyse) erforderlich machen, wird Gentamicin durch dieses Ersatzverfahren aus dem Serum entfernt.
4.6 Fertilität, Schwangerschaft und Stillzeit
Fertilität
Es liegen keine Daten zur Auswirkung von Gentamicin auf die Fertilität vor.
Schwangerschaft
Es liegen keine hinreichenden Daten zur Anwendung von Gentamicin während der Schwangerschaft vor. Tierstudien haben eine reproduktionstoxische Wirkung von Gentamicin gezeigt (siehe 5.3). Gentamicin durchdringt die Plazentaschranke und erreicht im fetalen Gewebe und in der Amnionflüssigkeit messbare Konzentrationen. Es besteht die potentielle Gefahr, dass Gentamicin zu Schäden des Innenohrs und der Niere beim Feten führt. Deshalb sollte Gentamicin während der Schwangerschaft grundsätzlich nur bei vitalen Indikationen angewendet werden und wenn keine sichereren Behandlungsalternativen zur Verfügung stehen.
Stillzeit
Gentamicin geht in geringen Mengen in die Muttermilch über, und niedrige Konzentrationen wurden im Serum gestillter Säuglinge gefunden. Ist eine Anwendung von Septopal®-Ketten/-Miniketten in der Stillzeit erforderlich, sollte abgestillt werden. Beim gestillten Säugling können Durchfälle und eine Sprosspilzbesiedelung der Schleimhäute auftreten. An die Möglichkeit einer Sensibilisierung sollte gedacht werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen
Anwendung im Straßenverkehr sowie bei Arbeiten mit Maschinen und Arbeiten ohne sicheren Halt:
Es liegen bisher keine Hinweise vor, dass durch die Implantation von Septopal®-Ketten/-Miniketten die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zur Bedienung von Maschinen beeinträchtigt ist. Gleiches gilt auch für das Arbeiten ohne sicheren Halt. Alle anderen Einschränkungen im Rahmen des operativen Eingriffes bleiben davon unberührt.
4.8 Nebenwirkungen
Toxische Gentamicin-Nebenwirkungen sind nicht zu erwarten, da nach Anwendung von Septopal®-Ketten/-Miniketten nur extrem niedrige Gentamicin-Konzentrationen im Serum nachweisbar sind. Dennoch sollte das Auftreten folgender Gentamicin-spezifischer Nebenwirkungen in Erwägung gezogen werden (siehe Tabelle Seite 5).
Anwendung bei Kindern
Zur Anwendung von Septopal®-Ketten/-Miniketten bei Kindern liegen keine Daten vor.
Anwendung von Septopa®-Ketten/-Miniketten bei Patienten mit eingeschränkter Nierenfunktion
Das Risiko Wirkstoff-spezifischer Nebenwirkungen wird auch für Patienten mit eingeschränkter Nierenfunktion als gering eingeschätzt, da nur extrem geringe systemische Gentamicinkonzentrationen nach Implantation von Septopal®-Ketten/-Miniketten auftreten. Bei Nierenfunktionsstörungen, die ein Nierenersatzverfahren (z.B. Hämodialyse) erforderlich machen, wird Gentamicin durch dieses Ersatzverfahren aus dem Serum entfernt.
|
System organklassen |
Sehr häufig > 1/10 |
Häufig > 1/100, < 1/10 |
Gelegentlich > 1/1.000, < 1/100 |
> 1/10.000, < 1/1.000 |
Sehr selten < 1/10.000, nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) |
|
Erkrankungen der Nieren und Harnwege |
Einschränkung der glomerulären Filtrationsrate Klinische Zeichen einer Nierenschädigung sind: Proteinurie/Hämaturie, Zylindrurie, Oligurie, Erhöhung der Konzentrationen von Kreatinin und Harnstoff im Serum. | ||||
|
Erkrankungen des Nervensystems |
Schädigungen des Nervus statoacusticus (N VIII), wobei sowohl das Gleichgewichts- als auch das Hörorgan betroffen sein können. Bei den ototoxischen Reaktionen stehen vestibuläre Störungen im Vordergrund. Hörstörungen betreffen zuerst den Hochtonbereich und sind zumeist irreversibel. Wichtigster Risikofaktor ist eine vorbestehende Niereninsuffizienz. Symptome der ototoxischen Wirkungen sind z.B. Schwindel, Tinnitus, Minderung des Hörvermögens. Polyneuropathien und periphere Parästhesien sind nach Gabe von Septopal® Ketten/Miniketten bisher nicht beschrieben worden. | ||||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Überempfindlichkeitsreaktionen unterschiedlicher Schweregrade, wie Hautausschlag, Juckreiz und Urtikaria können auftreten. | ||||
|
Erkrankungen des Immunsystems |
Überempfindlichkeitsreaktionen auf das Implantat sind möglich. | ||||
|
Erkrankungen des Blutes und des Lymphsystems |
Folgende Erkrankungen wären aufgrund des Nebenwirkungsspektrums des Gentamicins möglich, sind aber bisher nach Implantation von Septopal® Ketten /Miniketten noch nicht beobachtet worden: Unter der Behandlung mit Gentamicin kann es selten zu einer Veränderung der Zahl der Blutplättchen (Thrombozytopenie) und der weißen Blutkörperchen (Leukopenie, Eosinophilie, Granulozytopenie) kommen. | ||||
|
Sehr selten kann bei hochdosierter Langzeitbehandlung (mehr als 4 Wochen) ein Syndrom mit Hypokaliämie, Hypokalzämie, Hypomagnesiämie auftreten. | |||||
|
Leber- und Gallenerkrankungen |
Folgende Erkrankungen wären aufgrund des Nebenwirkungsspektrums des Gentamicins möglich, sind aber bisher nach Implantation von Septopal® Ketten / Miniketten noch nicht beobachtet worden: | ||||
|
Ein reversibler Anstieg von Leberenzymen (Transaminasen, alkalische Phosphatase) sowie der Konzentration von Bilirubin im Serum ist nach Gentamicin-Injektionen gelegentlich beobachtet worden. |
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem BfArM anzuzeigen.
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
https://verbraucher-uaw.pei.de
4.9 Überdosierung
Bisher nicht bekannt.
Die Menge der zu applizierenden Septopal®-Ketten/-Miniketten richtet sich nach der Größe des Knochen- bzw. Weichteildefektes. Da bei der Anwendung von Septopal®-Ketten/-Miniketten nur extrem niedrige Gentamicinkonzentrationen im Serum auftreten, sind potentielle oto- und nephrotoxische Nebenwirkungen des Gentamicins nicht zu erwarten.
Anwendung bei Kindern
Zur Anwendung von Septopal®-Ketten/-Miniketten bei Kindern liegen keine Daten vor.
Anwendung von SeptopaP-Ketten/-Miniketten bei Patienten mit eingeschränkter Nierenfunktion
Das Risiko für Überdosierung wird auch für Patienten mit eingeschränkter Nierenfunktion als gering eingeschätzt, da nur extrem geringe systemische Gentamicinkonzentrationen nach Implantation von Septopal®-Ketten/-Miniketten auftreten. Bei Nierenfunktionsstörungen, die ein Nierenersatzverfahren (z.B. Hämodialyse) erforderlich machen, wird Gentamicin durch dieses Ersatzverfahren aus dem Serum entfernt.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe
Gentamicin ist ein parenterales Antibiotikum aus der Gruppe der Aminoglykoside. Es stellt ein Gemisch aus den strukturell sehr ähnlichen Homologen Gentamicin C1, C1a, C2, C2a und C2b dar.
ATC-Code:
J01GB03
Wirkungsweise
Der Wirkungsmechanismus von Gentamicin beruht auf einer Störung der Proteinbiosynthese am bakteriellen Ribosom durch Interaktion mit der rRNS und nachfolgender Hemmung der Translation. Hieraus resultiert eine bakterizide Wirkung.
Beziehung zwischen Pharmakokinetik und Pharmakodynamik
Die Wirksamkeit hängt im Wesentlichen von dem Quotienten aus maximaler Serumkonzentration (Cmax) und minimaler Hemmkonzentration (MHK) des Erregers ab.
Resistenzmechanismen
Eine Resistenz gegenüber Gentamicin kann auf folgenden Mechanismen beruhen:
• Enzymatische Inaktivierung: Die enzymatische Modifikationen der Aminoglykosidmoleküle ist der häufigste Resistenzmechanismus. Hierfür sind Acetyltransferasen, Phosphotransferasen oder Nukleotidyltransferasen verantwortlich, die zumeist plasmidkodiert sind.
• Verminderte Penetration und aktiver Efflux: Diese Resistenzmechanismen finden sich vor allem bei Pseudomonas aeruginosa.
• Veränderung der Zielstruktur: Modifikationen innerhalb der Ribosomen kommen nur gelegentlich als Ursache einer Resistenz vor.
Es besteht eine weitgehende Kreuzresistenz von Gentamicin mit anderen Aminoglykosidantibiotika.
Grenzwerte
Die Testung von Gentamicin erfolgt unter Benutzung der üblichen Verdünnungsreihe. Folgende minimale Hemmkonzentrationen für sensible und resistente Keime wurden festgelegt:
EUCAST (European Committee on Antimicrobial Susceptibility Testing) Grenzwerte
|
Erreger |
Sensibel |
Resistent |
|
Enterobacteriaceae |
< 2 mg/l |
> 4 mg/l |
|
Pseudomonas spp. |
< 4 mg/l |
> 4 mg/l |
|
Acinetobacter spp. |
< 4 mg/l |
> 4 mg/l |
|
Staphylococcus spp. |
< 1 mg/l |
> 1 mg/l |
|
Nicht speziesspezifische Grenzwerte* |
< 2 mg/l |
> 4 mg/l |
* Basieren hauptsächlich auf der Serumpharmakokinetik
Prävalenz der erworbenen Resistenz in Deutschland
Die Prävalenz der erworbenen Resistenz einzelner Spezies kann örtlich und im Verlauf der Zeit variieren. Deshalb sind - insbesondere für die adäquate Behandlung schwerer Infektionen - lokale Informationen über die Resistenzsituation erforderlich. Falls auf Grund der lokalen Resistenzsituation die Wirksamkeit von Gentamicin in Frage gestellt ist, sollte eine Therapieberatung durch Experten angestrebt werden. Insbesondere bei schwerwiegenden Infektionen oder bei Therapieversagen ist eine mikrobiologische Diagnose mit dem Nachweis des Erregers und dessen Empfindlichkeit gegenüber Gentamicin anzustreben.
Prävalenz der erworbenen Resistenz in Deutschland auf der Basis von Daten der letzten 5 Jahre aus nationalen Resistenzüberwachungsprojekten und -studien (Stand: Dezember 2008):
|
Üblicherweise empfindliche Spezies |
Von Natur aus resistente Spezies | |
|
Aerobe Gram-positive Mikroorganismen |
Aerobe Gram-positive Mikroorganismen | |
|
Staphylococcus aureus (Methicillin-sensibel) |
Enterococcus spp.§ | |
|
Staphylococcus saprophyticus° |
Streptococcus spp.§ | |
|
Aerobe Gram-negative Mikroorganismen |
Aerobe Gram-negative Mikroorganismen | |
|
Enterobacter aerogenes |
Burkholderia cepacia | |
|
Enterobacter cloacae |
Stenotrophomonas maltophilia | |
|
Escherichia coli # |
Anaerobe Mikroorganismen | |
|
Klebsiella oxytoca |
Bacteroides spp. | |
|
Klebsiella pneumoniae |
Clostridium difficile | |
|
Proteus vulgaris |
Andere Mikroorganismen | |
|
Salmonella enterica (Enteritis-Salmonellen) |
Chlamydia spp. | |
|
Serratia liquefaciens° |
Chlamydophila spp. | |
|
Serratia marcescens |
Legionella pneumophila | |
|
Spezies, bei denen erworbene Resistenzen ein Problem bei der Anwendung darstellen können |
Mycoplasma spp. | |
|
Ureaplasma urealyticum | ||
|
Aerobe Gram-positive Mikroorganismen | ||
|
Staphylococcus aureus | ||
|
Staphylococcus aureus (Methicillin-resistent) |
° Bei Veröffentlichung der Tabellen lagen keine aktuellen Daten vor. In der Primärliteratur, Standardwerken und Therapieempfehlungen wird | |
|
Staphylococcus epidermidis + | ||
|
Staphylococcus haemolyticus+ |
von einer Empfindlichkeit ausgegangen. + In mindestens einer Region liegt die Resistenzrate bei über 50%. | |
|
Staphylococcus hominis | ||
|
Aerobe Gram-negative Mikroorganismen |
§ Klinische Wirksamkeit für die Therapie der | |
|
Acinetobacter baumannii |
Enterokokken- und Streptokokken-Endokarditis in Kombination mit Penicillin belegt, wenn keine hochgradige Resistenz (Enterokokken) vorliegt. | |
|
Citrobacter freundii | ||
|
Morganella morganii |
# Auf Intensivstationen liegt die Resistenzrate bei >10%. | |
|
Pseudomonas aeruginosa | ||
|
Proteus mirabilis |
5.2 Pharmakokinetische Eigenschaften 5.2.1 Septopal®-Ketten
Im Tierversuch an Beagle-Hunden konnte in der Umgebung der Septopal®-Kugeln im Knochengewebe bis zu einer Entfernung von 1-1,5 cm eine hohe Gentamicin-Konzentration festgestellt werden (vgl. Abb. 1 und zugehörige Tabelle 2). Nach 6 Monaten war bei 12 untersuchten Hunden immer noch eine Gentamicin-Konzentration von durchschnittlich
9.3 pg/g (1,5-35,0 pg/g) im Bindegewebe und 4,5 pg/g (0,4-16,3 pg/g) im Knochen nachweisbar
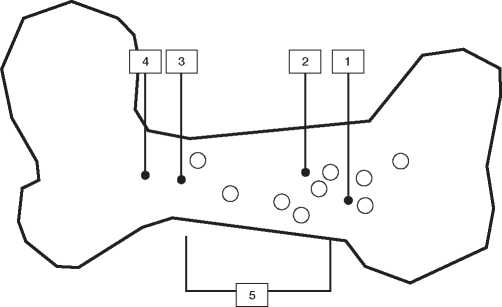
Abbildung 1
Gentamicin-Konzentration im Gewebe von Hunden (pg/g Gewebe, Feuchtgewicht)
1 bis 5 - Entnahmestellen der Gewebeproben
Tabelle 2 zu Abbildung 1 - Gentamicin-Konzentration im Gewebe von Hunden (pg/g Gewebe, Feuchtgewicht)
|
Implantierte Kugeln |
Gewebe | ||||||
|
Verweildauer in Tagen |
Anzahl |
Hämatom |
Binde gewebe |
Spongiosa |
Kortikalis | ||
|
1 |
1 |
2 |
3 |
4 |
5 | ||
|
3 |
17 |
148 |
17,8 |
3,6 |
6,8 | ||
|
3 |
15 |
112 |
15,2 |
3,6 |
13,0 | ||
|
7 |
13 |
200 |
24,0 |
14,5 |
4,0 |
20,1 | |
|
7 |
16 |
212 |
16,4 |
6,6 |
14,1 | ||
|
14 |
18 |
124 |
8,2 |
5,9 |
0,6 |
1,8 | |
|
14 |
17 |
104 |
5,2 |
2,1 |
0,8 |
3,8 | |
|
28 |
14 |
9,1 |
2,9 |
0,4 |
1,6 | ||
|
28 |
14 |
7,5 |
4,9 |
0,2 |
0,4 | ||
|
42 |
19 |
16,1 |
8,4 |
0,3 |
0,2 |
0,0 | |
|
42 |
19 |
7,7 |
4,9 |
0,9 |
0,5 |
0,0 | |
|
63 |
7 |
4,4 |
0,4 |
0,2 |
0,2 |
0,0 | |
|
63 |
14 |
4,4 |
0,9 |
0,0 |
0,0 |
0,0 | |
|
116 |
28 |
5,6 |
5,1 |
1,0 |
0,7 |
0,0 | |
|
116 |
39 |
5,4 |
2,6 |
0,2 |
0,2 |
0,0 | |
|
116 |
30 |
2,2 |
1,1 |
0,8 |
0,0 |
0,0 | |
|
174 |
15 |
8,2 |
1,4 |
0,3 |
0,0 | ||
|
174 |
12 |
11,6 |
3,9 |
0,0 |
0,0 | ||
Gentamicin-Konzentrationen im Gewebe (pg/g) nach Implantation von 14 - 180 Septopal®-Kugeln
|
Patient |
Implantationsdauer (Tage) |
Bindegewebe |
Spongiosa |
Kortikalis |
|
A.N. |
30 |
33,5 |
- |
1,0 |
|
K.C. |
47 |
11,0 |
- |
0 |
|
A.N. |
48 |
15,8 |
1,95 |
0,60 |
|
P.H. |
49 |
22,0 |
- |
- |
|
L.H. |
51 |
16,5 |
1,60 |
0,62 |
|
F.M. |
51 |
9,1 |
- |
- |
|
M.N. |
53 |
18,7 |
- |
0 |
|
A.D. |
63 |
10,0 |
4,3 |
3,0 |
|
L.H. |
70 |
25,0 |
3,3 |
- |
Tabelle 4
Gentamicin-Konzentrationen im Wundsekret (pg/ml) bei 10 Patienten nach Implantation von Septopal®-Kugeln in Knochenhöhlen
|
Patient |
Anzahl der Kugeln |
Sammelzeiten (Tage) | |||||||
|
i o |
1 - 2 |
2 - 3 |
3 - 4 | ||||||
|
ml |
pg/ml |
ml |
pg/ml |
ml |
pg/ml |
ml |
pg/ml | ||
|
B.A. |
180 |
650 |
35,9 |
540 |
56,9 |
200 |
71,3 |
180 |
58,0 |
|
R.M. |
90 |
60 |
89,0 |
150 |
36,7 |
60 |
124,0 |
50 |
124,5 |
|
K.C. |
11 |
150 |
9,5 |
50 |
20,5 |
3 |
8,2 |
6 |
5,3 |
|
S.J. |
30 |
30 |
72,5 |
14 |
45,9 |
10 |
40,0 |
16 |
30,2 |
|
O.A. |
90 |
450 |
41,0 |
75 |
36,0 |
60 |
42,7 |
35 |
28,0 |
|
H.J. |
90 |
350 |
17,8 |
125 |
15,1 |
60 |
18,2 |
60 |
25,1 |
|
H.F. |
90 |
350 |
26,6 |
100 |
91,7 |
50 |
78,4 |
30 |
19,5 |
|
K.B. |
87 |
560 |
59,0 |
15 |
268,8 |
50 |
345,6 |
15 |
268,8 |
|
P.H. |
57 |
200 |
51,4 |
30 |
70,5 |
5 |
33,9 |
3 |
14,3 |
|
J.H. |
60 |
155 |
55,6 |
80 |
30,0 |
50 |
22,6 |
5 |
14,7 |
Gentamicin-Konzentrationen im Serum (pg/ml) bei 10 Patienten nach Implantation von 80 bis 180 Septopal®-Kugeln in Knochenhöhlen
|
Patient |
Anzahl der Kugeln |
Sammelzeiten | |||
|
Stunden |
Tage | ||||
|
1 |
4 |
24 |
2 | ||
|
H.F. |
90 |
0 |
Spur |
Spur |
Spur |
|
K.B. |
87 |
0 |
0 |
0,07 |
Spur |
|
F.A. |
135 |
Spur |
0,05 |
0,12 |
0,30 |
|
H.S. |
90 |
Spur |
0,07 |
0,09 |
0,05 |
|
B.B. |
90 |
Spur |
Spur |
Spur |
Spur |
|
H.J. |
90 |
0 |
Spur |
0,50 |
Spur |
|
R.M. |
90 |
Spur |
Spur |
0,10 |
0,48 |
|
B.A. |
180 |
0,1 |
Spur |
Spur |
Spur |
|
G.P. |
120 |
Spur |
Spur |
Spur |
Spur |
|
S.J-L. |
80 |
Spur |
Spur |
Spur |
Spur |
Tabelle 6
Gentamicin-Konzentrationen im Urin (pg/ml) bei 10 Patienten nach Implantation von Septopal®-Kugeln in Knochenhöhlen
|
Patient |
Anzahl der Kugeln |
Sammelzeiten | ||||
|
Stunden |
Tage | |||||
|
6 - 24 |
1 - 2 |
3 - 4 |
5 - 6 |
9 - 10 | ||
|
F.A. |
135 |
4,5 |
4,9 |
1,1 |
9,3 | |
|
B.A. |
180 |
2,5 |
2,2 |
1,0 | ||
|
J.H. |
60 |
2,2 |
1,9 |
6,7 |
6,7 |
2,1 |
|
H.S. |
90 |
5,3 |
3,8 |
6,6 |
4,7 |
1,9 |
|
H.J. |
90 |
3,3 |
5,0 |
3,9 |
4,0 |
1,5 |
|
St.U. |
60 |
2,2 |
3,1 |
6,3 |
2,3 |
2,7 |
|
D.F. |
60 |
2,1 |
0 |
0,9 |
1,5 |
1,0 |
|
S.J. |
80 |
1,2 |
4,5 |
1,5 |
1,5 |
0,9 |
|
G.P. |
120 |
0,5 |
1,5 |
2,6 |
1,2 |
1,3 |
|
B.B. |
90 |
2,1 |
1,8 |
2,9 |
1,0 |
2,1 |
Wie Tabelle 3 zeigt, wurden beim Menschen auch nach 30-70 Tagen im Gewebe noch bakterizide Antibiotikumkonzentrationen gemessen. Es muss allerdings darauf hingewiesen werden, dass die Septopal®-Ketten im Allgemeinen zwischen dem 7. und 14. Tag nach der Operation gezogen werden sollten (vgl. Tabelle 3).
Ein Maß für den hohen lokalen Antibiotikumspiegel ist die Gentamicin-Konzentration im Wundsekret. Bei 10 Patienten wurden in den ersten 4 postoperativen Tagen bis zu 345,6 pg/ml nachgewiesen (vgl. Tabelle 4).
Im Serum und Urin dagegen blieben die Konzentrationen sehr gering (Serum: niedriger als 0,5 pg/ml; Urin: weniger als 10 pg/ml) (vgl. Tabellen 5 und 6). Die niedrigen Konzentrationen im Serum und Urin deuten auf eine minimale systemische Konzentration hin, so dass bei normaler oder eingeschränkter Nierenfunktion das Risiko Gentamicin-spezifischer Nebenwirkungen als sehr gering einzuschätzen ist.
Bei Nierenfunktionsstörungen, die ein Nierenersatzverfahren (z.B. Hämodialyse) erforderlich machen, wird Gentamicin durch dieses Ersatzverfahren aus dem Serum entfernt.
5.2.2 Septopal®-Miniketten
Tierversuch:
Im Tierversuch an Kaninchen-Tibiaknochen (Rasse: Weiße Neuseeländer) konnte in der Umgebung der ovalen Körper 28 Tage nach deren Implantation in einer Entfernung von 1-2 cm 0,28-7,44 pg Gentamicin/g Knochenmark gemessen werden. In der unmittelbar angrenzenden Spongiosa wurden zwischen 7,6 und 48,3 pg/g gefunden. In der Innenschicht der Kortikalis 0,72-3,7 pg/g und in der Außenschicht < 0,2-0,92 pg/g.
Mensch/Wundsekret:
Ein Maß für die hohen lokalen Antibiotikumspiegel ist die Gentamicin-Konzentration im Wundsekret. Bei insgesamt 40 Patienten wurden nach Implantation von 10-60 ovalen Körpern der Septopal®-Minikette Konzentrationen bis zu 403 pg Gentamicin/ml Wundsekret nachgewiesen.
Mensch/Serum und Urin:
Im Unterschied zum Wundsekret blieben in Serum und Urin die Gentamicin-Konzentrationen sehr gering (Serum: < als 0,42 pg/ml; Urin < 4,8 pg/ml).
Die niedrigen Konzentrationen im Serum und Urin deuten auf eine minimale systemische Konzentration hin, so dass bei normaler oder eingeschränkter Nierenfunktion das Risiko Gentamicin-spezifischer Nebenwirkungen als sehr gering einzuschätzen ist.
Bei Nierenfunktionsstörungen, die ein Nierenersatzverfahren (z.B. Hämodialyse) erforderlich machen, wird Gentamicin durch dieses Ersatzverfahren aus dem Serum entfernt.
5.3 Präklinische Daten zur Sicherheit
Die toxikologischen Eigenschaften entsprechen qualitativ denen des Gentamicins. Aufgrund der niedrigen systemischen Gentamicinkonzentration sind toxische Wirkungen bei der Therapie mit Septopal®-Ketten/-Miniketten nicht zu erwarten (s. Ziff. 5.2 Pharmakokinetische Eigenschaften).
Gentamicin ist wie alle Aminoglykosidantibiotika potentiell oto- und nephrotoxisch.
Bisherige in-vitro Tests mit Gentamicin ergaben keine Hinweise auf ein klinisch relevantes genotoxisches Potential. Gentamicin zeigte in Ratten (i.m. Verabreichung sehr hoher Dosen (75 mg/kg KG)) zu verschiedenen Zeitpunkten der Gestation eine transplazentare Nierentoxizität. In Meerschweinchen führte die tägliche i.m. Gabe von 4 mg/kg KG Gentamicin von Tag 48 bis 54 der Gestation zu einer vorübergehenden transplazentaren Nierentoxizität.
Von anderen Aminoglykosiden ist bekannt, dass sie zu einer Innenohrschädigung des Feten führen können.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
- Zirconium(IV)-oxid (monoklin)
- Methylmethacrylat-Polymer
- Methylmethacrylat-ethylacrylat-Copolymer
- Glycin = Aminoessigsäure
- Polyfiler chirurgischer Draht, der Eisen, Chrom, Nickel, Molybdän und Mangan enthält.
Weitere Informationen unter 2. "Qualitative und quantitative Zusammensetzung".
6.2 Inkompatibilitäten
Auf keinen Fall dürfen Septopal®-Ketten/-Miniketten zusammen mit einer Spül/Saug-Drainage angewendet werden, da dies infolge des Gentamicin-Verlustes und der hygienischen Probleme zu einer Entwicklung von Gentamicinresistenten Erregerstämmen führen kann.
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Es sind keine besonderen Lagerungsbedingungen erforderlich.
Nach Öffnen des Aluminiumschutzbeutels ( = Beutel 3, s. Ziff. 6.5) darf das Produkt nicht mehr gelagert werden.
Bei einer Operation nicht gebrauchte Reste von Septopal®-Ketten/-Miniketten können nicht resterilisiert werden; sie sind deshalb zu verwerfen.
6.5 Art und Inhalt des Behältnisses
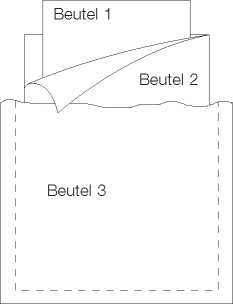
Jede Septopal®-Kette/-Minikette ist in einem innen wie außen sterilen Innenbeutel (Beutel 1, Peel-off-Packung) verpackt.
Beutel 1 ist in einem weiteren, innen sterilen Peel-off-Beutel verpackt (Beutel 2).
Beutel 2 befindet sich mit einem Trockenmittel in einem Aluminiumschutzbeutel (Peel-off), der weder innen noch außen steril ist (Beutel 3).
1 bzw. 5 dieser Beutel 3 werden zusammen mit der Packungsbeilage in eine Faltschachtel gepackt.
6.6. Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Siehe Empfehlungen in diesem Dokument, im besonderen Ziff. 4.2 und 6.4
7. Inhaber der Zulassung
Biomet Deutschland GmbH Gustav-Krone-Straße 2 D-14167 Berlin
8. Zulassungsnummern
Septopal®-10er-Kette Septopal®- 30er-Kette Septopal®- 60er-Kette Septopal®-10er-Minikette Septopal®- 20er-Minikette
Zulassungs-Nr. 2.00.02 Zulassungs-Nr. 2.00.01 Zulassungs-Nr. 2.00.03 Zulassungs-Nr. 2.00.04 Zulassungs-Nr. 2.00.05
9. Datum der Erteilung der Zulassung / Verlängerung der Zulassung
Septopal®-10er-Kette Septopal®- 30er-Kette Septopal®- 60er-Kette Septopal®-10er-Minikette Septopal®- 20er-Minikette
06.10.1980 /23.02.2005 24.07.1978 /22.04.2005
06.10.1980 /23.02.2005
05.03.1984 /23.02.2005
05.03.1984 /23.02.2005
10. Stand der Information
01.06.2015
13