Sixantone 30Mg Retardmikrokapseln Und Suspensionsmittel
FACHINFORMATION
(Zusammenfassung der Merkmale des Arzneimittels)
1. BEZEICHNUNG DES ARZNEIMITTELS
Sixantone® 30 mg Retardmikrokapseln und Suspensionsmittel
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Zweikammerspritze mit 352,9 mg Retardmikrokapseln und 1 ml Suspensionsmittel enthält:
30,0 mg Leuprorelinacetat, entsprechend 28,58 mg Leuprorelin
Sonstige Bestandteile mit bekannter Wirkung: Eine Zweikammerspritze enthält 5,0 mg Carmellose-Natrium
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Retardmikrokapseln und Suspensionsmittel
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Sixantone wird bei erwachsenen Männern zur palliativen Therapie des fortgeschrittenen hormonabhängigen Prostatakarzinoms angewendet.
Zur Behandlung des lokal fortgeschrittenen, hormonabhängigen Prostatakarzinoms; begleitend zur und nach der Strahlentherapie.
4.2 Dosierung und Art der Anwendung
Dosierung
Einmal sechsmonatlich 352,9 mg Retardmikrokapseln mit 30,0 mg Leuprorelinacetat suspendiert in 1 ml Suspensionsmittel s.c. applizieren.
Kinder und Jugendliche
Zur Anwendung des 6-Monats-Depots bei Kindern liegen zurzeit keine Erfahrungen vor. Für die Anwendung bei Kindern mit Pubertas praecox steht das 1-Monats-Depot Enantone Monats-Depot zur Verfügung.
Art der Anwendung
Die Suspension von Sixantone ist vor der Gabe frisch zuzubereiten (Hinweise zur Vorbereitung der Zweikammerspritze vor der Anwendung, siehe Abschnitt 6.6).
Sixantone wird einmal alle sechs Monate als subkutane Injektion verabreicht. Das Applikationsintervall sollte 168 Tage bis maximal 182 Tage (24 bis 26 Wochen) betragen.
Die Injektionsstelle sollte alle 6 Monate gewechselt werden. Dabei kann die subkutane Injektion in die Bauchhaut, das Gesäß oder z. B. den Oberschenkel erfolgen.
In der Regel ist die Therapie hormonabhängiger Prostatakarzinome mit Sixantone eine Langzeitbehandlung.
Klinische Daten haben gezeigt, dass bei lokal fortgeschrittenem, hormonabhängigem Prostatakarzinom, eine begleitend zur und nach der Strahlentherapie eingesetzte 3-jährige Androgenentzugstherapie einer 6-monatigen vorzuziehen ist (siehe auch Abschnitt 5.1). In medizinischen Leitlinien wird für Patienten (T3 - T4), die eine Strahlentherapie erhalten, eine Androgenentzugstherapie mit einer Behandlungsdauer von 2 - 3 Jahren empfohlen.
Eine versehentliche intraarterielle Injektion ist aufgrund tierexperimenteller Befunde (Thrombosierung kleiner Gefäße distal des Applikationsortes) unbedingt zu vermeiden.
4.3 Gegenanzeigen
- Überempfindlichkeit gegen Leuprorelin oder andere GnRH-Analoga, gegen Polymilchsäure oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile des Suspensionsmittels.
- Nachgewiesene Hormonunabhängigkeit des Karzinoms.
Sixantone ist nicht für die Anwendung bei Frauen bestimmt und ist während der Schwangerschaft und Stillzeit generell kontraindiziert.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Patienten mit Bluthochdruck sollten sorgfältig überwacht werden.
Bei Patienten, die mit GnRH Agonisten (Gonadotropin-Releasing-Hormon Agonisten), wie Leuprorel-in behandelt werden, besteht ein erhöhtes Risiko für Depressionen (die schwerwiegend sein können). Die Patienten sind über das Risiko aufzuklären, und im Falle auftretender Symptomatik entsprechend zu behandeln.
Nach chirurgischer Kastration bewirkt Sixantone keine weitere Absenkung des Testosteronspiegels.
Wegen des kurzfristigen Anstiegs des Serumtestosteronspiegels zu Beginn der Therapie, der zu einer vorübergehenden Verstärkung bestimmter Krankheitssymptome führen kann, sollten Patienten mit drohenden neurologischen Komplikationen, Wirbelsäulenmetastasen sowie Harnwegsobstruktionen während der ersten Behandlungswochen engmaschig überwacht werden.
Für die Initialphase der Behandlung sollte die zusätzliche Gabe eines geeigneten Antiandrogens erwogen werden, um so die möglichen Folgeerscheinungen des anfänglichen Testosteronanstiegs und die Verschlechterung der klinischen Symptomatik abzuschwächen.
Der Therapieerfolg sollte regelmäßig (insbesondere aber bei Anzeichen für eine Progression trotz adäquater Therapie) durch klinische Untersuchungen (rektale Austastung der Prostata, Sonographie, Skelettszintigraphie, Computertomographie) und durch Überprüfung der Phosphatasen bzw. des prostataspezifischen Antigens (PSA) und des Serumtestosterons kontrolliert werden.
Der unter der Langzeittherapie mit GnRH-Analoga bzw. Orchiektomie auftretende Hypogonadismus kann zu einer Osteoporose mit erhöhtem Frakturrisiko führen, wobei die Entwicklung einer Osteoporose nach Orchiektomie durch erhöhte Cortisolspiegel ausgeprägter ist als nach Applikation von
2
GnRH-Analoga. Bei Risikopatienten kann die zusätzliche Gabe eines Bisphosphonats eine Knochendemineralisierung verhindern.
Bei manchen Patienten, die mit LHRH Analoga behandelt werden, wurde über eine Veränderung der Glucosetoleranz berichtet. Eine engmaschigere Überwachung von Diabetikern ist während der Behandlung mit Sixantone zu empfehlen.
Eine Androgendeprivationstherapie kann die QT-Zeit verlängern. Bei Patienten mit einer QT-Zeitverlängerung in der Vorgeschichte oder mit einem Risiko für eine QT-Zeitverlängerung und bei Patienten, die gleichzeitig QT-zeitverlängernde Arzneimittel einnehmen (siehe Abschnitt 4.5), sollte daher vor der Anwendung von Sixantone eine sorgfältige Nutzen-Risiko-Bewertung inklusive des Risikos für die Entstehung von Torsade de pointes durchgeführt werden.
Die Anwendung von Sixantone kann bei Dopingkontrollen zu positiven Ergebnissen führen.
Sixantone enthält Natrium, aber weniger als 1 mmol (23 mg) Natrium pro Zweikammerspritze.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Da eine Androgendeprivationstherapie zu einer Verlängerung der QT-Zeit führen kann, sollte die gleichzeitige Anwendung von Sixantone mit anderen Arzneimitteln, die bekanntermaßen zu einer QT-Zeitverlängerung führen, oder Arzneimitteln, die ein Risiko zur Entstehung von Torsade de pointes haben, wie Antiarrhythmika der Klasse IA (z. B. Chinidin, Disopyramid) oder Klasse III (z. B. Amio-daron, Sotalol, Dofetilid, Ibutilid), Methadon, Moxifloxacin, Antipsychotika und andere sorgfältig geprüft werden (siehe Abschnitt 4.4).
4.6 Fertilität, Schwangerschaft und Stillzeit
Sixantone ist nicht für die Anwendung bei Frauen bestimmt und ist während der Schwangerschaft und Stillzeit generell kontraindiziert.
Fertilität bei Männern: Klinische und pharmakologische Studien an Männern haben gezeigt, dass die Unterdrückung der Fertilität spätestens 24 Wochen nach Absetzen einer kontinuierlichen Leuprorelin-Applikation voll reversibel war.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Wegen der insbesondere zu Therapiebeginn häufig auftretenden Müdigkeit, welche auch durch die zugrunde liegende Tumorerkrankung bedingt sein kann, kann dieses Arzneimittel auch bei bestimmungsgemäßem Gebrauch das Reaktionsvermögen so weit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen gering oder mäßig beeinträchtigt wird. Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Anfangs kommt es regelmäßig zu einem kurzfristigen Anstieg des Serumtestosteronspiegels, der zu einer vorübergehenden Verstärkung bestimmter Krankheitssymptome führen kann (Auftreten oder Zunahme von Knochenschmerzen, Harnwegsobstruktion und deren Folgen, Rückenmarkskompression, Muskelschwäche in den Beinen, Lymphödeme). Diese Zunahme der Beschwerden geht üblicherweise spontan zurück, ohne dass Sixantone abgesetzt werden muss.
Aufgrund des Entzuges der Geschlechtshormone kann es zum Auftreten von Nebenwirkungen kommen. Bei den Häufigkeiten zu Nebenwirkungen sind folgende Kategorien zugrunde gelegt: sehr häufig (>1/10), häufig (>1/100 bis <1/10), gelegentlich (>1/1.000 bis <1/100), selten (>1/10.000 bis <1/1.000), sehr selten (<1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
|
Erkrankungen des Immunsystems | |
|
Gelegentlich: |
Allgemeine allergische Reaktionen (Fieber, Juckreiz, Eosinophilie, Hautausschlag) |
|
Sehr selten: |
Anaphylaktische Reaktionen |
|
Stoffwechsel und Ernährungsstörungen | |
|
Häufig: |
Appetitabnahme/Appetitzunahme |
|
Selten: |
Veränderung einer diabetischen Stoffwechsellage (Erhöhung oder Senkung von Blutzuckerwerten) |
|
Psychiatrische Erkrankungen | |
|
Häufig: |
Depression, Stimmungsschwankungen |
|
Erkrankungen des Nervensystems | |
|
Häufig: |
Kopfschmerzen |
|
Selten: |
Schwindel, vorübergehende Geschmacksveränderungen |
|
Sehr selten: |
Wie auch bei anderen Arzneimitteln dieser Stoffklasse wurde in sehr seltenen Fällen über eine Apoplexie der Hypophyse nach initialer Verabreichung von Leuprorelin bei Patienten mit Hypophysenadenom berichtet. |
|
Herzerkrankungen | |
|
Nicht bekannt: |
Verlängerung der QT-Zeit (siehe Abschnitt 4.4 und 4.5) |
|
Gefäßerkrankungen | |
|
Sehr häufig: |
Hitzewallungen |
|
Gelegentlich: |
Blutdruckveränderungen (Hypertonie, Hypotonie) |
|
Erkrankungen des Gastrointestinaltrakts | |
|
Häufig: |
Übelkeit/Erbrechen |
|
Gelegentlich: |
Diarrhöe |
|
Erkrankungen der Haut und des Unterhautzellgewebes | |
|
Gelegentlich: |
Trockene Haut bzw. Schleimhaut, Nachtschweiß |
|
Selten: |
Alopezie |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | |
|
Sehr häufig: |
Knochenschmerzen |
|
Häufig: |
Auftreten von Gelenk- bzw. Rückenschmerzen, Muskelschwäche |
|
Erkrankungen der Geschlechtsorgane und Brustdrüse | |
|
Sehr häufig: |
Verminderung oder Verlust der Libido und der Potenz, Verkleinerung der Hoden |
|
Häufig: |
Gynäkomastie |
|
Gelegentlich: |
Testikuläre Schmerzen |
|
Erkrankungen der Nieren und Harnwege | |
|
Häufig: |
Nykturie, Dysurie, Pollakisurie |
|
Gelegentlich: |
Harnverhaltung |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort: | |
|
Sehr häufig: |
Reaktionen an der Injektionsstelle z. B. Rötung, Schmerzen, Ödeme, Juckreiz, die sich in der Regel auch bei fortgesetzter Behandlung zurückbilden. |
|
Nicht bekannt: |
In Einzelfällen trat ein Abszess an der Injektionsstelle auf. |
|
Sehr häufig: |
Vermehrtes Schwitzen |
|
Häufig: |
Müdigkeit, periphere Ödeme, Parästhesie, Schlafstörungen |
|
Untersuchungen: | |
|
Sehr häufig: |
Auftreten einer Gewichtszunahme |
|
Häufig: |
Anstiege der LDH, der Transaminasen, der Gamma-GT und der alkalischen Phosphatase, die jedoch Ausdruck der Grundkrankheit sein können |
|
Gelegentlich: |
Gewichtsabnahme |
Nach Zulassung wurde überwiegend in Japan über das Auftreten interstitieller Pneumonien berichtet.
Hinweise:
Die Reaktion auf die Sixantone -Therapie kann durch Messung der Serumspiegel von Testosteron, saurer Phosphatase und PSA (prostataspezifisches Antigen) kontrolliert werden. So steigt der Testosteronspiegel bei Behandlungsbeginn zunächst an und sinkt dann während eines Zeitraumes von zwei Wochen wieder ab. Nach zwei bis vier Wochen werden Testosteronspiegel erreicht, wie sie nach einer beidseitigen Orchiektomie beobachtet werden, und die über den gesamten Behandlungszeitraum bestehen bleiben.
Ein Anstieg saurer Phosphatasespiegel kann in der Anfangsphase der Therapie erfolgen und ist vorübergehender Natur. Gewöhnlich werden nach einigen Wochen wieder Normalwerte bzw. annähernde Normalwerte erreicht.
Der unter der Langzeittherapie mit GnRH-Analoga bzw. Orchiektomie auftretende Hypogonadismus kann zu einer Osteoporose mit erhöhtem Frakturrisiko führen (siehe Abschnitt 4.4). Bei Risikopatienten kann die zusätzliche Gabe eines Bisphosponats eine Knochendemineralisierung verhindern.
Im Fall von selten auftretenden Spritzenabszessen sollten die Testosteronspiegel überprüft werden, da eine unzureichende Resorption von Leuprorelin aus dem Depot mit einem möglichen Wiederansteigen des Testosteronspiegels resultieren kann.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Intoxikationssymptome wurden bisher nicht beobachtet.
Selbst bei Verabreichung von Dosen bis zu 20 mg Leuprorelinacetat pro Tag über zwei Jahre, die bei ersten klinischen Studien Anwendung fanden, konnten keine anderen bzw. neuen Nebenwirkungen gefunden werden, die sich von denen nach täglicher Applikation von 1 mg oder einer Applikation von 30mg alle 6 Monate unterschieden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: GnRH-Analoga ATC-Code: L02AE02
Leuprorelinacetat, der Wirkstoff von Sixantone, ist ein synthetisches Analogon des natürlich vorkommenden hypothalamischen "Releasing-Faktors" LHRH, der die Freisetzung der gonadotropen Hormone LH (luteinisierendes Hormon) und FSH (follikelstimulierendes Hormon) aus dem Hypophysenvorderlappen kontrolliert. Diese Hormone stimulieren ihrerseits die gonadale Steroidsynthese.
Im Gegensatz zum physiologischen LHRH, das pulsatil vom Hypothalamus freigesetzt wird, blockiert das auch als LHRH-Agonist bezeichnete Leuprorelinacetat bei therapeutischer Daueranwendung die LHRH-Rezeptoren der Hypophyse kontinuierlich und verursacht nach einer initialen, kurzfristigen Stimulation deren Desensibilisierung ("down regulation"). Als Folge kommt es zu einer reversiblen hypophysären Suppression der Gonadotropin-Freisetzung mit nachfolgendem Abfall der TestosteronSpiegel, und damit zu einer Beeinflussung des Wachstums des karzinomatös veränderten Prostatagewebes, das durch Dihydrotestosteron - gebildet durch Reduktion von Testosteron in den Prostatazellen - normalerweise stimuliert wird.
Die kontinuierliche Applikation von Leuprorelinacetat führt zu einer Abnahme der Anzahl und/oder der Empfindlichkeit (sogenannte "down regulation") der in der Hypophyse vorhandenen Rezeptoren und in der Folge zum Abfall der LH-, FSH- und DHT-Spiegel. Der Testosteronspiegel wird dabei in den Kastrationsbereich abgesenkt.
Auch in Tierversuchen konnte die hormonsenkende Wirkung und Wachstumshemmung von Prostatakarzinomen nachgewiesen werden.
Den experimentellen und klinischen Studien zufolge bewirkt die 6-monatliche Behandlung mit Sixan-tone nach anfänglicher Stimulation eine Hemmung der Gonadotropinfreisetzung.
Beim Mann bewirkt die subkutane Verabreichung von Sixantone einen anfänglichen Anstieg von LH (luteinisierendes Hormon) und FSH (follikelstimulierendes Hormon), gekennzeichnet durch einen passageren Spiegelanstieg von Testosteron und Dihydrotestosteron.
Da in Einzelfällen in den ersten drei Wochen eine damit zusammenhängende kurzfristige symptomatische Verschlechterung des Krankheitsbildes beobachtet wurde, ist bei Männern mit Prostatakarzinom die zusätzliche Gabe von Antiandrogenen zu erwägen.
Die Langzeittherapie mit Sixantone bewirkt bei allen Patienten eine Senkung der LH- und FSH-Spiegel; es werden beim Mann Androgenspiegel erreicht, wie sie nach einer beidseitigen Orchiekto-mie vorliegen. Diese Veränderungen treten meist zwei bis drei Wochen nach Therapiebeginn auf und sind über den gesamten Behandlungszeitraum manifest. Gegebenenfalls kann eine Orchiektomie durch eine Therapie mit Sixantone, das alle 6 Monate verabreicht werden muss, ersetzt werden. Kastrationsspiegel für Testosteron konnten bisher nach kontinuierlicher Gabe von Leuprorelinacetat über fünf Jahre gehalten werden.
Klinische Wirksamkeit
In einer multizentrischen, randomisierten Phase III Studie mit Leuprorelinacetat wurden 263 Patienten mit lokal fortgeschrittenem Prostatakarzinom der Stadien T3 - T4 oder pT3, N0, M0 ausgewertet. Eine Kombination aus Radiotherapie mit einer Langzeit-Androgenentzugstherapie über 3 Jahre erhielten 133 Patienten und eine alleinige dreijährige Androgenentzugstherapie mit Leuprorelinacetat 130 Patienten.
Basierend auf den ASTRO (Phoenix) Kriterien lag das 5-Jahres-Progressionsfreie Überleben bei
60,9 % (64,7 %) in der Kombinationstherapie im Vergleich zu 8,5 % (15,4 %) in der Gruppe mit allei-
6
niger Hormontherapie [p = 0,0001; (p = 0.0005)]. Entsprechend den ASTRO Kriterien lag das Progressionsrisiko 3,8 mal höher in der Gruppe mit alleiniger Hormontherapie (95 % CI [2,17; 6,49]).
Die mediane klinische oder biochemische progressionsfreie Überlebenszeit nach ASTRO Definition lag bei 641 Tagen (95 % CI [626; 812]) in der Gruppe mit alleiniger Androgenentzugstherapie und bei 2.804 Tagen (95 % CI [2090; -]; p < 0,0001) in der Gruppe mit Kombinationstherapie. Es ergaben sich weitere statistisch signifikante Unterschiede hinsichtlich einer lokoregionalen Progression [HR 3,6 (95 % CI [1,9; 6,8]; p < 0,0001)], metastatischer Progression (p < 0,018) und metastasenfreiem Überleben (p = 0,018) für die Gruppe mit Kombinationstherapie im Vergleich zur alleinigen Androgenentzugstherapie.
Die Ergebnisse dieser Studie konnten zeigen, dass eine 3-jährige Androgenentzugstherapie mit Leu-prorelinacetat in Kombination mit Strahlentherapie der alleinigen 3-jährigen Androgenentzugstherapie mit Leuprorelinacetat überlegen ist.
5.2 Pharmakokinetische Eigenschaften
Freisetzung
Der Wirkstoff Leuprorelinacetat wird nach Injektion der Depotsuspension Sixantone kontinuierlich aus dem Milchsäurepolymer über den Zeitraum von 6 Monaten freigesetzt. Das Polymer wird dabei wie chirurgisches Nahtmaterial resorbiert.
Resorption
Die Leuprorelinspiegel im Serum steigen nach einmaliger s.c. Applikation von Sixantone rasch an und fallen dann nach einigen Tagen auf ein Plateau ab. Innerhalb von 1,8 Stunden werden im Mittel maximale Serumspiegel von 102 ng/ml gemessen. In der Plateauphase befinden sich nachweisbare Spiegel im Serum bis > 26 Wochen nach der Applikation. Bei einigen Patienten waren Leuprorelinspiegel bis zu 30 Wochen nachweisbar. Abb. 1 zeigt den Verlauf des Leuprorelinspiegels nach einmaliger Gabe von Sixantone.
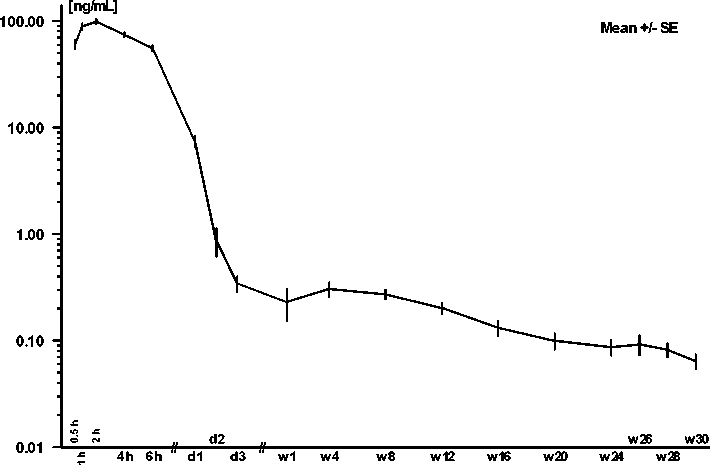
Abb.1: Leuprorelinspiegel im Serum nach einmaliger s.c. Applikation von 30,0 mg Leuprorelinacetat als Sixantone
Ein erster Wiederanstieg des Testosteronspiegels wird im Mittel nach 200 Tagen beobachtet, wenn keine weitere Injektion von Sixantone erfolgt.
Verteilung und Elimination
Das Verteilungsvolumen von Leuprorelin beträgt bei Männern 36 l, die totale Clearance liegt bei
139,6 ml/min. (bestimmt unter Anwendung von Enantone Monats-Depot).
Bei wiederholter Gabe kommt es zu einer anhaltenden Senkung des Testosteronspiegels in den Kastrationsbereich, ohne dass der Testosteronspiegel wie nach erstmaliger Injektion einen vorübergehenden Anstieg zeigt.
Patienten mit eingeschränkter Nierenfunktion/Leberfunktion
Bei Patienten mit eingeschränkter Nierenfunktion wurden nach Gabe von Leuprorelin (als Enantone Monats-Depot) teilweise höhere Leuprorelinserumspiegel gemessen, bei Patienten mit eingeschränkter Leberfunktion dagegen verminderte Werte. Klinisch scheint diese Beobachtung jedoch ohne Relevanz.
5.3 Präklinische Daten zur Sicherheit
Präklinische Studien mit Leuprorelinacetat zeigten bei beiden Geschlechtern Auswirkungen auf das Fortpflanzungssytem, die aufgrund der bekannten pharmakologischen Wirkungen zu erwarten sind. Diese Wirkungen sind im Prinzip nach einer Erholungsphase reversibel (siehe Abschnitt 5.1).
Leuprorelinacetat zeigte keine teratogene Wirkung. Aufgrund der pharmakologischen Wirkungen auf das Reproduktionssystem zeigte sich Embryotoxizität und -letalität bei Kaninchen.
Studien zur Karzinogenität wurden an Ratten und Mäusen über 24 Monate durchgeführt. Bei Ratten wurde nach subkutaner Injektion eine dosisabhängige Zunahme von Hypophysenadenomen bei Dosierungen von 0,6 bis 4 mg/kg/Tag beobachtet. Kein derartiger Effekt wurde bei Mäusen beobachtet, so dass der Effekt an Ratten als spezies-spezifisch angesehen werden kann.
Leuprorelinacetat wirkte nicht mutagen in einer Reihe von in vitro und in vivo Untersuchungen.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Retardmikrokapseln:
270,0 mg Polymilchsäure Mannitol (Ph.Eur.)
Suspensionsmittel:
Mannitol (Ph.Eur.)
Carmellose-Natrium Polysorbat 80 Essigsäure 99 %
Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Die Retardmikrokapseln und das Suspensionsmittel sind 36 Monate haltbar.
Bei Auftreten einer Verfärbung der Retardmikrokapseln und/oder Trübung des klaren Suspensionsmittels vor der Suspendierung darf die Zweikammerspritze nicht mehr verwendet werden. Nach der Zube-
8
reitung entsteht eine milchig-trübe Suspension.
Die chemische und physikalische Stabilität der gebrauchsfertigen Zubereitung wurde für 24 Stunden bei 25 °C nachgewiesen. Aus mikrobiologischer Sicht sollte die gebrauchsfertige Zubereitung sofort verwendet werden. Wenn die gebrauchsfertige Zubereitung nicht sofort verwendet wird, ist der Anwender für die Dauer und die Bedingungen der Aufbewahrung verantwortlich.
Vor der Injektion ist die Suspension erneut aufzuschütteln.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern. Zweikammerspritze im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
6.5 Art und Inhalt des Behältnisses
1 Zweikammerspritze mit 352,9 mg Retardmikrokapseln und 1 ml Suspensionsmittel
Die Zweikammerspritze (Glas EP Typ I) mit Luer-Lock-Verschluss (Polypropylen) und Stopfensystem (Chlorbutyl-Gummi) ist versiegelt in einer Blisterpackung.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Keine speziellen Anforderungen.
Anleitung zur Herstellung der Sixantone Suspension
1. Spritzenstempel bis zum Anschlag eindrehen.
2. Spritze mit der Kanüle senkrecht nach oben halten.
3. Das Stopfensystem langsam bis zur blauen Markierung vorschieben.
Dabei gelangt das Suspensionsmittel über den Bypass in die vordere Wirkstoffkammer.
4. Der Spritzenstempel darf jetzt nicht mehr zurückgezogen werden.
5. Spritze zur Herstellung einer milchigen Suspension mit der Kanüle senkrecht nach oben halten und durch Bewegung nach links und rechts oder Aufklopfen auf das Zeigefingergrundgelenk gut aufschütteln (nicht waagerecht oder nach unten halten, da sonst Suspensionsmittel austreten kann).
6. Vor der Injektion die Schutzkappe von der Injektionsnadel abziehen, nicht abdrehen! Dann die Luft über der Suspension vorsichtig herausdrücken.
Die Spritze ist jetzt injektionsbereit.
Eine Aspiration ist bei subkutan liegender Injektionsnadel möglich.
Handhabung nach der Injektion
7. Sicherheitsvorrichtung an der Kanüle bis zum fühlbaren/hörbaren Einrasten entsprechend der Pfeilmarkierung ganz nach vorne schieben.
8. Spritze bitte ordnungsgemäß entsorgen.
7. INHABER DER ZULASSUNG
Takeda GmbH Byk-Gulden-Str. 2 78467 Konstanz Tel.: 0800 825 332 5 Fax: 0800 825 332 9 E-Mail: medinfo@takeda.de
8. ZULASSUNGSNUMMER 63660.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 08.Juli 2008 Datum der Verlängerung der Zulassung: 03. Februar 2014
10. STAND DER INFORMATION
März 2015
11. VERKAUFSABGRENZUNG V erschreibungspflichtig.
10