Soolantra 10 Mg/G Creme
Wortlaut der für die Fachinformation vorgesehenen Angaben
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Soolantra 10 mg/g Creme
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Ein Gramm Creme enthält 10 mg Ivermectin.
Sonstige Bestandteile mit bekannter Wirkung:
Ein Gramm Creme enthält 35 mg Cetylalkohol (Ph.Eur.), 25 mg Stearylalkohol (Ph.Eur.),
2 mg Methyl-4-hydroxybenzoat (Ph.Eur.) (E218), 1 mg Propyl-4-hydroxybenzoat (Ph.Eur.) (E216) und 20 mg Propylenglycol.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Creme.
Weiße bis hellgelbe hydrophile Creme.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Soolantra wird angewendet bei erwachsenen Patienten zur topischen Behandlung von entzündlichen Läsionen der (papulopustulösen) Rosazea.
4.2 Dosierung und Art der Anwendung
Dosierung
Eine Anwendung pro Tag für die Dauer von bis zu 4 Monaten. Soolantra soll während des Behandlungszyklus täglich angewendet werden. Der Behandlungszyklus kann wiederholt werden. Falls es nach 3 Monaten zu keiner Besserung kommt, sollte die Behandlung abgebrochen werden.
Besondere Patientengruppen
Eingeschränkte Nieren funktion
Eine Anpassung der Dosis ist nicht erforderlich.
Eingeschränkte Leberfunktion
Bei Patienten mit schwerer Leberfunktionsstörung ist Vorsicht geboten.
Ältere Patienten
Bei älteren Patienten ist keine Dosisanpassung erforderlich (siehe auch Abschnitt 4.8). Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Soolantra bei Kindern und Jugendlichen unter 18 Jahren ist nicht erwiesen. Es liegen keine Daten vor.
Art der Anwendung
Nur zur Anwendung auf der Haut.
Jeweils eine erbsengroße Menge des Arzneimittels auf die Haut der fünf Bereiche des Gesichts auftragen: Stirn, Kinn, Nase und beide Wangen. Das Arzneimittel soll als dünne Schicht über das ganze Gesicht unter Vermeidung von Augen, Lippen und Schleimhaut verteilt werden.
Soolantra darf nur auf das Gesicht aufgetragen werden.
Die Hände sollen nach dem Auftragen des Arzneimittels gewaschen werden.
Kosmetika können nach dem Trocknen des Arzneimittels aufgetragen werden.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Soolantra wurde bei Patienten mit Nieren- oder Leberfunktionsstörungen nicht untersucht. Das Arzneimittel enthält:
- Cetylalkohol und Stearylalkohol, Methyl-4-hydroxybenzoat (E218), Propyl-4-hydroxybenzoat (E216) und Propylenglycol, die örtlich begrenzte Hautreaktionen (z. B. Kontaktdermatitis) hervorrufen können.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt (siehe Abschnitt 5.2 zur Biotransformation).
Die gleichzeitige Anwendung von Soolantra mit anderen topischen oder systemischen Arzneimitteln zur Rosazea-Behandlung wurde nicht untersucht.
In vitro Studien haben gezeigt, dass Ivermectin primär über CYP3A4 metabolisiert wird. Daher ist Vorsicht geboten, wenn Ivermectin gleichzeitig mit potenten CYP3A4 Inhibitoren angewendet wird, da der Plasmaspiegel signifikant erhöht werden könnte.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Bisher liegen keine oder nur begrenzte Daten zur kutanen Anwendung von Ivermectin bei Schwangeren vor. Studien zur oralen Reproduktionstoxizität haben gezeigt, dass
Ivermectin bei Ratten und Kaninchen teratogen ist (siehe Abschnitt 5.3); aufgrund der niedrigen systemischen Exposition nach topischer Anwendung des Produktes in der vorgeschlagenen Dosierung gibt es dennoch geringe Bedenken für die Sicherheit des menschlichen Fötus. Die Anwendung von Soolantra während der Schwangerschaft wird nicht empfohlen.
Stillzeit
Ivermectin wird nach oraler Gabe in geringen Mengen in die Muttermilch ausgeschieden. Die Ausscheidung in die Muttermilch nach topischer Anwendung wurde nicht untersucht. Die zur Verfügung stehenden pharmakokinetischen/toxikologischen Daten vom Tier haben ebenfalls gezeigt, dass Ivermectin in die Muttermilch übergeht. Ein Risiko für das gestillte Neugeborene/Kind kann nicht ausgeschlossen werden. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Soolantra verzichtet werden soll bzw. die Behandlung mit Soolantra zu unterbrechen ist. Dabei soll sowohl der Nutzen des Stillens als auch der Nutzen der Therapie für die Frau berücksichtigt werden.
Fertilität
Es liegen keine Daten zur Wirkung von Ivermectin auf die Fertilität beim Menschen vor.
Bei Ratten hatte die Behandlung mit Ivermectin keine Auswirkungen auf Paarung oder Fertilität.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Soolantra hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Zusammenfassung des Sicherheitsprofils
Die am häufigsten berichteten Nebenwirkungen sind brennendes Gefühl auf der Haut, Hautreizung, Pruritus und trockene Haut, die in klinischen Studien alle bei höchstens 1 % der mit dem Arzneimittel behandelten Patienten auftraten. Sie sind üblicherweise von leichtem bis mäßigem Schweregrad und lassen im Allgemeinen im Laufe der Behandlung nach. Zwischen Patienten im Alter von 18 bis 65 Jahren und Patienten > 65 Jahre wurde kein bedeutsamer Unterschied im Sicherheitsprofil beobachtet.
Tabellarische Auflistung der Nebenwirkungen
Die Nebenwirkungen werden nach Systemorganklasse und Häufigkeit unter Anwendung der folgenden Kategorien klassifiziert: sehr häufig (> 1/10), häufig (> 1/100 bis < 1/10), gelegentlich (> 1/1.000 bis < 1/100), selten (> 1/10.000 bis < 1/1.000), sehr selten (< 1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar). Sie wurden während der Behandlung mit Soolantra in klinischen Studien berichtet (siehe Tabelle 1).
Tabelle 1: Nebenwirkungen
|
Systemorganklasse |
Häufigkeit |
Nebenwirkungen |
|
Erkrankungen der |
Häufig |
Brennendes Gefühl auf der Haut |
Haut und des Unterhautzellgewebes
|
Gelegentlich |
Hautreizung, Pruritus, trockene Haut |
|
Nicht bekannt |
Erythem |
Methy-4-hydroxybenzoat und Propyl-4-hydroxybenzoat können Überempfindlichkeitsreaktionen, auch Spätreaktionen, hervorrufen
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels.
Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt.
Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de __^-£Feidfunktion geändert anzuzeigen.
4.9 Überdosierung
Es liegen keine Berichte zur Überdosierung mit Soolantra vor.
Bei versehentlicher oder erheblicher Exposition gegenüber unbekannten Mengen von Veterinärformulierungen von Ivermectin beim Menschen entweder durch Einnahme, Inhalation, Injektion oder durch Einwirkung auf Körperoberflächen wurden die folgenden Nebenwirkungen am häufigsten berichtet: Ausschlag, Ödem, Kopfschmerzen, Schwindel, Asthenie, Übelkeit, Erbrechen und Diarrhö. Weitere Nebenwirkungen, über die berichtet wurde, sind: Krampfanfall, Ataxie, Dyspnoe, Bauchschmerzen, Parästhesie, Urtikaria und Kontaktdermatitis.
Bei versehentlicher Einnahme sollten die unterstützenden Maßnahmen, falls angezeigt, die Zufuhr parenteraler Flüssigkeiten und Elektrolyte, Atemunterstützung (Sauerstoff und mechanische Beatmung, falls erforderlich) und bei klinisch bedeutsamer Hypotonie die Gabe blutdrucksteigernder Substanzen einschließen. Auslösen von Erbrechen und/oder eine möglichst baldige Magenspülung, gefolgt von Laxantien und routinemäßigen Entgiftungsmaßnahmen, können angezeigt sein, falls sie zur Vermeidung der Resorption des geschluckten Materials erforderlich sind.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Andere dermatologische Zubereitungen, andere Dermatika, ATC-Code: D11AX22
Wirkmechanismus
Ivermectin ist ein Mitglied der Avermectin-Klasse. Avermectin entfaltet antientzündliche Wirkungen durch Hemmung der Lipopolysaccharid-induzierten Produktion entzündlicher Zytokine. In Tiermodellen der Hautentzündung wurden antientzündliche Eigenschaften von kutanem Ivermectin beobachtet. Ivermectin tötet auch Parasiten, hauptsächlich durch selektive und hochaffine Bindung an Glutamat-aktivierte Chloridkanäle, die sich in Nerven und Muskelzellen Wirbelloser befinden. Der Wirkmechanismus von Soolantra bei der Behandlung entzündlicher Läsionen der Rosazea ist nicht bekannt, kann aber sowohl mit den antientzündlichen Wirkungen von Ivermectin als auch mit der Abtötung von
Demodex-Milben in Zusammenhang stehen, von denen berichtet wird, dass sie bei der Entzündung der Haut eine Rolle spielen.
Klinische Wirksamkeit und Sicherheit
Zur Behandlung entzündlicher Läsionen der Rosazea einmal täglich vor dem Schlafengehen aufgetragenes Soolantra wurde in zwei randomisierten, doppelblinden, Vehikel-kontrollierten klinischen Studien mit identischem Design geprüft. Die Studien wurden an 1.371 Patienten im Alter von mindestens 18 Jahren durchgeführt, die 12 Wochen lang einmal täglich mit Soolantra oder einem Vehikel behandelt wurden.
Insgesamt 96 % der Patienten waren Kaukasier und 67 % Frauen. Mithilfe der Investigator Global Assessment(IGA)-5-Punkte-Skala wurde die Erkrankung vor Therapiebeginn bei 79 % der Patienten als mittelschwer (IGA = 3) und bei 21 % als schwer (IGA = 4) eingestuft.
Die koprimären Wirksamkeitsendpunkte waren in beiden klinischen Studien die Erfolgsrate auf Basis des IGA-Ergebnisses (Prozentsatz der Patienten mit „abgeheilter“ und „fast abgeheilter“ Erkrankung in Woche 12 der Studie) sowie die absolute Veränderung der Anzahl entzündlicher Läsionen gegenüber dem Ausgangswert. Die IGA-Skala basiert auf folgenden Definitionen:
Tabelle 2: Investigator Global Assessment(IGA)-Skala
|
Grad |
Score |
Klinische Beschreibung |
|
Abgeheilt |
0 |
Keine entzündlichen Läsionen, kein Erythem |
|
Fast abgeheilt |
1 |
Sehr wenige kleine Papeln/Pusteln, sehr leichtes Erythem |
|
Leicht |
2 |
Wenige kleine Papeln/Pusteln, leichtes Erythem |
|
Mittelschwer |
3 |
Mehrere kleine oder große Papeln/Pusteln, mittelschweres Erythem |
|
Schwer |
4 |
Zahlreiche kleine und/oder große Papeln/Pusteln, schweres Erythem |
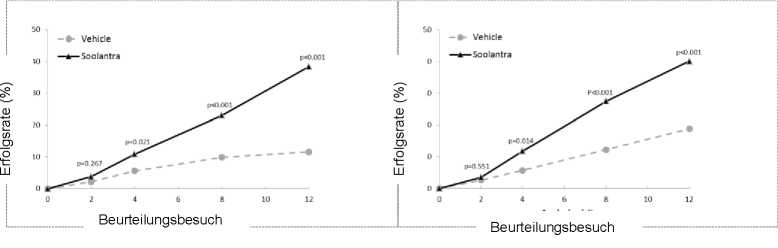
Die Ergebnisse beider klinischer Studien zeigten, dass 12 Wochen lang einmal täglich aufgetragenes Soolantra der Vehikel-Creme hinsichtlich der IGA-Erfolgsrate und der absoluten Veränderung der Anzahl entzündlicher Läsionen statistisch signifikant überlegen war (p<0,001, siehe Tabelle 3 und Abbildungen 1, 2, 3 und 4).
Die folgende Tabelle und die Abbildungen zeigen die Wirksamkeitsergebnisse aus beiden Studien.
Tabelle 3: Wirksamkeitsergebnisse
|
Studie1 |
Studie 2 | |||
|
Soolantra (n = 451) |
Vehikel (n = 232) |
Soolantra (n = 459) |
Vehikel (n=229) | |
|
Investigator Global Assessment (Gesamturteil des Prüfarztes) | ||||
|
Anzahl (%) der auf der IGA-Skala in Woche 12 als abgeheilt oder fast abgeheilt eingestuften Patienten |
173 (38,4) |
27 (11,6) |
184 (40,1) |
43 (18,8) |
|
Entzündliche Läsionen | ||||
|
Mittlere Anzahl entzündlicher |
31,0 |
30,5 |
33,3 |
32,2 |
|
Läsionen vor Therapiebeginn | ||||
|
Mittlere Anzahl entzündlicher Läsionen in Woche 12 |
10,6 |
18,5 |
11,0 |
18,8 |
|
Mittlere absolute Veränderung (% Veränderung) der Anzahl entzündlicher Läsionen ab Therapiebeginn bis Woche 12 |
-20,5 (-64,9) |
-12,0 (-41,6) |
-22,2 (-65,7) |
-13,4 (-43,4) |
Abbildungen 1 und 2: IGA-Erfolgsraten im Verlauf der Zeit in Wochen
Studie 1
Studie 2
Abbildungen 3 und 4: Mittlere absolute Veränderung der Anzahl entzündlicher Läsionen im Verlauf der Zeit in Wochen
Studie 2
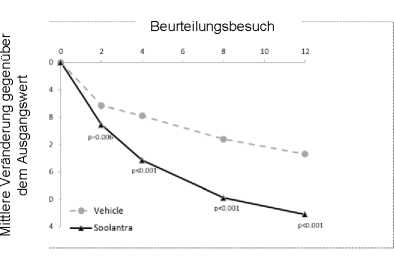
Studie 1
Beurteilungsbesuch
0 2 4 6 8 10 12
Mittlere Veränderung gegenüber
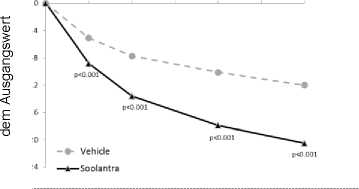
Soolantra war der Vehikel-Creme hinsichtlich der koprimären Wirksamkeitsendpunkte statistisch signifikant überlegen, wobei die Wirkung nach 4-wöchiger Behandlung einsetzte (p<0,05).
Die Beurteilung mithilfe der IGA-Skala wurde während der 40-wöchigen Verlängerung der zwei klinischen Studien fortgesetzt und der Prozentsatz der mit Soolantra behandelten Patienten, die einen IGA-Score von 0 oder 1 erreichten, stieg bis zu Woche 52 an. Die Erfolgsrate (IGA = 0 oder 1) in Woche 52 betrug in Studie 1 und Studie 2 71% bzw. 76%.
Die Wirksamkeit und Sicherheit des Arzneimittels bei der Behandlung entzündlicher Läsionen der Rosazea wurden auch in einer randomisierten, Prüfarzt-verblindeten, aktiv kontrollierten klinischen Studie untersucht. Die Studie wurde an 962 Patienten im Alter von mindestens 18 Jahren durchgeführt, die 16 Wochen lang entweder einmal täglich mit Soolantra oder zweimal täglich mit Metronidazol 7,5 mg/g Creme behandelt wurden. In
dieser Studie waren 99,7 % der Patienten Kaukasier und 65,2 % Frauen; auf der IGA-Skala wurde die Erkrankung vor Therapiebeginn bei 83,3 % der Patienten als mittelschwer (IGA = 3) und bei 16,7 % als schwer (IGA = 4) eingestuft (siehe Abbildung 5).
Die Ergebnisse der Studie zeigten, dass Soolantra der Metronidazol 7,5 mg/g Creme hinsichtlich des primären Wirksamkeitsendpunkts (mittlere prozentuale Veränderung der Anzahl entzündlicher Läsionen) mit einer Abnahme von 83,0% und 73,7% gegenüber dem Ausgangswert nach 16-wöchiger Behandlung in der Ivermectin- bzw. in der Metronidazol-Gruppe statistisch signifikant überlegen war (p<0,001). Die Überlegenheit von Soolantra in Woche 16 wurde durch die auf dem IGA-Score basierende Erfolgsrate und die absolute Veränderung der Anzahl entzündlicher Läsionen (sekundäre Endpunkte) bestätigt (p<0,001).
Abbildung 5: Mittlere prozentuale Veränderung im Verlauf der Zeit in Wochen
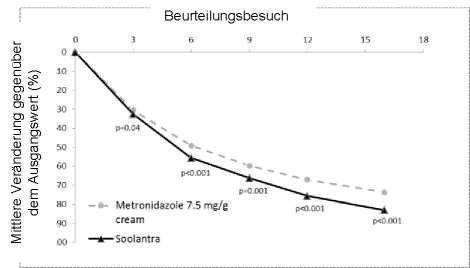
In allen klinischen Studien wurden insgesamt annähernd 300 Patienten im Alter von mindestens 65 Jahren mit dem Arzneimittel behandelt. Zwischen den älteren Patienten und den Patienten im Alter von 18 bis 65 Jahren wurden keine bedeutsamen Unterschiede im Wirksamkeits- und Sicherheitsprofil beobachtet.
Das in Abschnitt 4.8 beschriebene Sicherheitsprofil blieb unter den Bedingungen der Langzeitanwendung stabil, wie bei Langzeitbehandlungen von bis zu einem Jahr beobachtet wurde.
Kinder und Jugendliche
Die Europäische Arzneimittel-Agentur hat für Soolantra eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen bei papulopustulöser Rosazea gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
5.2 Pharmakokinetische Eigenschaften
Resorption
Die Absorption von Ivermectin aus Soolantra wurde in einer klinischen Studie an erwachsenen Patienten mit schwerer papulopustulöser Rosazea unter maximalen Anwendungsbedingungen untersucht. Im Steady-State (nach 2-wöchiger Behandlung)
wurde die höchste mittlere (± Standardabweichung) Plasmakonzentration innerhalb von 10 ± 8 Stunden nach der Anwendung erreicht (Cmax: 2,1 ± 1,0 ng/ml; Bereich:
0,7-4,0 ng/ml) und die höchste mittlere (± Standardabweichung) AUC0-24hr betrug 36 ± 16 ng x Std./ml (Bereich: 14-75 ng x Std./ml). Die systemischen Ivermectin-Expositionslevel erreichten nach 2 wöchiger Behandlung ein Plateau (steady state). Bei den längeren Behandlungsphasen der Phase-3 Studien waren die systemischen Ivermectin-Expositionslevel ähnlich denen, die nach 2 wöchiger Anwendung beobachtet wurden. Unter steady state Bedingungen waren die systemischen Ivermectin-Expositionslevel (AUC0-24hr : 36 ± 16 ng x Std./ml) niedriger als die, die nach einer oralen Einzelgabe von 6 mg Ivermectin bei gesunden Probanden gefunden wurden (AUC0-24hr : 134 ± 66 ng x Std./ml).
Verteilung
In einer In-vitro-Studie wurde nachgewiesen, dass Ivermectin zu mehr als 99 % an Plasmaproteine und zwar hauptsächlich an humanes Serumalbumin gebunden ist. Es wurde keine signifikante Bindung von Ivermectin an Erythrozyten beobachtet.
Biotransformation
In-vitro-Studien unter Verwendung humaner hepatischer Mikrosomen und rekombinanter CYP450-Enzyme haben gezeigt, dass Ivermectin hauptsächlich durch CYP3A4 metabolisiert wird.
In-vitro-Studien zeigen, dass Ivermectin nicht die CYP450-Isoenzyme 1A2, 2A6, 2B6,
2C8, 2C9, 2C19, 2D6, 3A4, 4A11 oder 2E1 hemmt. Ivermectin führte in kultivierten humanen Hepatozyten zu keiner Induktion einer CYP450-Enzymexpression (1A2, 2B6, 2C9 oder 3A4).
In einer klinischen pharmakokinetischen Studie mit maximaler Anwendung wurden zwei Hauptmetaboliten von Ivermectin identifiziert und während der klinischen Phase-2-Studien beurteilt (3”-O-Demethyl-Ivermectin und 4a-Hydroxy-Ivermectin). Ähnlich wie die Muttersubstanz erreichten die Metaboliten nach 2-wöchiger Behandlung Steady-State-Bedingungen ohne Hinweis auf eine Kumulation bis zu 12 Wochen. Darüber hinaus waren die systemischen Expositionen der Metaboliten (geschätzt mit Cmax und AUC) unter Steady-State-Bedingungen viel niedriger als jene, die nach oraler Gabe von Ivermectin beobachtet wurden.
Elimination
In der klinischen pharmokokinetischen Studie mit maximaler Anwendung betrug die terminale Halbwertszeit bei Patienten, die das Arzneimittel 28 Tage lang einmal täglich auf die Haut auftrugen, im Mittel 6 Tage (Mittelwert: 145 Stunden, Bereich 92-238 Stunden). Bei topischer Anwendung von Soolantra ist die Elimination resorptionsabhängig. Die Pharmakokinetik von Ivermectin bei Patienten mit eingeschränkter Nieren- bzw. Leberfunktion wurde nicht untersucht.
5.3 Präklinische Daten zur Sicherheit
In Studien mit bis zu 9-monatiger wiederholter dermaler Applikation von Ivermectin 10 mg/g Creme bei Minischweinen wurden nach systemischer Exposition, die der klinischen Exposition vergleichbar war, keine toxischen Effekte oder lokale Toxizität nachgewiesen.
In einer Serie von In-vitro- und In-vivo-Tests war Ivermectin nicht genotoxisch. In einer 2-jährigen Studie zur Karzinogenität wurde nach dermaler Applikation von Ivermectin10 mg/g Creme bei Mäusen keine erhöhte Tumorinzidenz festgestellt.
Studien zur Reproduktionstoxizität nach oraler Gabe von Ivermectin zeigten teratogene Effekte bei Ratten (Gaumenspalten) und Kaninchen (karpale Verkrümmungen) bei hohen Dosen (Abstand der Exposition zum NOAEL mindestens das 70-Fache der klinischen Exposition)
Die neonatale Toxizität in Studien mit oraler Gabe an Ratten war nicht auf eine In-utero-Exposition zurückzuführen, sondern auf die postnatale Exposition durch die Muttermilch, die zu hohen Konzentrationen von Ivermectin im Gehirn und im Plasma der Nachkommen führte. Es gibt Belege, dass Ivermectin 10 mg/g Creme bei Meerschweinchen hautreizend, sensibilisierend und photosensibilisierend wirkt, aber nicht phototoxisch ist.
Beurteilung der Risiken für die Umwelt (Environmental Risk Assessment, ERA)
Ivermectin ist für Wirbellose sehr toxisch und es wurde ein Risiko für die Kompartimente Wasser, Sediment und Boden identifiziert. Es ist darauf zu achten, dass eine Belastung der Umwelt, besonders von Gewässern, vermieden wird.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Glycerol
Isopropylpalmitat
Carbomer (6.500 bis 15.500 cP) Typ B Dimeticon (20 cSt)
Natriumedetat (Ph.Eur.)
Citronensäure-Monohydrat Cetylalkohol (Ph.Eur.)
Stearylalkohol (Ph.Eur.)
Macrogolcetylstearylether (Ph.Eur.) (Ph.Eur.: 2 bis 33 EO-Einheiten) Sorbitanstearat
Methyl-4-hydroxybenzoat (Ph.Eur.)
Propyl-4-hydroxybenzoat (Ph.Eur.)
Phenoxyethanol (Ph.Eur.)
Propylenglycol Oleylalkohol (Ph.Eur.)
Natriumhydroxid-Lösung (10%)
Gereinigtes Wasser
6.2 Inkompatibilitäten
Nicht zutreffend
6.3 Dauer der Haltbarkeit
2 Jahre
Nach dem ersten Öffnen: 6 Monate.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
Polyethylen (PE)/Aluminium (Al)/ Polyethylen (PE) laminierte weiße Kunststofftuben mit:
- Einem weißen Kopfstück aus hochdichtem Polyethylen (HDPE) und einem kindergesicherten Verschluss aus Polypropylen (PP) bei den Tuben mit 15 g,
30 g, 45 g oder 60 g
- Einer weißen Kappe aus Polypropylen (PP) bei den Tuben mit 2 g (nicht kindergesicherter Verschluss)
Packungsgrößen: 1 Tube mit 2 g, 15 g, 30 g, 45 g oder 60 g.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Um eine Kontamination insbesondere wässriger Medien zu vermeiden oder zu reduzieren, sollten Maßnahmen zur Risikominimierung ergriffen werden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
Galderma Laboratorium GmbH Georg-Glock-Str. 8 D-40474 Düsseldorf Telefon: +49 (0) 800-5888850 Telefax: +49 (0) 211-63 55 82 70 E-Mail: kundenservice@galderma.com
8. ZULASSUNGSNUMMER
92429.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 29. April 2015
10. STAND DER INFORMATION
09.201508/2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Dieses Arzneimittel enthält den Wirkstoff Ivermectin, dessen Wirkung [bei erwachsenen Patienten zur topischen Behandlung von entzündlichen Läsionen der (papulopustulösen) Rosazea] in der medizinischen Wissenschaft noch nicht allgemein bekannt ist.
11