Spasmo-Mucosolvan Saft
F achinformation
Boehringer n| \v Ingelheim
1. BEZEICHNUNG DES ARZNEIMITTELS
Spasmo-Mucosolvan® Saft
0,005 mg / 7,5 mg in 5 ml Lösung zum Einnehmen
Wirkstoffe: Clenbuterolhydrochlorid und Ambroxolhydrochlorid
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
5 ml Lösung zum Einnehmen enthalten:
Clenbuterolhydrochlorid 0,005 mg Ambroxolhydrochlorid 7,5 mg
Sonstiger Bestandteil mit bekannter Wirkung: Sorbitol (siehe Abschnitt 4.4) Vollständige Auflistung der sonstigen Bestandteile: siehe Abschnitt 6.1
3. DARREICHUNGSFORM
Lösung zum Einnehmen
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Akute und chronische Atemwegserkrankungen, die mit spastischen Verengungen, veränderter Sekretbildung und gestörtem Sekrettransport einhergehen, insbesondere spastische Bronchitiden, Emphysembronchitiden und Asthma bronchiale.
Hinweis
Spasmo-Mucosolvan Saft ist nicht zur symptomorientierten Behandlung des akuten Asthmaanfalls geeignet. Sofern eine Dauerbehandlung eines Asthma bronchiale mit Spasmo-Mucosolvan Saft erforderlich ist, soll stets eine begleitende antiinflammatorische Therapie (z. B. mit Kortikoiden) erfolgen.
4.2 Dosierung und Art der Anwendung
Soweit nicht anders verordnet wird, ist bei Kindern bis zu 12 Jahren im Allgemeinen wie in der folgenden Tabelle angegeben zu dosieren:
|
Lebensalter |
Körpergewicht |
Tagesdosis |
|
0 - 8 Monate |
4 - 8 kg |
2 x 2,5 ml |
|
8 - 24 Monate |
8 - 12 kg |
2 x 5,0 ml |
|
2 - 4 Jahre |
12 - 16 kg |
2 x 7,5 ml |
|
4 - 6 Jahre |
16 - 22 kg |
2 x 10,0 ml |
|
6 - 12 Jahre |
22 - 35 kg |
2 x 15,0 ml |
Dem Dosierungsschema für Kinder sind Erfahrungswerte von 0,0008 - 0,0015 mg Clenbuterolhydrochlorid pro kg Körpergewicht/Tag zugrunde gelegt.
Jugendliche ab 12 Jahren und Erwachsene nehmen je nach Stärke der Beschwerden 2 - 3 x 15 - 20 ml Lösung täglich. Eine Gesamttagesdosis von 80 ml Spasmo-Mucosolvan Saft soll nicht überschritten werden.
Hinweise
Spasmo-Mucosolvan Saft enthält keinen Alkohol (Ethanol) und ist für Diabetiker geeignet.
Spasmo-Mucosolvan Saft sollte individuell dosiert und zu den Mahlzeiten mit reichlich Flüssigkeit eingenommen werden. Empfindlich auf ß2-Sympathomimetika reagierende Patienten benötigen in der Regel eine geringere Tagesdosis als die durchschnittlich empfohlene. Bei solchen Patienten kann auch eine einschleichende Behandlung angezeigt sein.
Spasmo-Mucosolvan Saft nicht im Liegen einnehmen.
4.3 Gegenanzeigen
Überempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile. Spasmo-Mucosolvan darf nicht angewendet werden bei schwerer Hyperthyreose, tachykarden Arrhythmien, hypertropher obstruktiver Kardiomyopathie und Phäochromozytom.
Bei einer angeborenen Veranlagung, die zu einer Unverträglichkeit gegen einen der sonstigen Bestandteile des Arzneimittels führen kann, ist das Arzneimittel kontraindiziert (siehe auch Abschnitt 4.4).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Bei frischem Herzinfarkt und/oder schwerer koronarer Herzkrankheit soll die Behandlung vorsichtig mit niedriger Dosierung erfolgen.
Bei Patienten mit schwer kontrollierbarem Diabetes mellitus sollte Spasmo-Mucosolvan Saft nur unter ärztlicher Überwachung angewendet werden.
Kardiovaskuläre Nebenwirkungen können bei Sympathomimetika, zu denen auch Spasmo-Mucosolvan zählt, beobachtet werden. Es gibt Hinweise nach Markteinführung sowie aus Veröffentlichungen für ein seltenes Auftreten einer mit Beta-Agonisten assoziierten Myokardischämie. Mit Spasmo-Mucosolvan behandelte Patienten, die an einer schweren Grunderkrankung des Herzens leiden (z. B. ischämische Herzerkrankung, Arrhythmie oder schwere Herzinsuffizienz), sollten ärztlichen Rat einholen, wenn bei ihnen Schmerzen in der Brust oder andere Anzeichen einer sich verschlechternden Herzerkrankung auftreten. Besondere Aufmerksamkeit ist bei der Beurteilung von Symptomen wie Atemnot und Schmerzen in der Brust geboten, da diese einen respiratorischen oder kardialen Ursprung haben können.
Bei gestörter Bronchomotorik und größeren Sekretmengen (z. B. beim seltenen malignen Ziliensyndrom) sollte Spasmo-Mucosolvan Saft wegen eines möglichen Sekretstaus nur mit Vorsicht verwendet werden.
Bei eingeschränkter Nierenfunktion oder einer schweren Lebererkrankung darf Spasmo-Mucosolvan Saft nur mit besonderer Vorsicht (d. h. in größeren Einnahmeabständen oder in verminderter Dosis) angewendet werden.
Bei schwerer Niereninsuffizienz muss mit einer Kumulation der in der Leber gebildeten Metaboliten von Ambroxol gerechnet werden.
Sehr selten ist im zeitlichen Zusammenhang mit der Anwendung von Substanzen mit Schleim lösender Wirkung (z. B. Ambroxol) über das Auftreten von schweren Hauterscheinungen wie StevensJohnson-Syndrom und Lyell-Syndrom berichtet worden, welche in den meisten Fällen mit der Grundkrankheit bzw. mit der Begleitmedikation erklärt werden konnten. Bei Neuauftreten von Hautoder Schleimhautveränderungen sollte unverzüglich ärztlicher Rat eingeholt und vorsichtshalber die Anwendung von Ambroxol beendet werden.
Dieses Arzneimittel enthält Sorbitol. Patienten mit der seltenen hereditären Fructose-Intoleranz sollten Spasmo-Mucosolvan Saft nicht einnehmen.
5 ml Lösung zum Einnehmen enthalten 1225 mg Sorbitol (eine Quelle für 306 mg Fructose,
ca. 0,1 BE). Dies entspricht 14,7 g Sorbitol (3,675 g Fructose, ca. 1,2 BE) pro maximal empfohlener
Tagesdosis. Sorbitol kann eine leicht laxierende Wirkung haben.
Kommt es trotz der verordneten Therapie zu keiner befriedigenden Besserung oder gar zu einer Verschlechterung der Symptome, ist ärztliche Beratung erforderlich, um die Therapie gegebenenfalls durch eine Kombination mit anderen Arzneimitteln neu festzulegen. Bei akuter oder sich rasch verschlimmernder Atemnot muss unverzüglich ärztliche Hilfe in Anspruch genommen werden. Eine erhebliche Überschreitung, insbesondere der vorgegebenen Einzeldosen beim akuten Anfall, aber auch der Tagesdosis, kann lebensgefährlich sein.
Es ist wiederholt über ein erhöhtes Risiko für das Auftreten schwerer Komplikationen der Grunderkrankung bis hin zu Todesfällen berichtet worden, wenn das Bronchialasthma mit ß2-Sympathomimetika zur Inhalation über längere Zeit mit hohen und überhöhten Dosen behandelt wurde und die entzündungshemmende Therapie unzureichend war.
Die ursächlichen Zusammenhänge konnten bisher nicht hinreichend geklärt werden. Eine entscheidende Rolle scheint aber die unzureichende entzündungshemmende Therapie zu spielen.
Die Anwendung von Spasmo-Mucosolvan Saft kann bei Dopingkontrollen zu positiven Ergebnissen führen. Siehe auch Abschnitt 4.9.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bei gleichzeitiger Therapie mit anderen ß2-Sympathomimetika (neben Spasmo-Mucosolvan Saft), Methylxanthinen (z. B. Theophyllin), Anticholinergika (wie z. B. Ipratropiumbromid) und entzündungshemmenden Arzneimitteln (Kortikosteroiden) kann die Wirkung von Spasmo-Mucosolvan Saft erhöht werden. Wenn Spasmo-Mucosolvan Saft mit anderen ß2-Sympathomimetika, Methylxanthinen (z. B. Theophyllin) oder systemisch verfügbaren Anticholinergika (wie z. B. Pirenzepin-haltige Präparate) angewendet wird, können verstärkt Nebenwirkungen auftreten wie z. B. Tachykardien und Herzrhythmusstörungen.
Daher ist eine genaue ärztliche Überwachung erforderlich.
Die Gabe von Betarezeptorenblockern hebt die Wirkung von Clenbuterol auf und kann zu schweren Bronchospasmen führen.
In Analogie zu anderen ß2-Sympathomimetika ist eine erhöhte Arrhythmiegefahr bei gleichzeitiger Narkose mit halogenierten Kohlenwasserstoffen nicht auszuschließen.
Die gleichzeitige Anwendung von Clenbuterol und Monoaminoxidasehemmstoffen oder trizyklischen Antidepressiva kann eine verstärkte Wirkung von Clenbuterol auf das Herz-Kreislauf-System auslösen.
Die Blutzucker senkende Wirkung von Antidiabetika kann bei gleichzeitiger Therapie vermindert werden. Es sollte überprüft werden, ob eine Dosisänderung des Antidiabetikums erforderlich ist.
Bei hoch dosierter Therapie mit Spasmo-Mucosolvan Saft kann eine Hypokaliämie auftreten. Diese kann bei gleichzeitiger Anwendung von Methylxanthinen, Kortikosteroiden, Diuretika oder Digitalisglykosiden oder bei gleichzeitig bestehender Hypoxämie noch verstärkt werden. Die Kontrolle des Serumkaliumspiegels wird empfohlen.
Bei kombinierter Anwendung von Ambroxolhydrochlorid mit Antitussiva kann aufgrund des eingeschränkten Hustenreflexes ein gefährlicher Sekretstau entstehen, sodass die Indikation zu dieser Kombinationsbehandlung besonders sorgfältig gestellt werden sollte.
Die gleichzeitige Verabreichung von Ambroxol und Antibiotika (Amoxicillin, Cefuroxim, Erythromycin, Doxycyclin) führt zu einem verbesserten Übertritt der Antibiotika in das Lungengewebe.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
In präklinischen Studien wurden bei außerordentlich hohen Dosen von Clenbuterol, die weit über der maximal empfohlenen Tagesdosis beim Menschen lagen, teratogene Effekte beobachtet (siehe Abschnitt 5.3).
Ambroxol passiert die Plazentaschranke. In präklinischen Studien ergaben sich keine schädlichen Wirkungen von Ambroxol auf Schwangerschaft, Geburtsverlauf oder embryonale/foetale oder postnatale Entwicklung (siehe Abschnitt 5.3).
Spasmo-Mucosolvan Saft sollte nur unter sorgfältiger Nutzen-Risiko-Abwägung während der Schwangerschaft verordnet werden. Von der Anwendung während der ersten 3 Schwangerschaftsmonate wird abgeraten.
Aufgrund der starken wehenhemmenden Wirkung der Wirksubstanz Clenbuterol soll Spasmo-Mucosolvan in den letzten Tagen vor einer Geburt nur nach ärztlicher Beratung angewendet werden.
Stillzeit
In präklinischen Untersuchungen zeigte sich, dass Clenbuterol und Ambroxol in die Muttermilch übertreten. Falls während der Stillzeit eine Behandlung mit Spasmo-Mucosolvan erforderlich ist, sollte daher abgestillt werden.
Fertilität
Klinische Daten zur Fertilität sind weder für die Kombination von Clenbuterol und Ambroxol noch für Clenbuterol oder Ambroxol allein vorhanden.
In präklinischen Studien mit Clenbuterol oder Ambroxol allein gab es keine Hinweise auf schädliche Auswirkungen auf die Fertilität (siehe Abschnitt 5.3).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Jedoch sollten die Patienten darauf hingewiesen werden, dass bei ihnen während der Behandlung mit Spasmo-Mucosolvan unerwünschte Wirkungen wie zum Beispiel Schwindel auftreten können und sie daher beim Fahren oder beim Bedienen von Maschinen vorsichtig sein sollten. Beim Auftreten von Schwindel sollten die Patienten potenziell gefährliche Tätigkeiten wie zum Beispiel Fahren oder das Bedienen von Maschinen vermeiden.
4.8 Nebenwirkungen
Wie alle Arzneimittel kann Spasmo-Mucosolvan Saft Nebenwirkungen haben.
Die Nebenwirkungen von Spasmo-Mucosolvan werden nachfolgend nach System-Organ-Klassen zusammengefasst. Den Häufigkeitsangaben zu den Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
|
Sehr häufig: |
> 1/10 |
|
Häufig: |
> 1/100 bis < 1/10 |
|
Gelegentlich: |
> 1/1.000 bis < 1/100 |
|
Selten: |
> 1/10.000 bis < 1/1.000 |
|
Sehr selten: |
< 1/10.000 |
|
Nicht bekannt: |
Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar |
Erkrankungen des Immunsystems, Erkrankungen der Haut und des Unterhautzellgewebes
Allergische Reaktionen (z. B. Haut- und/oder Schleimhautreaktionen, Gesichtsschwellungen, Atemnot, Temperaturanstieg mit Schüttelfrost, Juckreiz, Hautausschlag, Hautrötung, Purpura, Thrombopenie, Nephritis)
Anaphylaktische Reaktionen einschließlich anaphylaktischem Schock Allergische Kontaktdermatitis
Stoffwechselerkrankungen
Hypokaliämie
Hyperglykämie
Anstieg des Blutspiegels von Insulin, freien Fettsäuren, Glycerol und Ketonkörpern
Psychiatrische Erkrankungen
Unruhegefühl 1 Nervosität
Erkrankungen des Nervensystems
Tremor 1 Kopfschmerzen 1 Schwindel
Herzerkrankungen
Palpitationen 1 Tachykardie Arrhythmie Blutdrucksenkungen Pektanginöse Beschwerden Ventrikuläre Extrasystolie
gelegentlich
sehr selten sehr selten
selten
nicht bekannt nicht bekannt
häufig
häufig
häufig
häufig
gelegentlich
häufig häufig gelegentlich gelegentlich sehr selten sehr selten
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Trockenheit der Luftwege sehr selten
Rhinorrhoe sehr selten
Übelkeit
häufig
gelegentlich
gelegentlich
gelegentlich
gelegentlich
sehr selten
sehr selten
Erbrechen
Dyspepsie
Bauchschmerzen und Durchfall
Mundtrockenheit
Obstipation
Sialorrhoe
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Muskelschmerzen gelegentlich
Muskelkrämpfe gelegentlich
Erkrankungen der Nieren und Harnwege
Beeinträchtigungen beim Harnlassen gelegentlich
1 Solche Begleiterscheinungen klingen bei Fortführung der Therapie im Allgemeinen meist nach 1 - 2 Wochen ab.
Zusätzlich zu diesen für Spasmo-Mucosolvan bekannten Nebenwirkungen sind bei den Monosubstanzen die folgenden Nebenwirkungen bekannt:
Nebenwirkungen bei Clenbuterol-Monotherapie waren wie folgt:
Herzerkrankungen
Myokardischämie nicht bekannt
Nebenwirkungen bei Ambroxol-Monotherapie waren wie folgt:
Erkrankungen des Nervensystems
Dysgeusie nicht bekannt
Erkrankungen der Haut und des Unterhautzellgewebes
Angioödem nicht bekannt
Urticaria nicht bekannt
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Hypästhesie des Rachenraums nicht bekannt
Erkrankungen des Gastrointestinaltrakts
Orale Hypästhesie nicht bekannt
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte,
Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn,
Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
a) Symptome der Intoxikation
Clenbuterol:
Gesichtsrötung, Benommenheit, Kopfschmerzen, Tachykardie, Palpitationen, Arrhythmien, Hypertonie oder Hypotonie bis hin zum Schock, Ruhelosigkeit, Brustschmerzen, Erregung, eventuell Extrasystolen und heftiger Tremor insbesondere der Finger, aber auch am ganzen Körper.
Es kann zur Hyperglykämie kommen.
Fälle mit lebensbedrohlichem Verlauf und tödlichem Ausgang sind beobachtet worden, insbesondere bei Überdosierung von Clenbuterol im Rahmen von missbräuchlicher Anwendung.
Darüber hinaus wurde bei Überdosierung von Clenbuterol eine metabolische Azidose beobachtet.
Nach oraler Intoxikation können gastrointestinale Beschwerden einschließlich Übelkeit und Erbrechen auftreten.
Bei hohen Einzeldosen ist bei anderen ß2-Adrenergika eine dosisabhängige Senkung des Serumkaliumspiegels beobachtet worden. Bei Patienten mit einer bestehenden Hypokaliämie (z. B. durch Thiazid-Diuretika oder Laxanzien) empfehlen sich entsprechende Kontrollen.
Ambroxol:
Intoxikationserscheinungen sind bei Überdosierung von Ambroxol nicht beobachtet worden. Es sind kurzzeitige Unruhe und Durchfall berichtet worden.
Ambroxol wurde bei parenteraler Gabe bis zu einer Dosis von 15 mg/kg Körpergewicht/Tag gut vertragen.
In Analogie zu vorklinischen Untersuchungen können bei extremer Überdosierung vermehrte Speichelsekretion, Würgereiz, Erbrechen und Blutdruckabfall auftreten.
b) Therapie von Intoxikationen
Die Behandlung nach ß2-sympathomimetischer Überdosierung erfolgt hauptsächlich symptomatisch. Die Wirkung von Clenbuterol kann durch Betarezeptorenblocker antagonisiert werden, hierbei ist jedoch der Gefahr der Auslösung eines schweren Bronchospasmus bei Patienten mit Asthma bronchiale Rechnung zu tragen. Dies gilt auch für so genannte kardioselektive Betarezeptorenblocker.
Zur kardialen Überwachung ist EKG-Monitoring angezeigt.
Bei oraler Überdosierung sollte eine Magenspülung erwogen werden, Aktivkohle und Abführmittel können die unerwünschte Resorption des ß2-Sympathomimetikums günstig beeinflussen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Bronchospasmolytika/Antiasthmatika (Sympathomimetika, ß2-Adrenergika)
ATC-Code: R03CC
Kombinationspräparat aus einem ß2-selektiven-Sympathomimetikum (Clenbuterol) und einem Sekrettherapeutikum (Ambroxol). Clenbuterol und Ambroxol liegen als Hydrochloride vor.
Die Wirkstoffe von Spasmo-Mucosolvan, Clenbuterol und Ambroxol, ergänzen sich durch ihr pharmakodynamisches Profil bei der Therapie obstruktiver Atemwegserkrankungen sinnvoll. Das ß2-Sympathomimetikum Clenbuterol löst bronchiale Spasmen und aktiviert die Zilienschlagfrequenz des Flimmerepithels. Ambroxol wirkt sekretolytisch und sekretomotorisch im Bereich des Bronchialtraktes. Beide Substanzen aktivieren so auf unterschiedliche Weise das tracheo-bronchiale Schleimtransportsystem, verbessern die Öffnung des Bronchialsystems und damit die Ventilation.
Clenbuterolhydrochlorid
Clenbuterol ist ein direkt wirkendes Sympathomimetikum mit überwiegender ß2-Selektivität.
Clenbuterol verursacht eine Erschlaffung der glatten Muskulatur in den Bronchien und Blutgefäßen sowie eine Relaxation der Uterusmuskulatur durch Stimulation der ß2-Rezeptoren. Clenbuterol wirkt antiallergisch durch die Hemmung der Freisetzung von Mediatoren aus den Mastzellen. Ferner ist eine Steigerung der mukoziliären Clearance im Bronchialsystem nachweisbar. Am elektrisch stimulierten, isolierten Meerschweinchenvorhof konnte eine konzentrationsabhängige Schlagfrequenzminderung durch Clenbuterol gezeigt werden. Diese Wirkungen werden über eine Aktivierung der Adenylatcyclase vermittelt, wobei es zu einer Anreicherung von zyklischem 3,5-Adenosinmonophosphat (c-AMP) kommt, welches seinerseits die kontraktilen Elemente der glatten Muskulatur hemmt.
Die ß2-sympathomimetische Wirkung von Clenbuterol ist relativ stark bronchoselektiv, seine Wirkungen auf das Herz wie Anstieg der Herzfrequenz, Steigerung der Kontraktilität (positiv inotroper und chronotroper Effekt) sind durch indirekte Folgen der vaskulären Wirkungen zu erklären.
In präklinischen Untersuchungen mit hohen Dosierungen ist für Clenbuterol, wie für andere ß2-Sympathomimetika auch, eine Hypertrophie der quer gestreiften Muskulatur beschrieben worden. Der Wirkungsmechanismus für diesen Effekt ist noch nicht geklärt. Eine über die Betarezeptoren der Myozyten vermittelte Reduktion des Proteinabbaus wird diskutiert. Die Bedeutung dieser Befünde für den Menschen ist unklar.
Die bronchospasmolytische Wirkung von Clenbuterolhydrochlorid per os beginnt nach 5 - 20 Minuten. Die Wirkdauer beträgt bis zu 14 Stunden.
Ambroxolhydrochlorid
Ambroxol, ein substituiertes Benzylamin, ist ein Metabolit von Bromhexin. Es unterscheidet sich vom Bromhexin durch das Fehlen einer Methylgruppe und die Einführung einer Hydroxylgruppe in ParaTrans-Stellung des Cyclohexylringes.
Ambroxol wirkt sekretolytisch und sekretomotorisch im Bereich des Bronchialtraktes. In präklinischen Untersuchungen steigert es den Anteil des serösen Bronchialsekretes. Durch die Verminderung der Viskosität und die Aktivierung des Flimmerepithels soll der Abtransport des Schleims gefördert werden.
Ambroxol bewirkt eine Aktivierung des Surfactant-Systems durch direkten Angriff an den Pneumozyten-Typ 2 der Alveolen und den Clarazellen im Bereich der kleinen Atemwege. Es fördert die Bildung und Ausschleusung von oberflächenaktivem Material im Alveolar- und Bronchialbereich der fetalen und der adulten Lunge. Diese Effekte sind in der Zellkultur und in vivo an verschiedenen Spezies nachgewiesen.
Durchschnittlich tritt die Wirkung bei oraler Verabreichung nach 30 Minuten ein und hält je nach Höhe der Einzeldosis 6 - 12 Stunden an.
5.2 Pharmakokinetische Eigenschaften
Clenbuterolhydrochlorid
Die Resorption von Clenbuterol erfolgt nach oraler sowie inhalativer Gabe rasch und vollständig. Die Invasionshalbwertszeit beträgt ca. 60 Minuten. Nach einmaliger oraler Gabe wird die maximale Plasmakonzentration nach 120 - 180 Minuten erreicht.
Bei konstanter Dosierung wird nach vier Behandlungstagen ein Steady state der Plasmakonzentrationen erreicht. Bei höherer initialer Dosierung wird der entsprechende Plasmaspiegel früher erreicht. Die Kinetik ist dosislinear, sodass unkalkulierbare Kumulationseffekte auszuschließen sind.
Clenbuterol passiert die Plazentaschranke bei Mensch und Tier. Bei Untersuchungen unmittelbar nach der Geburt wurden im Rahmen von klinischen Prüfungen mit Clenbuterol als Tokolytikum im kindlichen Plasma 67 % der im mütterlichen Plasma vorliegenden Konzentration gemessen.
In der Muttermilch wird Clenbuterol auf etwa das Doppelte der mütterlichen Plasmakonzentration angereichert (Tier).
Die Bioverfügbarkeit aller oralen Darreichungsformen liegt bei 100 % (Tier).
Clenbuterol wird überwiegend in unveränderter Form mit dem Urin ausgeschieden. Die Elimination aus dem Plasma ist biphasisch, mit einer raschen (Halbwertszeit 60 Minuten) und einer langsamen Eliminationsphase (Halbwertszeit 34 Stunden).
Ambroxolhydrochlorid
Ambroxol wird nach oraler Verabreichung praktisch vollständig resorbiert. Die Tmax nach oraler Gabe beträgt 1 - 3 Stunden. Ambroxol erreicht im Lungengewebe eine höhere Konzentration als im Plasma bei parenteraler Applikation.
Die absolute Bioverfügbarkeit von Ambroxol nach oraler Gabe liegt bei ca. 80 %; sie ist durch einen First-pass-Metabolismus um ca. 1/3 vermindert. Es entstehen dabei nierengängige Metaboliten (z. B. Dibromanthranilsäure, Glukuronide).
Die Bindung an Plasmaproteine beträgt ca. 85 % (80 - 90 %). Die terminale Halbwertszeit im Plasma liegt bei 7 - 12 Stunden. Die Plasmahalbwertszeit der Summe aus Ambroxol und seiner Metaboliten beträgt ca. 22 Stunden.
Ambroxol ist liquor- und plazentagängig und tritt in die Muttermilch über.
Die Ausscheidung erfolgt zu ca. 90 % renal in Form der in der Leber gebildeten Metaboliten. Weniger als 10 % der renalen Ausscheidung sind dem unveränderten Ambroxol zuzuordnen. Aufgrund der hohen Proteinbindung und des hohen Verteilungsvolumens sowie der langsamen Rückverteilung aus dem Gewebe ins Blut ist keine wesentliche Elimination von Ambroxol durch Dialyse oder forcierte Diurese zu erwarten.
Bei schweren Lebererkrankungen wird die Clearance von Ambroxol um 20 - 40 % verringert. Bei schwerer Nierenfunktionsstörung ist die Eliminationshalbwertszeit für die Metaboliten von Ambroxol verlängert.
5.3 Präklinische Daten zur Sicherheit
Clenbuterolhydrochlorid
a) Akute Toxizität
Die LD50 liegt mit 13 mg/kg Körpergewicht (Meerschweinchen, i.v.) bzw. mit 800 mg/kg Körpergewicht (Hund, p.o.) weit oberhalb der therapeutischen Einzeldosen.
b) Chronische Toxizität
In Langzeituntersuchungen wurden nach chronischer oraler Applikation bei Ratten ab einer Dosis von 1 mg/kg/Tag (26 Wochen) und beim Hund ab einer Dosis von 0,1 mg/kg/Tag (52 Wochen) ischämische kleinherdige Myokardnekrosen bzw. Vernarbungen im kleineren Papillarmuskel des linken Ventrikels festgestellt; bei Hunden außerdem eine Zunahme des Herzgewichtes.
Bei inhalativer Gabe hoher Dosen (no-effect-dose: 0,16 mg/kg Körpergewicht) wurden auch bei Ratten fokale Myokardnekrosen beobachtet, wie sie beim Hund nach oraler Applikation beschrieben wurden.
Die myokardialen Verletzungen werden als die Kategorie-Effekte von Beta-Sympathomimetika angesehen, hauptsächlich verursacht durch eine verringerte Sauerstoffperfusion aufgrund einer Reflextachykardie.
Die hierbei applizierten Dosen lagen um mehr als das 1000-fache höher als die beim Hund nach oraler Applikation zu Myokardnekrosen führenden Dosierungen. Im Gegensatz hierzu führte eine chronische inhalative Zufuhr selbst bei hohen Dosierungen beim Affen zu keinerlei Intoxikationen.
c) Tumorerzeugendes und mutagenes Potenzial
Mutagenitätsuntersuchungen (AMES-Test, Mikrokerntest, V79 [HGPRT]-Test) und Kanzerogenitätsuntersuchungen an Ratten und Mäusen in Dosierungen bis zu 25 mg/kg Körpergewicht ergaben keinen Hinweis auf ein mutagenes, tumorigenes oder kanzerogenes Risiko. Ausgenommen hiervon waren lediglich mesovariale Leiomyome bei Sprague-Dawley Ratten. Das Auftreten dieses Tumors nach einer Exposition gegenüber Beta-Sympathomimetika ist bei einzelnen Rattenstämmen gut dokumentiert und wird nicht als Hinweis auf ein erhöhtes Risiko für den Menschen bewertet.
d) Reproduktionstoxikologie
Bei Embryotoxizitätsstudien an Ratte und Kaninchen in Dosierungen bis zu 1 mg/kg Körpergewicht bzw. 0,3 mg/kg Körpergewicht p.o. und 0,078 mg/kg Körpergewicht bzw. 0,3 mg/kg Körpergewicht bei Inhalation ergaben sich keine Hinweise auf ein teratogenes oder sonstiges embryotoxisches Potenzial von Clenbuterol. Bei Ratten beeinflussten Dosierungen von 0,015 mg/kg/Tag die Fertilität, das Reproduktionsverhalten oder die peri- oder postnatale Entwicklung nicht.
Materno-, foeto- und embryotoxische sowie teratogene Wirkungen traten in einzelnen Versuchstierstämmen bei Kaninchen und Ratte bei exzessiv hohen Dosen von mehr als 10 mg/kg/Tag auf. Diese überstiegen die für Menschen empfohlene Tageshöchstdosis von 0,06 mg um das mehr als 1000-fache (bezogen auf Dosierungen in mg/m2 bei Tier und Mensch).
Teratogene Effekte (NOAEL) wurden bei Ratte und Kaninchen beim 135-fachen bzw. 270-fachen der für Menschen empfohlenen Tageshöchstdosis (bzgl. mg/m2 bei Mensch und Tier) gezeigt. Sie werden als Klasseneffekt der Beta-Sympathomimetika (z. B. Vertebral-Costal-Syndrom) angesehen.
Ambroxolhydrochlorid
a) Akute Toxizität
Präklinische Untersuchungen zur akuten Toxizität haben keine besondere Empfindlichkeit ergeben.
b) Chronische Toxizität
Präklinische Untersuchungen zur chronischen Toxizität zeigten keine substanzbedingten Veränderungen.
Für Ambroxol wurden als NOAEL orale Dosen von 50 mg/kg/Tag (Ratte; 52 und 78 Wochen) bzw.
50 mg/kg/Tag /Hund; 52 Wochen) bestimmt.
Toxikologische Zielorgane wurden nicht gefunden.
c) Tumorerzeugendes und mutagenes Potenzial
Präklinische Langzeituntersuchungen in Mäusen und Ratten ergaben bis zu einer Dosis von 800 bzw. 1000 mg/kg/Tag keine Hinweise auf ein tumorigenes oder karzinogenes Potenzial von Ambroxol.
Ambroxol wurde keiner ausführlichen Mutagenitätsprüfung unterzogen; bisherige Untersuchungen verliefen negativ.
d) Reproduktionstoxikologie
Embryotoxizitätsuntersuchungen an Ratte und Kaninchen haben bis zu einer Dosis von 3 g/kg Körpergewicht bzw. 200 mg/kg Körpergewicht keine Hinweise auf ein teratogenes Potenzial ergeben. Die peri- und postnatale Entwicklung von Ratten war erst oberhalb einer Dosis von 500 mg/kg Körpergewicht beeinträchtigt. Fertilitätsstörungen wurden bei Ratten bis zu einer Dosis von 1,5 g/kg Körpergewicht nicht beobachtet.
Auf der Basis einer Studie zur peri- und postnatalen Entwicklung wurde ein NOAEL von 50 mg/kg/Tag ermittelt. Eine Dosis von 500 mg/kg/Tag war für Muttertier und Junge leicht toxisch (verringerte Entwicklung des Körpergewichts und kleinere Wurfgrößen).
Kombinationstoxizität
Alle Toxizitätsstudien mit der Kombination wurden mit einem Ambroxol-Clenbuterol-Verhältnis von 1500:1 durchgeführt. Aufgrund dieses Verhältnisses waren die Clenbuterol-Dosierungen in diesen Studien deutlich niedriger als in den Studien mit Clenbuterol allein. Folglich wurden die Effekte, die in den jeweiligen Kombinationsstudien beobachtet wurden, überwiegend durch Ambroxol verursacht.
a) Akute Toxizität
Die oralen LD50-Werte der Kombination betrugen 7746 bzw. 1000 - 1250 mg/kg bei Ratten bzw. Hunden.
Die Prüfung der Kombination von Ambroxol und Clenbuterol nach einmaliger und wiederholter Gabe an Ratte und Hund ergab bei der Ratte keine toxikologischen Befunde. Beim Hund wurden in der hohen Dosis von 250 mg/kg Körpergewicht zentralnervöse Störungen beobachtet, wie sie gleichermaßen bei Applikation von Ambroxol anzutreffen waren. Ebenso fanden sich bei dieser Dosis im Herzmuskel einzelner Tiere durch die Herzfrequenzsteigerung durch den Clenbuterolanteil bedingte Fibroseherde im Myokard.
Die Untersuchungen belegen, dass durch die Kombination von Ambroxol und Clenbuterol keine synergistischen toxischen Effekte hervorgerufen werden. Die Kombination ist ebenso gut verträglich wie die beiden Einzelkomponenten.
b) Chronische Toxizität
Bei Studien zur oralen chronischen Toxizität der Kombination über 13 Wochen hinweg wurde die Kombination bis zu einer Dosis von 450 bzw. 50 mg/kg/Tag durch Ratten bzw. Hunde gut vertragen (NOAEL).
c) Reproduktionstoxikologie
Für die Kombination wurden keine Reproduktions- oder Karzinogenitätsstudien durchgeführt.
d) Tumorerzeugendes und mutagenes Potenzial
Der Maus-Mikronukleus-Test verlief für die Kombination negativ. Verschiedene Genotoxizitätsassays verliefen negativ für Clenbuterol und Ambroxol.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Natriumbenzoat, Sorbitol-Lösung 70 % (nicht kristallisierend) (Ph. Eur.), Propylenglycol, Hyetellose, Weinsäure (Ph. Eur.), Glycerol 85 %, Grenadin-Aroma, gereinigtes Wasser
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
Nach Anbruch der Flasche beträgt die Haltbarkeit noch 3 Monate.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 30 °C lagern.
6.5 Art und Inhalt des Behältnisses
Braunglasflasche mit kindergesichertem Kunststoff-Schraubverschluss aus PP/PE OP mit 100 ml Lösung OP mit 250 ml Lösung
Klinikpackung mit 1000 (10 x 100) ml Lösung
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
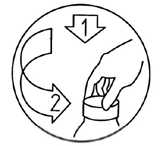
Kindergesicherter Flaschenverschluss:
Zum Öffnen den Schraubverschluss nach unten drücken und gleichzeitig in Pfeilrichtung drehen. Nach Gebrauch muss der Schraubverschluss wieder fest zugedreht werden, damit die Kindersicherung erneut gewährleistet ist.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
Boehringer Ingelheim Pharma GmbH & Co. KG
Binger Str. 173
55216 Ingelheim am Rhein
Telefon: 0 800 / 77 90 900
Telefax: 0 61 32 / 72 99 99
E-Mail: info@boehringer-ingelheim.de
8. ZULASSUNGSNUMMER
4661.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 27.06.1984
Datum der letzten Verlängerung der Zulassung: 09.06.2004
10. STAND DER INFORMATION
Oktober 2013
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Seite 13 von 13