Spiro-D-Tablinen 50 Mg
1. BEZEICHNUNG DER ARZNEIMITTEL
Spiro-D-Tablinen® 50 mg
(50 mg/20 mg Tabletten)
Spiro-D-Tablinen® 100 mg
(100 mg/20 mg Tabletten)
Wirkstoffe: Spironolacton und Furosemid
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Spiro-D-Tablinen 50 mg
1 Tablette enthält 50 mg Spironolacton und 20 mg Furosemid.
Spiro-D-Tablinen 100 mg
1 Tablette enthält 100 mg Spironolacton und 20 mg Furosemid.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Tablette.
Spiro-D-Tablinen 50 mg
Weiße, runde, bikonvexe Tabletten mit einem Durchmesser von ca. 9 mm und einer Kerbe auf einer Seite. Die Kerbe dient nicht zum Teilen der Tablette.
Spiro-D-Tablinen 100 mg
Weiße, runde, bikonvexe Tabletten mit einem Durchmesser von ca. 11 mm.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Ödeme und Aszites, wenn zusätzlich Störungen des Elektrolythaushaltes durch Hyperaldosteronismus vorliegen und bisherige diuretische Therapiemaßnahmen nicht ausreichen:
- Ödeme und/oder Lungenstauung infolge Herzinsuffizienz,
- Aszites infolge Leberinsuffizienz.
4.2 Dosierung und Art der Anwendung
Die Dosierung sollte individuell - in Abhängigkeit vom Schweregrad und Ausmaß des Hyperaldosteronismus - festgelegt werden. Es gelten folgende Richtdosen:
Erwachsene erhalten in den ersten 3-6 Tagen je nach Anwendungsgebiet 1- bis 4-mal täglich 1 Tablette Spiro-D-Tablinen 50 mg bzw. 1- bis 4-mal täglich 1 Tablette Spiro-D-Tablinen 100 mg (entsprechend 50-400 mg Spironolacton und 20-80 mg Furosemid pro Tag). Für die Weiterbehandlung genügen als Erhaltungsdosis meist 1- bis 3-mal täglich 1 Tablette Spiro-D-Tablinen 50 mg bzw. Spiro-D-Tablinen 100 mg (entsprechend 50-300 mg Spironolacton und 20-60 mg Furosemid pro Tag). In der Regel ist täglich 1 Tablette Spiro-D-Tablinen 50 mg (entsprechend 50 mg Spironolacton und 20 mg Furosemid pro Tag) bzw. 1 Tablette Spiro-D-Tablinen 100 mg (entsprechend 100 mg Spironolacton und 20 mg Furosemid pro Tag) ausreichend. Diese Erhaltungsdosis kann je nach Bedarf täglich, jeden 2. oder jeden 3. Tag verabreicht werden.
Kinder und Jugendliche
Spiro-D-Tablinen 50 mg bzw. 100 mg werden für die Anwendung bei Kindern und Jugendlichen nicht empfohlen, da keine ausreichenden Daten zur Wirksamkeit und Unbedenklichkeit vorliegen.
Art und Dauer der Anwendung
Die Tabletten sind unzerkaut zum Frühstück oder Mittagessen mit reichlich Flüssigkeit einzunehmen. Eine abendliche Gabe ist insbesondere in der Anfangszeit der Behandlung wegen der sonst zu erwartenden verstärkten nächtlichen Harnausscheidung nicht zu empfehlen.
Die Dauer der Behandlung richtet sich nach Art und Schwere der Erkrankung. Sie sollte auf einen möglichst kurzen Zeitraum begrenzt werden.
Die Notwendigkeit einer Therapie über längere Zeit sollte periodisch überprüft werden.
4.3 Gegenanzeigen
Spiro-D-Tablinen 50 mg bzw. 100 mg dürfen nicht angewendet werden bei:
- Überempfindlichkeit gegen Spironolacton oder Furosemid, gegen Sulfonamide (mögliche Kreuzallergie mit Furosemid) oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile,
- Hyperkaliämie,
- schwerer Hypokaliämie,
- schwerer Hyponatriämie,
- Hypovolämie oder Dehydratation,
- Anurie,
- akutem Nierenversagen,
- schwerer Niereninsuffizienz (Kreatinin-Clearance unter 30 ml/min pro 1,73 m2 Körperoberfläche bzw. Serumkreatinin über 1,8 mg/dl),
- Coma und Praecoma hepaticum im Zusammenhang mit einer hepatischen Enzephalopathie,
- Schwangerschaft (siehe auch Abschnitt 4.6),
- stillenden Frauen (siehe auch Abschnitt 4.6).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die Behandlung mit Spiro-D-Tablinen 50 mg bzw. 100 mg erfordert regelmäßige ärztliche Kontrolle.
Eine besonders sorgfältige ärztliche Überwachung ist erforderlich bei:
- Hypokaliämie,
- Hyponatriämie,
- Nierenfunktionseinschränkung leichteren Grades (Kreatinin-Clearance 30-80 ml/min bzw. Serumkreatinin zwischen 1,3 und 1,8 mg/dl; erhöhtes Risiko einer Hyperkaliämie),
- Hypotonie,
- Patienten, die durch einen unerwünscht starken Blutdruckabfall besonders gefährdet wären, z. B. Patienten mit zerebrovaskulären Durchblutungsstörungen oder koronarer Herzkrankheit,
- Azidose,
- latentem oder manifestem Diabetes mellitus (regelmäßige Kontrolle des Blutzuckers ist erforderlich),
- Gicht (regelmäßige Kontrolle der Harnsäure im Serum ist erforderlich),
- Hypoproteinämie, z. B. bei nephrotischem Syndrom (vorsichtige Einstellung der Dosierung),
- Harnabflussbehinderung (z. B. bei Prostatahypertrophie, Hydronephrose, Ureterstenose),
- hepatorenalem Syndrom (rasch progrediente Niereninsuffizienz verbunden mit einer schweren Lebererkrankung, z. B. Leberzirrhose).
Spironolacton kann zu Stimmveränderungen führen. Bei der Entscheidung, ob eine Therapie mit Spiro-D-Tablinen 50 mg bzw. 100 mg begonnen werden soll, ist dieses Risiko besonders sorgfältig abzuwägen bei Patienten mit Berufen, in denen die Stimme eine besondere Bedeutung hat (z. B. bei Schauspielern, Sängern, Lehrern).
Bei gleichzeitiger Anwendung von Spironolacton und kaliumsparenden Diuretika, kaliumhaltigen Präparaten oder ACE-Hemmern kann es zu lebensgefährlichen Hyperkaliämien kommen. Die Kombination der vorgenannten Arzneimittel mit Spiro-D-Tablinen 50 mg bzw. 100 mg wird daher nicht empfohlen.
Die gleichzeitige Anwendung potenziell ototoxischer Arzneimittel (z. B. Aminoglykoside, Cisplatin) oder nephrotoxischer Arzneimittel (z. B. Aminoglykoside, Cephalosporine, Polymyxine) sollte unterbleiben.
Spiro-D-Tablinen 50 mg bzw. 100 mg führen zu einer verstärkten Ausscheidung von Natrium und Chlorid und infolgedessen von Wasser. Auch die Ausscheidung anderer Elektrolyte ist erhöht. Als Folge der vermehrten Flüssigkeits- und Elektrolytausscheidung kann es - insbesondere bei eingeschränkter Nierenfunktion - zu Störungen im Flüssigkeits- und Elektrolythaushalt kommen (u. a. verstärkte Ausscheidung von Elektrolyten wie Natrium, Calcium, Magnesium, Chlorid).
Bei der Therapie mit Spiro-D-Tablinen 50 mg bzw. 100 mg sollten in regelmäßigen Abständen die Serumelektrolyte (insbesondere Kalium, Natrium, Calcium, Bikarbonat), die harnpflichtigen Substanzen Kreatinin, Harnstoff und Harnsäure im Serum sowie der Säure-Basen-Status, gegebenenfalls auch Blutzucker und Blutfette kontrolliert werden.
Eine besonders enge Überwachung ist erforderlich bei Patienten mit einem hohen Risiko, Elektrolytstörungen zu entwickeln, oder im Falle eines stärkeren Flüssigkeitsverlustes (z. B. durch Erbrechen, Diarrhö oder intensives Schwitzen). Hypovolämie oder Dehydratation sowie wesentliche Elektrolytstörungen oder Störungen im Säure-Basen-Haushalt müssen korrigiert werden. Dies kann die zeitweilige Einstellung der Behandlung mit Spiro-D-Tablinen 50 mg bzw. 100 mg erfordern.
Die mögliche Entwicklung von Elektrolytstörungen wird durch zugrunde liegende Erkrankungen (z. B. Leberzirrhose, Herzinsuffizienz), Begleitmedikation (siehe Abschnitt 4.5) und Ernährung beeinflusst.
Bei eingeschränkter Nierenfunktion mit einer Kreatinin-Clearance unter 60 ml/min bzw. Serumkreatinin über 1,5 mg/dl sowie bei gleichzeitiger Anwendung von Arzneimitteln, die zu einem Anstieg des Serumkaliumspiegels führen können, sollte die Behandlung mit Spiro-D-Tablinen 50 mg bzw. 100 mg nur unter häufiger Kontrolle des Serumkaliumspiegels erfolgen.
Bei Patienten mit Miktionsstörungen (z. B. bei Prostatahypertrophie) muss für freien Harnabfluss gesorgt werden, da eine plötzlich einsetzende Harnflut zu einer Harnsperre (Harnverhaltung) mit Überdehnung der Blase führen kann.
Der durch verstärkte Urinausscheidung hervorgerufene Gewichtsverlust sollte unabhängig vom Ausmaß der Urinausscheidung 1 kg/Tag nicht überschreiten.
Gleichzeitige Anwendung mit Risperidon:
In placebokontrollierten Studien mit Risperidon bei älteren Patienten mit Demenz wurde eine höhere Mortalitätsinzidenz bei Patienten beobachtet, die gleichzeitig mit Furosemid und Risperidon behandelt wurden (7,3 %, Durchschnittsalter 89 Jahre, Altersspanne 75 bis 97 Jahre), im Vergleich zu Patienten, die Risperidon allein (3,1 %, Durchschnittsalter 84 Jahre, Altersspanne 70 bis 96 Jahre) oder Furosemid allein (4,1 %, Durchschnittsalter 80 Jahre, Altersspanne 67 bis 90 Jahre) erhalten hatten. Die gleichzeitige Anwendung von Risperidon mit anderen Diuretika (hauptsächlich niedrig dosierte Thiaziddiuretika) war nicht mit einem ähnlichen Befund assoziiert.
Ein pathophysiologischer Mechanismus zur Erklärung dieser Beobachtung konnte nicht identifiziert werden und es wurde kein einheitliches Muster für die Todesursache festgestellt. Dennoch ist Vorsicht angezeigt, und Risiken und Nutzen dieser Kombination oder der gleichzeitigen Behandlung mit anderen stark wirksamen Diuretika sind vor der Therapieentscheidung abzuwägen. Die Mortalitätsinzidenz war bei Patienten, die andere Diuretika als Begleittherapie zu Risperidon erhalten hatten, nicht erhöht. Behandlungsunabhängig war Dehydratation ein allgemeiner Risikofaktor für Mortalität und soll daher bei älteren Patienten mit Demenz vermieden werden (siehe Abschnitt 4.3).
Spironolacton kann eine Störung bestimmter diagnostischer Tests (z. B. Digoxin-RIA) verursachen.
Kinder und Jugendliche
Ausreichende Erfahrungen zur Anwendung von Spiro-D-Tablinen 50 mg bzw. 100 mg bei Kindern und Jugendlichen liegen nicht vor.
Die Anwendung von Spiro-D-Tablinen 50 mg bzw. 100 mg kann bei Dopingkontrollen zu positiven Ergebnissen führen. Zudem kann es bei Missbrauch von Spiro-D-Tablinen 50 mg bzw. 100 mg als Dopingmittel zu einer Gefährdung der Gesundheit kommen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Folgende Wechselwirkungen mit anderen Arzneimitteln sind zu beachten:
Die gleichzeitige Anwendung von Spiro-D-Tablinen 50 mg bzw. 100 mg und kaliumhaltigen Präparaten, ACE-Hemmern (z. B. Captopril, Enalapril) oder kaliumsparenden Arzneimitteln (Triamteren, Amilorid) kann zu schweren Hyperkaliämien führen und ist daher zu vermeiden.
Bei der Kombination der Monosubstanz Spironolacton mit kaliumhaltigen Präparaten, ACE-Hemmern oder kaliumsparenden Arzneimitteln wurden lebensbedrohliche Hyperkaliämien beobachtet.
Auch die Kombination von nicht steroidalen Antiphlogistika (z. B. Acetylsalicylsäure, Indometacin) mit Spironolacton kann zu Hyperkaliämien führen.
Die gleichzeitige Anwendung von Spiro-D-Tablinen 50 mg bzw. 100 mg und Glukokortikoiden, Carbenoxolon oder Laxanzien kann zu verstärkten Kaliumverlusten führen. Spironolacton und Carbenoxolon können sich gegenseitig in ihrer Wirkung beeinträchtigen. Größere Mengen von Lakritze wirken in dieser Hinsicht wie Carbenoxolon.
Die Wirkung blutdrucksenkender Arzneimittel kann durch Spiro-D-Tablinen 50 mg bzw. 100 mg verstärkt werden.
Bei gleichzeitiger Anwendung von Diuretika mit ACE-Hemmern oder Angiotensin-II-Rezeptorantagonisten, insbesondere bei erstmaliger Verabreichung von ACE-Hemmern oder Angiotensin-II-Rezeptorantagonisten oder bei erstmaliger Gabe in höherer Dosierung, können massive Blutdruckabfälle bis zum Schock, eine Verschlechterung der Nierenfunktion und in Einzelfallen akutes Nierenversagen auftreten. Wenn möglich, sollte die Furosemid-Therapie daher vorübergehend eingestellt oder wenigstens die Dosis für 3 Tage reduziert werden, bevor die Therapie mit einem ACE-Hemmer oder Angiotensin-II-Rezeptorantagonisten begonnen oder seine Dosis erhöht wird.
Bei gleichzeitiger Anwendung von Spiro-D-Tablinen 50 mg bzw. 100 mg und anderen Diuretika kann es zu verstärkter Diurese und verstärktem Blutdruckabfall kommen.
Nicht steroidale Antiphlogistika (z. B. Acetylsalicylsäure, Indometacin) sowie Phenytoin können die Wirkung von Spiro-D-Tablinen 50 mg bzw. 100 mg abschwächen. Bei Patienten, die eine Hypovolämie entwickeln, oder bei Dehydratation kann die gleichzeitige Gabe nicht steroidaler Antiphlogistika ein akutes Nierenversagen auslösen.
Probenecid, Methotrexat und andere Arzneimittel, die wie Furosemid in der Niere beträchtlich tubulär sezerniert werden, können die Wirkung von Spiro-D-Tablinen 50 mg bzw. 100 mg abschwächen. Umgekehrt kann Furosemid die renale Elimination dieser Arzneimittel verringern, was bei hoch dosierter Behandlung zu erhöhten Serumspiegeln und zu einem größeren Nebenwirkungsrisiko führen kann.
Bei gleichzeitiger Behandlung mit herzwirksamen Glykosiden ist zu beachten, dass bei einer sich unter der Behandlung mit Spiro-D-Tablinen 50 mg bzw. 100 mg entwickelnden Hypokaliämie und/oder Hypomagnesiämie die Empfindlichkeit des Myokards gegenüber herzwirksamen Glykosiden erhöht ist. Dadurch können Wirkungen und Nebenwirkungen der herzwirksamen Glykoside verstärkt werden.
Es besteht ein erhöhtes Risiko von Herzrhythmusstörungen (Kammerarrhythmien inklusive Torsade de pointes) bei gleichzeitiger Anwendung von Arzneimitteln, die ein Syndrom des verlängerten QT-Intervalls verursachen können (z. B. Terfenadin, einige Antiarrhythmika der Klassen I und III), und beim Vorliegen von Elektrolytstörungen.
Spironolacton kann über eine Verlängerung der Digoxin-Halbwertszeit zu erhöhten DigoxinPlasmaspiegeln führen.
Spironolacton kann mit der RIA-Bestimmung der Digoxin-Serumkonzentration interferieren. Neomycin kann die Resorption von Spironolacton verzögern.
Colestyramin: Hyperkaliämie kann im Zusammenhang mit einer hyperchlorämischen metabolischen Azidose bei Patienten auftreten, die Spironolacton zusammen mit Colestyramin anwenden.
Die Ototoxizität von Aminoglykosiden (z. B. Kanamycin, Gentamicin, Tobramycin) und anderen ototoxischen Arzneimitteln (z. B. Cisplatin) kann bei gleichzeitiger Anwendung von Furosemid verstärkt werden. Dabei auftretende Hörstörungen können irreversibel sein. Die gleichzeitige Anwendung der vorgenannten Arzneimittel sollte daher vermieden werden.
Bei gleichzeitiger Anwendung mit Cisplatin müssen Spiro-D-Tablinen 50 mg bzw. 100 mg mit besonderer Vorsicht gegeben werden, da es zu einer Verstärkung der Nephrotoxizität von Cisplatin kommen kann.
Furosemid kann die nephrotoxische Wirkung bestimmter Arzneimittel (z. B. Aminoglykoside, Cephalosporine, Polymyxine) verstärken. Bei Patienten, die gleichzeitig mit Furosemid und hohen Dosen bestimmter Cephalosporine behandelt werden, kann es zu einer Verschlechterung der Nierenfunktion kommen.
Die Wirkung von Antidiabetika oder blutdruckerhöhenden Sympathomimetika (z. B. Epinephrin, Norepinephrin) kann bei gleichzeitiger Anwendung von Furosemid abgeschwächt sein.
Die Wirkung von Theophyllin oder curareartigen Muskelrelaxanzien kann durch Furosemid verstärkt werden.
Die gleichzeitige Gabe von Furosemid und Lithium kann über eine verminderte Lithiumausscheidung zu einer Verstärkung der kardio- und neurotoxischen Wirkung des Lithiums führen. Daher wird empfohlen, bei Patienten, die gleichzeitig mit Lithiumsalzen behandelt werden, den Lithiumspiegel sorgfältig zu überwachen.
Bei der gleichzeitigen Therapie mit hoch dosierten Salicylaten kann deren Toxizität auf das zentrale Nervensystem durch Furosemid verstärkt werden.
Die zeitgleiche Einnahme von Spiro-D-Tablinen 50 mg bzw. 100 mg und Sucralfat ist zu vermeiden, da Sucralfat die Aufnahme von Furosemid vermindert und somit dessen Wirkung abschwächt. Die beiden Arzneimittel sollten daher in einem zeitlichen Abstand von mindestens 2 Stunden eingenommen werden.
Bei Patienten, die mit Risperidon behandelt werden, ist Vorsicht angezeigt, und Risiken und Nutzen der Kombination oder gleichzeitigen Behandlung mit Furosemid oder mit anderen stark wirksamen Diuretika sind vor der Therapieentscheidung abzuwägen. (Siehe Abschnitt 4.4 bezüglich der erhöhten Mortalität bei älteren Patienten mit Demenz, die gleichzeitig Risperidon erhalten.)
Die gleichzeitige Anwendung von Cyclosporin A und Furosemid ist mit einem erhöhten Risiko von Arthritis urica verbunden, als Folge einer durch Furosemid verursachten Hyperurikämie und einer Beeinträchtigung der renalen Harnsäureausscheidung durch Cyclosporin.
Bei Patienten mit hohem Risiko für eine Nierenschädigung durch Röntgenkontrastmittel trat unter Behandlung mit Furosemid eine Verschlechterung der Nierenfunktion nach einer Röntgenkontrastuntersuchung häufiger auf als bei Risikopatienten, die nur eine intravenöse Flüssigkeitszufuhr (Hydratation) vor der Kontrastuntersuchung erhielten.
Es wurden einzelne Fälle beschrieben, bei denen es nach intravenöser Gabe von Furosemid innerhalb von 24 Stunden nach Einnahme von Chloralhydrat zu Hitzegefühl, Schweißausbruch, Unruhe, Übelkeit, Blutdruckanstieg und Tachykardie kam. Eine solche Reaktion könnte auch mit Spiro-D-Tablinen 50 mg bzw. 100 mg auftreten.
4.6 Schwangerschaft und Stillzeit
Spiro-D-Tablinen 50 mg bzw. 100 mg sind in der Schwangerschaft und Stillzeit kontraindiziert (siehe Abschnitt 4.3).
Es liegen keine hinreichenden Daten für die Verwendung von Spironolacton bei Schwangeren vor. Tierexperimentelle Untersuchungen haben Feminisierung der Genitalien männlicher Nachkommen sowie Hinweise auf endokrine Störungen bei weiblichen und männlichen Nachkommen ergeben (siehe Abschnitt 5.3). Beim Menschen sind antiandrogene Wirkungen nachgewiesen worden die zu nicht eindeutig ausgebildeten äußeren Geschlechtsorganen (Zwitterbildung) bei männlichen Neugeborenen führen können.
Zur Ausscheidung von Spironolacton in die Muttermilch liegen keine Daten vor. Der pharmakologisch aktive Metabolit Canrenoat ist nachgewiesen worden (Milch/Plasma-Konzentrationsverhältnis 0,7).
Diuretika sind für die routinemäßige Therapie von Hypertonie und Ödemen in der Schwangerschaft nicht geeignet, da sie die Perfusion der Plazenta und damit das intrauterine Wachstum beeinträchtigen. Eine Verdrängung des Bilirubins aus der Albuminbindung und damit ein erhöhtes Kern-ikterusrisiko bei Hyperbilirubinämie wird für Furosemid diskutiert.
Furosemid passiert die Plazenta und erreicht im Nabelschnurblut 100 % der maternalen Serumkonzentration. Bisher sind keine Fehlbildungen beim Menschen bekannt geworden, die mit einer Furosemid-Exposition in Zusammenhang stehen könnten. Es liegen jedoch zur abschließenden Beurteilung einer eventuellen schädigenden Wirkung auf den Embryo/Fötus keine ausreichenden Erfahrungen vor. Beim Feten kann dessen Urinproduktion in utero stimuliert werden. Bei der Behandlung von Frühgeborenen mit Furosemid wurde das Auftreten von Urolithiasis beobachtet.
Furosemid wird in die Muttermilch ausgeschieden und hemmt die Laktation.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Diese Arzneimittel können auch bei bestimmungsgemäßem Gebrauch das Reaktionsvermögen so weit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr, zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt wird. Dies gilt in verstärktem Maße bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Erkrankungen des Blutes und des Lymphsystems:
Häufig: Hämokonzentration (bei übermäßiger Diurese).
Gelegentlich: Thrombozytopenie.
Selten: Leukopenie, Eosinophilie.
Sehr selten: hämolytische Anämie, aplastische Anämie, Agranulozytose.
Hinweise auf eine Agranulozytose können Fieber mit Schüttelfrost, Schleimhautveränderungen und Halsschmerzen sein.
Erkrankungen des Immunsystems:
Gelegentlich: allergische Haut- und Schleimhautreaktionen (siehe „Erkrankungen der Haut und des Unterhautzellgewebes“).
Selten: schwere anaphylaktische oder anaphylaktoide Reaktionen wie anaphylaktischer Schock (zur Behandlung siehe Abschnitt 4.9).
Erste Anzeichen für einen Schock sind u. a. Hautreaktionen wie Flush oder Urtikaria, Unruhe, Kopfschmerz, Schweißausbruch, Übelkeit, Zyanose.
Endokrine Erkrankungen:
Selten: Spironolacton kann bei Frauen zu einer Vertiefung der Stimmlage, bei Männern zu einer Erhöhung der Stimmlage führen. Stimmveränderungen können auch in Form von Heiserkeit auftreten. Eine Veränderung der Stimmlage geht bei manchen Patienten auch nach Absetzen von Spiro-D-Tablinen 50 mg bzw. 100 mg nicht zurück.
Stoffwechsel- und Ernährungsstörungen (siehe Abschnitt 4.4):
Sehr häufig: Elektrolytstörungen (einschließlich symptomatischer), Dehydratation und Hypovolämie (besonders bei älteren Patienten), Triglyceride im Blut erhöht.
Häufig: Hyperkaliämie (durch Spironolacton, insbesondere bei eingeschränkter Nierenfunktion), Hyponatriämie und Hypochlorämie (insbesondere bei eingeschränkter Zufuhr von Natriumchlorid und bei Aufnahme größerer Mengen Wasser), Cholesterin im Blut erhöht, Harnsäure im Blut erhöht und Gichtanfälle.
Gelegentlich: eingeschränkte Glucosetoleranz und Hyperglykämie. Bei Patienten mit manifestem Diabetes mellitus kann dies zu einer Verschlechterung der Stoffwechsellage führen. Ein latenter Diabetes mellitus kann manifest werden (siehe Abschnitt 4.4).
Häufigkeit nicht bekannt: Hypokaliämie (zu Behandlungsbeginn, insbesondere bei gleichzeitig verminderter Kaliumzufuhr und/oder erhöhten Kaliumverlusten, z. B. bei Erbrechen oder chronischer Diarrhö); Hypokalzämie, Hypomagnesiämie, metabolische Alkalose (unter Furosemid), hyperchlorämische metabolische Azidose (unter Spironolacton), Pseudo-Bartter-Syndrom (im Zusammenhang mit Missbrauch und/oder Langzeitanwendung von Furosemid).
Vorwiegend auftretende Elektrolytstörungen sind Hyperkaliämie und Hyponatriämie. Jedoch kann es zu Behandlungsbeginn infolge übermäßiger Kaliumausscheidung zu einer Hypokaliämie kommen.
Infolge übermäßiger Diurese kann es zu Hypovolämie und Hyponatriämie kommen. Dies kann sich in Appetitlosigkeit, Mundtrockenheit und Durst, Erbrechen, Kopfschmerzen bzw. Kopfdruck, Schwäche- und Schwindelgefühl, Schläfrigkeit, Sehstörungen, Apathie, Verwirrtheitszuständen, Muskelkrämpfen (z. B. Wadenkrämpfen) und Kreislaufstörungen äußern.
Im Zusammenhang mit einer Hypovolämie, Dehydratation oder Hyperkaliämie können Schwindel oder Krämpfe in den Beinen auftreten.
Daher ist es wichtig, unerwünschte Flüssigkeitsverluste (z. B. bei Erbrechen, Durchfall, starkem Schwitzen) auszugleichen. Störungen des Elektrolytgleichgewichts, insbesondere ausgeprägte Elektrolytstörungen, müssen korrigiert werden.
Als Folge der Elektrolytstörungen im Blut kann es zu Müdigkeit, Benommenheit, Muskelschwäche, Blutdruckabfall und Herzrhythmusstörungen kommen. Bei unregelmäßigem Pulsschlag, Müdigkeit oder Muskelschwäche (z. B. in den Beinen) muss besonders an die Möglichkeit einer Hyperkaliämie gedacht werden. Nach Einnahme von hohen Dosen wurden Lethargie und Verwirrtheitszustände beobachtet.
Unter der Gabe von Spironolacton als Monosubstanz werden - insbesondere bei Patienten mit eingeschränkter Nierenfunktion - häufig bedrohliche Hyperkaliämien beobachtet, die bis zum Auftreten von Muskellähmungserscheinungen (hyperkaliämischer Paralysen) und Herzrhythmusstörungen führen können.
Eine durch Furosemid verursachte Hypokaliämie kann sich in neuromuskulärer (Muskelschwäche, Parästhesien, Paresen), intestinaler (Erbrechen, Obstipation, Meteorismus), renaler (Polyurie, Polydipsie) und kardialer (Reizbildungs- und Reizleitungsstörungen) Symptomatik äußern. Schwere Kaliumverluste können zu einem paralytischen Ileus oder zu Bewusstseinsstörungen bis zum Koma führen.
Eine Hypokalzämie kann in seltenen Fällen eine Tetanie auslösen.
Als Folge einer Hypomagnesiämie wurde in seltenen Fällen eine Tetanie oder das Auftreten von Herzrhythmusstörungen beobachtet.
Es kann zu einem reversiblen Anstieg stickstoffhaltiger harnpflichtiger Stoffe kommen.
Erkrankungen des Nervensystems:
Häufig: hepatische Enzephalopathie bei Patienten mit Leberinsuffizienz (siehe Abschnitt 4.3). Gelegentlich: Kopfschmerzen, Schläfrigkeit, Verwirrtheitszustände, Ataxie.
Selten: Parästhesien.
Erkrankungen des Ohrs und des Labyrinths:
Gelegentlich: Hörstörungen, meist reversibel, besonders bei Patienten mit Niereninsuffizienz oder einer Hypoproteinämie (z. B. bei nephrotischem Syndrom). Nach oraler oder intravenöser Gabe von Furosemid wurden Fälle von Taubheit berichtet, die teilweise irreversibel waren.
Selten: Tinnitus.
Gefäße rkrankungen:
Selten: Vaskulitis.
Häufigkeit nicht bekannt: Hypotonie einschließlich Orthostasesyndrom (siehe Abschnitt 4.4), Thrombose (insbesondere bei älteren Patienten).
Bei übermäßiger Diurese können, insbesondere bei älteren Patienten und Kindern, Kreislaufbeschwerden (bis zum Kreislaufkollaps) auftreten, die sich vor allem als Kopfschmerz, Schwindel, Sehstörungen, Mundtrockenheit und Durst, Hypotonie und orthostatische Regulationsstörungen äußern.
Erkrankungen des Gastrointestinaltrakts:
Gelegentlich: Übelkeit.
Selten: Erbrechen, Diarrhö, Obstipation.
Sehr selten: akute Pankreatitis, Blutungen der Magenschleimhaut, gastrointestinale Ulcera (auch mit Blutungen).
Häufigkeit nicht bekannt: gastrointestinale Krämpfe (unter Spironolacton).
Leber- und Gallenerkrankungen:
Sehr selten: intrahepatische Cholestase und Transaminasen erhöht (unter Furosemid).
Häufigkeit nicht bekannt: Hepatotoxizität mit Ansteigen der Leberenzyme und histologisch nachgewiesener Hepatitis (unter Spironolacton).
Erkrankungen der Haut und des Unterhautzellgewebes:
Gelegentlich: Pruritus, Urtikaria, Ausschläge, bullöse Dermatitis, Erythema multiforme, Pemphigoid, Dermatitis exfoliativa, Purpura, Photosensibilität, Hirsutismus bei Frauen (durch Spironolacton).
Sehr selten: Erythema anulare, Lichen-ruber-planus-ähnliche Hautveränderungen, Haarausfall bis zur Alopezie, Lupus-ähnliches Syndrom.
Häufigkeit nicht bekannt: Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse, akute generalisierte exanthematische Pustulose (AGEP), Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen (DRESS).
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen:
Gelegentlich: Muskelkrämpfe (Wadenkrämpfe).
Sehr selten: Osteomalazie (nach Gabe von Spironolacton).
Erkrankungen der Nieren und Harnwege:
Sehr häufig: Kreatinin im Blut erhöht.
Häufig: Urinvolumen erhöht.
Selten: tubulointerstitielle Nephritis.
Häufigkeit nicht bekannt: Natrium im Urin erhöht, Chlorid im Urin erhöht, Blutharnstoff erhöht, Symptome einer Harnabflussbehinderung (z. B. bei Patienten mit Prostatahypertrophie, Hydro-nephrose, Ureterstenose) bis hin zur Harnsperre (Harnverhaltung) mit Sekundärkomplikationen (siehe Abschnitt 4.4), Nierenversagen (siehe Abschnitt 4.5), Nephrokalzinose und/oder Nephrolithiasis bei Frühgeborenen.
Erkrankungen der Geschlechtsorgane und der Brustdrüse:
Häufig: bei Frauen und Männern gesteigerte Berührungsempfindlichkeit der Brustwarzen, Brustspannung; meist reversible Gynäkomastie bei Männern (wegen der Ähnlichkeit von Spironolacton mit Geschlechtshormonen).
Gelegentlich: Mastodynie, Zwischenblutungen, Amenorrhö bei Frauen; Impotenz bei Männern (durch
Spironolacton).
Das Auftreten dieser Nebenwirkungen ist dosisabhängig.
Kongenitale, familiäre und genetische Erkrankungen:
Häufigkeit nicht bekannt: erhöhtes Risiko eines persistierenden Ductus arteriosus Botalli, wenn Frühgeborene in den ersten Lebenswochen mit Furosemid behandelt werden.
Allgemeine Erkrankungen:
Selten: Fieber.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Symptome einer Überdosierung
Das klinische Bild bei akuter oder chronischer Überdosierung ist vom Ausmaß des Wasser- und Elektrolytverlustes abhängig.
Überdosierung kann zu Hypotonie, orthostatischen Regulationsstörungen und Elektrolytstörungen (Hypo- oder Hyperkaliämie, Hyponatriämie, Hypochlorämie) oder Alkalose führen. Ausgeprägte Flüssigkeits- und Natriumverluste können infolge von Dehydratation und Hypovolämie zu Somnolenz und Verwirrtheitszuständen, zum Kreislaufkollaps, zur Hämokonzentration mit Thromboseneigung und zu einem akuten Nierenversagen führen. Bei raschen Wasser- und Elektrolytverlusten können delirante Zustandsbilder auftreten. Selten tritt ein anaphylaktischer Schock (Symptome: u. a. Schweißausbruch, Übelkeit, Zyanose, starker Blutdruckabfall, Bewusstseinsstörungen bis hin zum Koma) ein. Eine Hyperkaliämie kann zu Herzrhythmusstörungen (z. B. Vorhofflimmern, Kammerflimmern, AV-Block), Herzstillstand, EKG-Veränderungen (hohe zeltförmige T-Zacken und zunehmende Verbreiterung des QRS-Komplexes), Blutdruckabfall mit peripherem Kreislaufkollaps und neurologischen Störungen (schlaffe Lähmungen, Apathie, Verwirrtheitszustände) führen.
Therapiemaßnahmen bei Überdosierung
Bei Überdosierung oder Anzeichen einer Hypovolämie (Hypotonie, orthostatische Regulationsstörungen) muss die Behandlung mit Spiro-D-Tablinen 50 mg bzw. 100 mg umgehend abgesetzt werden.
Bei nur kurze Zeit zurückliegender Einnahme kann durch Maßnahmen der primären Giftelimination (induziertes Erbrechen, Magenspülung) oder resorptionsmindernde Maßnahmen (medizinische Kohle) versucht werden, die systemische Aufnahme von Spiro-D-Tablinen 50 mg bzw. 100 mg zu vermindern.
In schweren Fällen müssen unter intensivmedizinischen Bedingungen die vitalen Parameter überwacht sowie wiederholt Kontrollen des Wasser- und Elektrolythaushaltes, des Säure-BasenHaushaltes, des Blutzuckers und der harnpflichtigen Substanzen durchgeführt und Abweichungen gegebenenfalls korrigiert werden.
Bei Patienten mit Miktionsstörungen (z. B. bei Patienten mit Prostatahypertrophie) muss für freien Harnabfluss gesorgt werden, da eine plötzlich einsetzende Harnflut zu einer Harnsperre mit Überdehnung der Blase führen kann.
Spezifische Antidote gegen Spironolacton und Furosemid sind nicht bekannt.
Therapeutische Maßnahmen
- bei Hypovolämie und Hyponatriämie: Natrium- und Volumensubstitution.
- bei Kreislaufkollaps: Schocklagerung, falls nötig Schocktherapie.
- bei Hypokaliämie: Kaliumsubstitution.
- bei Hyperkaliämie: Bedrohliche Hyperkaliämien müssen unverzüglich einer Intensivbehandlung zugeführt werden.
Normalisierung des Verhältnisses zwischen intra- und extrazellulärer Kaliumkonzentration:
Natriumhydrogencarbonat erhöht über einen direkten Mechanismus die Kaliumaufnahme der Zelle: Infusion von 50-100 ml einer lmolaren (8,4%igen) Natriumhydrogencarbonatlösung i. v. (Wirkungseintritt: nach wenigen Minuten; Wirkungsdauer: mehrere Stunden).
Der Kaliumeinstrom in die Zelle wird besonders durch Glucose gefördert: z. B. 200 ml einer 25%igen (1,4 mol/l) Glucoselösung und 25 I. E. Altinsulin (1 I. E. Altinsulin pro 2 g Glucose) i. v. innerhalb von 30-60 Minuten infundieren (Wirkungsdauer: mehrere Stunden).
Elimination eines ggf. vorhandenen Kaliumüberschusses:
Nach den oben erwähnten Notfallmaßnahmen sollte überschüssiges Kalium durch längerfristig wirkende Maßnahmen aus dem Körper eliminiert werden. Lässt sich die renale Ausscheidung nicht steigern (z. B. durch Injektion von Furosemid), sind extrarenale Eliminationswege zu wählen. Hier ist die orale Gabe von Kationen-Austauscherharzen (z. B. Resonium A oder Calcium Resonium) zu empfehlen: 1 g der Harze bindet ca. 1 mmol Kalium im Darmlumen. Das gebundene Kalium wird mit den Fäzes ausgeschieden.
Lässt sich mit den o. g. Maßnahmen keine Normalisierung der extrazellulären Kaliumkonzentration erreichen, ist eine Peritoneal- oder Hämodialyse unumgänglich.
Sofortmaßnahmen bei anaphylaktischem Schock:
Bei den ersten Anzeichen (z. B. kutane Reaktionen wie Urtikaria oder Flush, Unruhe, Kopfschmerz, Schweißausbruch, Übelkeit, Zyanose):
- Venösen Zugang schaffen.
- Neben anderen gebräuchlichen Notfallmaßnahmen Kopf-Oberkörper-Tieflage, Atemwege freihalten, Applikation von Sauerstoff!
- Falls nötig sind weitere, ggf. auch intensivmedizinische Maßnahmen (u. a. Gabe von Epinephrin, Volumenersatzmittel, Glukokortikoid) einzuleiten.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Aldosteron-Antagonist und High-ceiling-Diuretikum,
ATC-Code: C03ED01.
Spironolacton
Spironolacton blockiert im spätdistalen Tubulus und im Sammelrohr kompetitiv die Bindung von Aldosteron an dessen zytoplasmatischen Rezeptor. Aldosteron kann dadurch nicht über seinen Rezeptor in den Zellkern eindringen, wodurch die Synthese der Aldosteron-induzierten Proteine unterbleibt. Damit wird der wesentlichen Aldosteronwirkung, der Natriumrückresorption und Kaliumsekretion, entgegengewirkt.
Aldosteronrezeptoren werden renal sowie extrarenal, z. B. in den Speicheldrüsen und im Darm, gefunden. Spironolacton entwickelt nur in Gegenwart von endogenem oder exogenem Aldosteron eigene Aktivität. Die Wirkung kann durch ansteigende Aldosteronspiegel aufgehoben werden.
Weder die Produktion noch die Ausscheidung von Aldosteron wird in therapeutischen Dosen verringert. Nur in extrem hoher Dosierung hemmt Spironolacton die Biosynthese des Aldosterons.
Spironolacton steigert die Natrium- und Chloridausscheidung sowie in geringem Maße die Calciumausscheidung; reduziert werden die Kalium- und Ammoniumausscheidung sowie die Azidität des Harns. Spironolacton vermindert die renale Magnesiumausscheidung.
Bei alleiniger Anwendung hat Spironolacton nur eine geringe diuretische Wirksamkeit. Durch zusätzliche Gabe von Thiaziden oder Schleifendiuretika kann die Natriurese weiter gesteigert werden.
Spironolacton kann über eine Senkung der glomerulären Filtrationsrate die Serumharnstoffkonzentration erhöhen.
Ein blutdrucksenkender Effekt bei Hypermineralokortikoidsyndromen bzw. bei verschiedenen Erkrankungen mit primärem oder sekundärem Hyperaldosteronismus ist erwiesen.
Furosemid
Furosemid ist ein starkes, kurz und schnell wirkendes Schleifendiuretikum. Es hemmt im aufsteigenden Teil der Henle-Schleife über eine Blockierung des Na+/K+/2Cl--Ionen-Carriers die Rückresorption dieser Ionen. Die fraktionelle Natriumausscheidung kann dabei bis zu 35 % des glomerulär filtrierten Natriums betragen. Als Folge der erhöhten Natriumausscheidung kommt es sekundär durch osmotisch gebundenes Wasser zu einer verstärkten Harnausscheidung und zu einer Steigerung der distal-tubulären K+-Sekretion. Ebenfalls erhöht ist die Ausscheidung der Ca2+- und Mg2+-Ionen. Neben den Verlusten an vorgenannten Elektrolyten kann es zu einer verminderten Harnsäureausscheidung und zu Störungen des Säure-Basen-Haushalts in Richtung metabolische Alkalose kommen.
Furosemid unterbricht den tubuloglomerulären Feed-back-Mechanismus an der Macula densa, so dass es zu keiner Abschwächung der saluretischen Wirksamkeit kommt.
Furosemid führt zu einer dosisabhängigen Stimulierung des Renin-Angiotensin-Aldosteron-Systems.
Furosemid wirkt blutdrucksenkend infolge einer gesteigerten Natriumchloridausscheidung und einer verminderten Ansprechbarkeit der glatten Gefäßmuskulatur auf vasokonstriktorische Reize sowie infolge einer Blutvolumenabnahme.
Furosemid führt bei Herzinsuffizienz akut zu einer Senkung der Vorlast des Herzens durch Erweiterung der venösen Kapazitätsgefäße. Dieser frühe vaskuläre Effekt scheint durch Prostaglandine vermittelt zu sein und setzt eine ausreichende Nierenfunktion mit Aktivierung des Renin-Angiotensin-Aldosteron-Systems und eine intakte Prostaglandinsynthese voraus.
5.2 Pharmakokinetische Eigenschaften
Spironolacton
Nach oraler Gabe wird Spironolacton rasch resorbiert (tmax 1-2 Stunden). Spironolacton unterliegt bei oraler Applikation einem ausgeprägten First-Pass-Effekt und wird zu 7-a-Thiospironolacton, Canrenon bzw. Canrenoat, 7-a-Thiomethylspironolacton bzw. 6-ß-Hydroxy-7-a-thiomethylspironolacton metabolisiert. Maximale Konzentrationen dieser Metaboliten treten nach etwa 2-3 Stunden auf. Die drei erstgenannten Metaboliten besitzen, verglichen mit der Muttersubstanz, eine relative antimineralokortikoide Aktivität von 26, 68 bzw. 33 %.
In niedrigen Dosierungen (50 bis etwa 200 mg) steigt die Fläche unter der Serumkonzentrations-Zeit-Kurve von Canrenon linear mit der Dosis an, während höhere Dosierungen zu relativ niedrigeren Konzentrationen führen, am ehesten bedingt durch eine Verminderung der enzymatischen Umwandlung von Spironolacton in seine Metaboliten.
Die Plasmaproteinbindung von Spironolacton und Canrenon beträgt in Abhängigkeit von der Methodik etwa 90 % (Gleichgewichtsdialyse) bzw. 98 % (Ultrafiltration). Die Elimination der Muttersubstanz erfolgt rasch (ti/2 etwa 1-2 Stunden), während die Metaboliten langsamer ausgeschieden werden. Die terminalen Halbwertszeiten betragen für Canrenon etwa 20 Stunden, für 7-a-Thiomethylspironolacton etwa 3 Stunden und für 6-ß-Hydroxy-7-a-thiomethylspironolacton etwa 10 Stunden.
Die Ausscheidung erfolgt überwiegend im Urin, in geringerem Ausmaß über die Galle. Der Anteil von unverändertem Spironolacton ist gering. Im Urin werden nur Metaboliten gefunden, vor allem Canrenon und sein Glukuronid-Ester sowie 6-ß-Hydroxysulfoxid.
Bei gleichzeitiger Einnahme mit einer Mahlzeit ist die Resorption von Spironolacton gesteigert. Dies resultiert aus einer Zunahme der Serumkonzentrationen der Muttersubstanz und Metaboliten um 50 bis 100 %.
Die diuretische Wirkung von Spironolacton setzt in der Regel langsam ein. Der Effekt ist etwa 23 Tage nach Therapiebeginn maximal und klingt etwa in der gleichen Zeit nach Absetzen des Arzneimittels wieder ab.
Spironolacton und seine Metaboliten penetrieren die Plazentaschranke. Canrenon geht in die Muttermilch über.
Furosemid
Nach oraler Applikation wird Furosemid zu 60 bis 70 % aus dem Gastrointestinaltrakt resorbiert. Bei Patienten mit chronischer Herzinsuffizienz oder nephrotischem Syndrom kann die Resorption auf weniger als 30 % reduziert sein.
Ein Wirkungseintritt kann nach ca. 30 Minuten erwartet werden.
Maximale Plasmaspiegel werden nach ca. 60 Minuten gemessen. Die Plasmaproteinbindung von Furosemid beträgt ca. 95 %; sie kann bei Niereninsuffizienz um bis zu 10 % reduziert sein. Das relative Verteilungsvolumen liegt bei 0,2 l/kg KG (bei Neugeborenen 0,8 l/kg KG).
Furosemid wird in der Leber nur geringgradig (ca. 10 %) metabolisiert und überwiegend unverändert ausgeschieden. Die Elimination erfolgt zu zwei Dritteln renal, zu einem Drittel über Galle und Fäzes.
Die Eliminationshalbwertszeit liegt bei normaler Nierenfunktion bei ca. 60 Minuten; sie kann bei terminaler Niereninsuffizienz auf bis zu 24 Stunden verlängert sein.
5.3 Präklinische Daten zur Sicherheit
Spironolacton
In Langzeituntersuchungen an Ratten mit Spironolacton wurden in hohen, klinisch irrelevanten Dosierungen tumorigene Effekte in Schilddrüse, Hoden, Leber und Uterus beobachtet.
Furosemid
Langzeituntersuchungen an Ratte und Maus ergaben keine Hinweise auf ein tumorerzeugendes Potenzial.
Reproduktionstoxizität
Spironolacton
Feminisierende Wirkungen auf die äußeren Genitalien wurden bei den männlichen Nachkommen während der Trächtigkeit exponierter Ratten bei Tagesdosen von ca. 160 mg/kg Körpergewicht beobachtet. Endokrine Störungen bei beiden Geschlechtern (Veränderungen von
Hormonkonzentrationen im Plasma) wurden schon bei ca. 80 mg/kg, Verminderung der Prostatagewichte bei männlichen Jungtieren bei 40 mg/kg gefunden. Untersuchungen an Ratten und Mäusen haben keine Hinweise auf teratogene Wirkungen ergeben.
Furosemid
In Studien zur Reproduktionstoxikologie traten an Rattenfeten nach Gabe hoher Dosen eine verminderte Anzahl differenzierter Glomeruli, Skelettanomalien an Scapula, Humerus und Rippen (bedingt durch Hypokaliämie) sowie Hydronephrosen bei Maus- und Kaninchenfeten auf.
5.4 Bioverfügbarkeit
Spiro-D-Tablinen 50 mg:
Spironolacton als Canrenon
Eine im Jahre 1999 durchgeführte Bioverfügbarkeitsuntersuchung an 24 Probanden ergab im Vergleich zum Referenzpräparat (bestimmt wurde der aktive Metabolit Canrenon):
Testpräparat Referenzpräparat
|
Maximale Plasmakonzentration (Cmax) : |
100,3 (28,96) ng/ml |
97,24 (29,43) ng/ml |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax) (0,70) Std. |
2,49 (0,82) Std. |
2,81 |
|
Fläche unter der Konzentrations-ZeitKurve (AUC) |
1102,5 (326,5) ng ml-1 x h |
1106,2 (333,9) ng ml-1 x h |
Angabe der Werte als Mittelwert und Streubreite
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm:
concentration (ng/ml)
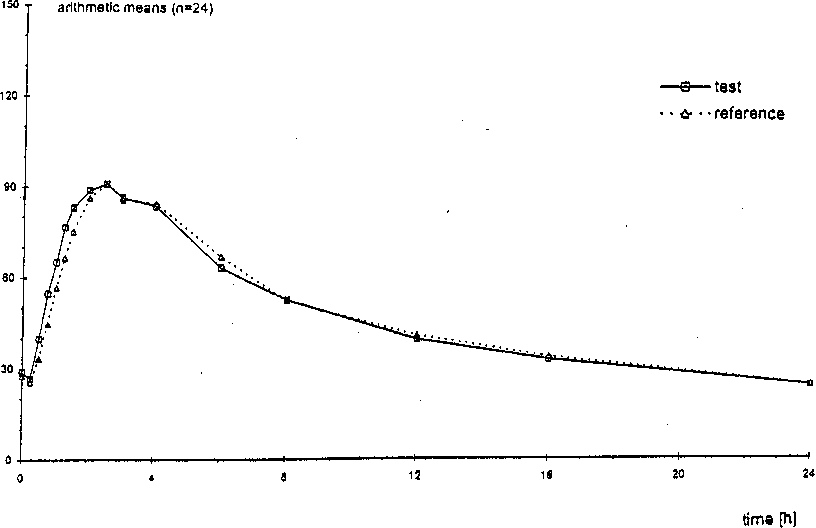
Eine im Jahre 1999 durchgeführte Bioverfügbarkeitsuntersuchung an 24 Probanden ergab im Vergleich zum Referenzpräparat:
Testpräparat
Referenzpräparat
Maximale Plasmakonzentration
(Cmax) : 573,8 (185,3) ng/ml 521,2 (168,4) ng/ml
Zeitpunkt der maximalen Plasmakonzentration
(tmax) 1,2 (0,72) Std. 1,44 (0,74) Std.
Fläche unter der Konzentrations-ZeitKurve (AUC) 1354,7 (390,2) 1171,1 (244,4)
ng ml-1 x h ng ml-1 x h
Angabe der Werte als Mittelwert und Streubreite
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm:
concentration (ng/mll
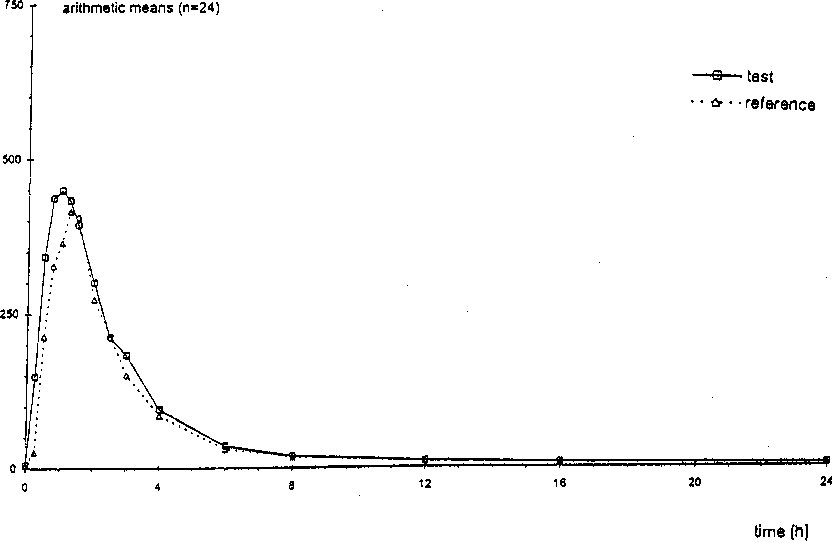
Spiro-D-Tablinen 100 mg:
Spironolacton als Canrenon
Eine im Jahre 1999 durchgeführte Bioverfügbarkeitsuntersuchung an 24 Probanden ergab im Vergleich zum Referenzpräparat (bestimmt wurde der aktive Metabolit Canrenon):
Testpräparat Referenzpräparat
Maximale Plasmakonzentration
(C
max) :
209,9 (± 54,14) ng/ml
172,7 (± 38) ng/ml
Zeitpunkt der maximalen Plasmakonzentration
(tmax)
2,36 (± 0,74) Std.
3,23 (± 1,17) Std.
2106,8 (± 678,6) ng ml-1 x h
1958,1 (± 587) ng ml-1 x h
Fläche unter der Konzentrations-ZeitKurve (AUC)
Angabe der Werte als Mittelwert und Streubreite
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Konzentrati ons -Zeit-Diagramm:
concentralion |ng/inl]
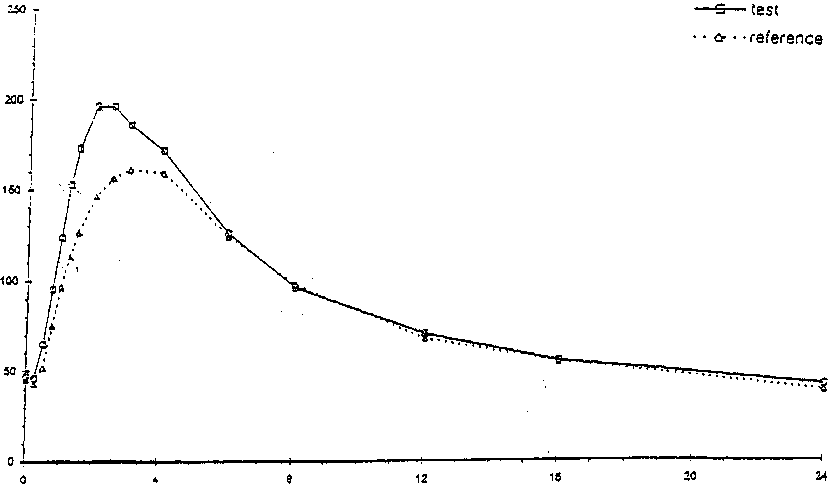
üme [h]
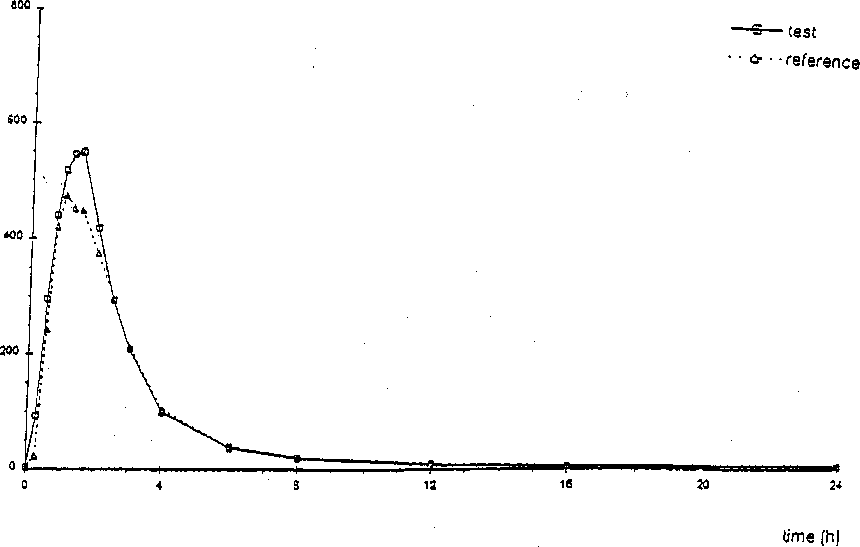
Eine im Jahre 1999 durchgeführte Bioverfügbarkeitsuntersuchung an 24 Probanden ergab im Vergleich zum Referenzpräparat:
Testpräparat
Referenzpräparat
Maximale Plasmakonzentration
(Cmax) : 720,3 (± 296,6) ng/ml
Zeitpunkt der maximalen Plasmakonzentration
(tmax) 1,27 (± 0,5) Std.
Fläche unter der Konzentrations-ZeitKurve (AUC) 1535,4 (± 576,9)
ng ml1 x h
652,5 (± 261,4) ng/ml
1,36 (± 0,67) Std.
1441,4 (± 520,5) ng ml-1 x h
Angabe der Werte als Mittelwert und Streubreite
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm:
concenl/alion (ng/ml)
PHARMAZEUTISCHE ANGABEN
6.
6.1 Liste der sonstigen Bestandteile
Calciumsulfat-Dihydrat, Maisstärke, Povidon K25, Magnesiumstearat (Ph. Eur.) [pflanzlich], hochdisperses Siliciumdioxid.
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
6.5 Art und Inhalt des Behältnisses PVC/Alublisterpackungen.
Originalpackungen mit 20, 50, 100 Tabletten.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Winthrop Arzneimittel GmbH
65927 Frankfurt am Main Telefon: (01 80) 2 02 00 101
Telefax: (01 80) 2 02 00 111
Mitvertrieb:
Zentiva Pharma GmbH 65927 Frankfurt am Main
8. ZULASSUNGSNUMMERN
Spiro-D-Tablinen 50 mg: 3320.00.00 Spiro-D-Tablinen 100 mg: 3320.01.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 27.06.1983
Datum der letzten Verlängerung der Zulassung: 25.06.2003
10. STAND DER INFORMATION
Juni 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig. 1
20
0,06 €/Anruf (dt. Festnetz); max. 0,42 €/min (Mobilfunk).