Staloral Birke 300 Ir/Ml
FACHTNFORMATION
1. BEZEICHNUNG DER ARZNEIMITTEL
STALORAL® Birke 10 I.R./ml und 300 I.R./ml STALORAL® Birke 300 I.R./ml
Lösungen zur sublingualen Anwendung
Wirkstoff: Allergenextrakt aus Birkenpollen
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 ml Lösung zur sublingualen Anwendung enthält 10 I.R. oder 300 I.R. eines Allergenextraktes aus Birkenpollen.
I.R. (Reaktivitätsindex): Der Reaktivitätsindex eines Allergenextraktes ist definiert als 100 I.R./ml, wenn im Pricktest mit einer Stallerpoint®-Nadel bei 30 gegen das Allergen sensibilisierten Patienten eine Quaddel von 7 mm Durchmesser (geometrisches Mittel) entsteht. Die Hautreaktivität dieser Patienten wird gleichzeitig mit 9 %igem Codeinphosphat oder 10 mg/ml Histamindihydrochlorid als Positivkontrolle gezeigt.
Sonstiger Bestandteil mit bekannter Wirkung: Natrium (1 mmol/ml).
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Lösung zur sublingualen Anwendung Klare, farblose Lösung.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
STALORAL® Birke ist ein Allergenextrakt zur spezifischen Immuntherapie allergischer Erkrankungen vom Soforttyp (Typ 1-Allergien nach der Einteilung von Coombs und Gell) bei Erwachsenen, ausgelöst durch Birkenpollen, die sich in Form von Rhinitis, Konjunktivitis, Rhinokonjunktivitis und/oder mildem Asthma manifestieren.
4.2 Dosierung und Art der Anwendung
Die Behandlung mit STALORAL® Birke sollte nur von Ärzten mit entsprechender Ausbildung und Erfahrung in der Behandlung von allergischen Erkrankungen verschrieben werden.
Die spezifische Immuntherapie sollte möglichst unmittelbar nach Stellung der Indikation beginnen.
Diese Therapie sollte als Behandlung der ersten Wahl bei jungen Erwachsenen eingesetzt werden, sofern deren Symptomatik dies rechtfertigt.
Die Wirksamkeit von STALORAL® Birke ist bisher nur an Erwachsenen belegt.
Für Kinder unter 6 Jahren und Jugendliche über 15 Jahren liegen keine Daten vor. Für Kinder im Alter von 6 bis 14 Jahren existieren wenig klinische Daten. Eine Wirksamkeit kann nicht belegt werden, jedoch lassen Daten zur Sicherheit kein höheres Risiko als gegenüber Erwachsenen erkennen.
Dosierung
Die Dosierung ist vom Alter unabhängig, aber sie sollte sich nach der individuellen Reaktivität jedes Patienten richten.
Die Therapie wird in zwei Schritten durchgeführt:
- Einleitungsbehandlung mit progressiv ansteigender Dosierung,
- Fortsetzungsbehandlung mit konstanter Dosierung.
Einleitungsbehandlung: Dosissteigerung
Das Arzneimittel ist täglich und in ansteigender Dosierung nach dem folgenden Therapieschema bis zum Erreichen der Erhaltungsdosis einzunehmen:
|
1. Woche |
2. Woche | ||||
|
Konzentration: 10 I.R./ml |
Konzentration: 300 I.R./ml | ||||
|
(blaue Kappe) |
(lila Kappe) | ||||
|
Tag |
Anzahl der Hübe* |
Dosierung (IR) |
Tag |
Anzahl der Hübe* |
Dosierung (IR) |
|
1 |
1 |
1 |
7 |
1 |
30 |
|
2 |
2 |
2 |
8 |
2 |
60 |
|
3 |
4 |
4 |
9 |
4 |
120 |
|
4 |
6 |
6 |
10 |
6 |
180 |
|
5 |
8 |
8 |
11 |
8 |
240 |
|
6 |
10 |
10 | |||
* 1 Hub entspricht einem Pumpstoß mit 100 pl Lösung.
Dieses Therapieschema dient nur zur Orientierung und muss in Abhängigkeit von dem Zustand des Patienten sowie möglicherweise auftretenden Reaktionen individuell angepasst werden.
Fortsetzungsbehandlung: Konstante Dosis
Die erreichte Höchstdosis wird entweder jeden Tag oder jeden zweiten Tag eingenommen. Im Allgemeinen ist die tägliche Einnahme verglichen mit der Einnahme jeden zweiten Tag mit einer besseren Compliance verbunden. Daher wird die tägliche Einnahme empfohlen.
Die empfohlene Dosierung entspricht mindestens 8 Hüben jeden zweiten Tag oder 4 Hüben STALORAL® Birke 300 I.R./ml täglich, wenn dies die maximal tolerierte Konzentration ist.
Die erreichte Erhaltungsdosis wird auch während der Pollenflugzeit unverändert weiter eingenommen.
Eine Dosierung entsprechend 10 Hüben der Lösung mit 300 I.R./ml täglich wurde in klinischen Studien gut vertragen.
Einnahmeunterbrechung
Im Fall der Einnahmeunterbrechung ist zwischen der Einleitungsbehandlung (Dosissteigerung) und der Fortsetzungsbehandlung mit der gut vertragenen Höchstdosis zu unterscheiden. Es gelten folgende allgemeine Empfehlungen, von denen jedoch gegebenenfalls individuell abgewichen werden muss.
- Bei Unterbrechung der Einleitungsbehandlung
Diese sollte möglichst nicht unterbrochen werden. Falls doch, so gilt:
Wiederbeginn mit etwa der Hälfte der letzten Dosis und Fortsetzung der Einleitungsbehandlung wie im Abschnitt „Einleitungsbehandlung: Dosissteigerung“ beschrieben.
- Bei Unterbrechung der Fortsetzungsbehandlung
Wiederbeginn mit etwa der Hälfte der letzten Dosis und Steigerung auf die alte, gut vertragene Erhaltungsdosis wie im Abschnitt „Einleitungsbehandlung: Dosissteigerung“ beschrieben.
Art der Anwendung
STALORAL® Birke ist ausschließlich zur sublingualen Anwendung bestimmt.
Die Lösung darf nicht injiziert werden.
Die Lösung wird tagsüber eingenommen, nicht zusammen mit Nahrung oder Getränken.
Die vorgeschriebene Menge der Lösung wird mit Hilfe der Dosierpumpe direkt unter die Zunge appliziert. Sie verbleibt für zwei Minuten unter der Zunge und wird danach hinuntergeschluckt.
Dauer der Anwendung
Es wird empfohlen, die Behandlung etwa 4 Monate vor der Pollenflugzeit zu beginnen und während der Saison fortzuführen.
Im Allgemeinen sollte eine spezifische Immuntherapie für die Dauer von 3 bis 5 Jahren weitergeführt werden.
Tritt keine Besserung der Symptome nach der ersten Saison ein, sollte die Indikationsstellung für STALORAL® Birke überprüft werden.
4.3 Gegenanzeigen
Überempfindlichkeit gegen einen der in Abschnitt 6.1 genannten sonstigen Bestandteile, Autoimmunerkrankungen, Immunkomplexerkrankungen oder Immunschwächeerkrankungen, maligne Erkrankung, Patienten mit unkontrolliertem oder schwerem Asthma (FEV1 < 70 % des Vorhersagewertes), Entzündungen in der Mundhöhle wie z. B. oraler Lichen planus, orale Ulzerationen oder orale Mykose (siehe Abschnitt 4.4).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Der Patient sollte den Arzt über zwischenzeitliche Erkrankungen oder eine Verschlechterung der allergischen Erkrankung informieren.
Vor Beginn einer spezifischen Immuntherapie ist die allergische Symptomatik nötigenfalls mit Hilfe einer geeigneten Behandlung zu stabilisieren. Die Behandlung sollte im Falle von schweren klinischen Symptomen der allergischen Erkrankung bei Beginn der Behandlung verschoben werden.
Patienten, denen eine sublinguale Allergenbehandlung verschrieben wurde, sollten immer auch die für eine symptomatische Behandlung üblichen Arzneimittel zur Verfügung stehen, z. B. Kortikoide, ß2-Sympathomimetika und H1-Antihistaminika (siehe Abschnitt 4.5).
Im Falle von entzündlichen Erkrankungen in der Mundhöhle, wie z. B. Mykosen, Aphthen, Schleimhautläsionen, Zahnverlust oder einem chirurgischen Eingriff in der Mundhöhle, einschließlich Zahnextraktion, sollte die Behandlung bis zur vollständigen Heilung unterbrochen werden.
Im Zusammenhang mit der sublingualen Immuntherapie wurden Fälle von eosinophiler Ösophagitis berichtet. Falls während der Behandlung mit STALORAL® Birke schwere oder anhaltende gastro-ösophageale Symptome (einschließlich Dysphagie oder Schmerzen in der Brust) auftreten, sollte die Einnahme von Staloral Birke unterbrochen und der Patient von einem Arzt untersucht werden. Die Therapie sollte nur auf Anweisung des Arztes wieder aufgenommen werden.
Bei Patienten, die mit trizyklischen Antidepressiva oder Monoaminoxidase (MAO-) Hemmern behandelt werden, sollte eine spezifische Immuntherapie erst nach sorgfältiger Abwägung erfolgen (siehe Abschnitt 4.5).
Patienten, die gleichzeitig mit Beta-Rezeptorblockern behandelt werden, reagieren bei der Behandlung schwerer systemischer Reaktionen (einschließlich Anaphylaxie) möglicherweise nicht auf die üblichen Dosen von Adrenalin (Epinephrin), da Betablocker den kardio-stimulierenden und bronchodilatierenden Wirkungen des von Adrenalins entgegenwirken (siehe Abschnitt 4.5).
1 ml der Lösung enthält 1 mmol (23 mg) Natrium (59 mg Natriumchlorid pro 1 ml Lösung). Dies ist bei Personen unter Natrium kontrollierter (natriumarmer/kochsalzarmer) Diät zu berücksichtigen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt. Aus klinischen Studien mit STALORAL® Birke wurden keine Wechselwirkungen mit Arzneimitteln zur Behandlung allergischer Symptome, wie Kortikoiden, ß2-Sympathomimetika und H1-Antihistaminika, berichtet. Dennoch können mögliche Wechselwirkungen nicht ausgeschlossen werden.
Schwere allergische Reaktionen können mit Adrenalin behandelt werden.
- Die Wirkungen des Adrenalins werden bei Patienten, die mit trizyklischen Antidepressiva oder Monoaminoxidase (MAO-) Hemmern behandelt werden, möglicherweise verstärkt.
- Die üblichen Dosen von Adrenalin sind bei Patienten, die gleichzeitig mit Betablockern behandelt werden, möglicherweise weniger oder nicht wirksam.
Dies kann lebensbedrohliche Folgen haben und ist vor Beginn der Therapie zu berücksichtigen.
Klinische Erfahrungen hinsichtlich einer gleichzeitigen Impfung während der Therapie mit STALORAL® Birke liegen nicht vor. STALORAL® Birke sollte am Tag einer antiviralen Impfung daher nicht eingenommen werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es gibt keine klinischen Daten zur Anwendung von STALORAL® Birke bei Schwangeren. Als Vorsichtsmaßnahme soll die Einleitung von STALORAL® Birke während der Schwangerschaft vermieden werden. Tritt eine Schwangerschaft während der Behandlung ein, kann die Behandlung unter engmaschiger Überwachung fortgesetzt werden.
Stillzeit
Es ist nicht bekannt, ob STALORAL® Birke in die Muttermilch übergeht.
Es wurden keine tierexperimentellen Studien durchgeführt, um den Übergang von STALORAL® Birke in die Muttermilch zu untersuchen.
Ein Risiko für Neugeborene/Kleinkinder kann nicht ausgeschlossen werden.
Es sollte erwogen werden, entweder das Stillen oder die STALORAL® Birke Therapie zu unterbrechen. Dabei sind sowohl der Nutzen der Therapie für die Frau als auch der Nutzen des Stillens für das Kind zu berücksichtigen.
Fertilität
Mit STALORAL® Birke wurden keine Studien zur Fertilität bei Tieren durchgeführt.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
STALORAL® Birke hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
a) Zusammenfassung des Sicherheitsprofils
Während der Behandlung mit STALORAL® Birke werden die Patienten Allergenen ausgesetzt, die allergische Reaktionen auslösen können. Diese Reaktionen können unmittelbar nach der Anwendung oder auch verzögert auftreten. Wie bei jeder sublingualen Immuntherapie treten Beschwerden am Verabreichungsort (z. B. oraler Pruritus) sehr häufig auf, während schwere allergische Reaktionen (wie schwere laryngopharyngeale Beschwerden oder systemische allergische Reaktionen) nur gelegentlich auftreten.
Die Verträglichkeit einer bereits verabreichten Dosis kann sich in Abhängigkeit vom Zustand des Patienten oder der Umweltbedingungen mit der Zeit ändern.
Eine symptomatische, antiallergische Vorbehandlung (zum Beispiel mit Antihistaminika) kann die Häufigkeit und Schwere von Nebenwirkungen reduzieren.
Im Falle des Auftretens von Nebenwirkungen sollte das Therapieregime überprüft werden. Informieren Sie die Patienten über die damit verbundenen Anzeichen und Symptome und veranlassen Sie, dass sie sich beim Auftreten dieser Anzeichen und Symptome sofort an einen Arzt wenden und die Behandlung abbrechen. Die Behandlung sollte erst nach Anordnung eines Arztes wieder aufgenommen werden.
b) Tabellarische Zusammenfassung der Nebenwirkungen
In zwei mit 645 Erwachsenen durchgeführten, Placebo-kontrollierten klinischen Studien berichteten 55 % der Anwender von STALORAL® Birke Nebenwirkungen im Vergleich zu 23 % der Placebo-Gruppe.
Die folgenden Nebenwirkungen wurden berichtet und sind gemäß der MedDRA-Konvention bezeichnet und nach Systemorganklassen und folgenden Häufigkeiten gegliedert:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1000 bis < 1/100)
|
Organsystem |
Häufigkeit |
Nebenwirkung |
|
Erkrankungen des Immunsystems |
Gelegentlich |
Überempfindlichkeit |
|
Psychiatrische Erkrankungen |
Gelegentlich |
Schlaflosigkeit |
|
Erkrankungen des Nervensystems |
Häufig |
Kopfschmerz |
|
Gelegentlich |
Parästhesie, Schwindelgefühl | |
|
Augenerkrankungen |
Häufig |
Konjunktivitis, Augenjucken |
|
Gelegentlich |
Augenödem | |
|
Erkrankungen des Ohrs und des Labyrinths |
Häufig |
Ohrenjucken |
|
Gelegentlich |
Erkrankung der Tuba eustachii | |
|
Erkrankungen der Atemwege, |
Häufig |
Rhinitis, Asthma, Rachenreizung, |
|
des Brustraums und Mediastinums |
pharyngeales Ödem | |
|
Gelegentlich |
Dysphonie, Husten, Bläschen im MundRachenraum, Dyspnoe | |
|
Erkrankungen des Gastrointestinaltrakts |
Sehr häufig |
Oraler Pruritus, Ödem des Mundes |
|
Häufig |
Lippenödem, Zungenödem, Parästhesie oral, Stomatitis, Beschwerden im Oropharynx | |
|
Gelegentlich |
Mundschmerzen, Ösophagusspasmus, Gastritis, Abdominalschmerz, Übelkeit, Diarrhö | |
|
Leber- und Gallenerkrankungen |
Gelegentlich |
Hyperbilirubinämie |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Häufig |
Pruritus, Erythem |
|
Gelegentlich |
Ekzem, Urtikaria | |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Gelegentlich |
Arthralgie |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Gelegentlich |
Asthenie, Ermüdung |
c) Beschreibung ausgewählter Nebenwirkungen
Wie bei jeder spezifischen Immuntherapie kann es auch bei der Therapie mit Staloral ®
Birke zu schweren allergischen Reaktionen (einschließlich schwere laryngopharyngeale Beschwerden durch die sublingualen Therapie) oder zu systemischen allergischen Reaktionen (akutes Einsetzen von Krankheitssymptomen unter Beteiligung von Haut, Schleimhautgewebe oder beiden, respiratorische Beeinträchtigung, anhaltende gastrointestinale Symptome oder Absenkung des Blutdrucks und/oder verbundene Symptome) kommen.
Folgende Nebenwirkungen wurden nach der Markteinführung zusätzlich berichtet: Mundtrockenheit, Geschmacksstörung, oropharyngeale Schwellung, Kehlkopfödem, Angioödem, Erbrechen, anaphylaktischer Schock, Lymphadenopathie, serumkrankheitähnliche Reaktion, Erkrankungen der Speicheldrüsen, Myalgie, Fieber und eosinophile Ösophagitis.
Patienten sollten Ihren Arzt über jedes Auftreten einer Nebenwirkung während einer Behandlung mit STALORAL® Birke informieren.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Str. 51-59, 63225 Langen, Tel: +49 6103 77 0, Fax: +49 6103 77 1234, Website: www.pei.de anzuzeigen.
4.9 Überdosierung
Bei einer erheblichen Überdosierung können die oben aufgeführten Nebenwirkungen verstärkt auftreten (siehe Abschnitt 4.8).
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Allergene, Allergen-Extrakte ATC-Code: V01AA05 Baumpollen
Der genaue Wirkungsmechanismus der im Rahmen einer spezifischen Immuntherapie gegebenen Allergene ist nicht bekannt. Folgende biologische Effekte, die möglicherweise an der Abschwächung allergischer Symptome beteiligt sind, konnten nachgewiesen werden:
- Initialer Anstieg der allergen-spezifischen IgE Titer ohne Änderung des Gesamtserum-IgE. Anschließend graduelles Absinken der Titer auf Basiswerte;
- Erscheinen von spezifischen Antikörpern (IgG), die als „blockierende Antikörper“ fungieren;
- Verlagerung der Aktivität der Th2- und Thl-Lymphozyten und Förderung der Produktion von Zytokinen (Verringerung von IL-4 und Erhöhung von IFN-y), welche die Produktion von IgE regulieren.
5.2 Pharmakokinetische Eigenschaften
Der größere Anteil der Allergene in STALORAL® Birke ist eine Mischung aus Proteinen und Glykoproteinen. Es ist keine Bioverfügbarkeit intakter Allergene im Blut zu erwarten. Aus diesem Grunde sind keine pharmakokinetischen Studien an Tieren oder Menschen durchgeführt worden, um das pharmakokinetische Profil und den Metabolismus von STALORAL® Birke zu untersuchen.
5.3 Präklinische Daten zur Sicherheit
Basierend auf Studien zur Genotoxizität mit Allergenextrakt aus Birkenpollen, der in STALORAL® Birke enthalten ist, lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Mannitol,
Natriumchlorid,
Glycerol,
Gereinigtes Wasser.
6.2 Inkompatibilitäten Keine bekannt.
6.3 Dauer der Haltbarkeit
- der Arzneimittel im unversehrten Behältnis: 3 Jahre
- der Arzneimittel nach Anbruch des Behältnisses: 4 Monate
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (2 °C - 8 °C). Nicht einfrieren.
Im Falle einer Umlagerung müssen die Flaschen in aufrechter Position bleiben.
Anwendungsfertige Flaschen mit montierter Dosierpumpe dürfen nur mit befestigtem Sicherheitsring in ihrer Packung transportiert werden.
Anwendungsfertige Flaschen dürfen während eines Fluges nicht im Gepäckraum transportiert werden.
6.5 Art und Inhalt des Behältnisses
Als Behältnis für 10 ml STALORAL® Birke Lösung werden 12 ml Typ I Glasflaschen mit Chlorobutyl-Stopfen und Aluminiumkapsel mit Plastikkappe verwendet.
Die Farbe der Plastikkappe kennzeichnet die Konzentration der Lösung:
Blau: 10 I.R./ml
Lila: 300 I.R./ml
Folgende Packungen sind erhältlich:
Standardbehandlung:
• Einleitungsbehandlung:
STALORAL® Birke 101.R./ml und 3001.R./ml
Kombinationspackung aus 1 x 10 ml STALORAL® Birke 10 I.R./ml und 3 x 10 ml STALORAL® Birke 300 I.R./ml
• Fortsetzungsbehandlung:
STALORAL® Birke 300 LR./ml
Originalpackung mit 3 x 10 ml STALORAL® Birke 300 I.R./ml
6.6 Besondere Vorsichtsmaßnahmen für die Entsorgung und sonstige Hinweise zur Handhabung
Handhabung
Zur Gewährleistung einer gleich bleibenden Qualität sind die Flaschen hermetisch durch eine Aluminiumkapsel mit Plastikkappe verschlossen.
Bei der ersten Anwendung ist folgendermaßen vorzugehen:
1. Plastikkappe abziehen.
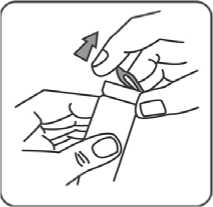
2. Nach Hochziehen der Metalllasche den Aluminiumverschluss vollständig entfernen.
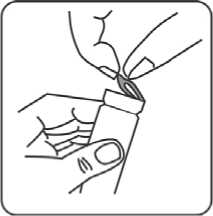
3. Grauen Gummistopfen entfernen.
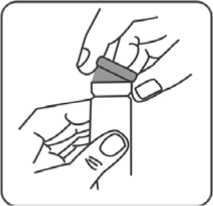
4. Pumpenaufsatz aus der Plastikhülle entnehmen. Flasche auf eine ebene Oberfläche stellen, mit einer Hand fixieren und den Pumpenaufsatz mit festem Druck in die Flasche einsetzen.
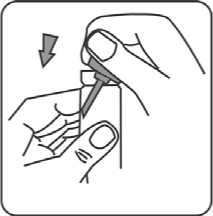
5. Sicherheitsring entfernen. Sicherheitsring nicht wegwerfen, da dieser beim Transport der Flasche wieder angebracht werden sollte, um die Pumpe zu verriegeln.
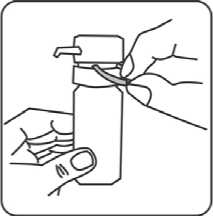
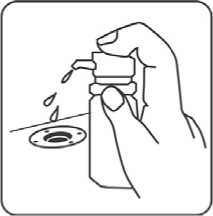
6. Kräftig pumpen (ca. fünfmal) bis erste Tröpfchen erscheinen.
7. Das Mundstück unter die Zunge platzieren. Wiederholt kräftig drücken, so dass ein durchgängiger Strahl entsteht, bis die Anzahl der verschriebenen Hübe erreicht ist. Die Lösung soll 2 Minuten unter der Zunge verbleiben.
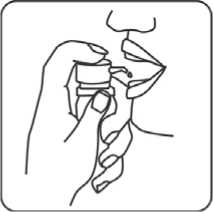
8. Reinigen des Mundstückes und Wiederaufsetzen des Sicherheitsringes.
Bei den folgenden Anwendungen werden nur noch die Schritte 7 und 8 ausgeführt. Entsorgung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Stallergenes GmbH Carl-Friedrich-Gauß-Str. 50 47475 Kamp-Lintfort Telefon: 02842/90 40-0 Telefax: 02842/90 40-165
8. ZULASSUNGSNUMMERN
STALORAL® Birke 10 I.R./ml und 300 I.R./ml PEI.H.03013.05.1
STALORAL® Birke 300 I.R./ml PEI.H.03013.03.1
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
STALORAL® Birke 10 I.R./ml und 300 I.R./ml 27.04.2005
STALORAL® Birke 300 I.R./ml 10.08.2004
10. STAND DER INFORMATION
Juli 2015
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
12