Striverdi Respimat 2,5 Mikrogramm/Hub Lösung Zur Inhalation
F achinformation
Boehringer n| \v Ingelheim
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen siehe Abschnitt 4.8.
1. BEZEICHNUNG DES ARZNEIMITTELS
Striverdi® Respimat® 2,5 Mikrogramm/Hub Lösung zur Inhalation
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Die abgegebene Menge beträgt 2,5 Mikrogramm Olodaterol pro Hub (als Olodaterolhydrochlorid).
Die abgegebene Menge ist die Menge, die für den Patienten nach Passieren des Mundstücks verfügbar ist.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Lösung zur Inhalation
Klare, farblose Lösung zur Inhalation
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Striverdi Respimat ist indiziert als Bronchodilatator zur Dauerbehandlung bei chronischer obstruktiver Lungenerkrankung (COPD).
4.2 Dosierung und Art der Anwendung
Dosierung
Das Arzneimittel ist nur zur Inhalation bestimmt. Die Patrone kann nur in den Respimat Inhalator eingesetzt und mit diesem verwendet werden.
Eine therapeutische Dosis besteht aus 2 Hüben aus dem Respimat Inhalator.
Erwachsene
Die empfohlene Tagesdosis beträgt 5 Mikrogramm Olodaterol, d. h. Inhalation von 2 Hüben aus dem Respimat Inhalator einmal täglich zur gleichen Tageszeit.
Die empfohlene Dosis darf nicht überschritten werden.
Ältere Patienten
Ältere Patienten können Striverdi Respimat in der empfohlenen Dosis anwenden.
Patienten mit Leberfunktionsstörung
Patienten mit leichter bis mittelgradiger Leberfunktionsstörung können Striverdi Respimat in der empfohlenen Dosis anwenden.
Zur Anwendung von Striverdi Respimat bei Patienten mit schwerer Leberfunktionsstörung liegen keine Daten vor.
Patienten mit Nierenfunktionsstörung
Patienten mit einer Nierenfunktionsstörung können Striverdi Respimat in der empfohlenen Dosis anwenden. Bei Patienten mit schwerer Nierenfunktionsstörung gibt es nur begrenzte Erfahrungen mit der Anwendung von Striverdi Respimat.
Kinder und Jugendliche
Es gibt keinen relevanten Nutzen von Striverdi Respimat bei Kindern und Jugendlichen unter 18 Jahren.
Art der Anwendung
Um die richtige Anwendung des Arzneimittels zu gewährleisten, soll der Patient von einem Arzt oder medizinisch-pharmazeutischem Fachpersonal im Gebrauch des Inhalators geschult werden.
Gebrauchsanweisung für Patienten
Striverdi Respimat Inhalator und Striverdi Respimat Patrone
Schutzkappc (A)
Mundstück
Lufrschlitze<C)
Auslöser (Di
Sucherheits
knöpf CE
Durchsichtiges
Gchauscuntertolll (G)
Dorn zum Auf
stechen der Patrone (I)
E.5 rTTKiiflP
Patrone CH)
Zählwerk \F\
1) Einsetzen der Patrone
Die folgenden Schritte 1 - 6 müssen vor der ersten Anwendung durchgeführt werden:
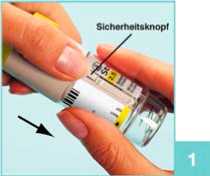
1
Drücken Sie bei geschlossener gelber Schutzkappe (A) auf den Sicherheitsknopf (E) und ziehen Sie währenddessen das durchsichtige Gehäuseunterteil (G) ab.

2a
Nehmen Sie die Patrone (H) aus der Schachtel. Schieben Sie das schmale Ende der Patrone in den Inhalator bis die Patrone einrastet.
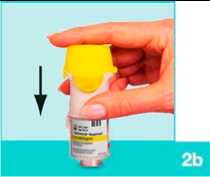
2b
Drücken Sie die Patrone fest gegen eine feste Oberfläche, um sicherzustellen, dass sie vollständig eingerastet ist.
Die Patrone schließt nicht bündig mit dem Inhalator ab, so dass der silberne Ring am unteren Ende der Patrone weiterhin sichtbar ist.
Die Patrone darf anschließend nicht wieder entfernt werden.

3
Stecken Sie das durchsichtige Gehäuseunterteil (G) wieder auf.
Das durchsichtige Gehäuseunterteil darf anschließend nicht wieder entfernt werden.
2) Vorbereitung des Striverdi Respimat Inhalators für die erstmalige Anwendung
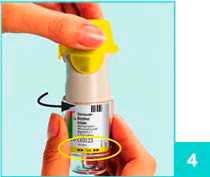
4
Halten Sie den Striverdi Respimat Inhalator mit geschlossener gelber Schutzkappe (A) senkrecht.
Drehen Sie das durchsichtige Gehäuseunterteil (G) in Pfeilrichtung (schwarze Pfeile auf dem Etikett) bis es einrastet (eine halbe Umdrehung).
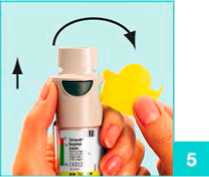
Öffnen Sie die gelbe Schutzkappe (A) bis zum Anschlag.

6
Halten Sie den Striverdi Respimat Inhalator in Richtung Boden und drücken Sie den Auslöser (D). Schließen Sie die gelbe Schutzkappe (A).
Wiederholen Sie die Schritte 4, 5 und 6 solange, bis eine sichtbare Sprühwolke austritt.
Wiederholen Sie anschließend die Schritte 4, 5 und 6 noch weitere 3-mal um sicherzustellen, dass der Inhalator gebrauchsfertig ist.
Der Striverdi Respimat Inhalator ist nun für die Anwendung bereit.
Die vorbereitenden Schritte 1 - 6 beeinträchtigen nicht die Anzahl der verfügbaren Dosen. Nach dieser Vorbereitung wird der Striverdi Respimat Inhalator die vorgesehenen 60 Hübe (30 therapeutische Dosen)abgeben._
Tägliche Anwendung des Striverdi Respimat Inhalators
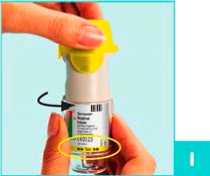
Wenden Sie den Striverdi Respimat Inhalator nur EINMAL TÄGLICH an. Inhalieren Sie dabei jeweils 2 HÜBE.
I
Halten Sie den Striverdi Respimat Inhalator mit geschlossener gelber Schutzkappe (A) senkrecht, um ein unbeabsichtigtes Auslösen zu verhindern.
Drehen Sie das durchsichtige Gehäuseunterteil (G) in Pfeilrichtung (schwarze Pfeile auf dem Etikett) bis es einrastet (eine halbe Umdrehung).
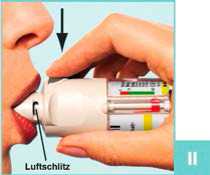
II
Öffnen Sie die gelbe Schutzkappe (A) bis zum Anschlag.
Atmen Sie langsam und tief aus, umschließen Sie dann das Ende des Mundstücks mit den Lippen, ohne dass die Luftschlitze (C) verdeckt sind.
Halten Sie den Striverdi Respimat Inhalator waagerecht in Richtung Rachen.
Atmen Sie langsam und tief durch den Mund ein, drücken Sie gleichzeitig den Auslöser (D) und atmen Sie weiter so lange wie möglich langsam ein.
Halten Sie den Atem möglichst 10 Sekunden lang an oder solange, dass es nicht unangenehm wird.
III
Wiederholen Sie die Schritte I und II, um die empfohlene therapeutische Dosis (2 HÜBE) zu inhalieren.
Wenden Sie diesen Inhalator nur EINMAL TÄGLICH an.
Schließen Sie die gelbe Schutzkappe bis zur nächsten Anwendung des Striverdi Respimat Inhalators.
Wenn der Striverdi Respimat Inhalator länger als 7 Tage nicht verwendet wurde, muss ein Hub in Richtung Boden abgegeben werden.
Wurde der Striverdi Respimat Inhalator länger als 21 Tage nicht verwendet, müssen die Schritte 4 - 6 erneut ausgeführt werden, bis eine sichtbare Sprühwolke austritt. Dann müssen die Schritte 4 - 6 noch weitere 3-mal wiederholt werden.
Wann ist ein neuer Striverdi Respimat Inhalator zu besorgen?

Der Striverdi Respimat Inhalator enthält 60 Hübe (30 therapeutische Dosen). Das Zählwerk zeigt in etwa an, wie viele Hübe noch vorhanden sind.
Wenn der Anzeiger den Anfang des roten Bereiches der Skala erreicht, sind noch etwa 14 Hübe (Dosis für 7 Tage) vorhanden. Zu diesem Zeitpunkt ist die Verordnung eines neuen Striverdi Respimat Inhalators notwendig.
Wenn der Anzeiger am Ende der roten Skala angelangt ist (d. h. wenn alle 60 Hübe = 30 therapeutische Dosen aufgebraucht sind), ist der Striverdi Respimat Inhalator leer und wird automatisch gesperrt. Das durchsichtige Gehäuseunterteil kann nicht mehr gedreht werden.
Spätestens 3 Monate nach der erstmaligen Anwendung sollte der Striverdi Respimat Inhalator entsorgt werden, selbst wenn das Arzneimittel noch nicht vollständig aufgebraucht ist._
Pflege des Inhalators
Reinigen Sie das Mundstück einschließlich der Metalldüse im Inneren des Mundstücks mindestens einmal wöchentlich mit einem feuchten Tuch oder Papiertuch.
Leichte Verfärbungen des Mundstücks haben keine Auswirkungen auf die Funktionsfähigkeit des Striverdi Respimat Inhalators.
Falls erforderlich, können Sie die Außenseite des Striverdi Respimat Inhalators mit einem feuchten Tuch abwischen.
4.3 Gegenanzeigen
Striverdi Respimat ist kontraindiziert bei Überempfindlichkeit gegen den Wirkstoff Olodaterol oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Asthma
Striverdi Respimat darf bei Asthma nicht angewendet werden. Die langfristige Wirksamkeit und Sicherheit von Olodaterol bei Asthma ist bisher nicht untersucht worden.
Akute Bronchospasmen
Als Bronchodilatator zur Dauerbehandlung mit einmal täglicher Anwendung darf Striverdi Respimat nicht zur Behandlung akuter Bronchospasmen, d. h. nicht als Notfallmedikament, eingesetzt werden.
Überempfindlichkeitsreaktionen
Wie bei allen Arzneimitteln sind nach der Anwendung von Striverdi Respimat allergische Reaktionen vom Soforttyp möglich.
Paradoxe Bronchospasmen
Wie andere Inhalativa kann auch Striverdi Respimat paradoxe Bronchospasmen auslösen, die lebensbedrohlich sein können. Falls ein paradoxer Bronchospasmus auftritt, muss Striverdi Respimat sofort abgesetzt und durch eine andere Therapie ersetzt werden.
Systemische Wirkungen
Lang-wirksame Beta2-Adrenozeptor-Agonisten dürfen bei Patienten mit kardiovaskulären Erkrankungen, insbesondere ischämischer Herzkrankheit, schwerer Herzinsuffizienz, Herzrhythmusstörungen, hypertropher obstruktiver Kardiomyopathie, Hypertonie oder einem Aneurysma, bei Patienten mit Krampfleiden oder Hyperthyreose, bei Patienten mit bekannter oder vermuteter Verlängerung des QT-Intervalls (d. h. QT-Zeit > 0,44 s) sowie bei Patienten, die ungewöhnlich empfindlich auf sympathomimetische Amine ansprechen, nur mit Vorsicht angewendet werden.
Patienten mit einem Herzinfarkt in den zurückliegenden 12 Monaten, mit instabilen oder lebensbedrohlichen Herzrhythmusstörungen, mit einem Krankenhausaufenthalt aufgrund einer Herzinsuffizienz in den zurückliegenden 12 Monaten oder mit paroxysmaler Tachykardie (Pulsrate > 100/min) waren von den klinischen Prüfungen ausgeschlossen. Daher ist die Erfahrung bei diesen Patientengruppen begrenzt. Striverdi Respimat darf bei diesen Patientengruppen nur mit Vorsicht angewendet werden.
Wirkungen auf das Herz-Kreislauf-Svstem
Wie andere Beta2-Adrenozeptor-Agonisten kann auch Olodaterol bei manchen Patienten klinisch relevante kardiovaskuläre Wirkungen zeigen, die sich in beschleunigtem Puls, erhöhtem Blutdruck und/oder anderen Symptomen äußern. In solchen Fällen kann es notwendig sein, die Behandlung abzubrechen. Darüber hinaus wurden unter der Behandlung mit Beta-Adrenozeptor-Agonisten EKG-Veränderungen beobachtet, z. B. eine Abflachung der T-Welle und eine Senkung der ST-Strecke. Die klinische Relevanz dieser Beobachtungen ist jedoch nicht bekannt.
Hypokaliämie
Beta2-Adrenozeptor-Agonisten können bei manchen Patienten eine signifikante Hypokaliämie auslösen, die zu unerwünschten kardiovaskulären Effekten führen kann. Der Abfall des SerumKaliumspiegels ist normalerweise vorübergehend und erfordert keine Supplementierung. Bei Patienten mit schwerer COPD kann die Hypokaliämie durch Hypoxie und die Begleittherapie verstärkt werden (siehe Abschnitt 4.5). Dies kann die Anfälligkeit für Herzrhythmusstörungen erhöhen.
Hyperglykämie
Die Inhalation hoher Dosen von Beta2-Adrenozeptor-Agonisten kann zu einem Anstieg des Blutzuckerspiegels führen.
Anästhesie
Bei einer anstehenden Operation unter Narkose mit halogenierten Kohlenwasserstoffen ist Vorsicht geboten, da die Anfälligkeit für die kardialen Nebenwirkungen von beta-adrenergen Bronchodilatatoren verstärkt sein kann.
Striverdi Respimat sollte nicht zusammen mit anderen lang-wirksamen Beta2-Adrenozeptor-Agonisten angewendet werden.
Patienten, die bisher regelmäßig (z. B. 4-mal täglich) kurz-wirksame Beta2-Adrenozeptor-Agonisten inhaliert haben, sollten angewiesen werden, diese nur noch zur Linderung bei akuten respiratorischen Symptomen anzuwenden.
Die Anwendung von Striverdi Respimat kann bei Dopingkontrollen zu positiven Ergebnissen führen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Adrenerge Wirkstoffe
Die gleichzeitige Anwendung anderer adrenerger Wirkstoffe (allein oder als Bestandteil einer Kombinationstherapie) kann die Nebenwirkungen von Striverdi Respimat verstärken.
Xanthin-Derivate, Steroide und Diuretika
Die gleichzeitige Behandlung mit Xanthin-Derivaten, Steroiden oder nicht kaliumsparenden Diuretika kann zu einer Verstärkung der hypokaliämischen Wirkung von Adrenozeptor-Agonisten führen (siehe Abschnitt 4.4).
Beta-Blocker
Beta-Rezeptorenblocker können die Wirkung von Striverdi Respimat abschwächen oder antagonisieren. Darum darf Striverdi Respimat nur zusammen mit Beta-Rezeptorenblockern (einschließlich Augentropfen) angewendet werden, wenn zwingende Gründe für die Anwendung vorliegen. Unter solchen Umständen können kardioselektive Beta-Blocker in Erwägung gezogen werden, doch sind diese mit Vorsicht anzuwenden.
MAO-Hemmer, trizyklische Antidepressiva sowie Wirkstoffe, die die QTc-Zeit verlängern Monoaminoxidase-Hemmer, trizyklische Antidepressiva oder andere Arzneimittel, die bekanntermaßen das QTc-Intervall verlängern, können die Wirkung von Striverdi Respimat auf das Herz-Kreislauf-System verstärken.
Pharmakokinetische Arzneimittel-Wechselwirkungen
In Arzneimittel-Wechselwirkungsstudien mit gleichzeitiger Anwendung von Fluconazol, als beispielhaftem Inhibitor der CYP2C9, wurden keine relevanten Auswirkungen auf die systemische Exposition gegenüber Olodaterol beobachtet.
Die gleichzeitige Anwendung von Ketoconazol, als potentem P-Glykoprotein- und CYP-Inhibitor, erhöhte die systemische Exposition gegenüber Olodaterol um ca. 70 %. Eine Dosisanpassung ist nicht erforderlich.
Die gleichzeitige Anwendung von Olodaterol und Tiotropium hatte bei beiden Wirkstoffen keine relevanten Auswirkungen auf die systemische Exposition.
In-vitro-Untersuchungen haben gezeigt, dass Olodaterol bei den im klinischen Alltag gemessenen Plasmakonzentrationen weder das CYP-Enzymsystem noch Wirkstoff-Transportproteine hemmt.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Bisher gibt es keine Erfahrungen mit der Anwendung von Striverdi Respimat bei Schwangeren. Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte schädigende Wirkungen im Sinne einer Reproduktionstoxizität. Vorsichtshalber soll eine Anwendung von Striverdi Respimat während der Schwangerschaft vermieden werden.
Wie andere Beta2-Adrenozeptor-Agonisten könnte Olodaterol aufgrund eines relaxierenden Effekts auf die Uterusmuskulatur den Geburtsvorgang hemmen.
Stillzeit
Bisher gibt es keine Erfahrungen mit der Anwendung von Striverdi Respimat bei stillenden Frauen. Es ist nicht bekannt, ob Olodaterol und/oder seine Metabolite in die Muttermilch übergehen. Die verfügbaren pharmakokinetischen/toxikologischen Daten vom Tier haben gezeigt, dass Olodaterol und/oder seine Metabolite in die Milch übergehen.
Bei stillenden Müttern ist die systemische Exposition gegenüber Olodaterol und/oder seinen Metaboliten bei der therapeutischen Dosis von 5 Mikrogramm/Tag vernachlässigbar. Bedeutsame Auswirkungen auf das gestillte Kind sind daher nicht zu erwarten.
Die Entscheidung, ob das Stillen unterbrochen oder auf die Behandlung mit Striverdi Respimat verzichtet bzw. die Behandlung unterbrochen werden soll, sollte unter Berücksichtigung der Vorteile des Stillens für das Kind und der Vorteile der Therapie für die Stillende getroffen werden.
Fertilität
Klinische Daten zur Fertilität liegen für Striverdi Respimat nicht vor. In präklinischen Studien mit Olodaterol zeigten sich keine schädlichen Auswirkungen auf die Fertilität.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
Jedoch sollte den Patienten mitgeteilt werden, dass in klinischen Studien Schwindelanfälle aufgetreten sind und sie daher beim Autofahren oder beim Bedienen von Maschinen vorsichtig sein sollten. Beim Auftreten von Schwindel sollten die Patienten potenziell gefährliche Tätigkeiten wie Autofahren oder das Bedienen von Maschinen vermeiden.
4.8 Nebenwirkungen
a) Zusammenfassung des Sicherheitsprofils
Die häufigsten Nebenwirkungen bei der empfohlenen Dosierung waren Nasopharyngitis, Schwindel, Hypertonie, Ausschlag (Rash) und Arthralgie. Diese Nebenwirkungen waren im Allgemeinen von leichter bis mittelgradiger Ausprägung.
b) Tabellarische Zusammenfassung der Nebenwirkungen
Die Häufigkeiten der unten aufgelisteten Nebenwirkungen basieren auf dem Auftreten dieser unerwünschten Arzneimittelwirkungen (d. h. Ereignisse, die Olodaterol zugeordnet werden) in der 5-Mikrogramm-Olodaterol-Dosisgruppe (insgesamt 1.035 Patienten). Es handelt sich um Daten aus 6 gepoolten, Placebo-kontrollierten klinischen Prüfungen in Parallelgruppen bei COPD-Patienten, mit einer Behandlungsdauer zwischen 4 und 48 Wochen.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10); Häufig (> 1/100 bis < 1/10); Gelegentlich (> 1/1.000 bis < 1/100); Selten (> 1/10.000 bis < 1/1.000); Sehr selten (< 1/10.000); Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Systemorganklasse / Häufigkeit
MedDRA Terminologie
Infektionen und parasitäre Erkrankungen Nasopharyngitis Gelegentlich
Erkrankungen des Nervensystems
Schwindel Gelegentlich
Gefäßerkrankungen
Hypertonie Selten
Erkrankungen der Haut und des Unterhautzellgewebes Hautausschlag (Rash) Gelegentlich
Skelettmuskulatur-. Bindegewebs- und Knochenerkrankungen Arthralgie Selten
c) Beschreibung ausgewählter Nebenwirkungen
Ein Hautausschlag (Rash) kann als Überempfindlichkeitsreaktion auf Striverdi Respimat angesehen werden. Wie bei allen topisch angewendeten Arzneimitteln könnten auch andere Überempfindlichkeitsreaktionen auftreten.
d) Nebenwirkungsprofil von Beta2-Agonisten
Striverdi Respimat gehört zur Gruppe der lang-wirksamen Beta2-Adrenozeptor-Agonisten. Daher ist auf Anzeichen für bekannte Nebenwirkungen der Beta-Adrenozeptor-Agonisten zu achten, wie Tachykardie, Arrhythmie, Palpitationen, Myokardischämie, Angina pectoris, Hypertonie oder Hypotonie, Tremor, Kopfschmerzen, Nervosität, Insomnie, Schwindel, Mundtrockenheit, Übelkeit, Muskelkrämpfe, Erschöpfung, Unwohlsein, Hypokaliämie, Hyperglykämie und metabolische Azidose.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte,
Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn,
Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome
Eine Überdosierung von Olodaterol führt voraussichtlich zu den für Beta2-Adrenozeptor-Agonisten typischen Symptomen, z. B. Myokardischämie, Hypertonie oder Hypotonie, Tachykardie, Arrhythmie, Palpitationen, Schwindel, Nervosität, Insomnie, Angstzustände, Kopfschmerzen, Tremor, Mundtrockenheit, Muskelkrämpfe, Übelkeit, Erschöpfung, Unwohlsein, Hypokaliämie, Hyperglykämie und metabolische Azidose.
Behandlung von Intoxikationen
Die Behandlung mit Striverdi Respimat sollte abgebrochen werden. Eine unterstützende und symptomatische Behandlung ist angezeigt, in schweren Fällen eine Krankenhauseinweisung. Wenn die Anwendung eines kardioselektiven Beta-Blockers erwogen wird, ist größtmögliche Vorsicht geboten, da Beta-Blocker Bronchospasmen auslösen können.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Mittel bei obstruktiven Atemwegserkrankungen, selektive Beta2-Adrenozeptor-Agonisten; ATC-Code: R03AC19
Wirkmechanismus
Olodaterol weist eine hohe Affinität und hohe Selektivität für den humanen Beta2-Adrenozeptor auf. In-vitro-Untersuchungen haben gezeigt, dass Olodaterol an Beta2-Adrenozeptoren eine 241-fach stärkere agonistische Wirkung als an Betai-Adrenozeptoren und eine 2.299-fach stärkere agonistische Wirkung als an Beta3-Adrenozeptoren ausübt.
Die pharmakologischen Wirkungen dieses Wirkstoffes beruhen auf der Bindung und Aktivierung von Beta2-Adrenozeptoren nach topischer Verabreichung durch Inhalation.
Die Aktivierung dieser Rezeptoren in den Atemwegen führt zu einer Stimulierung der intrazellulären Adenylatzyklase, eines Enzyms, das die Synthese von zyklischem Adenosin-3',5'-monophosphat (cAMP) vermittelt. Ein erhöhter cAMP-Spiegel löst über die Relaxation der glatten Muskulatur in den Atemwegen eine Bronchodilatation aus.
Olodaterol verfügt über das präklinische Profil eines lang-wirksamen selektiven Beta2-Adrenozeptor-Agonisten (LABA) mit schnellem Wirkungseintritt und einer Wirkdauer von mindestens 24 Stunden.
Beta Adrenozeptoren werden in drei Subtypen eingeteilt, wobei Beta1-Adrenozeptoren vorwiegend in der Herzmuskulatur, Beta2-Adrenozeptoren vorwiegend in der glatten Muskulatur der Atemwege und Beta3-Adrenozeptoren überwiegend im Fettgewebe exprimiert werden. Beta2-Agonisten führen zur Bronchodilatation. Der Beta2-Adrenozeptor ist zwar der vorherrschende adrenerge Rezeptor in der glatten Muskulatur der Atemwege, doch findet er sich auch auf der Oberfläche verschiedener anderer Zellen, z. B. auf Lungenepithel- und Endothelzellen und im Herzen. Die genaue Funktion der Beta2-Rezeptoren im Herzen ist nicht bekannt, doch lässt ihr Vorhandensein darauf schließen, dass selbst hochselektive Beta2-Adrenozeptor-Agonisten kardiale Wirkungen ausüben könnten.
Die Auswirkungen von Olodaterol auf das QT/QTc-Intervall im EKG wurden in einer doppelblinden, randomisierten, Placebo- und Verum-(Moxifloxacin-)kontrollierten Studie an 24 gesunden männlichen und weiblichen Freiwilligen untersucht. Olodaterol in Einzeldosen von 10, 20, 30 und 50 Mikrogramm führte im Vergleich zu Placebo über einen Zeitraum von 20 Minuten bis 2 Stunden nach der Verabreichung zu einer dosisabhängigen Zunahme der mittleren Veränderung des QT-Intervalls gegenüber Baseline: von 1,6 ms (10 Mikrogramm Olodaterol) bis 6,5 ms (50 Mikrogramm Olodaterol). Nach individueller Korrektur der QT-Zeiten lag die Obergrenze des zweiseitigen 90 %-Konfidenzintervalls auf allen Dosisstufen bei weniger als 10 ms.
Die Effekte von 5 Mikrogramm und 10 Mikrogramm Striverdi Respimat auf die Herzfrequenz und den Herzrhythmus wurden im Rahmen der 48-wöchigen Placebo-kontrollierten Phase-III-Studien anhand einer kontinuierlichen EKG-Aufzeichnung über 24 Stunden (Langzeit-EKG) in einer Untergruppe von 772 Patienten beurteilt. Dabei wurden hinsichtlich der Größenordnung der mittleren Veränderungen von Herzfrequenz oder Extrasystolen keine dosis- oder zeitbedingten Tendenzen oder Muster beobachtet. Abweichungen der Extrasystolen gegenüber Baseline gegen Ende der Behandlung waren kein Anzeichen für bedeutsame Unterschiede zwischen 5 Mikrogramm bzw. 10 Mikrogramm Olodaterol und Placebo.
Klinische Wirksamkeit und Sicherheit
Das klinische Phase-III-Entwicklungsprogramm für Striverdi Respimat umfasste vier Paare von replizierten, randomisierten, doppelblinden, Placebo-kontrollierten Studien mit 3.533 COPD-Patienten (1.281 Patienten erhielten die 5 Mikrogramm-Dosis und 1.284 Patienten die 10 Mikrogramm-Dosis):
1. zwei replizierte, Placebo- und Verum-kontrollierte Parallelgruppenstudien über 48 Wochen mit Formoterol (12 Mikrogramm zweimal täglich) als aktiver Vergleichssubstanz (Studien 1 und 2)
2. zwei replizierte, Placebo-kontrollierte Parallelgruppenstudien über 48 Wochen (Studien 3 und 4)
3. zwei replizierte, Placebo- und Verum-kontrollierte 6-wöchige Crossover-Studien mit Formoterol (12 Mikrogramm zweimal täglich) als aktiver Vergleichssubstanz (Studien 5 und 6)
4. zwei replizierte, Placebo- und Verum-kontrollierte 6-wöchige Crossover-Studien mit Tiotropium HandiHaler (18 Mikrogramm einmal täglich) als aktiver Vergleichssubstanz (Studien 7 und 8)
In allen Studien wurden Messungen der Lungenfunktion (forciertes exspiratorisches Volumen in einer Sekunde, FEVi) vorgenommen. In den 48-wöchigen Studien wurden sowohl die höchsten (AUC0_3) als auch die tiefsten Lungenfunktionswerte beurteilt, während in den 6-wöchigen Studien das Lungenfunktionsprofil über ein kontinuierliches 24-Stunden-Dosierungsintervall ausgewertet wurde.
In den beiden replizierten, Placebo- und Verum-kontrollierten 48-wöchigen Studien wurden außerdem der „Transition Dyspnea Index“ (TDI) als ein Maß für die Dyspnoe und der Fragebogen „St. George’s Respiratory Questionnaire“ (SGRQ) als ein Maß für die gesundheitsbezogene Lebensqualität verwendet.
In das Phase-III-Studienprogramm wurden Patienten im Alter von mindestens 40 Jahren mit einer klinischen COPD-Diagnose, mindestens 10 Packungsjahren in der Raucheranamnese und mittelschwerer bis sehr schwerer Einschränkung der Lungenfunktion (FEV1 nach Bronchodilatation < 80 % des vorhergesagten Normalwertes (Stadien II-IV nach GOLD); Verhältnis FEV1/FVC nach Bronchodilatation < 70 %) eingeschlossen.
Patientencharakteristika
Die Mehrzahl der 3.104 Patienten, die für die weltweit durchgeführten 48-wöchigen Studien (Studien 1 und 2, Studien 3 und 4) rekrutiert wurden, war männlich (77 %) sowie „weiß“ (66 %) oder „asiatisch“ (32 %); das mittlere Lebensalter betrug 64 Jahre. Das mittlere FEV1 nach
Bronchodilatation betrug 1,38 l (GOLD II [50 %], GOLD III [40 %], GOLD IV [10 %]). Die mittlere Ansprechbarkeit für Beta2-Agonisten lag bei 15 % des Ausgangswertes (0,160 l). Mit Ausnahme anderer lang-wirksamer Beta2-Agonisten waren alle Atemwegstherapeutika als Begleittherapie zulässig (z. B. Tiotropium [24 %], Ipratropium [25 %], inhalative Steroide [45 %], Xanthine [16 %]). Die Aufnahme der Patienten in die Studien erfolgte stratifiziert nach Tiotropium-Anwendung. Die primären Wirksamkeitsendpunkte in Bezug auf die Lungenfunktion waren in allen vier Studien die Veränderung der FEV1 AUC0-3 gegenüber dem Ausgangswert vor der Behandlung, sowie die Veränderungen des FEVi-Tiefstwertes (trough FEVi, vor der Inhalation) gegenüber den Ausgangswerten vor der Behandlung (nach 24 Wochen in den Studien 1 und 2, nach 12 Wochen in den Studien 3 und 4).
Die 6-wöchigen Studien (Studien 5 und 6, Studien 7 und 8) wurden in Europa und Nordamerika durchgeführt. In den Studien 5 und 6 war die Mehrzahl der 199 rekrutierten Patienten männlich (53 %) und „weiß“ (93 %); das mittlere Lebensalter betrug 63 Jahre. Das mittlere FEV1 nach Bronchodilatation betrug 1,43 l (GOLD II [54 %], GOLD III [39 %], GOLD IV [7 %]). Die mittlere Ansprechbarkeit für Beta2-Agonisten lag bei 17 % des Ausgangswertes (0,187 l). Mit Ausnahme anderer lang-wirksamer Beta2-Agonisten waren alle Atemwegstherapeutika als Begleittherapie zulässig (z. B. Tiotropium [24 %], Ipratropium [16 %], inhalative Steroide [31 %], Xanthine [0,5 %]). In den Studien 7 und 8 war die Mehrzahl der 230 rekrutierten Patienten männlich (69 %) und „weiß“ (99,6 %); das mittlere Lebensalter betrug 62 Jahre. Das mittlere FEV1 nach Bronchodilatation betrug 1,55 l (GOLD II [57 %], GOLD III [35 %], GOLD IV [7 %]). Die mittlere Ansprechbarkeit für Beta2-Agonisten lag bei 18 % des Ausgangswertes (0,203 l). Mit Ausnahme von anderen langwirksamen Beta2-Agonisten und Anticholinergika waren alle Atemwegstherapeutika als Begleittherapie zulässig (z. B. inhalative Steroide [49 %], Xanthine [7 %]).
Lungenfunktion
In den 48-wöchigen Studien bewirkte Striverdi Respimat (Inhalation von 5 Mikrogramm einmal täglich morgens) innerhalb von 5 Minuten nach der ersten Dosis eine signifikante Verbesserung (p < 0,0001) der Lungenfunktion (mittlere Zunahme des FEV1 um 0,130 l, verglichen mit einem Ausgangswert von 1,18 l vor der Behandlung). Die signifikante Verbesserung der Lungenfunktion hielt über die Dauer von 24 Stunden an (mittlere Zunahme des FEV1 AUC0-3 um 0,162 l im Vergleich zu Placebo, p < 0,0001; mittlere Zunahme des FEV1-Tiefstwertes (trough FEV1) um 0,071 l im Vergleich zu Placebo, p < 0,0001). Die Verbesserung der Lungenfunktion ließ sich bei Anwendern und Nicht-Anwendern von Tiotropium gleichermaßen beobachten. Das Ausmaß der bronchodilatatorischen Wirkung von Olodaterol (FEV1 AUC0-3) hing vom Grad der Reversibilität der Einschränkung des Atemflusses zu Behandlungsbeginn ab (gemessen unter Anwendung eines kurzwirksamen Beta-Agonisten). Bei Patienten mit einem höheren Grad der Reversibilität zu Behandlungsbeginn zeigte Olodaterol generell eine stärkere bronchodilatatorische Wirkung als bei Patienten mit einem geringeren Grad der Reversibilität zu Behandlungsbeginn. Bei Patienten mit schwererer COPD hatten sowohl Olodaterol als auch die aktive Vergleichssubstanz eine geringere bronchodilatatorische Wirkung (gemessen in Liter). Die bronchodilatatorische Wirkung von Striverdi Respimat hielt über die 48-wöchige Behandlungsphase hinweg an. Striverdi Respimat führte im Vergleich zu Placebo außerdem zu einer Verbesserung der morgendlichen und abendlichen maximalen exspiratorischen Atemflussrate (PEFR), die anhand der täglichen Aufzeichnungen der Patienten ermittelt wurde.
In den 6-wöchigen Studien bewirkte Striverdi Respimat im Vergleich zu Placebo über das gesamte 24-Stunden-Dosierintervall hinweg signifikant größere Effekte auf das FEV1:
Mittlere Zunahme der FEV1 AUC0-3 im Vergleich zu Placebo: 0,175 l (Studien 5 und 6) bzw. 0,211 l (Studien 7 und 8), jeweils p < 0,0001; mittlere Zunahme der FEV1 AUC0_24 im Vergleich zu Placebo: 0,137 l (Studien 5 und 6) bzw. 0,168 l (Studien 7 und 8), jeweils p < 0,0001; mittlere Zunahme des 24-Stunden-FEV1-Tiefstwertes (trough FEV1) im Vergleich zu Placebo: 0,102 l (Studien 5 und 6) bzw. 0,134 l (Studien 7 und 8), jeweils p < 0,0001.
Die Verbesserung der Lungenfunktion war vergleichbar mit der Wirkung von Formoterol zweimal täglich (Studien 5 und 6: mittlere Zunahme der FEV1 AUC0-3 im Vergleich zu Placebo: 0,205 l; mittlere Zunahme des 24-Stunden-FEV1-Tiefstwertes (trough FEV1) im Vergleich zu Placebo: 0,108 l; jeweils p < 0,0001), und ebenso vergleichbar mit der Wirkung von Tiotropium einmal täglich mit dem HandiHaler angewendet (Studien 7 und 8: mittlere Zunahme der FEV1 AUC0-3 im Vergleich zu Placebo: 0,211 l; mittlere Zunahme des 24-Stunden-FEV1-Tiefstwertes (trough FEV1) im Vergleich zu Placebo: 0,129 l; jeweils p < 0,0001).
Dyspnoe, gesundheitsbezogene Lebensqualität, Anwendung von Notfallmedikation, allgemeine Bewertung durch den Patienten
In den replizierten, Placebo- und aktiv kontrollierten 48-wöchigen Studien (Studien 1 und 2) wurden auch der „Transition Dyspnea Index“ (TDI) und der Fragebogen „St. George’s Respiratory Questionnaire“ (SGRQ) verwendet.
Nach 24 Wochen gab es in Bezug auf den Dyspnoe-Score (TDI Focal Score) keine signifikanten Unterschiede zwischen Striverdi Respimat, Formoterol und Placebo. Dies lag an einer unerwarteten Verbesserung in der Placebogruppe in einer Studie (siehe Tabelle 1). In einer Post-hoc-Analyse, in der Behandlungsabbrüche berücksichtigt wurden, ergab sich ein signifikanter Unterschied zwischen Striverdi Respimat und Placebo.
Tabelle 1: Dyspnoe-Score (TDI Focal Score) nach 24 Wochen Behandlung
|
Mittelwert nach Behandlungsgruppe |
Differenz zu Placebo: Mittelwert (p-Wert) | ||
|
Primäre Analyse |
Placebo |
1,5 (0,2) | |
|
Olodaterol 5 Mikrogramm einmal täglich |
1,9 (0,2) |
0,3 (p = 0,1704) | |
|
Formoterol 12 Mikrogramm zweimal täglich |
1,8 (0,2) |
0,2 (p = 0,3718) | |
|
Post-hoc-Analyse |
Placebo |
1,5 (0,2) | |
|
Olodaterol 5 Mikrogramm einmal täglich |
2,0 (0,2) |
0,5 (p = 0,0270) | |
|
Formoterol 12 Mikrogramm zweimal täglich |
1,8 (0,2) |
0,4 (p = 0,1166) |
Nach 24 Wochen verbesserte Striverdi Respimat im Vergleich zu Placebo den mittleren SGRQ-Gesamtscore signifikant (siehe Tabelle 2). Diese Verbesserung ließ sich für alle drei Kategorien des SGRQ nachvollziehen (Krankheitssymptome, Aktivitäten, Belastungen). Die Verbesserung des SGRQ-Gesamtscores überstieg bei einer größeren Zahl der mit Striverdi Respimat als der mit Placebo behandelten Patienten den geringsten klinisch relevanten Unterschied (MCID) von 4 Einheiten (50,2 % versus 36,4 %, p < 0,0001).
Tabelle 2: SGRQ-Gesamtscore nach 24 Wochen Behandlung
|
Mittelwert nach Behandlungsgruppe (Veränderung gegenüber dem Ausgangswert) |
Differenz zu Placebo: Mittelwert (p-Wert) | ||
|
Gesamtscore |
Ausgangswert |
44,4 | |
|
Placebo |
41,6 (-2,8) | ||
|
Olodaterol 5 Mikrogramm einmal täglich |
38,8 (-5,6) |
-2,8 (p = 0,0034) | |
|
Formoterol 12 Mikrogramm zweimal täglich |
40,4 (-4,0) |
-1,2 (p = 0,2009) |
Die mit Striverdi Respimat behandelten Patienten wendeten sowohl tagsüber als auch nachts weniger Salbutamol als Notfallmedikation an als die Patienten, die Placebo erhielten.
In allen 48-wöchigen Studien nahmen die mit Striverdi Respimat behandelten Patienten eine deutlichere Besserung ihrer Atemwegserkrankung wahr als die Patienten, die Placebo erhielten, wie anhand der PGR-Skala (Patients Global Rating) ermittelt wurde.
Kinder und Jugendliche
Die Europäische Arzneimittel-Agentur hat für Striverdi Respimat eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen bei chronischer obstruktiver Lungenerkrankung (COPD) gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
5.2 Pharmakokinetische Eigenschaften
a) Allgemeine Einführung
Informationen zur Pharmakokinetik von Olodaterol wurden an gesunden Probanden sowie an COPD-und Asthma-Patienten nach Inhalation von Dosen im und oberhalb des therapeutischen Bereichs gewonnen.
Olodaterol zeigte eine lineare Pharmakokinetik mit einem dosisproportionalen Anstieg der systemischen Exposition nach Inhalation von Einzeldosen zwischen 5 und 70 Mikrogramm sowie von Mehrfachdosen zwischen 2 und 20 Mikrogramm einmal täglich.
Bei wiederholter einmal täglicher Inhalation wurde nach 8 Tagen der Steady-State der Olodaterol-Plasmakonzentration erreicht. Das Ausmaß der Exposition nahm im Vergleich zu einer Einzeldosis bis auf das 1,8-fache zu.
b) Allgemeine Merkmale des Wirkstoffs nach Anwendung des Arzneimittels
Resorption
Die maximale Olodaterol-Plasmakonzentration wird normalerweise innerhalb von 10 bis 20 Minuten nach der Inhalation des Arzneimittels erreicht. Bei gesunden Freiwilligen wurde die absolute Bioverfügbarkeit von Olodaterol nach Inhalation auf etwa 30 % geschätzt, wohingegen die absolute Bioverfügbarkeit bei Verabreichung als Lösung zum Einnehmen weniger als 1 % betrug. Somit wird die systemische Verfügbarkeit von Olodaterol nach Inhalation im Wesentlichen durch die Resorption über die Lunge bestimmt.
Verteilung
Olodaterol zeigt sowohl nach Inhalation als auch nach intravenöser Anwendung eine MultiKompartiment-Dispositionskinetik. Das Verteilungsvolumen ist hoch (1.110 l) und lässt auf extensive Verteilung im Gewebe schließen. Die Bindung von 14C-Olodaterol an menschliche Plasmaproteine erfolgt in vitro konzentrationsunabhängig und liegt bei etwa 60 %.
Olodaterol ist ein Substrat für die Transportproteine PGP, OAT1, OAT3 und OCT1. Für die folgenden Transportproteine ist Olodaterol kein Substrat: BCRP, MRP, OATP2, OATP8, OATP-B, OCT2 und OCT3.
Biotransformation
Olodaterol wird im Wesentlichen durch direkte Glucuronidierung sowie durch O-Demethylierung an der Methoxygruppe und nachfolgende Konjugation metabolisiert. Von den sechs bekannten Metaboliten bindet nur das unkonjugierte Demethylierungsprodukt an Beta2-Rezeptoren. Dieser Metabolit ist jedoch nach fortgesetzter Inhalation der empfohlenen therapeutischen Dosis oder in bis zu 4-fach höherer Dosierung im Plasma nicht nachweisbar. Daher wird einzig Olodaterol als für die pharmakologische Wirkung relevant erachtet.
An der O-Demethylierung von Olodaterol sind die Cytochrom-P450-Isoenzyme CYP2C9 und CYP2C8 beteiligt, während CYP3A4 unbedeutend ist. An der Bildung von Olodaterol-Glucuroniden sind nachweislich die Isoformen UGT2B7, UGT1A1, UGT1A7 und UGT1A9 der Uridindiphosphat-Glycosyltransferase beteiligt.
Elimination
Die Gesamt-Clearance von Olodaterol bei gesunden Freiwilligen liegt bei 872 ml/min und die renale Clearance bei 173 ml/min.
Nach intravenöser Gabe von 14C-markiertem Olodaterol wurden 38 % der radioaktiven Dosis im Urin und 53 % in den Fäzes nachgewiesen. Der im Urin nachgewiesene Anteil an unverändertem Olodaterol lag nach intravenöser Gabe bei 19 %. Nach oraler Anwendung wurden nur 9 % der Radioaktivität (0,7 % unverändertes Olodaterol) im Urin nachgewiesen, der Hauptanteil (84 %) hingegen in den Fäzes gefunden. Über 90 % der Dosis wurden innerhalb von 6 Tagen nach intravenöser bzw. 5 Tagen nach oraler Verabreichung ausgeschieden. Nach Inhalation belief sich die Ausscheidung von unverändertem Olodaterol im Urin innerhalb des Dosierintervalls bei gesunden Freiwilligen im Steady-State auf 5-7 % der Dosis.
Nach Inhalation sinkt die Olodaterol-Plasmakonzentration in einem mehrphasigen Verlauf, die terminale Halbwertszeit beträgt etwa 45 Stunden.
c) Patientencharakteristika
Unter Verwendung von Daten aus zwei kontrollierten klinischen Studien, an denen 405 Patienten mit COPD und 296 Patienten mit Asthma teilgenommen hatten, die mit Striverdi Respimat behandelt worden waren, wurde eine pharmakokinetische Metaanalyse durchgeführt.
Die Analyse zeigte, dass bei COPD-Patienten, ausgehend von den Effekten von Lebensalter, Geschlecht und Körpergewicht auf die systemische Exposition nach Inhalation von Striverdi Respimat, keine Dosisanpassung notwendig ist.
Niereninsuffizienz
Bei Patienten mit einer Nierenfunktionsstörung gab es keine klinisch relevante Erhöhung der systemischen Exposition.
Leberinsuffizienz
Patienten mit leichter bis mittelschwerer Leberfunktionsstörung zeigten weder bei der Olodaterol-Elimination noch bei der Proteinbindung Unterschiede im Vergleich zur gesunden Kontrollgruppe. Bei Patienten mit schwerer Leberfunktionsstörung wurde keine Studie durchgeführt.
Rasse
Der Vergleich pharmakokinetischer Daten innerhalb und zwischen Studien ergab eine Tendenz zu einer höheren systemischen Exposition für Japaner und „andere Asiaten“ im Vergleich zu „Kaukasiern“.
In klinischen Studien mit einer Dauer von bis zu einem Jahr, an denen „Asiaten“ und „Kaukasier“ teilnahmen, die Striverdi Respimat in Dosen bis zum 2-fachen der empfohlenen therapeutischen Dosis erhielten, ergaben sich keine Bedenken bezüglich der Sicherheit.
5.3 Präklinische Daten zur Sicherheit
Präklinische Effekte wurden nur nach Expositionen beobachtet, die ausreichend über der maximalen humantherapeutischen Exposition lagen. Die klinische Relevanz wird als gering bewertet.
Studien zur Genotoxizität und zum kanzerogenen Potenzial lassen keine besonderen Gefahren für den Menschen erkennen.
Bei Ratten wurde eine erhöhte Inzidenz von Leiomyomen im Mesovarium beobachtet, bei Mäusen eine erhöhte Inzidenz von Leiomyomen am Uterus und von Leiomyosarkomen. Dies gilt als Klasseneffekt bei Nagetieren nach einer Langzeitbehandlung mit hohen Dosen von Beta2-Agonisten. Bisher sind Beta2-Agonisten nicht mit Krebserkrankungen beim Menschen in Zusammenhang gebracht worden.
Bei Ratten traten nach der Inhalation von Dosen bis zu 1.054 Mikrogramm/kg/Tag keine teratogenen Effekte auf. Diese Dosis entspricht etwa dem 1.600-fachen der empfohlenen täglichen Höchstdosis für Erwachsene (5 Mikrogramm), bezogen auf mg/m2. Bei trächtigen NZW-Kaninchen zeigte sich nach inhalativer Verabreichung einer Olodaterol-Dosis von 2.489 Mikrogramm/kg/Tag (mehr als das 3.500-fache der empfohlenen täglichen Höchstdosis für Erwachsene, bezogen auf die AUC0-24) eine fetale Toxizität, wie sie typischerweise nach Beta-Adrenozeptor-Stimulation auftritt, u. a. ungleichmäßige Verknöcherung, verkürzte/verkrümmte Knochen, teilgeöffnete Augen, Gaumenspalte, kardiovaskuläre Abnormitäten. Nach einer Inhalationsdosis von 974 Mikrogramm/kg/Tag traten keine signifikanten Effekte auf. Diese Dosis entspricht etwa dem 1.580-fachen der empfohlenen täglichen Höchstdosis für Erwachsene, bezogen auf mg/m2.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Benzalkoniumchlorid Natriumedetat (Ph. Eur.)
Citronensäure Gereinigtes Wasser
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
Haltbarkeit nach Anbruch: 3 Monate
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht einfrieren.
6.5 Art und Inhalt des Behältnisses
Art und Material des Behältnisses, das in Kontakt mit dem Arzneimittel kommt:
Die Lösung ist abgefüllt in einer Polyethylen/Polypropylen-Patrone mit einer Schutzkappe aus Polypropylen mit integriertem Silikondichtungsring. Die Patrone befindet sich in einem Aluminiumzylinder.
Jede Patrone enthält 4 ml Lösung zur Inhalation.
Packungsgrößen und beigefügtes Medizinprodukt:
Einzelpackung: 1 Respimat Inhalator und 1 Patrone mit 60 Hüben (30 therapeutische Dosen) Doppelpackung: 2 Einzelpackungen, bestehend aus jeweils 1 Respimat Inhalator und 1 Patrone mit 60 Hüben (30 therapeutische Dosen)
Dreifachpackung: 3 Einzelpackungen, bestehend aus jeweils 1 Respimat Inhalator und 1 Patrone mit 60 Hüben (30 therapeutische Dosen)
Klinikpackung: 8 Einzelpackungen, bestehend aus jeweils 1 Respimat Inhalator und 1 Patrone mit 60 Hüben (30 therapeutische Dosen)
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
Boehringer Ingelheim International GmbH Binger Straße 173 55216 Ingelheim am Rhein Deutschland
8. ZULASSUNGSNUMMER
87146.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG
22. November 2013
10. STAND DER INFORMATION
November 2013
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Dieses Arzneimittel enthält einen Stoff, dessen Wirkung in der medizinischen Wissenschaft noch nicht allgemein bekannt ist.
Örtlicher Vertreter des Zulassungsinhabers in Deutschland
Boehringer Ingelheim Pharma GmbH & Co. KG
Binger Straße 173
55216 Ingelheim am Rhein
Telefon: 0800 / 77 90 900
Telefax: 0 61 32 / 72 99 99
E-Mail: info@boehringer-ingelheim.de
Seite 18 von 18