Sufenta Epidural
F achinform ation
1. Bezeichnung des Arzneimittels Sufenta epidural, 5 ^g/ml Injektionslösung
2. Qualitative und quantitative Zusammensetzung Wirkstoff: Sufentanilcitrat.
1 Ampulle mit 2 ml Injektionslösung enthält 15 ^g Sufentanilcitrat (entsprechend 10 ^g Sufentanil).
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Injektionslösung Klare, farblose Lösung.
4. Klinische Angaben
4.1 Anwendungsgebiete
Sufenta epidural ist bei Erwachsenen als ergänzendes analgetisches Mittel zu epidural verabreichtem Bupivacain indiziert:
- für die postoperative Behandlung von Schmerzen nach allgemeinchirurgischen, thorakalen und orthopädischen Eingriffen und nach einem Kaiserschnitt.
- für die Behandlung von Schmerzen während der Wehentätigkeit und vaginalen Entbindungen.
Anwendung bei Kindern
Sufenta epidural ist indiziert für die postoperative Behandlung von Schmerzen nach allgemeinchirurgischen, thorakalen oder orthopädischen Eingriffen bei Kindern, die 1 Jahr und älter sind.
4.2 Dosierung, Art und Dauer der Anwendung
Sufentanil sollte nur von Ärzten verabreicht werden, die Erfahrung mit dessen Gebrauch und den klinischen Auswirkungen der Anwendung haben. Die epidurale Verabreichung darf nur durch einen Arzt erfolgen, der hinreichend erfahren in der Technik der epiduralen Applikation ist. Die korrekte Position der Nadel oder des Katheters muss vor der Verabreichung überprüft werden.
Dosierung
Die Dosierung von Sufentanil richtet sich nach Alter und Körpergewicht sowie individuell nach der klinischen Situation (klinischer Befund, Begleitmedikation, Narkoseverfahren, Art und Dauer des operativen Eingriffs). Die Wirkung der Initialdosis muss bei Verabreichung weiterer Dosen berücksichtigt werden.
Für die postoperative Behandlung von Schmerzen nach allgemeinchirurgischen, thorakalen und orthopädischen Eingriffen und nach einem Kaiserschnitt:
Erwachsene
Unter Berücksichtigung von Risikofaktoren wird folgendes Dosierungsschema bei Erwachsenen empfohlen:
Nach präoperativer Anlage eines Periduralkatheters, dessen Lage durch Verabreichen einer Testdosis kontrolliert wurde, kann intraoperativ eine epidurale Aufsättigungsdosis verabreicht werden: 10-15 ml Bupivacain 0,25% plus 1 Mikrogramm Sufentanil/ml.
In der postoperativen Phase sollte eine kontinuierliche epidurale Applikation von Bupivacain 0,175% plus 1 Mikrogramm Sufentanil/ml als Basisinfusion zur Analgesie mit einer Infusionsrate von anfänglich 5 ml/Stunde und zur Aufrechterhaltung mit einer individuellen patientenadaptierten Infusionsrate von 4-14 ml/Stunde erfolgen.
Bei Bedarf sollte der Patient die Möglichkeit zu Bolusinjektionen von 2 ml über ein patientengesteuertes Spritzenpumpensystem haben. Eine an der Spritzenpumpe voreingestellte Sperrzeit von 20 Minuten für eine weitere Bolusgabe wird empfohlen.
Für die Behandlung von Schmerzen während der Wehentätigkeit und vaginalen Entbindungen:
Ein Zusatz von 10 Mikrogramm Sufentanil in Verbindung mit epidural verabreichtem Bupivacain (0,125%-0,25%) gewährleistet eine länger andauernde und bessere Analgesie. Um eine bessere Durchmischung von Bupivacain und Sufentanil in der Spritze zu erreichen, sollte zuerst Sufentanil und dann Bupivacain im gewünschten Verhältnis aufgezogen werden.
Falls notwendig kann das optimale Gesamtvolumen von 10 ml durch Verdünnung mit 0,9%iger Natriumchlorid-Lösung erreicht werden. Zwei weitere Injektionen dieser Kombination können bei Bedarf verabreicht werden, wobei eine Pause von mindestens 30 min. zwischen den Einzelgaben eingehalten und die Höchstdosis von Bupivacain berücksichtigt werden sollte. Eine Gesamtdosis von 30 Mikrogramm Sufentanil sollte nicht überschritten werden.
Besondere Patientengruppen:
Eine Dosisreduktion sollte bei älteren und geschwächten Patienten sowie bei Patienten, die bereits mit Arzneimitteln behandelt werden, die eine Atemdepression verursachen, erwogen werden.
Bei Patienten unter chronischer Medikation mit Opioiden oder anamnestisch bekanntem Opioidabusus muss von einem erhöhten Dosisbedarf ausgegangen werden.
Bei Leber- und Niereninsuffizienz ist eine möglicherweise verminderte Ausscheidung zu berücksichtigen und gegebenenfalls die Dosis zu reduzieren.
Kinder und Jugendliche
Sufenta epidural darf Kindern epidural nur durch Anästhesisten verabreicht werden, die in der Epiduralanästhesie bei Kindern und im Management atemdepressiver Wirkungen von Opioiden speziell geschult sind. Entsprechende Geräte zur Reanimation, einschließlich Hilfsmitteln zur Atemwegssicherung und Opioidantagonisten müssen unmittelbar verfügbar sein.
Pädiatrische Patienten müssen mindestens 2 Stunden nach epiduraler Verabreichung von Sufenta epidural auf Anzeichen einer Atemdepression überwacht werden.
Die Anwendung von epidural verabreichtem Sufentanil ist bei Kindern lediglich in einer begrenzten Anzahl von Fällen dokumentiert worden.
Kinder > 1 Jahr:
Eine einzelne intra-operativ verabreichte Bolusgabe von 0,25-0,75 pg/kg Körpergewicht Sufenta epidural führt zu einer Schmerzlinderung für einen Zeitraum zwischen 1 und 12 Stunden. Die Dauer der tatsächlichen Analgesie wird durch den chirurgischen Eingriff und die gleichzeitige Verabreichung epiduraler Amid-Lokalanästhetika beeinflusst.
Kinder < 1 Jahr:
Die Sicherheit und Wirksamkeit von Sufenta epidural bei Kindern jünger als 1 Jahr ist bisher noch nicht erwiesen (siehe auch Abschnitte 4.4 und 5.1).
Die derzeit verfügbaren Daten für Kinder älter als 3 Monate sind in Abschnitt 5.1 beschrieben, Empfehlungen zu Dosierungen können jedoch nicht gegeben werden.
Für Neugeborene und Säuglinge jünger als 3 Monate sind keine Daten verfügbar.
Besondere Dosierungshinweise; Art und Dauer der Anwendung
Die beabsichtigte Gesamtdosis sollte vorsichtig titrierend verabreicht werden, insbesondere wenn bei Patienten eine der folgenden Erkrankungen vorliegt:
nicht kompensierte Hypothyreose; pulmonale Erkrankungen, vor allem solche mit verminderter Vitalkapazität; Adipositas; Alkoholkrankheit. Bei diesen Patienten ist eine länger dauernde postoperative Überwachung angezeigt.
Hinweis:
Die hergestellten Gemische sind zum sofortigen Gebrauch bestimmt. Restmengen der unverdünnten oder verdünnten Lösungen sind zu verwerfen.
Dauer der Anwendung:
Die Anwendungsdauer bei epiduraler Applikation richtet sich nach dem Verlauf der postoperativen Schmerzen.
Da die fetale Herzfrequenz sich während epiduraler Applikation möglicherweise verändert, ist eine Beobachtung der Herzfrequenz und, falls notwendig, eine entsprechende Behandlung angezeigt.
4.3 Gegenanzeigen
Sufenta epidural darf nicht angewendet werden
- bei Überempfindlichkeit gegen den Wirkstoff, andere Opioide oder einen der sonstigen Bestandteile
- während der Stillzeit; 24 Stunden nach der Anästhesie kann wieder mit dem Stillen begonnen werden
- bei Krankheitszuständen, bei denen eine Dämpfung des Atemzentrums vermieden werden muss
- bei schweren Blutungen oder Schock, Sepsis, Infektionen der Injektionsstelle, Veränderungen im Blutbild, Störungen der Blutgerinnung wie Thrombozytopenie und Koagulopathie oder Behandlung mit Antikoagulanzien sowie Behandlung mit anderen Arzneimitteln oder medizinische Bedingungen, die die Durchführung einer Epiduralanästhesie kontraindizieren
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die Durchführung der Periduralanalgesie darf nur unter der Aufsicht eines in der Durchführung von epiduralen Applikationstechniken erfahrenen Arztes erfolgen.
Besondere Patientengruppen
Bei Schädel-Hirn-Trauma und erhöhtem Hirndruck sollte Sufentanil nur mit besonderer Vorsicht angewendet werden.
Es wird empfohlen, die Dosis bei älteren und geschwächten Patienten zu reduzieren. Besondere Vorsicht ist geboten bei unkontrollierter Hypothyreose, pulmonalen Erkrankungen, verminderter Atemreserve, Leber- oder Nierenfunktionsstörungen, Fettleibigkeit, Alkoholkrankheit und bei Patienten, die mit zentraldämpfenden Arzneimitteln behandelt werden. Bei diesen Patienten ist eine länger dauernde postoperative Überwachung angezeigt.
Weiterhin sollte Sufentanil bei epiduraler Anwendung nur mit Vorsicht angewandt werden bei Patienten, die an einer Atemdepression, verminderter Atemfunktion oder -reserve, möglicher Atmungsbeeinträchtigung oder fetalem Distress leiden. Der Patient sollte nach jeder Dosis mindestens eine Stunde eng überwacht werden, da eine frühe Atemdepression auftreten kann. Bei akuten hepatischen Porphyrien ist die Indikation für eine epidurale Anwendung von Sufentanil eng zu stellen.
Da Sufentanil, insbesondere bei hypovolämischen Patienten, eine Hypotension auslösen kann, sollte die beabsichtigte Gesamtdosis vorsichtig titrierend gegeben werden. Es sollten weiterhin angemessene Maßnahmen zur Aufrechterhaltung eines stabilen Blutdrucks zur Anwendung kommen.
Sonstige Hinweise
Sufentanil kann eine dosisabhängige Atemdepression hervorrufen; diese und andere pharmakologische Effekte können durch spezifische Opioidantagonisten aufgehoben werden. Wegen der kurzen Wirkdauer der Antagonisten kann die Atemdepression jedoch erneut auftreten, so dass eine wiederholte Gabe des Antagonisten erforderlich werden kann. Die erforderliche Dosis und das Dosierungsintervall sind von der verabreichten Sufentanil-Dosis und dem Zeitpunkt der letzten Gabe abhängig. Die durch Sufenta epidural erzeugte Atemdepression kann länger anhalten als die opiatantagonistische Wirkung von Naloxon, daher sollte der Patient weiterhin angemessen überwacht werden. Es ist sicherzustellen, dass die apparative und medikamentöse Standardausrüstung zur Wiederbelebung sofort verfügbar ist. Hyperventilation während der Anästhesie kann das Ansprechen des Patienten auf CO2 verändern, was sich auf die postoperative Atmung auswirkt.
Es kann zu Bradykardie bis hin zum Herzstillstand kommen, wenn das vorher gegebenenfalls verabreichte Anticholinergikum unterdosiert oder Sufentanil mit einem nicht-vagolytisch wirkenden Relaxans kombiniert wurde. Eine Bradykardie kann mit Atropin behandelt werden.
Nach schnellen intravenösen Bolusinjektionen ist über das Auftreten von Husten berichtet worden.
Nicht-epileptische (myo)klonische Bewegungen können auftreten.
Sufenta epidural enthält Natrium, aber weniger als 1 mmol (23 mg) Natrium pro ml, d. h. es ist nahezu "natriumfrei". Ab einer Dosierung von 6,5 ml enthält Sufenta epidural mehr als 1 mmol (23 mg) Natrium. Dies ist zu berücksichtigen bei Personen unter Natrium-kontrollierter (natriumarmer/kochsalzarmer) Diät.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Sufenta epidural bei Kindern jünger als 1 Jahr ist bisher noch nicht erwiesen (siehe auch Abschnitte 4.2 und 5.1).
Physische Abhängigkeit und Toleranz
Sufentanil kann aufgrund seiner morphinartigen Eigenschaften zu physischer Abhängigkeit führen. Wird Sufentanil ausschließlich zur intraoperativen Anästhesie verwendet, ist das Auftreten einer solchen Abhängigkeit nicht zu erwarten. Insbesondere nach längerer kontinuierlicher intravenöser Anwendung in der Intensivtherapie kann sich dagegen eine physische Abhängigkeit entwickeln. Entzugserscheinungen sind möglich nach einer Behandlungsdauer von mehr als einer Woche und wahrscheinlich nach mehr als zwei Wochen. Die folgenden Empfehlungen sind zu beachten:
1. Die Sufentanil-Dosis sollte das erforderliche Maß nicht überschreiten.
2. Die Dosierung ist langsam über mehrere Tage zu reduzieren.
3. Zur Unterdrückung von Entzugserscheinungen kann bei Bedarf Clonidin eingesetzt werden.
Patienten unter einer Dauertherapie mit Opioiden oder mit einer Vorgeschichte von Opioidabusus benötigen möglicherweise höhere Dosen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bei gleichzeitiger Anwendung mit Barbituraten, Benzodiazepinen, Etomidat, Opioiden, Tranquilizern, Neuroleptika, Alkohol, Allgemeinanästhetika, halogenierten Gasen oder anderen zentraldämpfenden Substanzen ist mit einer wechselseitigen Verstärkung der zentral dämpfenden Wirkung und der Atemdepression zu rechnen.
Wenn Patienten solche Arzneimittel erhalten haben, wird eine geringere Menge an Sufentanil als üblich benötigt. Gleichermaßen sollte nach der Verabreichung von Sufentanil, die Dosis anderer zentraldämpfender Substanzen reduziert werden.
Die gleichzeitige Gabe von Benzodiazepinen kann zu einem Blutdruckabfall führen.
Sufentanil wird hauptsächlich über das Enzym Cytochrom-P450-3A4 metabolisiert. Wenngleich bisher in vivo keine Inhibition durch Erythromycin (einen bekannten Cytochrom-P450-3A4-Inhibitor) beobachtet wurde, weisen in-vitro-Daten auf eine mögliche Inhibition des Abbaus von Sufentanil durch andere potente Cytochrom-P450-3A4-Enzyminhibitoren (z. B. Ketoconazol, Itraconazol, Ritonavir) hin.
Dies könnte das Risiko einer verlängerten oder verzögert einsetzenden Atemdepression erhöhen.
Die gleichzeitige Anwendung solcher Arzneimittel erfordert besondere Sorgfalt und Beobachtung des Patienten; insbesondere kann eine Dosisreduktion von Sufentanil erforderlich sein.
Bei gleichzeitiger Anwendung von Sufentanil in hoher Dosierung und von Lachgas kann es zu einem Abfall von Blutdruck, Herzfrequenz und Herzzeitvolumen kommen.
Es wird in der Regel empfohlen, MAO-Hemmer 2 Wochen vor chirurgischen oder anästhesiologischen Maßnahmen abzusetzen.
Die gleichzeitige Verabreichung von Sufentanil und Vecuronium oder Suxamethonium kann zu einer Bradykardie führen, insbesondere wenn der Puls bereits präoperativ (z. B. unter einer Therapie mit Calcium-Kanalblockern oder ß-Blockern) verlangsamt ist. In diesen Fällen muss die Dosis von einem oder von beiden Arzneistoffen reduziert werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen keine hinreichenden Daten für die Anwendung von Sufentanil bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt, teratogene Effekte wurden nicht beobachtet (siehe Abschnitt 5.3). Das potentielle Risiko für den Menschen ist nicht bekannt. Sufenta epidural darf nicht während der Schwangerschaft angewendet werden, es sei denn, dies ist eindeutig erforderlich (Nutzen-Risiko-Abwägung).
Eine Langzeitbehandlung während der Schwangerschaft kann zu Entzugserscheinungen beim Neugeborenen führen.
Sufentanil passiert die menschliche Plazenta schnell mit einem linearen Anstieg bei steigender mütterlicher Plasmakonzentration. Nach epiduraler Anwendung einer Gesamtdosis, die 30 ^g nicht überstieg, wurden in der Umbilikalvene durchschnittliche Plasmakonzentrationen von 0,016 ng/ml gefunden.
Die intravenöse Verabreichung bei der Geburtshilfe (einschließlich Sectio caesarea) ist kontraindiziert, da Sufentanil, gleich anderen Opioiden, die Plazenta passiert und eine Atemdepression beim Neugeborenen bewirken kann.
Falls Sufentanil dennoch eingesetzt wird, muss ein Antidot für die Behandlung des Kindes verfügbar sein.
Kontrollierte klinische Studien während Entbindungen haben gezeigt, dass epidural verabreichtes Sufentanil als Zusatz zu epidural verabreichtem Bupivacain bis zu einer Gesamtdosis von 30 Mikrogramm keine schädlichen Auswirkungen auf die Verfassung der Mutter während der Geburt oder auf den APGAR-Score des Kindes hat.
Stillzeit
Sufentanil wird in die Muttermilch ausgeschieden. Daher ist Sufentanil bei stillenden Müttern kontraindiziert.
Unter Berücksichtigung pharmakokinetischer Daten kann vierundzwanzig Stunden nach dem Ende einer Narkose wieder mit dem Stillen begonnen werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Der Patient sollte nur aktiv am Straßenverkehr teilnehmen oder eine Maschine bedienen, wenn nach Gabe von Sufentanil eine angemessene Zeit verstrichen ist. Der Patient sollte sich nur in Begleitung nach Hause begeben und keinen Alkohol zu sich nehmen.
4.8 Nebenwirkungen
Die Sicherheit von Sufentanil wurde bei 650 Studienteilnehmern, die Sufentanil in 6 klinischen Studien erhielten, untersucht. 78 dieser Studienteilnehmer nahmen an 2 Studien teil, in denen Sufentanil intravenös als analgetische Komponente während der Einleitung und Aufrechterhaltung von Kombinationsnarkosen bei großen chirurgischen Eingriffen (Bypass der Koronararterie oder Operation am offenen Herzen) verabreicht wurde. Die verbleibenden 572 Studienteilnehmer nahmen an 4 Studien teil, bei denen Sufentanil epidural postoperativ allein oder als ergänzendes analgetisches Mittel zu epidural verabreichtem Bupivacain für die Behandlung von Schmerzen während der Wehen und bei vaginaler Entbindung verabreicht wurde. Die Studienteilnehmer erhielten mindestens eine Dosis Sufentanil und lieferten Sicherheitsdaten.
a) Zusammenfassung des Sicherheitsprofils
Auf Grundlage der gepoolten Sicherheitsdaten aus den klinischen Studien waren die am häufigsten (Inzidenz > 5%) berichteten Nebenwirkungen (mit einer Inzidenz in %): Sedierung (19,5%), Pruritus (15,2%), Übelkeit (9,8%) und Erbrechen (5,7%).
b) Tabellarische Zusammenfassung der Nebenwirkungen
Die in klinischen Studien mit Sufentanil berichteten Nebenwirkungen, einschließlich der oben angeführten Nebenwirkungen und der Erfahrung nach Markteinführung sind in der folgenden Tabelle aufgeführt.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig Häufig Gelegentlich Selten Sehr selten Nicht bekannt
(> 1/10)
(> 1/100 bis < 1/10)
(> 1/1.000 bis < 1/100)
(> 1/10.000 bis < 1/1.000)
(< 1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Systemorganklasse |
Nebenwirkungen | ||||
|
Häufigkeit | |||||
|
Sehr häufig |
Häufig |
Gelegentlich |
Selten |
Nicht bekannt | |
|
Infektionen und parasitäre Erkrankungen |
Rhinitis | ||||
|
Erkrankungen des Immunsystems |
Überempfind lichkeit |
anaphylaktischer Schock, anaphylaktische Reaktion, anaphylaktoide Reaktion | |||
|
Psychiatrische Erkrankungen |
Apathie, Nervosität | ||||
|
Erkrankungen des Nervensystems |
Sedierung |
neonataler Tremor, Schwindel, Kopfschmerz |
Ataxie, neonatale Dyskinesie, Dystonie, Hyperreflexie, gesteigerte Muskelspan nung, neonatale Hypokinese, Somnolenz |
Koma, Konvulsionen, unwillkürliche Muskelkon traktionen | |
|
Augenerkrankungen |
Sehstörung |
Miosis | |||
|
Herzerkrankungen |
Tachykardie |
atrio-ventriku-lärer Block, Zyanose, Bradykardie, Arrhythmie, anomales Elektrokardiogramm |
Herzstillstand | ||
|
Gefäßerkrankungen |
Hypertonie, Hypotonie, Blässe |
Schock | |||
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
neonatale Zyanose |
Bronchospas mus, Hypoventila tion, Dysphonie, Husten*, Schluckauf, Atemwegser krankungen |
Atemstill stand, Apnoe, Atemdepres sion, Lungenödem, Laryngospas- mus | ||
|
Erkrankungen des Gastrointestinaltrakts |
Erbrechen, Übelkeit | ||||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Pruritus |
Hautverfär bung |
allergische Dermatitis, Hyperhidrose, Hauterkran kung, Hautausschlag, neonataler Hautausschlag, trockene Haut |
Erythem | |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Muskel zuckungen |
Rückenschmer zen, verminderte neonatale Muskelspan nung, Muskelrigidität |
Muskel spasmen | ||
|
Erkrankungen der Nieren und Harnwege |
Harnverhalt, Harninkon tinenz | ||||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Fieber |
Hypothermie, erniedrigte Körpertempera tur, erhöhte Körpertempera tur, Schüttelfrost, |
|
Reaktion an der Injektionsstelle, Schmerzen an der Injektionsstelle, Schmerzen |
* bei schnellen intravenösen Bolusinjektionen tritt Husten sehr häufig auf
c) Kinder und Jugendliche
Ein Unterschied hinsichtlich der Häufigkeit, Art und Schwere von Nebenwirkungen bei Kindern im Vergleich zu Erwachsenen ist nicht zu erwarten.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website:
http://www.bfarm.de, anzuzeigen.
4.9 Überdosierung
Anzeichen und Symptome:
Bei Überdosierung kann es zu einer Verstärkung der pharmakologischen Wirkung und der Nebenwirkungen kommen. Es kann eine Atemdepression auftreten, deren Schweregrad von Bradypnoe bis Apnoe variieren kann.
Behandlung:
Bei Hypoventilation bzw. Apnoe sollte Sauerstoff gegeben werden und eine assistierte oder kontrollierte Beatmung ist angezeigt. Ein spezifischer Opioidantagonist kann zur Anwendung kommen, um die Atemdepression zu kontrollieren. Dies schließt die Anwendung von mehr unmittelbaren Gegenmaßnahmen nicht aus. Wegen der kurzen Wirkdauer des Antagonisten kann die Atemdepression jedoch erneut auftreten, so dass eine wiederholte Gabe des Antagonisten erforderlich werden kann.
Wenn die Atemdepression mit Muskelrigidität einhergeht, kann die intravenöse Anwendung eines Muskelrelaxans angezeigt sein, um die assistierte oder kontrollierte Beatmung zu ermöglichen.
Der Patient sollte sorgfältig überwacht sowie eine normale Körpertemperatur und angemessene Flüssigkeitsaufnahme gewährleistet werden. Ursache einer schweren oder andauernden Hypotension kann eine Hypovolämie sein. Sie wird mit bedarfsorientierter parenteraler Volumengabe behandelt.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Opioidanästhetika ATC-Code: N01AH03
Sufentanil, ein hochpotentes Opioidanalgetikum, ist ein spezifischer p-Agonist mit einer im Vergleich zu Fentanyl 7- bis 10-mal höheren Affinität zu den ^-Rezeptoren. Die analgetische Potenz ist etwa 500-1000-mal stärker als die von Morphin. Nach intravenöser Gabe wird das Wirkmaximum innerhalb weniger Minuten erreicht.
Wesentliche Erkenntnisse aus den pharmakologischen Studien waren kardiovaskuläre Stabilität, Fentanyl-analoge EEG-Reizantworten und fehlende Immunsuppression, Hämolyse oder Histaminfreisetzung. Eine mögliche Bradykardie wird, wie bei anderen Opioiden, durch Wirkung am zentralen Vaguskern erklärt. Herzfrequenzsteigerungen durch Pancuronium werden durch Sufentanil nicht oder nur geringfügig unterdrückt.
Sufentanil besitzt eine hohe therapeutische (und Sicherheits-) Breite (LD50/ED50 für den niedrigsten Analgesiegrad) bei Ratten. Mit 25211 ist dieser Quotient höher als der von Fentanyl (277) oder Morphin (69,5). Aufgrund einer begrenzten Akkumulation und schnellen Elimination aus den Speicherkompartimenten kommt es zu einer schnellen Erholung. Die analgetische Wirkung ist dosisabhängig und kann dem operationsbedingten Schmerzniveau angepasst werden.
Sufentanil kann in Abhängigkeit von Dosis und Injektionsgeschwindigkeit Rigor, Euphorie, Miosis und Bradykardie verursachen. Die Wirkung von Sufentanil kann durch die Gabe eines Opioidantagonisten abgeschwächt bzw. aufgehoben werden.
Kinder und Jugendliche
EPIDURALE VERABREICHUNG:
Nach einer Verabreichung von 0,75 pg Sufentanil/kg Körpergewicht bei 15 Kindern zwischen 4 und 12 Jahren betrug der Beginn und die Dauer der Analgesie im Mittel 3,0 ± 0,3 bzw. 198 ± 19 Minuten.
Epidurales Sufentanil zur postoperativen Schmerzkontrolle wurde nur einer begrenzten Zahl von Kindern im Alter von 3 Monaten bis 1 Jahr als einzelne Bolusgabe von 0,25-0,75 pg/kg Körpergewicht verabreicht.
Bei Kindern älter als 3 Monate wurde durch eine epidurale Bolusgabe von 0,1 pg Sufentanil/kg Körpergewicht, gefolgt von einer epiduralen Infusion von 0,03-0,3 pg/kg/h in Kombination mit einem Amid-Lokalanästhetikum eine effektive postoperative Analgesie für bis zu 72 Stunden nach einem subumbilikalen Eingriff erreicht.
5.2 Pharmakokinetische Eigenschaften
Sufentanil ist ein synthetisches Opioid mit p-agonistischen pharmakologischen Wirkungen.
Verteilung
Spitzenplasmakonzentrationen von epidural appliziertem Sufentanil werden im Allgemeinen innerhalb von 10 Minuten erreicht und sind 4- bis 6-mal niedriger als nach i.v.-Anwendung. Durch Zugabe von Adrenalin (50-75 pg) wird die anfangs rasche Absorption um 25-50% reduziert.
Studien mit intravenösen Dosen von 250-1500 pg Sufentanil, in denen über einen längeren Zeitraum Messungen der Serumkonzentrationen durchgeführt wurden, zeigten folgende Ergebnisse:
Die Halbwertszeiten der Verteilungsphase betrugen 2,3-4,5 Minuten und 35-73 Minuten, das Verteilungsvolumen im zentralen Kompartiment 14,2 l und im Steady state 344 l. Für den Abfall der Plasmakonzentration vom therapeutischen in den subtherapeutischen Bereich sind die Halbwertszeiten der Verteilungsphase bestimmend, nicht die terminale Halbwertszeit (4,1 h nach 250 pg bis 10-16 h nach 500-1500 pg). Im untersuchten Dosisbereich zeigt die Pharmakokinetik von Sufentanil einen linearen Verlauf.
Die Plasmaproteinbindung von Sufentanil beträgt ca. 92,5%.
Metabolismus
Die Biotransformation erfolgt hauptsächlich in Leber und Dünndarm. Sufentanil wird hauptsächlich über das humane Enzym Cytochrom P450 3A4 metabolisiert.
Elimination
Die mittlere terminale Eliminationshalbwertszeit von Sufentanil beträgt 784 (Bereich 656-938) Minuten. Aufgrund der methodisch bedingten Nachweisgrenze ergab sich nach der 250 pg Dosis eine signifikant kürzere Eliminationshalbwertszeit (240 Minuten) als nach 1500 pg. Die Plasma-Clearance beträgt 917 ml/min. Annähernd 80% der zugeführten Dosis werden innerhalb von 24 Stunden ausgeschieden, nur 2% der Dosis als unveränderte Substanz.
Besondere Patientengruppen Lebererkrankungen
Bei Patienten mit Leberzirrhose ist im Vergleich zu Kontrollpersonen das Verteilungsvolumen leicht erhöht und die totale Clearance leicht erniedrigt. Dies resultiert in einer signifikant verlängerten Halbwertszeit von ca. 30%, welche eine längere postoperative Überwachungszeit verlangt (siehe auch Abschnitt 4.4).
Nierenerkrankungen
Im Steady-state unterscheiden sich das Verteilungsvolumen, die totale Clearance und die terminale Eliminationshalbwertszeit bei Patienten während der Dialyse und bei Patienten, die sich einer Nierentransplantation unterziehen, nicht von gesunden Kontrollpersonen. Die Fraktion an freiem Sufentanil in dieser Population unterscheidet sich nicht von gesunden Patienten.
Kinder und Jugendliche
Die pharmakokinetischen Informationen für Kinder sind begrenzt.
EPIDURALE VERABREICHUNG:
Nach epiduraler Gabe von 0,75 pg Sufentanil/kg Körpergewicht bei 15 Kindern im Alter von 4 bis 12 Jahren bewegten sich die Plasmaspiegel, die 30, 60, 120 und 240 min nach der Injektion gemessen wurden im Bereich von 0,08 ± 0,01 bis 0,10 ± 0,01 ng/ml.
Bei 6 Kindern im Alter zwischen 5 und 12 Jahren, die einen Bolus von 0,6 pg Sufentanil/kg Körpergewicht erhielten, gefolgt von einer kontinuierlichen epiduralen Infusion mit 0,08 pg/kg/h Sufentanil und 0,2 mg/kg/h Bupivacain über 48 h, wurde die maximale Konzentration ca. 20 min nach der Bolus-Injektion erreicht und wies ein Intervall von unterhalb der Nachweisgrenze (<0,02 ng/ml) bis zu 0,074 ng/ml auf.
5.3 Präklinische Daten zur Sicherheit
Bezüglich akuter Toxizität siehe Abschnitt 4.9
Sufentanil zeigte bei täglicher Injektion über einen Monat die für narkotische Analgetika typischen Effekte. Bei Hunden wurde Ataxie, Hypoxie, Mydriasis und Schlaf beobachtet. Ratten zeigten Exophthalmus, Muskelstarre und einen Verlust des Aufrichtreflexes. Bei allen Tieren kam es zu einer verminderten Futteraufnahme und damit zu einer Gewichtsabnahme. Dadurch und durch die täglich wiederholt eintretende Reduktion der physischen Aktivität sind auch die unspezifischen Toxizitätszeichen zu erklären.
Sufentanil passiert die Plazenta und erreicht in Rattenfeten eine Konzentration von 33% der im mütterlichen Plasma gemessenen Spitzenkonzentration. Auswirkungen auf die Reproduktion (Fertilitätsstörungen, embryotoxische Wirkungen, fetotoxische Wirkungen, Neugeborenensterblichkeit) wurden in Untersuchungen an Ratten und Kaninchen erst im für die Elterntiere toxischen Dosisbereich festgestellt (entsprechend dem 2,5-fachen der Dosis beim Menschen für 10-30 Tage).
Teratogene Effekte wurden nicht beobachtet.
Aus den vorliegenden Mutagenitätsstudien ergaben sich keine Hinweise auf mutagene Eigenschaften von Sufentanil.
Langzeituntersuchungen am Tier auf ein Tumor erzeugendes Potential liegen nicht vor.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Natriumchlorid
Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Das Arzneimittel darf nicht mit anderen Arzneimitteln, außer mit den unter Abschnitt 6.6 aufgeführten, gemischt werden.
6.3 Dauer der Haltbarkeit
Die Haltbarkeit im unversehrten Behältnis beträgt 3 Jahre. Das Verfalldatum dieses Arzneimittels ist auf dem Etikett der Ampulle und auf der Faltschachtel aufgedruckt.
Nach Ablauf dieses Datums darf das Arzneimittel nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25°C lagern.
Im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
6.5 Art und Inhalt des Behältnisses
Klinikpackung (gebündelt):
50 (10 x 5) Ampullen zu je 2 ml Injektionslösung
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Nach Anbruch Rest verwerfen.
Wenn die gebrauchsfertige Zubereitung nicht sofort verwendet wird, ist der Anwender für die Dauer und die Bedingungen der Aufbewahrung verantwortlich.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
Öffnen der Ampullen
Tragen Sie Handschuhe, wenn Sie die Ampulle öffnen.
R

Farbringe farbiger Punkt Bruchstelle

Fassen Sie die Ampulle so zwischen Daumen und Zeigefinger, dass die Spitze der Ampulle frei bleibt.

Fassen Sie mit der anderen Hand die Spitze der Ampulle, indem Sie den Zeigefinger an den Hals der Ampulle und den Daumen auf den farbigen Punkt parallel zu den Farbringen legen.
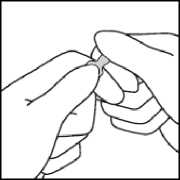
Während Sie die Ampulle mit der einen Hand festhalten, belassen Sie den Daumen der anderen Hand weiter auf dem farbigen Punkt und brechen die Spitze der Ampulle scharf ab.
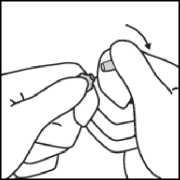
Bei versehentlichem Hautkontakt soll die betroffene Stelle mit Wasser gewaschen werden. Es sollen keine Seife, Alkohol oder andere Reinigungsmittel verwendet werden, die chemische oder physikalische Hautschäden verursachen könnten.
7. Inhaber der Zulassung
JANSSEN-CILAG GmbH 41457 Neuss
Telefon: (02137) 955-955
Internet: www.ianssen-cilag.de
8. Zulassungsnummer
27475.00.00
9. Datum der Erteilung der Zulassung / Verlängerung der Zulassung
23.11.1995 / 29.09.2006
10. Stand der Information
Februar 2014
11. Verkaufsabgrenzung
V erschreibungspflichtig, Betäubungsmittel
Seite 13 von 13